Evaluation of impact bruise susceptibility for green banana based on pendulum impact test
-
摘要:目的
评估一束适收期青香蕉果穗内梳层节点、节点嵌套的内外排层、果指表面区域和冲击水平对果实碰撞损伤敏感性的影响,为后续生产处理环节中确保果指质量的针对性防护提供参考。
方法嵌套、单因素和正交试验设计结合单因素及多因素方差分析,确定显著影响果实碰撞损伤敏感性的因素及主次关系。设计和搭建摆动冲击试验台,开展果实的碰撞损伤试验。通过测量碰撞部位的损伤体积和吸收能量,计算果实的碰撞损伤敏感性(单位吸收能量下的损伤体积)。
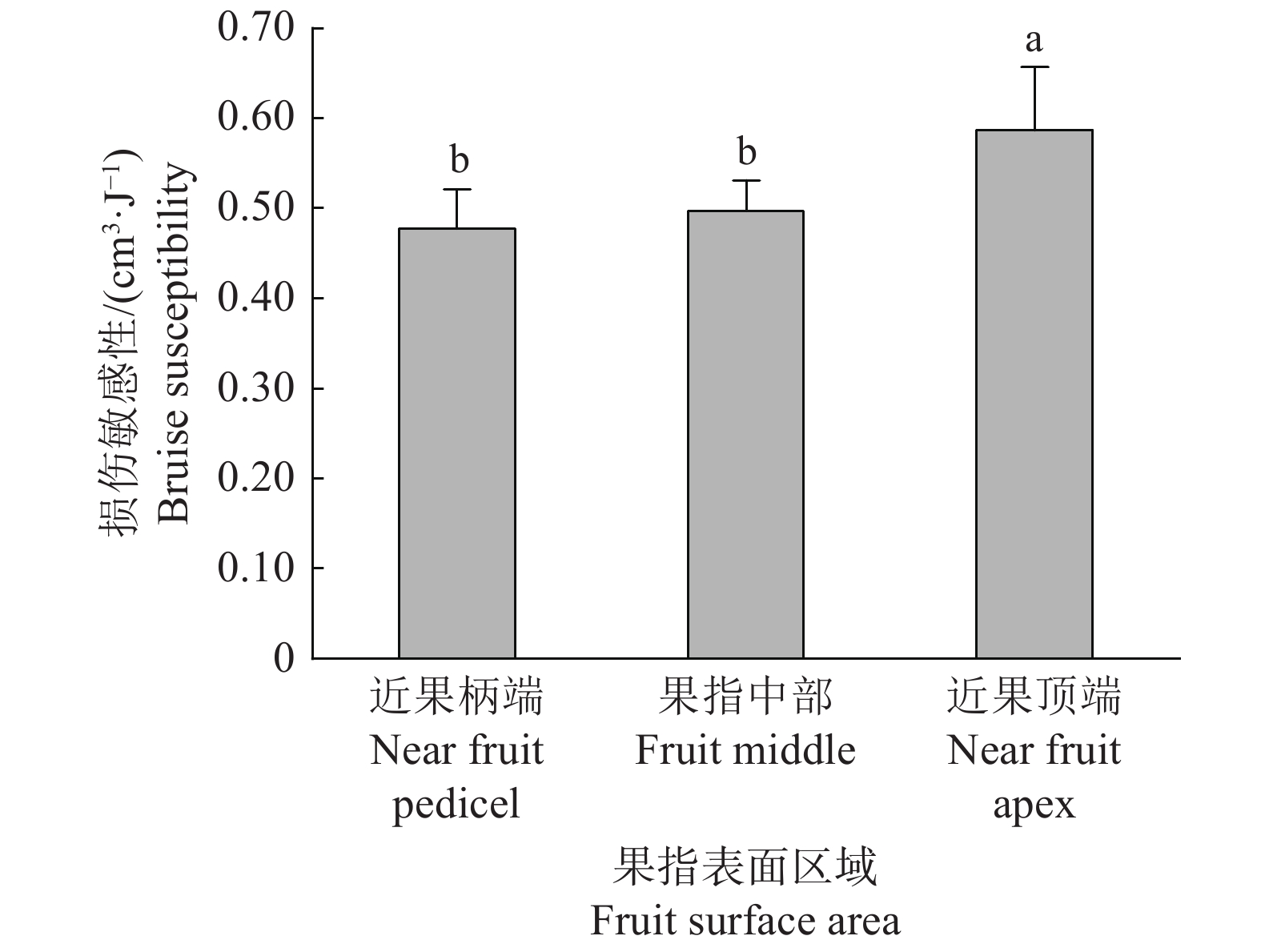
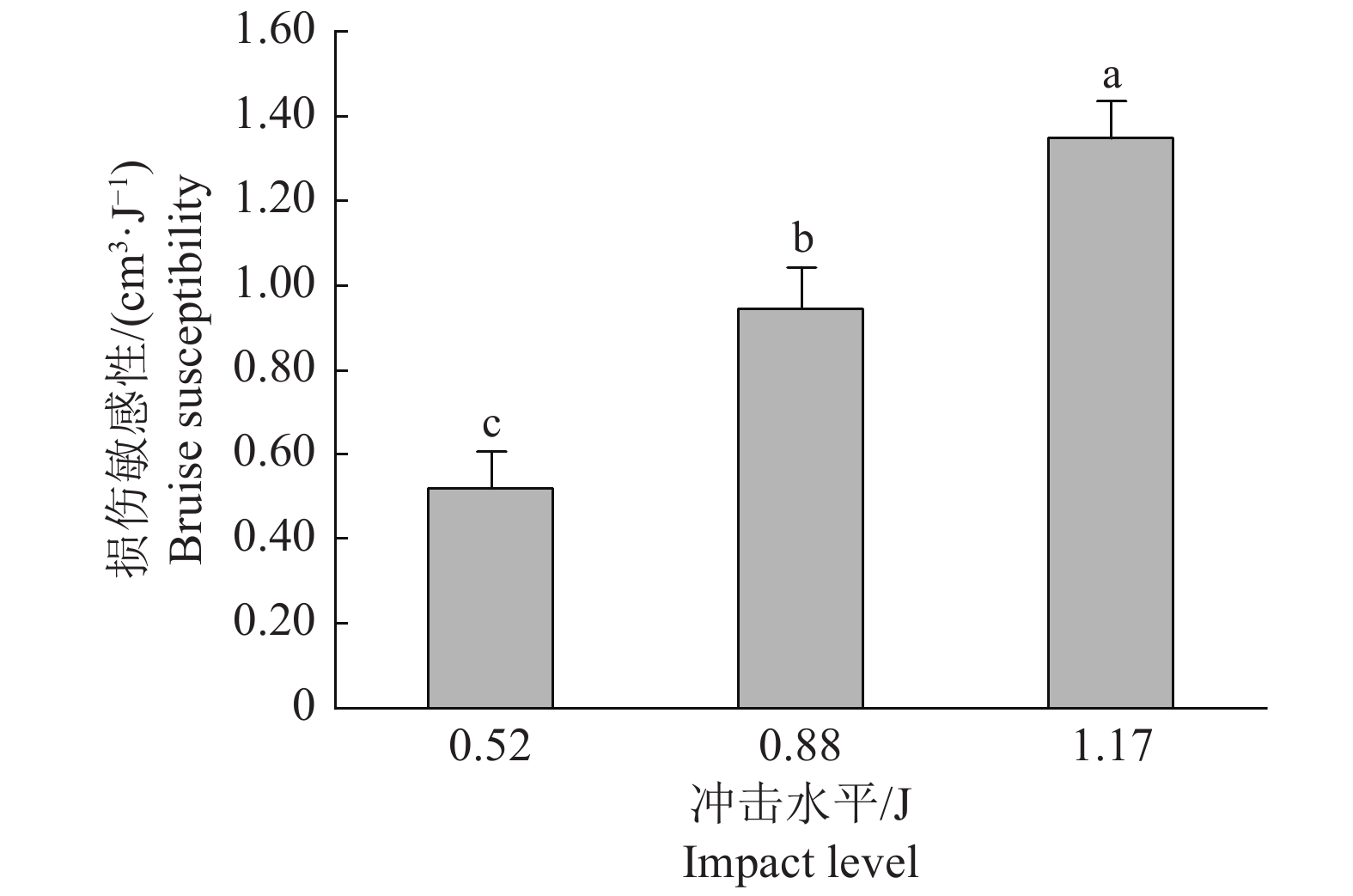
结果嵌套试验结果表明:梳层节点对损伤敏感性无显著影响;节点嵌套的排层对其影响极显著;根据多重比较分析结果节点嵌套排层的14个水平可分为4组。单因素试验结果表明:果指表面区域对损伤敏感性的影响极显著,近果顶端>果指中部>近果柄端;损伤敏感性随冲击水平的提高而显著增加。正交试验结果表明:影响果实碰撞损伤敏感性各因素的主次顺序为冲击水平>生长位置>果指表面区域。
结论一束香蕉梳层节点嵌套的内外排层及果指表面不同区域的碰撞损伤敏感性具有统计意义上的差异。
Abstract:ObjectiveThis study was aimed to evaluate the effect of nodes within a green banana bunch harvested in suitable period, inner and outer row layers nested in nodes, fruit finger surface area and impact level on fruit impact bruise susceptibility, providing references for targeted protection to ensure fruit finger quality in subsequent production and handling processes.
MethodNested, one-way and orthogonal experimental designs were combined with one-way and multi-way ANOVAs to determine the factors and primary-secondary relationship that significantly affect the bruise susceptibility of fruits. A pendulum impact bench was designed and constructed to carry out the impact damage test on fruits. The bruise susceptibility (bruise volume per unit absorbed energy) of fruits was calculated based on measuring bruise volume and corresponding absorbed energy.
ResultThe results of the nested test showed that the nodes within a banana bunch had no significant effect on the bruise susceptibility while the row layer nested in nodes had an extremely significant effect. The 14 levels of the row layers nested in nodes could be divided into four groups according to the results of multiple comparisons analysis. The results of the one-way test showed that fruit finger surface area had highly significant effect on the bruise susceptibility which was in order of near fruit apex >fruit middle >near fruit pedicel. The bruise susceptibility increased with the increase of impact level. The results of the orthogonal test showed that the order of the factors affecting fruit bruise susceptibility was impact level > growth location> fruit finger surface area.
ConclusionThe impact bruise susceptibilities were significantly different between inner and outer row layers nested in nodes within a banana bunch, and among different fruit finger surface areas.
-
香蕉Musa nana Lour.是世界上重要的经济作物之一,而香蕉枯萎病是一种广泛分布的重要病害,严重影响了香蕉产业的发展[1]。香蕉枯萎病是一种毁灭性病害,由尖孢镰刀菌古巴专化型(Fusarium oxysporum f. sp. cubense, Foc)引起,主要破坏香蕉维管束,导致植株死亡。这种病菌在土壤中能长期存活,该病菌具有高度的致病性,对香蕉的生长发育和产量造成了严重的影响。目前,香蕉枯萎病有3个生理小种,分别为1号生理小种(Foc 1)、2号生理小种(Foc 2)和4号生理小种(Foc 4),其中,1号和4号危害最大[2]。当前减轻病害的主要措施是筛选抗性品种和化学防治[3],目前还没有完全抗病的香蕉品种[4]。化学农药的普遍使用和用量增加带来了一系列问题,包括病原细菌抗药性增强和环境污染等,开发生态友好型生物杀菌剂已成为农业生产的当务之急。生物防治被认为是化学防治最有潜力的替代方法之一[5]。许多生物防治剂如酵母和细菌已被用于有效地抑制植物病害。周登博等[6]发现对镰刀菌Fusarium有拮抗作用的一些细菌包括荧光假单胞菌Pseudomonas fluorescens、解淀粉芽孢杆菌Bacillus amyloliquefaciens、枯草芽孢杆菌Bacillus subtilis等。甘林等[7]研究表明,生物防治剂和抗病品种相结合的预防效果可达90%。植物内生菌是与植物互利共生的微生物,是生物防治的天然资源[8]。内生菌可以通过诱导植物系统抗性来保护植物免受生物胁迫[9];此外,还能促进植物生长,如产生生长素等[10]。不同植物内生菌可以防治不同类型的植物病害,近些年来已开发了很多内生菌应用到植物病害防治中[11-14]。
目前,应用香蕉内生菌防治香蕉枯萎病的研究有很多,如利用香蕉内生芽孢杆菌提高香蕉组培苗抗香蕉枯萎病能力[15];从云南种植的巴西蕉Mimosa nana Lour.品种分离鉴定出2种内生菌解淀粉芽孢杆菌和枯草芽孢杆菌,具有明显的防治效果和促生效果,为当地种植园提供了新的生物防治资源[16];周维等[17]从‘桂蕉9号’分离出内生解淀粉芽孢杆菌,能提高盆栽抗、感病香蕉品种的防治效果。关于威廉斯香蕉内生拮抗菌的分离鉴定较少,威廉斯香蕉主要是在广东和广西种植,在种植过程中受香蕉枯萎病危害严重。本研究利用威廉斯香蕉抗枯萎病株系为材料,筛选高效拮抗香蕉枯萎病的内生菌,探究拮抗菌抑菌能力、抑菌相关的活性因子的分泌以及对植物的促生和生防效果,以期为香蕉枯萎病的生物防治提供新的微生物种质资源和理论支撑。
1. 材料与方法
1.1 材料
香蕉抗枯萎病株由广州澄华农业科技有限公司提供,品种为威廉斯香蕉,具有抗病特性,能够在严重感染香蕉枯萎病的香蕉园中正常生长,植株处于成株期,叶片绿色,假茎和球茎白色。
LB固体培养基(1.0 L):蛋白胨 9.0 g,酵母提取粉 6.0 g,氯化钠 9.0 g,琼脂16.0 g,pH 7.0;PDA培养基(1.0 L):土豆 200.0 g,葡萄糖 22.0 g,琼脂 16.0 g,pH 7.0;高氏一号培养基(1.0 L):硝酸钾 1.0 g,磷酸二氢钾 0.5 g,七水硫酸镁 0.5 g,七水硫酸亚铁 0.01 g,氯化钠 0.5 g,可溶性淀粉 20.0 g,琼脂 16.0 g,pH 7.0。
1.2 方法
1.2.1 香蕉抗枯萎病株系内生菌的分离和鉴定
在广东省广州市增城区大量感染香蕉枯萎病的香蕉种植园地中,选取叶片绿色、假茎和球茎白色、正常生长的香蕉植株,采集香蕉抗枯萎病植株的根、球茎及假茎并用无菌水冲洗干净,剪成长1~3 cm的小段;然后,在超净工作台进行材料消毒,75%(φ)乙醇溶液浸泡30 s,10% (w)次氯酸钠溶液浸泡2 min,无菌水冲洗7~8次;最后,一次涂布于LB板,无菌生长。将离体材料进行研磨,加无菌水梯度稀释10−1、10−2、10−3、10−4、10−5、10−6倍,取各梯度100 μL涂布于LB、PDA及高氏一号平板,倒置于37 ℃的培养箱中培养。在平板上出现菌落后,挑选大小和形状有差异的单菌落,参照Redburn等[18]的方法,选用引物27F和1492R,PCR 扩增 16S rDNA 基因片段;委托天一辉远生物有限公司进行测序,将所得序列通过 NCBI 数据库进行 Blast 相似性分析,采用 MEGA5.0 软件构建系统发育树。
1.2.2 各类群代表菌株生理生化指标测定
对代表菌株进行生理生化检测,测定的生化指标包括革兰染色、过氧化氢酶测定、甲基红(M.R.)染色试验、乙酰甲基甲醇(V.P.)试验、硝酸还原试验、明胶液化试验、柠檬酸盐试验和蔗糖利用试验。
1.2.3 香蕉抗枯萎病株系内生菌离体拮抗能力测定
用灭过菌的接种环从保存液中蘸取少量内生菌菌液及香蕉枯萎病Foc 1、Foc 4菌液,在固体平板上进行富集,30 ℃恒温培养7 d。采用平板对峙培养法,在PDA平板中央接种7 mm病原菌菌饼,然后将分离纯化的菌株在离平板边缘1 cm处进行划线,使其周围产生4条线纹并围成一个正方形。以不划线内生菌且只有病原菌的培养基为对照,3次重复。筛选拮抗Foc 1、Foc 4抗病香蕉内生菌菌株,十字交叉法测量菌落直径,计算抑菌率。
抑菌率=(对照菌落直径−处理菌落直径)/(对照菌落直径−菌饼直径)×100%。
1.2.4 香蕉抗枯萎病株系内生菌抑菌活性物质的探究
用 CAS[19] 液体培养基检测产嗜铁素的能力,内生菌的各种酶通过不同的培养基进行测定,包括β−1, 3−葡聚糖酶[20]、蛋白酶[21-22]、纤维素酶[23]和酯酶[24]。菌落周围的光晕区显示酶活性。
1.2.5 香蕉抗枯萎病株系内生菌产促生活性物质的研究
参照Bano 等[25]的方法进行产吲哚乙酸(IAA) 的定性和定量分析。用钾长石培养基[26]测定菌株的解钾能力,用PVK法[27]研究溶磷能力,观察各培养基中菌落周围是否形成透明圈,并使用标准曲线计算溶磷、解钾能力。
1.2.6 代表菌株对香蕉枯萎病的防效及促生效果研究
1) 拮抗菌菌液制备。将菌株接种于LB液体培养基中,摇床37 ℃、125 r/min培养33 h后,用无菌水将菌液调整为1×108 CFU/mL 。
2) Foc1及Foc4分生孢子悬浮液制备。根据方中达[28]的方法进行分生孢子悬浮液制备,待PDA平板上的病原菌长满时,用3~5 mL无菌水冲洗平板上的分生孢子,灭菌纱布过滤、混匀,进行孢子浓度测定,并稀释至1×106 CFU/mL。
3)代表菌株盆栽试验。将生长一致的5~6片叶香蕉苗进行伤根处理,在1×106 CFU/mL的香蕉枯萎病病原菌Foc 1及Foc 4混合病原菌液中浸泡30 min,使病原菌充分侵染香蕉苗,将香蕉苗种植于无菌土壤盆栽中并灌溉香蕉枯萎病病原菌菌液,使土壤充分淋湿并带病。以浸泡并浇灌病原菌菌液但不浇灌拮抗菌菌液的香蕉盆栽作为阳性对照(CK1),以浸泡清水30 min并在后续试验中只浇灌清水的处理作为空白对照(CK2),以浸泡并浇灌病原菌菌液和拮抗菌菌液的香蕉盆栽作为阴性处理组。用培养液发酵拮抗菌,5 d后在每盆香蕉苗土壤中灌根施加200 mL拮抗菌发酵液;此后,每5 d根据土壤情况施加适量无菌水。每盆种植1株苗,每个处理5盆。40 d后观察结果,记录发病情况,统计发病指数以及根长、株高、根体、茎周长等指标,以抗病防效为主要因素、以促生效果为次要因素,筛选高抗病能力且具有一定促生效果的菌株,用于后续大田试验。
4)代表菌株大田试验。选择香蕉枯萎病株发病率30%以上、土壤肥力一致、发病较均匀的香蕉园,每株施加稀释100倍的拮抗菌发酵液1 L,后续灌溉正常水肥。以浇灌清水且不浇灌拮抗菌发酵液的处理组为对照(CK)。3个月后测量各处理香蕉的长势、株高、假茎周长并统计病情指数,验证筛选出的高抗菌株在大田中的防治效果。
5)香蕉枯萎病病情分级标准。0 级:叶片无症状,正常,球茎、假茎组织白色;1 级:下部 1~2 片叶黄化,有小面积黄色斑块,占叶面积的 25%以下,其余叶片正常,球茎变褐组织为球茎面积的 5%以下,假茎组织未变褐色;3 级:3~4 片叶黄化,黄色斑块占叶面积的 25%~50%,其余叶片正常,球茎变褐组织占球茎面积的 5%~15%,假茎组织未变褐色;5 级:外围叶片黄化,大面积黄色斑块,占叶面积的 50%以上,叶片萎蔫,球茎变褐组织占球茎面积的 16%~25%,假茎组织上部未见变褐;7级:大部分叶片黄化、萎蔫,仅叶心正常,球茎变褐组织占球茎面积的26%~50%,假茎上、下部出现褐色线条状病变;9 级:植株萎蔫,枯萎死亡,球茎变褐组织占球茎面积的 50%以上或全部腐烂,或植株枯萎死亡。
2. 结果与分析
2.1 香蕉抗枯萎病株系内生菌的分离及鉴定结果
通过稀释涂布法共分离得到45株内生菌,对菌株进行16S rDNA测序和相似性分析,构建了菌株亲缘关系发育树,得到了13种菌株,分别属于克雷伯氏菌属Klebsiella、科萨克氏菌属Kosakonia、寡养假单胞菌属Stenotrophomon、芽孢杆菌属Bacillus、类芽孢杆菌属Paenibacillus、普里斯特氏菌属Priestia (图1)。
2.2 香蕉抗枯萎病株系内生菌生理生化指标
由表1可见,XJJ0204、XQJ0301、XJJ0205、XG0108、XQJ0209、XQJ0201和XG1093为革兰阴性菌,其余均为革兰阳性菌;所有革兰阴性菌菌株均能产生过氧化氢酶,减少了代谢产物对机体造成的损害。XG0103、XG1093甲基红试验为阳性反应,表明这些菌株具有将葡萄糖分解成丙酮酸、醋酸等有机酸的能力;在硝酸还原试验中,XG1028、XG1093呈阴性反应,其余均为阳性反应,阳性反应的菌株具有硝酸盐还原能力;在明胶液化试验中,XG0103、XG0302、XG1011、XQJ1012、XG1028、XG1161、XG0108、XG1093呈阳性反应,表明这些菌株具有产明胶酶的能力;在V.P.试验中,XG0103、XJJ0204、XJJ0205、XG0302、XQJ1012、XG1028、XG1161、XQJ0209、XG0108均呈阳性反应;在柠檬酸盐试验中,XG0103、XG0302、XG1028、XQJ0209均呈阴性反应,其余均呈阳性反应;在蔗糖利用试验中,XG1011、XQJ1012、XG1093均呈阴性反应,其余均呈阳性反应。
表 1 香蕉抗枯萎病株系内生菌生理生化指标1)Table 1. Physiological and biochemical indices of endophytic bacteria of banana fusarium wilt resistant strains菌株
编号
No. of
strain菌株
名称
Strain
name革兰
染色
Gram
faerbung过氧化
氢酶
Cata-
lase甲基红试验
Methyl
red test硝酸
还原
Nitrate
reductase明胶
液化
Gelatin
liquefactionV.P.
试验
V.P.
test柠檬
酸盐
Citrate蔗糖利用
Sucrose
utilizationXG0103 Bacillus siamensis + − + + + + − + XJJ0204 Kosakonia oryzae − + − + − + + + XQJ0301 Klebsiella quasivariicola − + − + − − + + XJJ0205 Kosakonia arachidis − + − + − + + + XG0302 B. tequilensis + − − + + + − + XG1011 Priestia megaterium + + − + + − + − XQJ1012 B. subtilis + + − + + + + − XG1028 B. velezensis + + − − + + − + XG1161 B. amyloliquefaciens + + − + + + + + XG0108 Stenotrophomonas pavanii − + − + + + + + XQJ0209 Kosakonia radicincitans − + − + − + − + XQJ0201 Klebsiella varicola subsp. tropica − + − + − − + + XG1093 Paenibacillus silvae − + + − + − + − 1) “+”阳性反应;“−”阴性反应
1) “+” Positive reaction;“−” Negative reaction2.3 香蕉抗枯萎病株系内生菌抑菌能力
平板对峙试验结果(图2)表明,香蕉抗枯萎病株系内生菌中XJJ0204、XG0108、XG0302、XG0103、XQJ0301、XG1028、XG0201和XJJ0205对病原菌Foc 1具有拮抗效果。拮抗菌株对病原菌Foc 1的抑菌率为53.25%~68.55%,其中,XJJ0204、XQJ0301、XG0103、XG1028和XJJ0205的抑菌效果较好,且这5个菌株的抑菌能力无显著性差异,抑菌率均在66%以上(表2),均可作为对病原菌Foc 1的生防菌株开发利用。
表 2 香蕉抗枯萎病株系内生菌对病原菌的抑菌效果Table 2. Bacteriostatic effect of endophyte of banana fusarium resistant strain on pathogenic bacteria病原菌
Pathogenic
bacteria菌株编号
No. of
strain菌落直径/mm
Colony diameter抑菌率1)/%
Bacteriostasis
rate对照
Control处理1)
TreatmentFoc 1 XJJ0204 90.00 36.61±0.59c 66.74±0.74a XQJ0301 90.00 35.16±1.07c 68.55±1.34a XG0302 90.00 43.03±0.49b 58.71±0.61b XG0103 90.00 35.56±0.89b 68.05±1.12a XG0108 90.00 47.40±0.34a 53.25±0.42c XG1028 90.00 35.48±0.49c 68.15±0.61a XJJ0205 90.00 35.95±0.16c 67.56±0.20a XQJ0201 90.00 41.35±0.31a 60.81±0.39c Foc 4 XQJ0301 90.00 30.03±0.73f 74.96±0.91a XG0302 90.00 44.40±1.89b 57.00±2.36e XG0103 90.00 41.25±0.17c 60.94±0.21d XG0108 90.00 53.57±0.86a 45.54±1.07f XG1028 90.00 38.30±0.44d 64.63±0.54c XJJ0205 90.00 35.28±0.74e 68.40±0.93b XQJ0201 90.00 38.19±0.72d 64.76±0.90c 1)表中数据为3次重复的平均值±标准误,相同病原菌同列数据后不同字母表示差异显著(P<0.05,Duncan’s法)
1)The data in the table was mean ± standard error for three repetitions , and the different letters after data at the same column for the same pathogenic bacteria indicated significant differences (P<0.05,Duncan’s method)香蕉抗枯萎病株系内生菌中XG0108、XG0302、XG0103、XQJ0301、XG1028、XG0201和XJJ0205对病原菌Foc 4具有拮抗效果(图3),抑菌率为45.54%~74.96%,其中,XQJ0301的抑菌效果最好,抑菌率高达74.96%;其次是XJJ0205,抑菌率达到68.40%;XG1028、XQJ0201和XG0103抑菌率为60.94%~64.76%(表2),这5个菌株均可作为对病原菌Foc 4的生防菌株开发利用。
2.4 香蕉抗枯萎病株系内生菌抗病相关活性物质
由表3可知,XG0302、XG0103、XQJ0201具有产β−1, 3−葡聚糖酶的功能且差异显著,其中,XG0302产β−1, 3−葡聚糖酶能力最强,溶解圈直径与菌落直径的比值(D/d)达到1.36;其次是XG0201,D/d为1.20;产β−1, 3−葡聚糖酶能力最差的是XG0103,D/d为1.08。XG0302、XG0103和XQJ0301这3株菌株具有纤维素酶活性,其中,XG0302产纤维素能力最强,D/d达到6.57;XG0103及XQJ0301产纤维素的D/d分别为2.69和2.29,且差异显著。使用脱脂奶粉固体培养基初步筛选,共得到6株代表菌株具有产蛋白酶活性,分别为XG0302、XG0103、XQJ1012、XG1161、XG1011和XG1028,产蛋白酶活性能力从高到低依次是XG0302、XG1028、XG0103、XG1161、XG1011、XQJ1012(表3)。
表 3 香蕉抗枯萎病株系内生菌产β−1, 3−葡聚糖酶、纤维素酶和蛋白酶能力的测定结果1)Table 3. Results of β-1, 3-glucanase,cellulase and protease produced by endophyte of banana fusarium resistant strain酶
Enzyme菌株编号
No. of strain溶解圈直径(D)/ mm
Dissolving ring diameter菌落直径(d)/ mm
Colony diameterD/d β−1, 3−葡聚糖酶 XG0302 18.83±0.92b 13.84±0.46b 1.36±0.04a β-1,3-glucanase XG0103 29.30±1.24a 27.05±1.16a 1.08±0.01c XQJ0201 10.11±0.74c 8.45±0.58c 1.20±0.04b 纤维素酶 XG0302 14.89±0.30a 2.40±0.40a 6.57±1.08a Cellulase XG0103 7.24±0.27b 2.78±0.35a 2.69±0.37b XQJ0301 6.59±0.61b 2.93±0.30a 2.29±0.26b 蛋白酶 XG0302 16.99±0.49b 3.79±0.32b 4.55±0.39a Protease XG0103 17.96±0.85b 7.39±0.58a 2.46±0.19c XQJ1012 12.34±0.20c 7.38±0.37a 1.68±0.10d XG1161 17.38±0.65b 7.40±0.68a 2.37±0.15cd XG1011 9.00±0.41d 4.48±0.33b 2.05±0.26cd XG1028 23.57±0.52a 6.92±0.74a 3.47±0.29b 1)表中数据为3次重复的平均值±标准误,相同酶同列数据后不同字母表示差异显著(P<0.05,Duncan’s法)
1)The data in the table was mean±standard error for three repetitions, and the different letters after data at the same column for the same enzyme indicated significant differences (P<0.05,Duncan’s method)采用MSA-CAS检测培养基对代表菌株进行铁载体功能检测,结果(图4A)表明,有8株具有分泌铁载体功能,分别为XJJ0204、XQJ0301、XJJ0205、XG0302、XG0103、XG0108、XQJ0201和XQJ0209。对13株代表菌株进行产酯酶功能鉴定,7 d后观察平板上的透明圈,由图4B可知, 4株菌株XQJ0209、XG0302、XG0103和XQJ1012具有产酯酶能力。
2.5 香蕉抗枯萎病株系内生菌产促生活性物质
溶磷菌初步筛选结果(图5)表明,有7株菌株具有溶磷能力,分别是XJJ0204、XQJ0301、XJJ0205、XG0108、XQJ0201、XQJ0209和XG1093。采用钼锑抗比色法进行可溶性磷含量测定,7株菌株发酵液中可溶性磷质量浓度为14.55~41.45 mg/L;其中,XQJ0201表现出最强的溶磷能力,发酵液中可溶性磷质量浓度高达41.45 mg/L;其余6株菌株发酵液中可溶性磷含量从大到小依次为XJJ0205、XQJ0301、XJJ0209、XG0108、XG1093、XJJ0204。
解钾固体培养基初筛得到了7株具有解钾能力的菌株,分别为XJJ0204、XQJ0301、XJJ0205、XG0108、XQJ0201、XQJ0209和XQJ1012(图6)。7株菌株发酵液中可溶性钾的质量浓度为27.98~57.74 mg/L;其中,XQJ0201表现出最强的溶钾能力,发酵液中可溶性钾质量浓度高达57.74 mg/L;其余6株菌株发酵液中可溶性钾含量从小到大依次为XJJ0204、XQJ0301、XJJ0205、XJJ0209、XQJ1012、XG0108。
对各代表菌株进行生长素类化合物的定性和定量检测,结果见表4。由表4可知,有6株菌株具有分泌生长素的能力,但产生长素能力均较低,产生的生长素质量浓度为5.01~16.81 mg/L;其中,XG0108产生长素能力最高,其次是XQJ0301和XJJ0209,能力最弱的是XQJ0201和XJJ0204。
表 4 香蕉抗枯萎病株系内生菌产生长素能力1)Table 4. The auxin production ability of endophyte of banana fusarium resistant strain菌株编号
No. of strainρ(IAA)/(mg·L−1)
IAA content分离部位
Separation siteXQJ0301 7.99±0.17b 球茎 Bulb XQJ0201 4.71±0.30d 球茎 Bulb XJJ0205 6.13±0.34c 假茎 Pseudostem XG0108 16.81±0.60a 根 Stem XJJ0209 7.39±0.12b 假茎 Pseudostem XJJ0204 5.01±0.22d 假茎 Pseudostem 1 ) 表中数据为3次重复的平均值±标准误,不同字母表示差异显著(P<0.05,Duncan’s法)
1)The data in the table was mean ± standard error for three repetitions, and the different letters indicated significant differences (P<0.05,Duncan’s method)2.6 代表菌株对香蕉枯萎病的抗病及促生效果
由图7可以看出,盆栽香蕉接种病原菌以及拮抗菌40 d后,只接种Foc 1及Foc 4的对照组CK1(图7A)长势最差,对照组全部染病且大多数新叶出现大面积的黄色斑块,占叶面积的50%以上,球茎组织变褐,假茎组织有的变褐,根有的变褐,属于病情分级标准中的3~5级;只加清水的CK2(图7B)均不发病;而添加拮抗菌及病原菌(图7C~7I)的处理组有的叶片出现小面积黄色斑块,占叶面积的50%以下,根有的变褐,属于病情分级标准中的0~1级。
![图 7 盆栽试验验证拮抗菌对香蕉枯萎病防效]() 图 7 盆栽试验验证拮抗菌对香蕉枯萎病防效A:CK1为只施加病原菌的阳性对照组;B:CK2为只施加清水的阴性对照组;C:施加XG1028以及病原菌处理组;D:施加XQJ0301及病原菌处理组;E:施加XG1028和XQJ0301以及病原菌处理组;F:施加XG0302以及病原菌处理组;G:施加XG0103以及病原菌处理组;H:施加XJJ0205以及病原菌处理组;I:施加XG0103和XJJ0205以及病原菌处理组Figure 7. Verification of control effect of antagonistic bacteria on banana wilt in pot experimentA: CK1 was a positive control group treated with pathogenic bacteria only; B: CK2 was treated with water only; C: Treated with XG1028 and pathogen; D: Treated with XQJ0301 and pathogen; E: Treated with XG1028,XQJ0301 and pathogen; F: Treated with XG0302 and pathogen; G: Treated with XG0103 and pathogen; H: Treated with XJJ0205 and pathogen; I: Treated with XG0103, XJJ0205 and pathogen
图 7 盆栽试验验证拮抗菌对香蕉枯萎病防效A:CK1为只施加病原菌的阳性对照组;B:CK2为只施加清水的阴性对照组;C:施加XG1028以及病原菌处理组;D:施加XQJ0301及病原菌处理组;E:施加XG1028和XQJ0301以及病原菌处理组;F:施加XG0302以及病原菌处理组;G:施加XG0103以及病原菌处理组;H:施加XJJ0205以及病原菌处理组;I:施加XG0103和XJJ0205以及病原菌处理组Figure 7. Verification of control effect of antagonistic bacteria on banana wilt in pot experimentA: CK1 was a positive control group treated with pathogenic bacteria only; B: CK2 was treated with water only; C: Treated with XG1028 and pathogen; D: Treated with XQJ0301 and pathogen; E: Treated with XG1028,XQJ0301 and pathogen; F: Treated with XG0302 and pathogen; G: Treated with XG0103 and pathogen; H: Treated with XJJ0205 and pathogen; I: Treated with XG0103, XJJ0205 and pathogen由表5可以看出,XQJ0301、XG1028+XQJ0301、XG0103防治效果最好,病情指数最小,仅为16.67;XJJ0205处理组防治效果最差,病情指数最大,为41.67;其中,XG0103+XJJ0205处理组病情指数高于单独施加XG0103处理组,XG1028+XQJ0301处理组与单独施加XQJ0301的病情指数相同。单独施加XG1028或XQJ0301在根长、株高、根体积、假茎周长方面,优于其他处理组。混合施加相较于单独施加拮抗菌发酵液的促生效果均有所降低(表5)。综合考虑试验结果及成本,在实际生产过程中,以单独施加XG1028、XQJ0301或XG0103菌株发酵液为最优选择。
表 5 香蕉抗枯萎病株系内生菌盆栽试验拮抗和促生效果Table 5. Antagonist and growth promotion effects of endophyte of banana fusarium resistant strain in pot experiment处理
Treatment根长1)/cm
Root length株高1)/cm
Plant height根体积1)/cm3
Root volume假茎周长1)/mm
Pseudostem circumference病情指数
Disease index防治效果/%
Control effectCK1 12.52±2.24d 22.98±1.55a 10.22±0.89b 3.97±0.48b 100 0 CK2 13.01±1.54d 23.52±1.69a 8.53±0.96b 4.83±0.50ab 0 XG1028 22.87±0.52a 28.43±1.90a 16.69±0.47a 4.94±0.47ab 25.00 75.00 XQJ0301 13.66±2.63d 26.06±0.55a 14.78±2.39a 5.99±0.45a 16.67 83.33 XG1028+XQJ0301 11.39±1.42d 22.35±2.17a 9.68±1.98b 4.77±0.45ab 16.67 83.33 XG0302 15.09±1.75cd 22.55±2.72a 9.56±0.89b 3.85±0.57b 33.33 66.67 XG0103 11.31±1.05d 25.17±1.28a 9.05±0.69b 5.47±0.5ab 16.67 83.33 XJJ0205 17.74±1.40abc 25.08±1.64a 9.23±0.90b 5.43±0.35ab 41.67 58.33 XG0103+XJJ0205 16.70±1.82bcd 22.82±2.48a 8.68±1.08b 4.35±0.73ab 25.00 75.00 1)表中数据为3次重复的平均值±标准误,同列数据后不同字母表示差异显著(P<0.05,Duncan’s法)
1)The data in the table was mean ± standard error for three repetitions, and the different letters at the same column indicated significant differences (P<0.05,Duncan’s method)大田试验结果(表6)表明,施用拮抗菌对于抑制香蕉枯萎病的传播与扩散具有明显的作用。施加拮抗菌后,病情指数显著降低,其中,防治效果最好的是XQJ0301,其次是XG1028;3种菌液处理的株高均显著高于对照组,且处理间株高无显著性差异;假茎周长最长的是XG1028,其次是XQJ0301,说明3种菌株对于促进香蕉植株的生长有所差异,且在促生方面的效果与盆栽试验具有一致性。
表 6 香蕉抗枯萎病株系内生菌大田试验抗病及促生效果Table 6. Antagonist and growth promotion effects of endophyte of banana fusarium resistant strain in field experiment处理
Treatment株高1)/m
Plant height假茎周长1)/mm
Pseudostem circumference病情指数
Disease index防治效果/%
Control effectCK 2.47±0.02b 67.55±0.26c 74.44 25.56 XG1028 2.64±0.02a 70.00±0.41a 25.58 74.42 XQJ0301 2.59±0.03a 69.11±0.46ab 24.86 75.14 XG0103 2.64±0.02a 68.19±0.46bc 28.36 71.64 1)表中数据为3次重复的平均值±标准误,同列数据后不同字母表示差异显著(P<0.05,Duncan’s法)
1)The data in the table was mean ± standard error for three repetitions, and the different letters at the same column indicated significant differences (P<0.05,Duncan’s method)对施加拮抗菌以及施加清水的香蕉植株的球茎及假茎部位进行解剖,结果如图8所示。由图8可以看出,二者表型具有明显的差异,施加拮抗菌的球茎组织变褐面积占球茎面积的1/4~1/2,假茎组织出现浅褐色条纹病变,变褐部位较干,属于病情分级标准中的3~5级;施加清水的球茎组织变褐面积占球茎面积的2/3以上,假茎上、下部均出现褐色条纹病变,并逐渐变为黑褐色,属于病情分级标准中的9级。表明筛选出的拮抗菌对于香蕉枯萎病防治具有明显效果。
![图 8 拮抗菌处理对感染香蕉枯萎病植株球茎和假茎的影响]() 图 8 拮抗菌处理对感染香蕉枯萎病植株球茎和假茎的影响A、C分别为施用拮抗菌的球茎和假茎横、纵切面;B、D分别为施用清水的球茎和假茎横、纵切面Figure 8. Effect of antagonistic treatment on bulb and pseudostem of banana blight infected plantA and C were the cross and longitudinal sections of bulb and pseudostem applied with antagonist,respectively;B and D were the transverse and longitudinal sections of bulb and pseudostem applied with water,respectively
图 8 拮抗菌处理对感染香蕉枯萎病植株球茎和假茎的影响A、C分别为施用拮抗菌的球茎和假茎横、纵切面;B、D分别为施用清水的球茎和假茎横、纵切面Figure 8. Effect of antagonistic treatment on bulb and pseudostem of banana blight infected plantA and C were the cross and longitudinal sections of bulb and pseudostem applied with antagonist,respectively;B and D were the transverse and longitudinal sections of bulb and pseudostem applied with water,respectively3. 讨论与结论
植物内生菌作为一种新型的天然生防资源,存在于植物的各个组织和器官,与植物互利共生。内生菌通过生态位竞争、合成抗菌活性物质、诱导植物抗性和促进植物生长等机制提高宿主植物抗病性[29]。本研究分离和鉴定了抗香蕉枯萎病株系内生菌,得到了13个代表菌株。通过生理生化试验确定菌株的代谢产物,对菌株的分类鉴定具有一定意义,同时也可对菌株的功能进行预测。内生菌占据生态位,减少病原菌的生存空间,降低其对环境的适应性,从而抑制其生长。通过代表菌株的平板对峙试验,观察其是否对病原菌具有致畸作用并筛选具有拮抗效果的菌株,从而达到生防目的。内生菌也可以通过产生活性物质抑制病原菌的生长和繁殖,对拮抗菌可能的生防因子进行筛选有助于进一步认识和研究拮抗机理。研究表明内生菌可以通过产生各种植物生长促进因子和增加养分吸收过程直接帮助寄主植物溶磷解钾、分泌生长素等[30]。
β−1, 3−葡聚糖是病原真菌细胞壁的主要成分之一,大部分真菌细胞壁外层覆盖丰富的葡聚糖。研究表明一些植物内生菌具有产β−1, 3−葡聚糖酶的能力,β−1, 3−葡聚糖酶可催化水解细胞壁表层的葡聚糖,因此具有直接侵入和杀死病原菌的潜在能力,这种酶能够有效地抑制病原体的繁殖和生长,与植物抗病途径密切相关[31]。柴庆凯等[32]研究发现,解淀粉芽孢杆菌能诱导黄瓜产生 β−1, 3− 葡聚糖酶破坏病菌细胞壁,从而达到防治作用。有研究指出,假单胞菌BTa14、Bar25的发酵液中均可产生果胶酶、纤维素酶和蛋白酶等拮抗因子,且活性较高,能够发挥抗病作用,直接导致病原菌菌丝膨大、畸形、扭曲,从而影响病菌的生长[33]。地衣芽孢杆菌Kll产纤维素酶且对不溶性纤维素具有纤维素分解活性,如真菌细胞壁纤维素,具有抗真菌活性,还表现出对尖孢镰刀菌Fusarium oxysporum极强的拮抗能力[34]。铁载体是一种可以结合三价铁离子并且供给微生物细胞的低分子量物质,细菌可通过分泌铁载体与植物病原菌竞争铁离子,从而抑制病原菌生长繁殖。脂类及其代谢物在植物和病原菌的互作中发挥着重要的作用,而酯酶催化了脂类的代谢,细菌可能通过分泌酯酶调控植物的免疫反应机制。
本研究通过盆栽和大田试验筛选出3株高效拮抗菌株,分别为贝莱斯芽孢杆菌XG1028、变栖克雷伯氏菌XQJ0301、暹罗芽孢杆菌XG0103,丰富了抗香蕉枯萎病微生物种质资源,也为防治香蕉枯萎病寻找安全、环保新型生物防治剂提供了新的依据。近年来,芽孢杆菌因其在促进植物生长和控制各种病原体方面的出色表现而闻名[35]。暹罗芽孢杆菌最早于2009年被发现[36],暹罗芽孢杆菌具有产生脂肽生物表面活性剂能力,脂肽生物表面活性剂对革兰杆菌,特别是对镰刀菌具有显著的拮抗活性[37]。本研究的结果也表明,该菌株具有产β−1, 3−葡聚糖酶、纤维素酶、蛋白酶、脂酶、铁载体等抗病活性因子,并对尖孢镰刀菌古巴专化型侵染引起的香蕉枯萎病具有高抗病活性。朱亚珠等[38]研究表明,贝莱斯芽孢杆菌的菌株代谢产物对多种常见真菌致病菌均具有抑制作用,在其上清液中含有表面活性素、可胆苷A、氨基糖苷类抗生素庆大霉素和异帕胺素、链霉素抗生素达福普汀等具有抗菌活性的物质。本研究也发现,该菌株具有高抗病活性效果,在盆栽试验以及大田试验中均有良好的表现,虽然未发现该菌株具有产生长素以及溶磷、解钾能力,但盆栽试验中具有良好的促生效果。这可能是由于该菌株通过其他激素刺激植物生长或者调控植物中生长发育相关基因的表达有关。本研究还发现,变栖克雷伯氏菌具有产生长素、解钾、产铁载体、产纤维素酶的能力,并对香蕉枯萎病具有较强的拮抗活性,盆栽试验以及大田试验的生防效果均较好,可作为高效生防菌株开发利用。
-
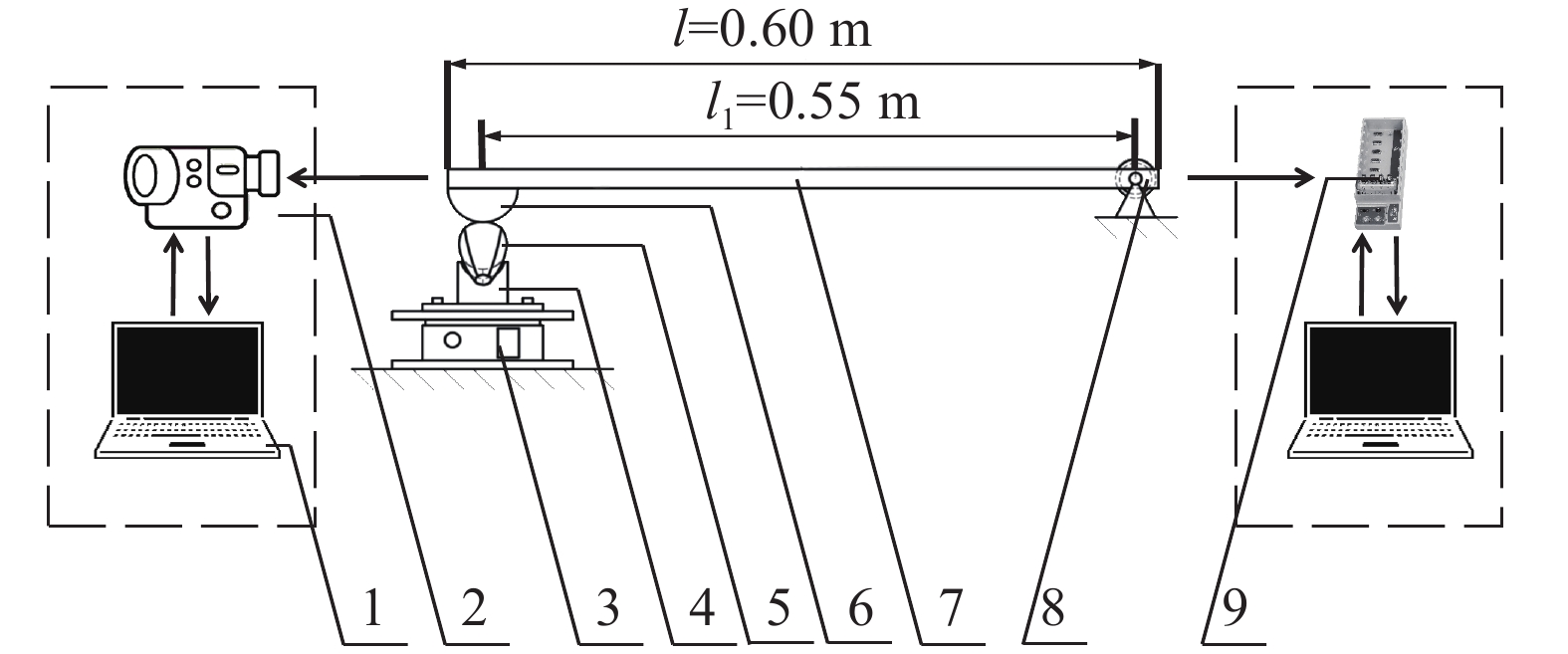
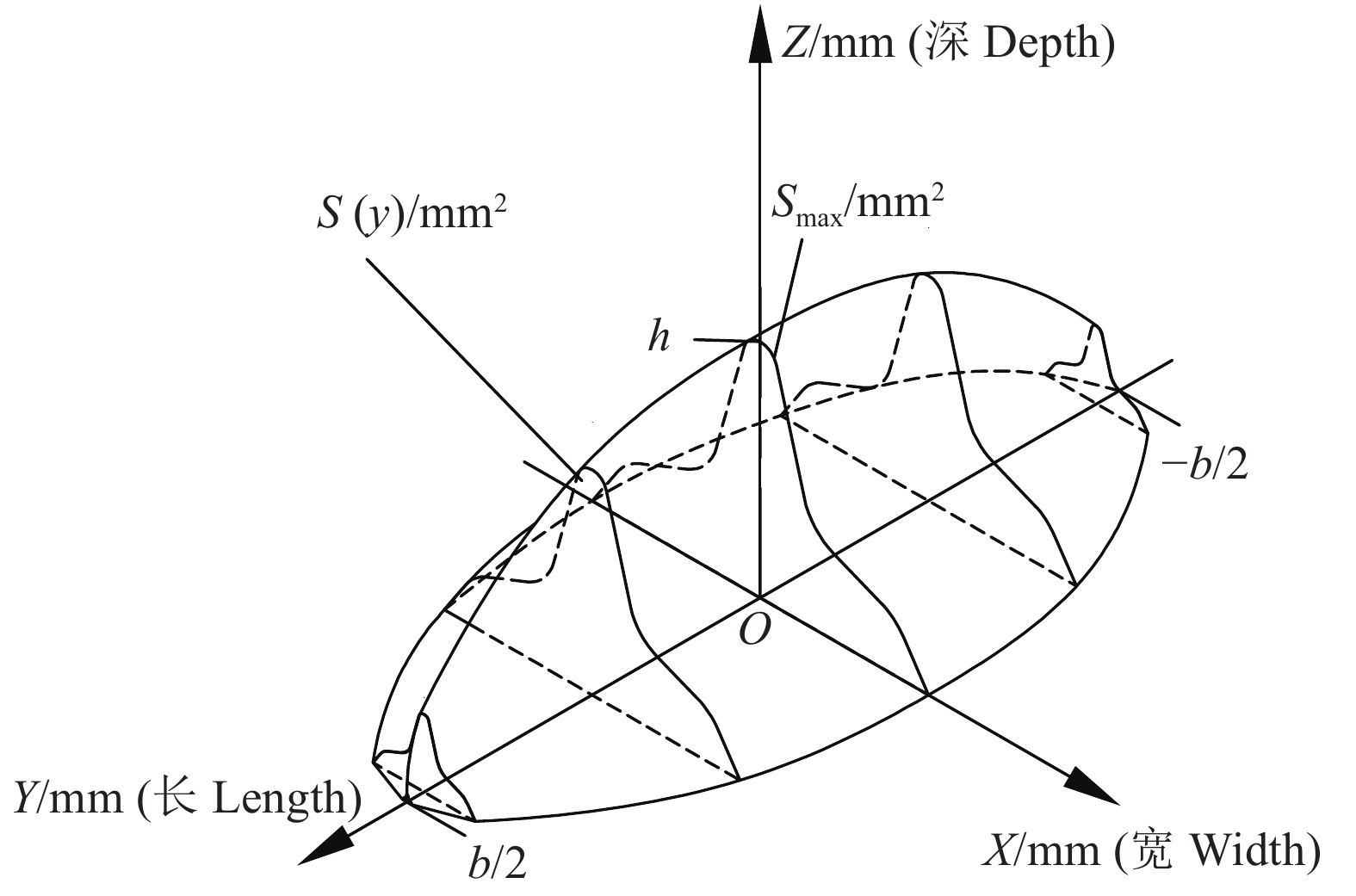
图 2 摆动冲击试验台示意图
1:计算机;2:高速相机;3:升降台;4:仿形部件;5:香蕉果指;6:木锤;7:摆臂;8:角度传感器;9:数据采集卡与卡槽;l:摆臂长度; l1:木锤中心到转动中心距离
Figure 2. Schematic of the pendulum impact test device
1: Computer; 2: High-speed camera; 3: Lifting platform; 4: Profiling part; 5: Banana finger; 6: Wooden bob; 7: Pendulum arm; 8: Angular transducer; 9: Data acquisition card and card slot; l: Pendulum arm length; l1: Distance from the wooden mallet to the center of rotation
图 8 不同冲击水平下香蕉内排果指近果顶端的损伤敏感性
冲击位置为近果顶端;柱子上方的不同小写字母表示差异显著(P<0.05,Duncan’s法)
Figure 8. Bruise susceptibility near apex of the banana finger in the inner row under different impact levels
Impact area is the near fruit pedicel; Different lowercase letters on bars indicate significant differences(P<0.05, Duncan’s method)
表 1 嵌套试验因素和水平
Table 1 Nested test factors and levels
水平
Level梳层节点(A)
Node排层[B(A)]
Row1 首梳(A1)
The first node外排[B1(A1)] Outer row 内排[B2(A1)] Inner row 2 第2梳(A2)
The second node外排[B1(A2)] Outer row 内排[B2(A2)] Inner row 3 第3梳(A3)
The third node外排[B1(A3)] Outer row 内排[B2(A3)] Inner row 4 第4梳(A4)
The fourth node外排[B1(A4)] Outer row 内排[B2(A4)] Inner row 5 第5梳(A5)
The fifth node外排[B1(A5)] Outer row 内排[B2(A5)] Inner row 6 第6梳(A6)
The sixth node外排[B1(A6)] Outer row 内排[B2(A6)] Inner row 7 尾梳(A7)
The last node外排[B1(A7)] Outer row 内排[B2(A7)] Inner row 表 2 正交试验因素和水平
Table 2 Orthogonal test factors and levels
水平 Level 生长位置(B′) Growth location 果指表面区域(C) Fruit surface area 冲击水平(D/J) Impact level 1 B′1 近果柄端 Near fruit pedicel 低水平 (0.52) Low level 2 B′2 果指中部 Fruit middle 中水平 (0.88) Medium level 3 B′3 近果顶端 Near fruit apex 高水平 (1.17) High level 4 B′4 表 3 不同生长位置香蕉果指碰撞损伤敏感性均值的多重比较结果1)
Table 3 Multiple comparisons of average bruise susceptibility of banana finger at various growth positions
梳层节点(A)
Node排层[B(A)]
Row损伤敏感性/
(cm3·J−1)
Bruise susceptibility首梳(A1)
The first node外排[B1(A)1] Outer row 1.06 ± 0.03d 内排[B2(A)1] Inner row 1.34 ± 0.08a 第2梳(A2)
The second node外排[B1(A)2] Outer row 1.07 ± 0.09d 内排[B2(A)2] Inner row 1.31 ± 0.07a 第3梳(A3)
The third node外排[B1(A)3] Outer row 1.15 ± 0.07bcd 内排[B2(A)3] Inner row 1.31 ± 0.07a 第4梳(A4)
The fourth node外排[B1(A)4] Outer row 1.19 ± 0.05abcd 内排[B2(A)4] Inner row 1.32 ± 0.09a 第5梳(A5)
The fifth node外排[B1(A)5] Outer row 1.19 ± 0.16abcd 内排[B2(A)5] Inner row 1.32 ± 0.07a 第6梳(A6)
The sixth node外排[B1(A)6] Outer row 1.13 ± 0.10cd 内排[B2(A)6] Inner row 1.21 ± 0.02abcd 尾梳(A7)
The last node外排[B1(A)7] Outer row 1.29 ± 0.08ab 内排[B2(A)7] Inner row 1.22 ± 0.07abc 1)冲击能量为1.17 J;冲击位置为果指中部;表中数据为平均值±标准差;同列数据后的不同小写字母表示差异显著(P<0.05,Duncan’s法)
1) The impact energy is 1.17 J; Impact position is the finger middle; Data in the table are means±standard deviations; Different lowercase letters in the same column indicate significant differences(P<0.05, Duncan’s method)表 4 正交试验方案及结果1)
Table 4 The scheme and result of orthogonal test
编号
No.生长位置(B′)
Growth location果指表面区域(C)
Fruit surface area空列
Null column冲击水平(D)
Impact level空列
Null column损伤敏感性/(cm3·J−1)
Bruise susceptibility1 4 3 1 1 1 0.52 2 4 2 2 2 2 0.84 3 4 1 3 3 3 1.16 4 4 3 4 1 4 0.53 5 3 3 2 3 4 1.19 6 3 2 1 1 3 0.53 7 3 1 4 1 2 0.48 8 3 3 3 2 1 0.97 9 2 3 3 1 2 0.57 10 2 2 4 3 1 1.18 11 2 1 1 2 4 0.93 12 2 3 2 1 3 0.52 13 1 3 4 2 3 1.03 14 1 2 3 1 4 0.54 15 1 1 2 1 1 0.50 16 1 3 1 3 2 1.37 k1 0.76 0.77 0.84 0.52 0.79 k2 0.79 0.77 0.76 0.94 0.82 k3 0.80 0.84 0.81 1.23 0.81 k4 0.86 0.80 0.80 R 0.10 0.07 0.08 0.71 0.03 因素排列 Sequence of factors D>B'>C 1):k1~k4 分别是碰撞损伤敏感性在不同因素和水平下的总和平均值,R为极差
1): k1−k4 are the total average value of bruise susceptibility under different factors and levels, R is range表 5 正交试验方差分析
Table 5 Variance analysis of orthogonal test
变异来源
Source of variation自由度
Degree of
freedom离差平方和
Sum of squares
of deviations平均离差平方和
Sum of squares of
mean deviationsF P1) 生长位置(B′) Growth location 3 0.11 0.04 7.37 0.00** 果指表面区域(C) Fruit surface area 2 0.09 0.05 9.28 0.00** 冲击水平(D) Impact level 2 7.12 3.56 724.12 0.00** 误差 Error 72 0.36 0.01 总和 Sum 80 59.31 1)“**”表示显著性达到P<0.01的水平
1)“**” indicates the significance at P<0.01 level -
[1] 中华人民共和国国家统计局. 年度数据: 香蕉产量 [EB/OL].[2021-07-03]. https://data.stats.gov.cn/easyquery.htm?cn=C01. [2] 王南南. 基于高光谱成像技术的多指标综合决策香蕉品质等级研究[D]. 广州: 华南理工大学, 2015. [3] 邓理, 侯义龙, 陈立东, 等. 香蕉机械伤的初步研究[J]. 北方园艺, 2002(1): 48-50. doi: 10.3969/j.issn.1001-0009.2002.01.033 [4] VAN ZEEBROECK M, VAN LINDEN V, DARIUS P, et al. The effect of fruit properties on the bruise susceptibility of tomatoes[J]. Postharvest Biology & Technology, 2007, 45(2): 168-175.
[5] DIENER R G, ELLIOTT K C, NESSELROAD P E, et al. Bruise energy of peaches and apples[J]. Transactions of the ASAE, 1979, 22(2): 287-290. doi: 10.13031/2013.35007
[6] HUNG Y C, PRUSSIA S E. Effect of maturity and storage time on the bruise susceptibility of peaches (CV. red globe)[J]. Transactions of the ASAE, 1989, 32(4): 1368-1373.
[7] OPARA L U. Bruise susceptibilities of 'Gala' apples as affected by orchard management practices and harvest date[J]. Postharvest Biology & Technology, 2007, 43(1): 47-54.
[8] BLAHOVEC J, MARES V. Approximation of bruise spot volume in pears in plots against deformation parameters[J]. Research in Agricultural Engineering, 2003, 49(2): 50-55.
[9] MENESATTI P, PAGLIA G. pH—postharvest technology: Development of a drop damage index of fruit resistance to damage[J]. Journal of Agricultural Engineering Research, 2001, 80(1): 53-64. doi: 10.1006/jaer.2000.0669
[10] BAJEMA R W, HYDE G M. Instrumented pendulum for impact characterization of whole fruit and vegetable specimens[J]. Transactions of the ASAE, 1998, 41(5): 1399-1405. doi: 10.13031/2013.17274
[11] SCHOORL D, HOLT J E. Bruise resistance measurements in apples[J]. Journal of Texture Studies, 1980, 11(4): 389-394.
[12] HADI S, AHMAD D, AKANDE F B. Determination of the bruise indexes of oil palm fruits[J]. Journal of Food Engineering, 2009, 95(2): 322-326. doi: 10.1016/j.jfoodeng.2009.05.010
[13] BANKS N H, BORTON C A, JOSEPH M. Compression bruising test for bananas[J]. Journal of the Science of Food & Agriculture, 1991, 56(2): 223-226.
[14] AKKARAVESSAPONG P, JOYCE D C, TURNER D W. The relative humidity at which bananas are stored or ripened does not influence their susceptibility to mechanical damage[J]. Scientia Horticulturae, 1992, 52(3): 265-268. doi: 10.1016/0304-4238(92)90027-A
[15] KAJUNA S T A R, BILANSKI W K, MITTAL G S. Response of bananas and plantains to impact forces[J]. Journal of Texture Studies, 1997, 28(1): 71-85. doi: 10.1111/j.1745-4603.1997.tb00102.x
[16] BUGAUD C, OCRISSE G, SALMON F, et al. Bruise susceptibility of banana peel in relation to genotype and post-climacteric storage conditions[J]. Postharvest Biology & Technology, 2014, 87: 113-119.
[17] MAIA V M, SALOMAO L, SIQUEIRA D L, et al. Physical and metabolic alterations in "Prata Anã" banana induced by mechanical damage at room temperature[J]. Scientia Agricola, 2011, 68(1): 31-36. doi: 10.1590/S0103-90162011000100005
[18] FERNANDO I, FEI J, STANLEY R. Measurement and analysis of vibration and mechanical damage to bananas during long-distance interstate transport by multi-trailer road trains[J]. Postharvest Biology and Technology, 2019, 158: 110977.
[19] 中华人民共和国农业部. 青香蕉: NY/T 517—2002 [S]. 北京: 中国标准出版社, 2002. [20] 国家技术监督局. 香蕉: GB/T 9827—1988 [S]. 北京: 中国标准出版社, 1989. [21] 中华人民共和国农业部. 香蕉等级规格: NY∕T 3193—2018 [S], 北京: 中国标准出版社, 2018. [22] FU H, HE L, MA S, et al. ‘Jazz’ apple impact bruise responses to different cushioning materials[J]. Transactions of the ASABE, 2017, 60(2): 327-336.
[23] 关济雨. 基于光学特性的水果损伤敏感性预测评估[D]. 无锡: 江南大学, 2016. [24] KOMARNICKI P, STOPA R, SZYJEWICZ D, et al. Evaluation of bruise resistance of pears to impact load[J]. Postharvest Biology & Technology, 2016, 114: 36-44.
[25] CELIK H K, USTUN H, ERKAN M, et al. Effects of bruising of ‘Pink Lady’ apple under impact loading in drop test on firmness, colour and gas exchange of fruit during long term storage[J]. Postharvest Biology and Technology, 2021, 179: 111561.
[26] ABEDI G, AHMADI E. Bruise susceptibilities of Golden Delicious apples as affected by mechanical impact and fruit properties[J]. Journal of Agricultural Science, 2014, 152(3): 439-447. doi: 10.1017/S0021859613000038
[27] AHMADI E, GHASSEMZADEH H R, SADEGHI M, et al. The effect of impact and fruit properties on the bruising of peach[J]. Journal of Food Engineering, 2010, 97(1): 110-117. doi: 10.1016/j.jfoodeng.2009.09.024
[28] DU D, WANG B, WANG J, et al. Prediction of bruise susceptibility of harvested kiwifruit (Actinidia chinensis) using finite element method[J]. Postharvest Biology and Technology, 2019, 152: 36-44. doi: 10.1016/j.postharvbio.2019.02.013
-
期刊类型引用(9)
1. 朱杰,郑利乐,钟鸣鸾,童灵洁,李洁玲,李华平,李云锋,聂燕芳. 洋葱伯克霍尔德菌GD1-1的分离鉴定及对香蕉枯萎病的生防潜力. 华南农业大学学报. 2025(01): 72-80 .  本站查看
本站查看
2. 张丽,陈学达,杜运鹏,高俊莲,王娇,王芳. 百合枯萎病拮抗菌株Burkholderia sp.M-14的促生特性分析. 粮油与饲料科技. 2025(01): 80-82 .  百度学术
百度学术
3. 朱华,吴文源,张淼,陈龙,杨丽容,梁仁涛,黄诗萍,吴焕,施晓光. 石仙桃内生真菌的分离及抑菌活性菌株的筛选与鉴定. 湖北农业科学. 2025(02): 112-121 .  百度学术
百度学术
4. 黄敏清,谭佩婷,陈伊航,赵春茜,刘丽平,彭桂香,谭志远. 毛白杨内生细菌的分离鉴定及其对水稻促生作用. 微生物学通报. 2025(04): 1572-1586 .  百度学术
百度学术
5. 王玉鹏,何静,陈伟,王斌,张崇庆,李南,李瑞芸,颜宇科. 贝莱斯芽孢杆菌G18的抑菌及促生作用研究. 西北农林科技大学学报(自然科学版). 2025(05): 64-75 .  百度学术
百度学术
6. 王璐,段莹泽,张耀芳,罗舒茵,覃天涵,杨金新,朱英芝. 暹罗芽孢杆菌GXMZU-81对香蕉枯萎病的防治及对植物的促生效果. 云南大学学报(自然科学版). 2025(03): 589-600 .  百度学术
百度学术
7. 杨洲,区湘颖,张志宏,罗宇康,何俊宇,欧俊辰,段洁利. 早期香蕉枯萎病Foc4双探针核酸纸基检测传感器研制. 农业工程学报. 2024(05): 38-46 .  百度学术
百度学术
8. 兰佳贺,姜海燕,吴云菊,党海龙,蒋萌萌,房钰欣. 3株内生真菌对沙柳溃疡病病原菌的拮抗作用研究. 内蒙古林业科技. 2024(02): 35-39 .  百度学术
百度学术
9. 周士家,孙正海,李丽萍. 喀西茄内生真菌分离鉴定及促生功能验证. 西南农业学报. 2024(11): 2436-2443 .  百度学术
百度学术
其他类型引用(1)




 下载:
下载: