Functional analysis of SAP11 gene in cassava
-
摘要:目的
木薯Manihot esculenta Crantz是全球热带地区重要的粮食作物和经济作物,在生长发育过程中极易遭受低温、干旱、盐碱等非生物胁迫而导致减产。胁迫相关蛋白(Stress-associated protein,SAP)是一类新型的A20/AN1锌指蛋白,在模式作物应对多种非生物胁迫过程中发挥重要作用。目前,SAP基因在木薯应对非生物胁迫中的生物学功能尚不明确。本研究旨在分析木薯SAP家族成员的蛋白结构特征和表达模式,以及MeSAP11的互作蛋白,为进一步解析该家族基因在木薯抗逆中的功能提供理论支撑。
方法利用生物信息学技术对木薯SAP家族成员的进化关系、蛋白基序信息以及时空表达模式开展系统分析。同时,通过qRT-PCR研究各基因成员在不同组织中的特异表达以及对不同非生物胁迫的响应。进一步运用酵母双杂交结合高通量测序技术获得与MeSAP11相互作用的蛋白及对应生物学通路。
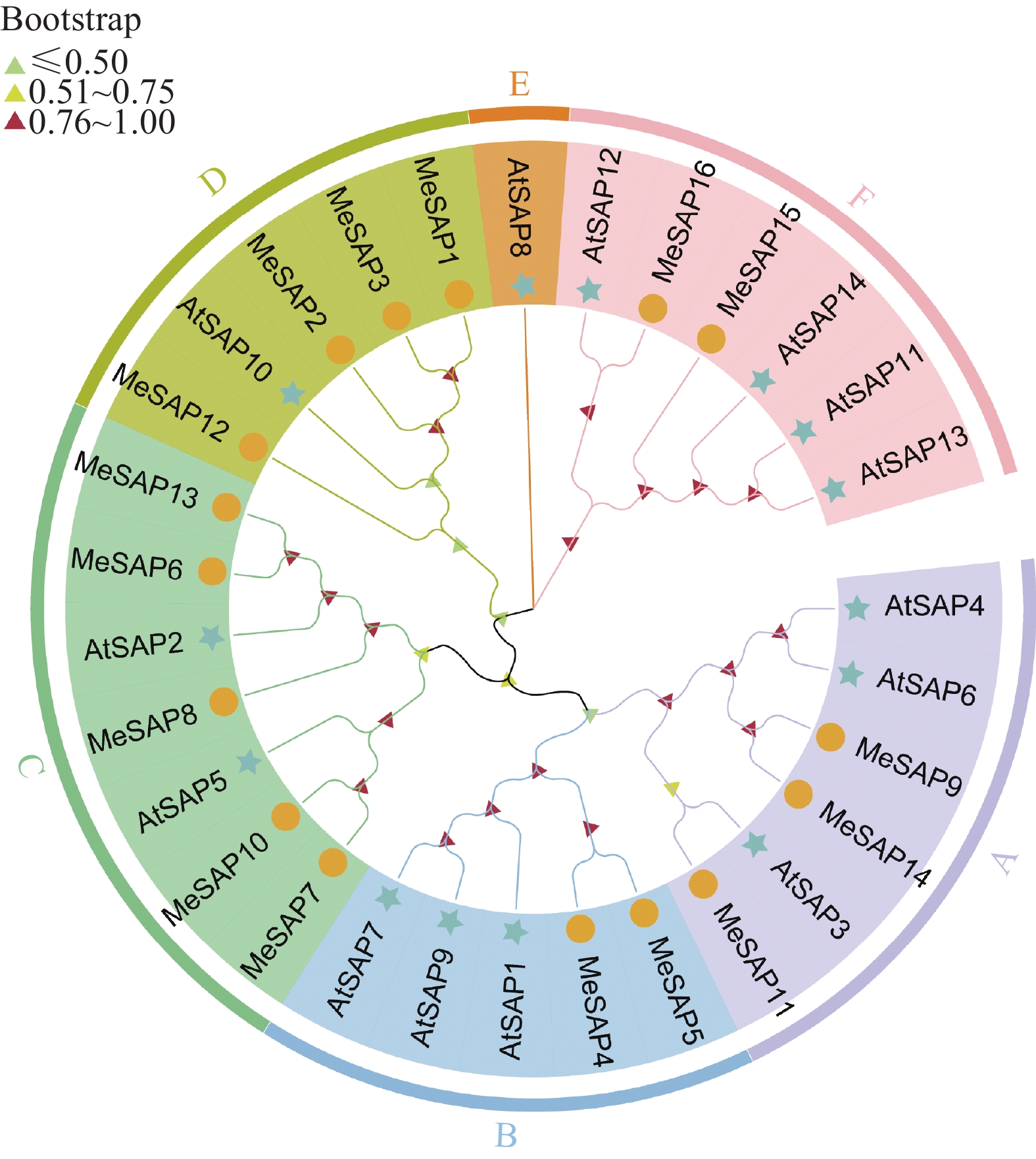
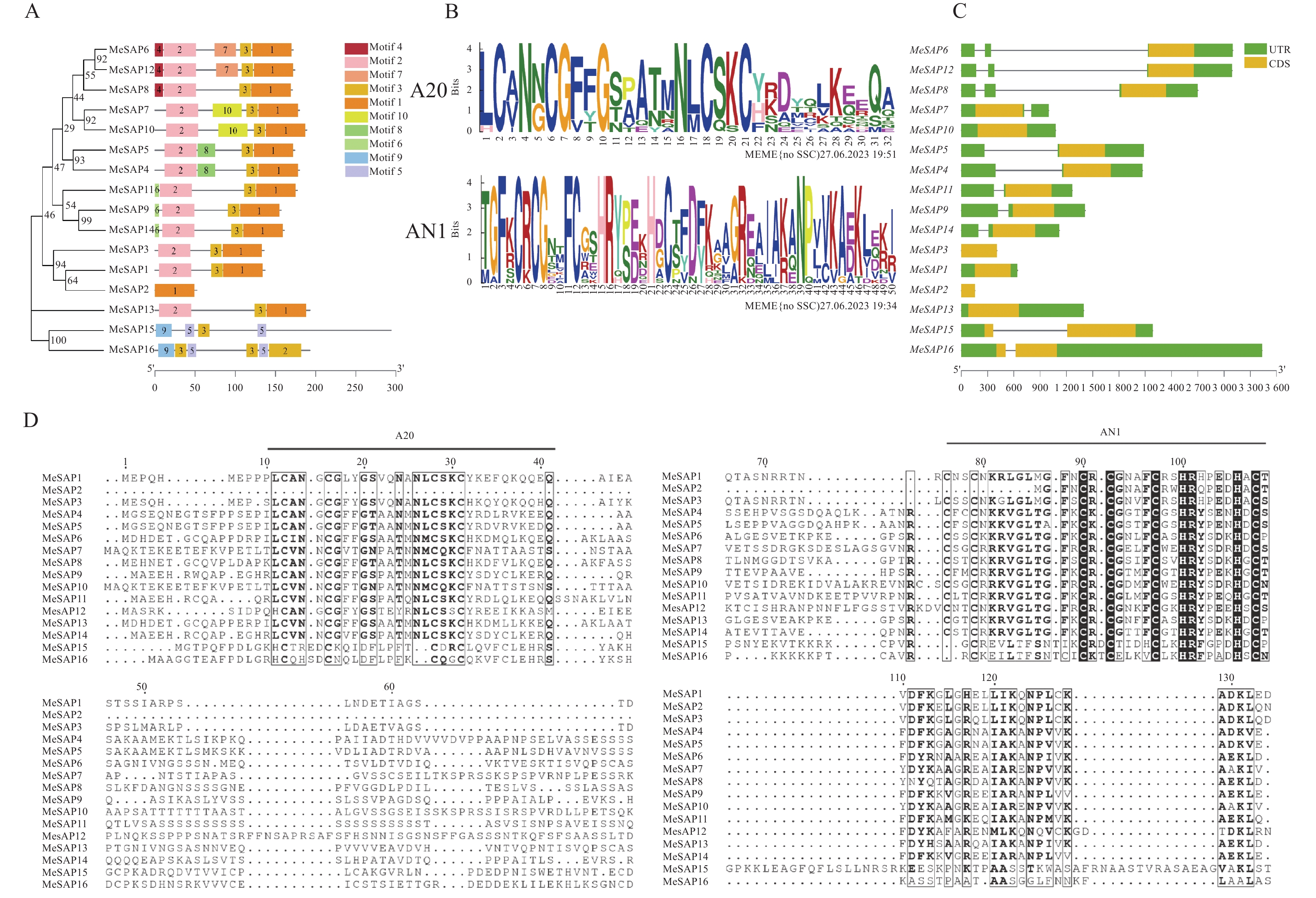
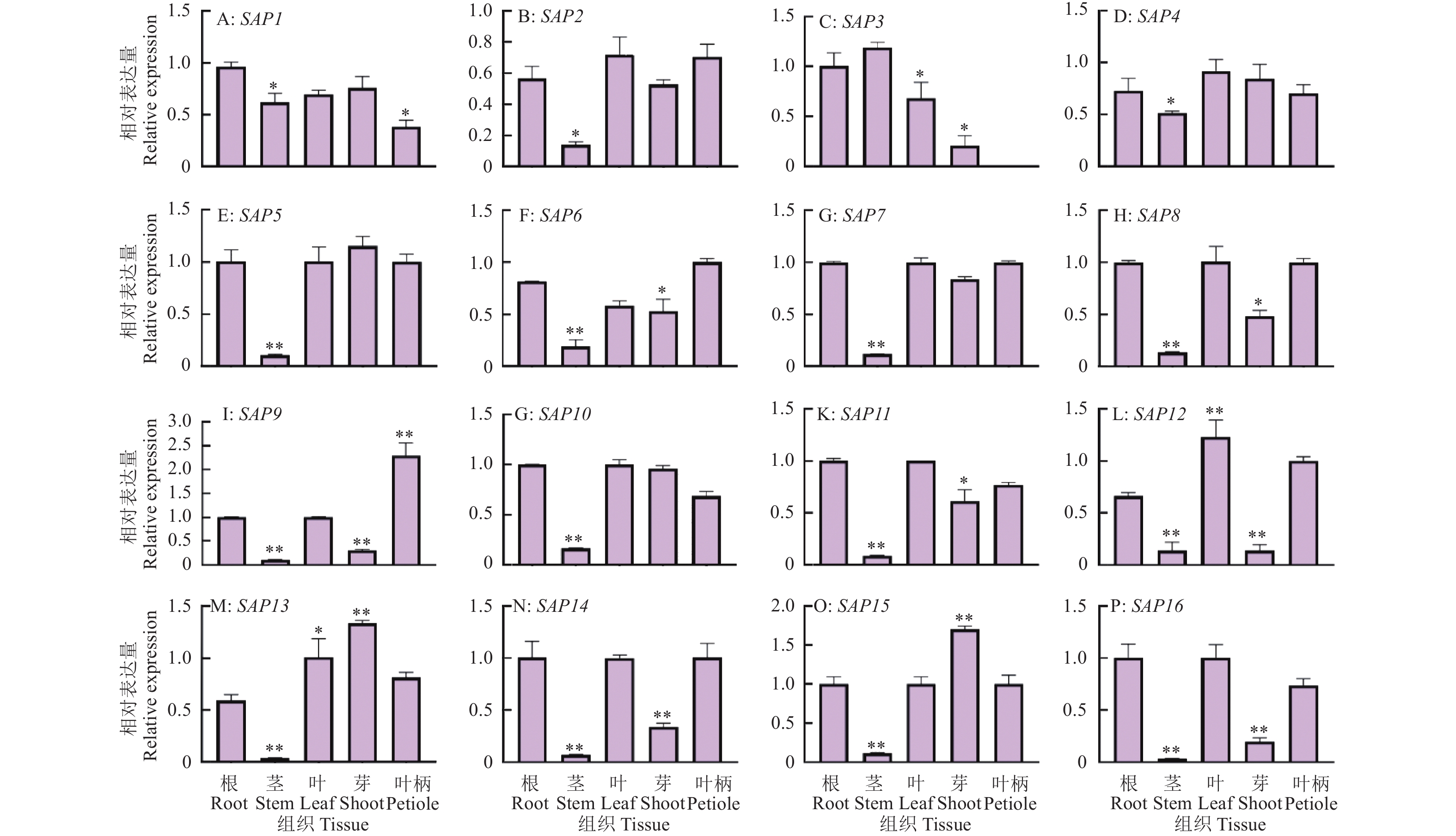
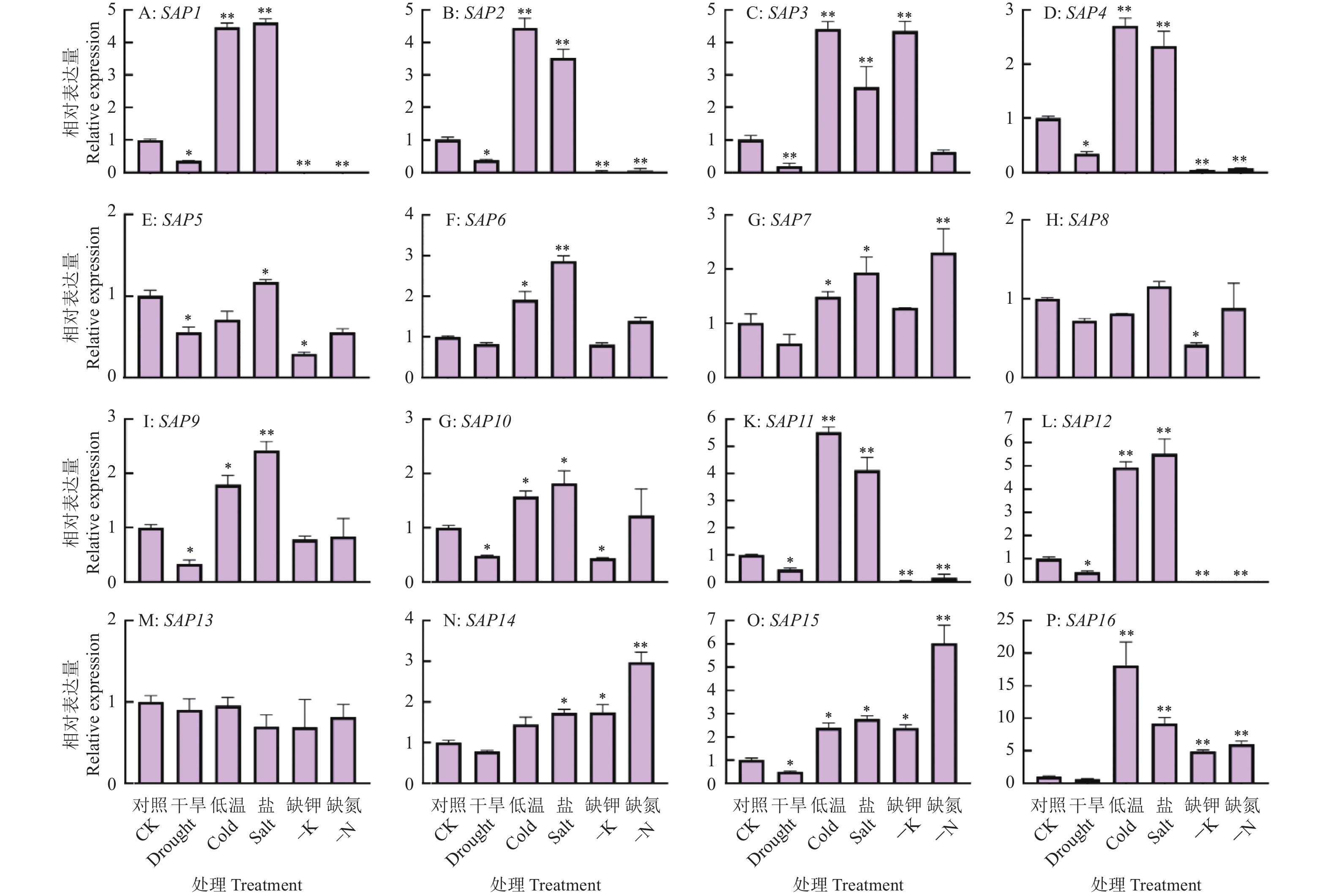
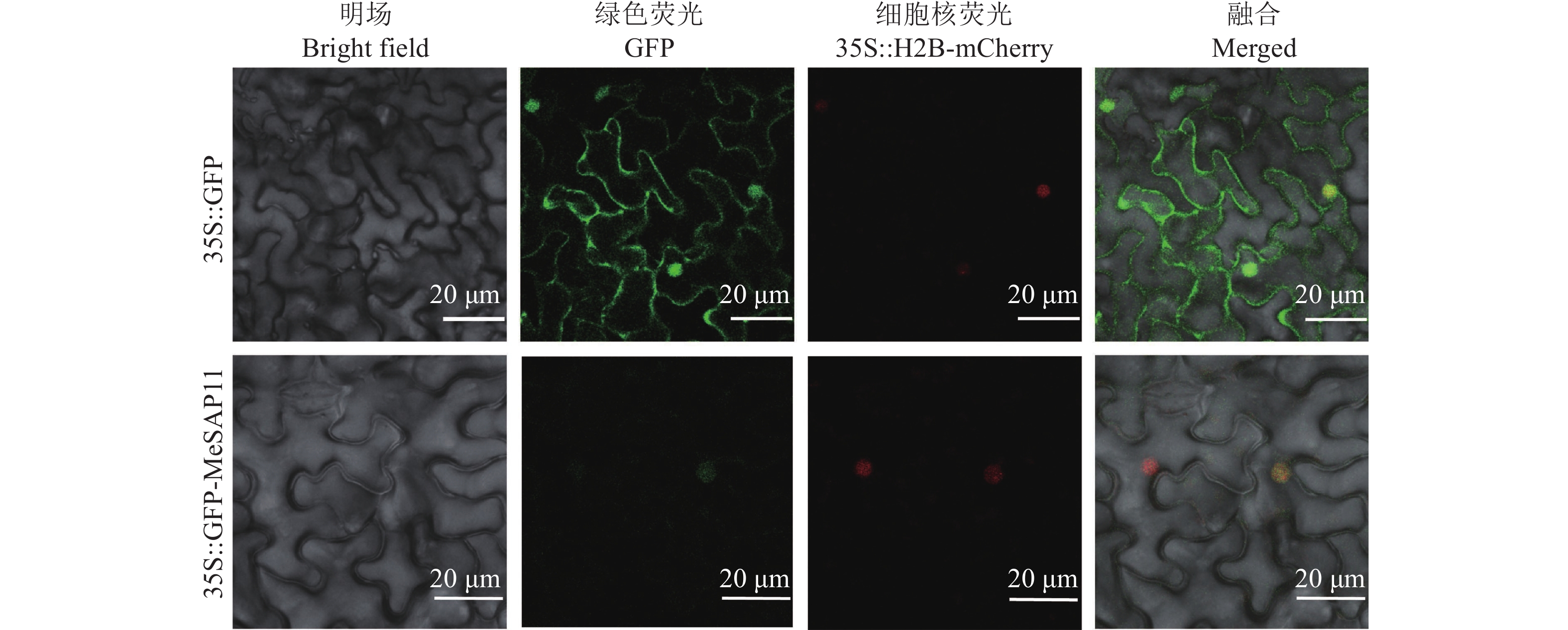
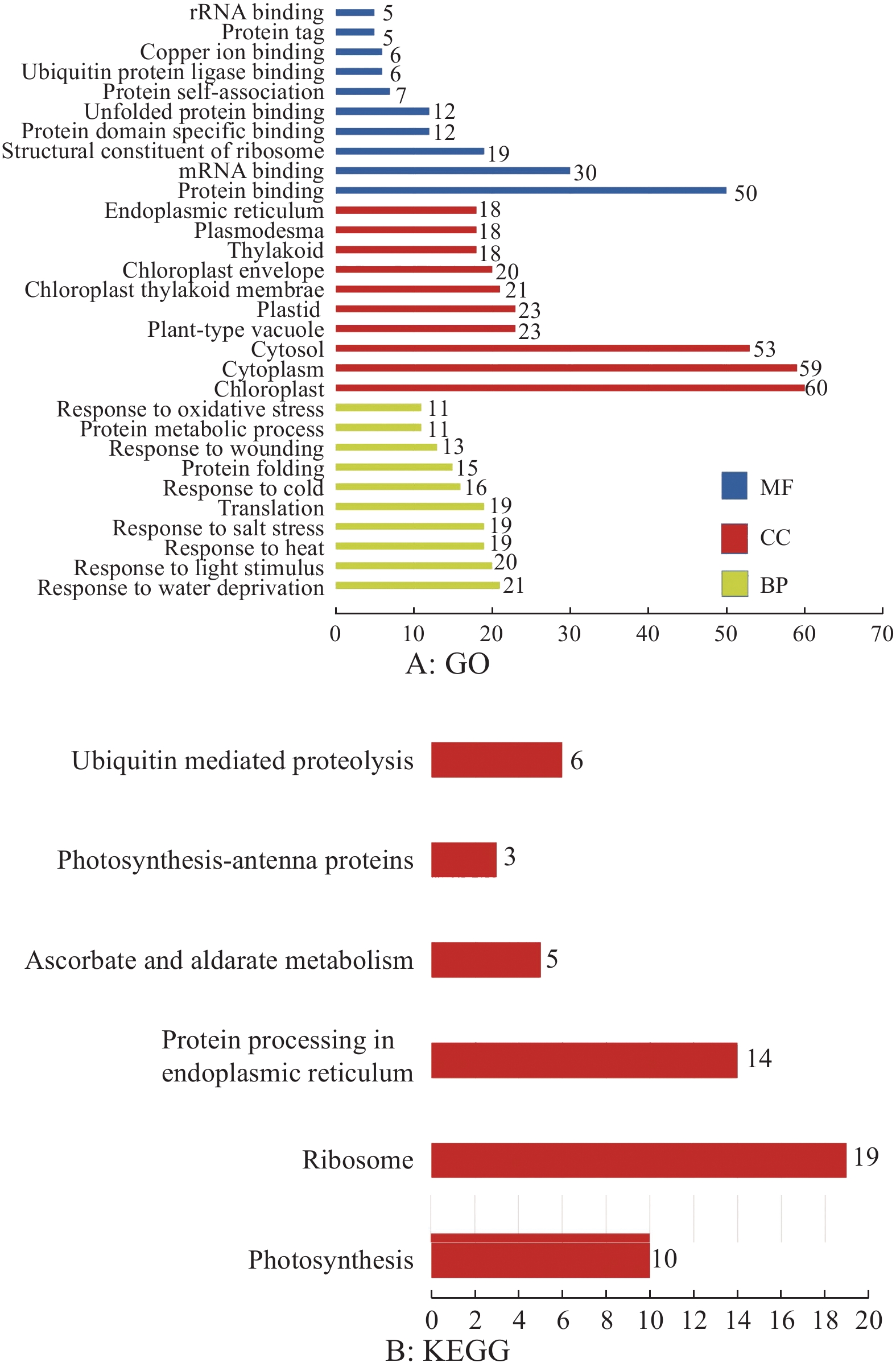
结果木薯SAP基因家族共6个大类16个成员,该家族成员在木薯根部和叶片中表达量较高,部分家族成员的表达在低温和盐胁迫中显著上调,在干旱、钾饥饿和氮饥饿显著下调。MeSAP11的表达受不同胁迫条件的显著调控,亚细胞定位结果表明MeSAP11蛋白主要定位在细胞核。利用酵母双杂交筛库技术筛选到256个与MeSAP11互作的蛋白,KEGG分析表明这些互作基因主要参与蛋白泛素化降解、内质网蛋白质加工通路等途径,暗示MeSAP11可能通过上述通路发挥功能。
结论木薯SAP 家族大部分成员显著响应低温、干旱、高盐以及缺氮、缺钾胁迫,研究结果为进一步研究MeSAP11在木薯响应非生物胁迫过程中的功能并解析其调控网络奠定了基础。下一步将把MeSAP11基因列为调控非生物逆境变化的候选基因开展深入研究。
Abstract:ObjectiveCassava is an important food and economic crop in tropical regions worldwide, and it is highly susceptible to yield reduction due to non-biological stresses such as low temperature, drought, and salinity during its growth and development. Stress-associated proteins (SAPs) are a novel class of A20/AN1 zinc finger proteins that play important roles in the response of model crops to various non-biological stresses. The biological functions of SAPs in cassava’s response to non-biological stresses are not yet clear. This study aims to analyze the protein structure characteristics and expression patterns of the cassava SAPs, as well as the interacting proteins of MeSAP11, and provide theoretical support for further understanding the function of cassava SAPs in response to abiotic stresses.
MethodBioinformatics techniques were used to systematically analyze the evolutionary relationships, protein motif information, and spatiotemporal expression patterns of the cassava SAPs. Additionally, qRT-PCR was used to study the specific expression of each gene member in different tissues and their response to abiotic stresses. Furthermore, yeast two-hybrid combined with high-throughput sequencing technology was used to identify the proteins interacting with MeSAP11 and their corresponding biological pathways.
ResultThe cassava SAP gene family consisted of six major classes and 16 members. The expression levels of these family members were higher in cassava roots and leaves. The expressions of several family members were significantly up-regulated by low temperature and salt stress, and significantly down-regulated by drought, potassium starvation and nitrogen starvation. The expression of MeSAP11 was significantly regulated under different stress conditions, and subcellular localization results indicated that the MeSAP11 protein was mainly located in the nucleus. Using yeast two-hybrid screening, 256 proteins were identified to interact with MeSAP11, and KEGG analysis indicated that these interacting genes are mainly involved in protein ubiquitination degradation and endoplasmic reticulum protein processing pathways, suggesting that MeSAP11 may function through these pathways.
ConclusionThe majority of the cassava SAPs are significantly regulated by low temperature, drought, high salinity, nitrogen deficiency, and potassium deficiency stresses. These results lay a theoretical fundation for the function exploration of MeSAP11 in cassava responding to abiotic stress, and point out a direction for further study to unravel its regulatory network. MeSAP11 is identified as a candidate gene for further in-depth research on regulating non-biological stress changes.
-
Keywords:
- Cassava /
- Abiotic stress /
- MeSAP gene /
- Protein-protein interaction screening
-
亚甲基蓝(Methylene blue, MB)属噻嗪类的染料类化合物。在淡水鱼类养殖中,MB对水霉病、红嘴病、小瓜虫病等淡水鱼常见疾病都有较好的预防和治疗的效果[1-2]。但随着渔业养殖行业的快速发展,也产生了含有大量MB的养殖废水,而高浓度的MB溶液具有一定的毒性,对自然环境和人体健康均有严重的影响[3-5],因此对养殖废水中的MB进行有效处理显得尤为重要。普鲁士蓝(Prussian blue, PB)是一种配位聚合物,属于有机骨架类,由无机金属中心内配位层与桥连的有机结构外配位层配体相互连接而成的、具有周期性框架结构的晶体材料[6-7]。在普鲁士蓝晶体中,每相邻的铁呈现2种不同的价态:FeII和FeIII,并且与—CN—一起构建成有机骨架。当FeII/H2O2混合后发现,FeII可以催化H2O2分解,产生氧化性较强的羟基自由基(•OH),可将有机污染物快速氧化分解,同时FeII转变成FeIII,因此芬顿(Fenton)催化降解成为一种治理环境的高效方法[8]。与此同时发现,FeIII具有光芬顿(Photo-Fenton)催化效果,FeIII/H2O2的混合体系被光照射时,FeIII在光的作用下催化H2O2分解产生•OH,对污染物有相似的降解效果,并且FeIII转变成FeII[9]。PB的组成元素中富含FeII和FeIII,当PB/H2O2体系受到光照射后,PB中的FeII/H2O2发生芬顿、FeIII/ H2O2发生光芬顿、该过程中的2种催化反应耦合,使FeII与FeIII相互循环转化,加快了•OH产生,提高了有机污染物的降解速率[10]。
在催化降解过程中对体系加热,热会激发活性氧的连续形成[11]。虽然热可以提高降解速率,但额外引入的热源浪费自然资源,不利于可持续化发展[12]。运用催化材料的光热效应来促进催化降解已经成为一种重要的节能方式[13-14]。PB独特的金属有机框架结构在近红外区域有着较强的光吸收,使之具有优异的光热转化效率。Fang等[15]研究表明,缓慢结晶形成的立方晶形PB的光热转化效率达到73.9%。为了高效利用太阳能,快速处理养殖溶液中MB这类有机污染物,本文制备出亚微米尺寸类球形普鲁士蓝(Submicron Prussian blue,smPB),并对smPB进行了光热转化性能的研究,以期进一步提高污染物的降解速率和太阳能的利用率,同时达到节约能源目的。
1. 材料与方法
1.1 材料
体积分数为30%的H2O2溶液、盐酸(HCl)和聚乙烯亚胺(PEI)均为分析纯,购自上海国药集团化学试剂有限公司(中国,上海),十水合亚铁氰化钠[Na4Fe(CN)6·10H2O]购自上海阿拉丁生化科技股份有限公司(中国,上海),所有药品均未进一步纯化使用。扫描电子显微镜(SEM)在Hitachi S4800仪器上测试(产自日本;供应商:天美仪拓实验设备有限公司,中国,上海);透射电子显微镜(TEM)在FEI Tecnai F20仪器上测试(产自美国;供应商:FEI香港有限公司,中国,香港);XRD在BRUKER D8 ADVANCE X射线衍射仪上测定(产自德国;供应商:布鲁克科技有限公司,中国,北京),2θ范围为5°~50°;红外光谱在Thermo NICOLET 6700红外光谱仪上测试(产自美国;供应商:赛默飞世尔科技有限公司,中国,北京),测试范围4 000~400 cm−1,KBr压片法;电子顺磁共振在Bruker A300上测试(产自德国;供应商:布鲁克科技有限公司,中国,北京);亚甲基蓝的吸光度在TU-1810上测试(产自中国;供应商:苏州赛力威仪器设备有限公司,中国,苏州);紫外可见光漫反射在LAMBDA 950上测试(产自美国;供应商:珀金埃尔默仪器有限公司,中国,上海);太阳光经SAN-EIELECTRIC模拟照射(产自日本;供应商:巨力科技有限公司,中国,北京)。
1.2 亚微米尺寸类球形普鲁士蓝的制备
采用水热缓慢结晶法制备smPB。在温室条件下,称取0.3 g的Na4Fe(CN)6·10H2O溶解在100 mL去离子水中;随后,向溶液里滴加0.1 g聚乙烯亚胺(Polyethylenimine, PEI,相对分子质量为1 000),搅拌10 min后,向溶液里滴加6 mL浓盐酸(体积分数为5%);接着,在60 ℃油浴锅里加热6 h;然后,使用真空抽滤装置收集沉淀物,并分别用水和乙醇溶液(体积分数为50%)清洗若干次;最后,在60 ℃的真空烘箱里干燥4 h。
1.3 光热转化试验
取20 mg的smPB置于100 mL的去离子水中,放置在太阳光模拟器下,使用1个太阳光的功率对其进行1 h的照射,每隔2 min记录1次溶液温度。smPB在200~2 500 nm波长范围内的光热转化效率(
$ \eta $ )计算公式如下:$$ \eta =\frac{\displaystyle\sum A_{i}{\eta }_{i}}{\displaystyle\sum {\eta }_{i}}\times 100{\text{%}} ,$$ 式中,Ai表示特定波长下的吸光率,%;ƞi表示特定波长下的能量;
${{i}}=200\sim 2 \;500 $ 。1.4 芬顿、光芬顿以及光热芬顿催化试验
取20 mg的smPB置于100 mL的MB溶液(ρ=20 mg/L)中,黑暗中搅拌30 min,使smPB达到吸附饱和平衡。芬顿催化降解时,向体系中加入1 mL的 H2O2溶液(质量分数为30%),每隔5 min取出4 mL溶液,测量MB浓度;光分顿催化降解时,将体系置于通入循环水的双层烧杯中,保持溶液温度26 ℃恒定,在1个太阳光功率照射下,向体系中加入1 mL的H2O2溶液,每隔5 min取出4 mL溶液,测量MB浓度;光热芬顿催化降解时,将体系置于太阳光模拟器下,用1个太阳光的功率照射,然后向体系中加入1 mL的H2O2溶液,每隔5 min取出4 mL溶液,测量MB浓度。
MB浓度测量方法:测量前期,首先准备0、0.1、0.2、0.4、0.8、1.0、5.0、10.0、15.0、20.0、25.0、30.0 mg/L的MB溶液,分别在TU-1810上测量MB不同质量浓度的吸光度,并以吸光度为横坐标,MB质量浓度为纵坐标绘制标准曲线。催化降解MB时,在TU-1810上测量出MB实时吸光度后,通过标准曲线找到MB实时质量浓度。MB去除效率(E)按照下式计算:
$$ E=\frac{{\rho }_{t}}{{\rho }_{0}}\times 100{\text{%}} , $$ 式中,ρ0表示初始MB质量浓度,ρt表示t时刻MB质量浓度,mg/L。
采用伪一级反应速率方程对MB催化反应过程的反应动力学进行分析,伪一级动力学公式如下:
$$ {{C}_{t}}={{C}_{0}}{{\text{e}}^{(-kt)}}, $$ 式中,Ct为反应时间为t的MB质量浓度,C0为初始MB质量浓度,mg·L−1;k为伪一级反应速率常数,min−1;t为时间,min。
2. 结果与分析
2.1 形貌表征
根据文献中报道的合成Fe4[Fe(CN)6]3立方体微粒的方法[13],向溶液中添加PEI,在PEI链上的氨基基团作用下,控制PB的结晶过程形成smPB粒子。如图1a所示,smPB粒子直径范围在200~300 nm之间,形貌、尺寸大小较为均一。如图1b所示,smPB表面呈蜂窝状纹路,层层复合。溶液里的PEI会影响普鲁士蓝表面生长,当普鲁士蓝初期缓慢结晶形成一个晶种时,PEI会附着在晶种表面,普鲁士蓝在表面附着PEI的晶种上生长,当长到一定厚度时,溶液中的PEI又会附着在刚长成的晶体表面,以此方式循环生长,直到尺寸变为一定大小时停止生长,形成类层层堆叠的结构形状。如图1c所示,可以清晰地观察到,smPB中C、Fe、N和O等元素,且分布较为均匀。
2.2 红外光谱和XRD表征
图2为smPB的红外光谱图,其中,3 430 cm−1属于水分子的振动吸收峰,2066 cm−1属于氰基的振动吸收峰,表示—CN—的振动[16],表明smPB具有PB的特征峰。
图3为未经PEI调控所制备的PB标准XRD谱图和经过PEI调控后制备的smPB的XRD谱图。从图3中可以发现,PB和smPB均在17.5°、24.8°、28°、35.1°、39.5°出现衍射峰,这与Fang等[15]报道的立方晶形PB衍射峰基本相同,表明smPB具有Fe4[Fe(CN)6]3的晶体结构。
2.3 XPS表征
为了进一步分析smPB材料的表面特性,对其进行XPS表征分析。由图4的 XPS总谱图可以知道,smPB材料由C、N、O、Fe组成,无其他元素,这与XRD表征结果一致。
由图5的精细谱可以知道,Fe2P有6个主峰,分别为FeII2P3/2、FeIII2P3/2、FeII2P1/2、FeIII2P1/2以及2个卫星峰;706.5和719.9 eV处的结合能峰代表分别为FeII2P3/2和FeIII2P1/2,708.9和722.4 eV处的结合能峰代表分别为FeIII2P3/2和FeIII2P1/2,712.2和725.1 eV处的结合能峰代表2个卫星峰。XPS表征结果与XRD表征结果一致,证明smPB为Fe4[Fe(CN)6]3的材料。
2.4 全光谱吸光率
为了研究smPB的吸光性能,在波长为200~2 500 nm的范围内对其进行测试。如图6所示,在太阳能主要分布的近红外区域200~1 200 nm的范围内,smPB的吸光率较高,对近红外光的吸光率达到90%左右;在太阳能分布较弱的其他波段也维持较高的吸收率;全光谱太阳光的照射下,smPB光热转化率达到89.8%。
2.5 羟基自由基检测结果
在芬顿催化降解反应体系中,•OH对有机污染物的催化降解起到重要作用。图7的结果表明,当smPB与H2O2共存于反应溶液中,在有、无光照的条件下均可以清晰地观察到强度对比为1∶2∶2∶1的•OH特征信号,表明在芬顿以及光芬顿催化降解过程中,smPB有效激活H2O2产生•OH。在没有太阳光照射的情况下,smPB与H2O2共存的体系中产生•OH的量较少,催化能力弱;但在有光照的条件下,•OH的特征信号峰强度远高于黑暗条件下的强度,太阳光加速FeII/FeIII的循环转化并促进了•OH的产生,从而加快催化降解速率。芬顿以及光芬顿催化降解过程和最终产物如下[17]:
$$ {{\rm{[F}}{{\rm{e}}^{{\rm{II}}}}{\left( {{\rm{CN}}} \right)_{\rm{6}}}]^{{\rm{4 - }}}}{\rm{ + }}{{\rm{H}}_{\rm{2}}}{{\rm{O}}_{\rm{2}}} \to {[{\rm{F}}{{\rm{e}}^{{\rm{III}}}}{\left( {{\rm{CN}}} \right)_{\rm{6}}}{\rm{]}}^{{\rm{3 - }}}} + \bullet {\rm{OH + O}}{{\rm{H}}^{\rm{ - }}}, $$ (3) $$ {{\rm{[F}}{{\rm{e}}^{{\rm{III}}}}{\left( {{\rm{CN}}} \right)_{\rm{6}}}\left] {^{{\rm{3 - }}}{\rm{ + }}{{\rm{H}}_{\rm{2}}}{{\rm{O}}_{\rm{2}}} \to {\rm{ }}} \right[{\rm{F}}{{\rm{e}}^{{\rm{II}}}}{\left( {{\rm{CN}}} \right)_{\rm{6}}}{\rm{]}}^{{\rm{4 - }}}} + \bullet {\rm{OOH + }}{{\rm{H}}^{\rm{ + }}}, $$ (4) $$ \bullet {\rm{OOH + }}{{\rm{H}}_{\rm{2}}}{{\rm{O}}_{\rm{2}}} \to \bullet {\rm{OH + }}{{\rm{H}}_{\rm{2}}}{{\rm{O}}_{\rm{2}}}{\rm{ + }}{{\rm{O}}_{\rm{2}}}, $$ (5) $$ {{\rm{[F}}{{\rm{e}}^{{\rm{III}}}}{\left( {{\rm{CN}}} \right)_{\rm{6}}}{\rm{]}}^{{\rm{3 - }}}}{\rm{ + }}hv{\rm{ + }}{{\rm{H}}_{\rm{2}}}{\rm{O}} \to {\rm{ [F}}{{\rm{e}}^{{\rm{II}}}}{\left( {{\rm{CN}}} \right)_{\rm{6}}}{{\rm{]}}^{{\rm{4 - }}}} + \bullet {\rm{OH + }}{{\rm{H}}^{\rm{ + }}}, $$ (6) $$ \bullet {\rm{OH + MB}} \to 中间产物 {\rm{}} \to {\rm{ C}}{{\rm{O}}_{\rm{2}}}{\rm{ + }}{{\rm{H}}_{\rm{2}}}{\rm{O}}。 $$ (7) 2.6 光热转化能力
smPB具有将光转化为热的能力。在1个太阳光的照射下,对有(无) smPB粒子的水溶液的温度进行了监测,结果见图8。由图8可见,纯水溶液在1个太阳光下照射1 h后,纯水的温度从26 ℃上升到31 ℃左右;含有smPB的水溶液,经过1 h的照射,温度由26.0 ℃上升到34.8 ℃左右。在纯水体系中,水对近红外光有一定的吸收能力,从而导致纯水温度上升。在0~15 min时,2条曲线重合,在这个阶段,2个体系中溶液温度的提升主要源自水对近红外光的吸收而产生的热;在15~60 min时,含有smPB粒子的溶液温度明显高于纯水溶液的温度,在此阶段,smPB进行光热转化作用产生的热远高于水吸收近红外产生的热,使含有smPB粒子体系的温度比纯水的温度高。
2.7 催化降解速率
为了考察光热、光以及无光等条件下,smPB对MB的催化降解情况,分别进行了光热芬顿催化降解、光芬顿催化降解以及芬顿催化降解,试验结果如图9所示。由图9可见,在可见光的照射且有光热产生的情况下,smPB的光热芬顿催化降解速率明显高于光芬顿和芬顿降解速率;在光热芬顿催化时,smPB在40 min时将20 mg/L的MB基本完全降解,而光芬顿催化降解率为50%、芬顿催化降解率为20%。没有加入smPB仅含有H2O2的对照组中,在有光照以及水吸收红外产生热的条件下,40 min时对MB的降解速率为40%(图9a);仅含有H2O2的对照组中,在光照且使用循环水装置去除热的条件下,40 min时的降解速率为10%(图9b);仅含有H2O2的对照组,在没有光照的条件下降解速率为0(图9c)。光热芬顿催化降解时,在光和热的作用下,加速FeII和FeIII的循环转化速率,加快•OH的产生,热会促进催化降解速率,光和热的耦合提高了有机污染物的催化降解速率。
采用伪一级反应速率方程进一步分析MB催化反应过程的动力学,结果见图10。从图10中可以看出,在光热条件下,smPB的反应速率常数达到0.058,高于其他条件下的反应速率常数。这是因为在光和热的作用下,加快了MB的催化降解速率。
3. 结论
采用Na4Fe(CN)6·10H2O与PEI为主要原料,通过水热缓慢结晶法,利用PEI链上的氨基基团,控制PB的结晶过程,研制出具有良好的光热转化性能以及光热芬顿催化性能的smPB催化剂。当自然界中最为丰富的清洁能源太阳能被smPB利用时,smPB可以将太阳能转化为热能,兼备光芬顿性能的smPB,将光和热2种功能耦合在一起,不仅提高了太阳能的利用率,同时加速对污染物的降解。在1个太阳光辐射1 h的情况下,含有smPB粒子的溶液温度提高8.8 ℃左右,比无smPB粒子的对照组溶液温度高3.8 ℃左右。在催化降解时,H2O2的降解能力较低,加入smPB催化剂后,对MB的催化降解速度有所提高;当利用太阳光对该体系进行光热芬顿催化降解时,在光和热的作用下,FeII和FeIII的循环转化速率加快,与光芬顿和芬顿条件下相比,MB的降解速度大大提升,40 min内可以将100 mL溶液(MB质量浓度为20 mg/L)中的MB污染物降解99%。
-
表 1 木薯MeSAP家族蛋白的理化性质
Table 1 Physical and chemical properties of MeSAP family protein in cassava
名称
Name氨基酸数量
Number of
amino acid相对分子质量
Relative molecular
weight理论等电点
Theoretical
PI不稳定系数
Instability
index蛋白疏水性
Aliphatic
index脂溶性系数
Coefficient of fat
solubilityMeSAP1 136 15 101.02 8.02 46.82 57.50 −0.744 MeSAP2 51 6 004.96 5.40 49.63 65.10 −0.698 MeSAP3 135 14 950.05 8.93 52.51 61.48 −0.583 MeSAP4 179 18 922.35 7.99 34.34 58.94 −0.380 MeSAP5 173 18 308.73 8.68 25.06 58.21 −0.387 MeSAP6 171 18 467.02 8.44 30.59 61.11 −0.480 MeSAP7 179 19 204.52 9.01 44.22 52.91 −0.618 MeSAP8 170 17 892.20 8.48 32.07 60.88 −0.284 MeSAP9 156 17 325.93 8.90 49.73 58.21 −0.440 MeSAP10 188 20 393.91 8.90 40.45 55.59 −0.545 MeSAP11 176 18 929.37 9.13 54.33 60.40 −0.431 MeSAP12 192 21 446.91 9.37 44.90 38.70 −0.782 MeSAP13 173 18 534.17 8.44 26.36 66.53 −0.349 MeSAP14 160 17 700.14 8.75 43.69 57.31 −0.589 MeSAP15 293 32 420.86 8.65 46.82 62.56 −0.597 MeSAP16 192 21 220.33 8.98 37.91 57.97 −0.588 表 2 MeSAP11酵母在cDNA文库的筛选结果
Table 2 Screening of MeSAP11 yeast in cDNA library
基因编号
Gene number注释
AnnotationManes.13G013400.1 小热休克蛋白HSP20 Manes.11G058600.1 聚泛素3 Polyubiquitin 3 Manes.17G035300.1 泛素样蛋白 Ubiquitin-like proteins Manes.16G032100.1 DNAJ同源家族C成员 DNAJ member C Manes.04G165900.1 GTPase激活蛋白 AGD11 Manes.01G042200.1/
Manes.13G124500.1热休克蛋白热应激转录因子
Heat shock protein HSF24Manes.07G019300.1 聚泛素4 Polyubiquitin 4 Manes.09G144100.1 转录因子 NAC47 Manes.09G032800.1 转录因子 SPL9 Manes.14G148600.1 I 类热休克蛋白
Class I heat shock proteinManes.09G042800.1 未知蛋白 Uncharacterized protein Manes.12G078200.1 WD重复蛋白 WD protein Manes.15G054800.1 转换因子 Translation factor Manes.05G204500.1 一种配子表达的跨膜蛋白HAP8 Manes.13G087500.1 蛋白激酶家族蛋白
Protein kinase family proteinsManes.09G036800.1 泛素样蛋白 Ubiquitin-like proteins -
[1] 曹升, 陈江枫, 黄富宇, 等. 广西木薯产业现状分析及其发展建议[J]. 南方农业学报, 2021, 52(6): 1468-1476. doi: 10.3969/j.issn.2095-1191.2021.06.005 [2] WANG W Q, FENG B X, XIAO J F, et al. Cassava genome from a wild ancestor to cultivated varieties[J]. Nature Communications, 2014, 5: 5110. doi: 10.1038/ncomms6110
[3] COBB J N, DECLERCK G, GREENBERG A, et al. Next-generation phenotyping: Requirements and strategies for enhancing our understanding of genotype-phenotype relationships and its relevance to crop improvement[J]. Theoretical and Applied Genetics, 2013, 126(4): 867-887. doi: 10.1007/s00122-013-2066-0
[4] 李智博, 董世满, 李淑霞, 等. 木薯SR45亚家族基因鉴定及表达[J]. 华南农业大学学报, 2022, 43(5): 20-28. doi: 10.7671/j.issn.1001-411X.202111032 [5] GONG Z, XIONG L, SHI H, et al. Plant abiotic stress response and nutrient use efficiency[J]. Science China-Life Sciences, 2020, 63(5): 635-674. doi: 10.1007/s11427-020-1683-x
[6] LANDI S, HAUSMAN J F, GUERRIERO G, et al. Poaceae vs. abiotic stress: Focus on drought and salt stress, recent insights and perspectives[J]. Frontiers in Plant Science, 2017, 8: 1214. doi: 10.3389/fpls.2017.01214
[7] 朱健康, 倪建平. 植物非生物胁迫信号转导及应答[J]. 中国稻米, 2016, 22(6): 52-60. doi: 10.3969/j.issn.1006-8082.2016.06.012 [8] MUKHOPADHYAY A, VIJ S, TYAJI A. Overexpression of a zinc-finger protein gene from rice confers tolerance to cold, dehydration, and salt stress in transgenic tobacco[J]. Proceedings of the National Academy of Sciences of the United States of America, 2004, 101(16): 6309-6314.
[9] 崔江慧, 杨溥原, 常金华. 高粱GRF基因家族鉴定及在非生物胁迫下的表达分析[J]. 中国农业科技导报, 2021, 23(4): 37-46. [10] KOTHARI K S, DANSANA P K, GIRI J, et al. Rice stress associated protein 1 (OsSAP1) interacts with aminotransferase (OsAMTR1) and pathogenesis-related 1a protein (OsSCP) and regulates abiotic stress responses[J]. Frontiers in Plant Science, 2016, 7: 1057.
[11] KANG M, ABDELMAGEED H, LEE S, et al. AtMBP-1, an alternative translation product of LOS2, affects abscisic acid responses and is modulated by the E3 ubiquitin ligase AtSAP5[J]. The Plant Journal, 2013, 76(3): 481-93. doi: 10.1111/tpj.12312
[12] WANG W X, VINOCUR B, ALTMAN A. Plant responses to drought, salinity and extreme temperatures: Towards genetic engineering for stress tolerance[J]. Planta Medica, 2003, 218(1): 1-14.
[13] DANSANA P K, KOTHARI K S, VIJ S, et al. OsiSAP1 overexpression improves water-deficit stress tolerance in transgenic rice by affecting expression of endogenous stress-related genes[J]. Plant Cell Reports, 2014, 33(9): 1425-1440. doi: 10.1007/s00299-014-1626-3
[14] HUANG J, WANG M M, JIANG Y, et al. Expression analysis of rice A20/AN1-type zinc finger genes and characterization of ZFP177 that contributes to temperature stress tolerance[J]. Genes, 2008, 420(2): 135-144.
[15] VIJ S, TYAGI A. Genome-wide analysis of the stress associated protein (SAP) gene family containing A20/AN1 zinc-finger(s) in rice and their phylogenetic relationship with Arabidopsis[J]. Molecular Genetics And Genomics, 2006, 276(6): 565-575. doi: 10.1007/s00438-006-0165-1
[16] JIA H X, LI J B, ZHANG J, et al. Genome-wide survey and expression analysis of the stress-associated protein gene family in desert poplar, Populus euphratica[J]. Tree Genetics & Genomes, 2016, 12(4): 78.
[17] BILLAH S A, KHAN N Z, ALI W, et al. Genome-wide in silico identification and characterization of the stress associated protein (SAP) gene family encoding A20/AN1 zinc-finger proteins in potato (Solanum tuberosum L.)[J]. PLoS One, 2022, 17(8): e0273416. doi: 10.1371/journal.pone.0273416
[18] HE X, XIE S, XIE P, et al. Genome-wide identification of stress-associated proteins (SAP) with A20/AN1 zinc finger domains associated with abiotic stresses responses in Brassica napus[J]. Environmental and Experimental Botany, 2019, 165: 108-119. doi: 10.1016/j.envexpbot.2019.05.007
[19] KANNEGANTI V, GUPTA A K. Overexpression of OsiSAP8, a member of stress associated protein (SAP) gene family of rice confers tolerance to salt, drought and cold stress in transgenic tobacco and rice[J]. Plant Molecular Biology Reporter, 2008, 66(5): 445-462. doi: 10.1007/s11103-007-9284-2
[20] HOZAIN M, ABDELMAGEED H, LEE J, et al. Expression of AtSAP5 in cotton up-regulates putative stress-responsive genes and improves the tolerance to rapidly developing water deficit and moderate heat stress[J]. Journal of Plant Physiology, 2012, 169(13): 1261-1270. doi: 10.1016/j.jplph.2012.04.007
[21] BEN S R, MEYNARD D, BEN R W, et al. The promoter of the AlSAP gene from the halophyte grass Aeluropus littoralis directs a stress-inducible expression pattern in transgenic rice plants[J]. Plant Cell Reports, 2015, 34(10): 1791-1806. doi: 10.1007/s00299-015-1825-6
[22] LI J, SUN P, XIA Y, et al. A stress-associated protein, PtSAP13, from Populus trichocarpa provides tolerance to salt stress[J]. International Journal of Molecular Sciences, 2019, 20(22): 5782. doi: 10.3390/ijms20225782
[23] FUENTES-BEALS C, VALDÉS-JIMÉNEZ A, RIADI G. Hidden Markov Modeling with HMMTeacher[J]. PLoS Computational Biology, 2022, 18(2): e1009703. doi: 10.1371/journal.pcbi.1009703
[24] GOODSTEIN D M, SHU S, HOWSON R, et al. Phytozome: A comparative platform for green plant genomics[J]. Nucleic Acids Research, 2012, 40(D1): D1178-D1186. doi: 10.1093/nar/gkr944
[25] CHEN C J, CHEN H, ZHANG Y, et al. TBtools: An integrative tookit developed for interactive analyses of big biological data[J]. Molecular Plant Pathology, 2020, 13(8): 1194-1202.
[26] KUMAR S, STECHER G, TAMURA K. MEGA7: Molecular evolutionary genetics analysis version 7.0 for bigger datasets[J]. Molecular Biology and Evolution, 2016, 33(7): 1870-1874. doi: 10.1093/molbev/msw054
[27] SHARMA G, GIRI J, TYAGI A K. Rice OsiSAP7 negatively regulates ABA stress signalling and imparts sensitivity to water-deficit stress in Arabidopsis[J]. Plant Science, 2015, 237: 80-92. doi: 10.1016/j.plantsci.2015.05.011
[28] DIXIT A R, DHANKHER O P. A novel stress-associated protein ‘AtSAP10’ from Arabidopsis thaliana confers tolerance to nickel, manganese, zinc, and high temperature stress[J]. PLoS One, 2011, 6(6): e20921. doi: 10.1371/journal.pone.0020921
[29] 张子奇, 李可, 陈银华, 等. 木薯MeSAP13基因的克隆及其抗细菌性枯萎病功能鉴定[J]. 热带作物学报, 2022, 43(10): 1981-1988. [30] ZHAO P, WANG D D, WANG R Q, et al. Genome-wide analysis of the potato Hsp20 gene family: Identification, genomic organization and expression profiles in response to heat stress[J]. BMC Genomics, 2018, 19(1): 61. doi: 10.1186/s12864-018-4443-1
[31] LI S X, CHENG Z H, LI Z B, et al. MeSPL9 attenuates drought resistance by regulating JA signaling and protectant metabolite contents in cassava[J]. Theoretical and Applied Genetics, 2022, 135(3): 817-832. doi: 10.1007/s00122-021-04000-z
[32] LIU G Z, LI X L, JIN S X, et al. Overexpression of rice NAC gene SNAC1 improves drought and salt tolerance by enhancing root development and reducing transpiration rate in transgenic cotton[J]. PLoS One, 2014, 9(1): e86895. doi: 10.1371/journal.pone.0086895
[33] KIM G D, CHO Y H, YOO S D. Regulatory functions of evolutionarily conserved AN1/A20-like Zinc finger family proteins in Arabidopsis stress responses under high temperature[J]. Biochemical and Biophysical Research Communications, 2015, 457(2): 213-220. doi: 10.1016/j.bbrc.2014.12.090
-
期刊类型引用(7)
1. 王铎,刘志刚,韩志武,张强,张楠楠,裴承慧. 灌木平茬锯片的仿生设计与试验验证. 林产工业. 2025(03): 57-62 .  百度学术
百度学术
2. 雷如飞. 重型绿篱修剪机刀具的可靠性提升策略. 南方农机. 2024(11): 194-195+198 .  百度学术
百度学术
3. 徐树英,陈淦兴,林常,刘世豪. 香蕉茎秆轧辊式压榨脱水机设计与试验. 农业工程学报. 2024(19): 21-32 .  百度学术
百度学术
4. 刘丽敏,任萍,陈建能,张雪恒. 基于作物力学特性的甘蔗收割机参数优化与田间试验. 浙江农业学报. 2023(05): 1187-1194 .  百度学术
百度学术
5. 梁堃,胡昀. 基于改进卷积网络的葡萄剪枝关键算法研究. 自动化与仪器仪表. 2023(06): 58-62 .  百度学术
百度学术
6. 陈月锋,宋占华,刘天宏,董世平,景全荣,李法德,孙长征. 自走式杂交构树收割机设计及试验. 农业工程. 2023(07): 89-96 .  百度学术
百度学术
7. 范方亮,邹胜良,张义广. 水下航行器变舵角滑行阻力数学建模分析. 舰船科学技术. 2022(20): 38-41+53 .  百度学术
百度学术
其他类型引用(10)









 下载:
下载: