Development and application of KASP marker for rice blast resistance gene Pi2
-
摘要:目的
水稻稻瘟病抗性基因Pi2对稻瘟病生理小种具有广谱抗性,开发Pi2的KASP分子标记并对其评价,为抗稻瘟病水稻品种分子育种提供简便、可靠的基因分型检测方法。
方法利用593份自然群体中筛选出的不同抗性和亲缘关系的2份材料H-74和H-78,针对Pi2基因核心区域的SNP位点开发成KASP标记Pi2-C3。
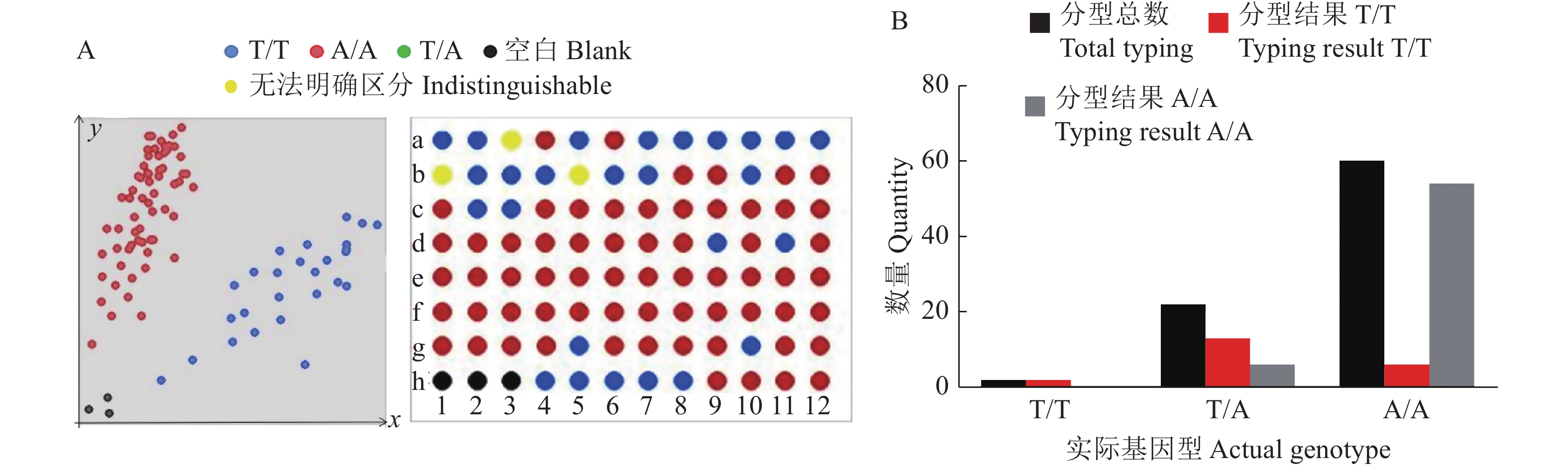
结果利用标记Pi2-C3对自然群体中的84份材料进行KASP基因分型,结果表明,该标记可以准确地将不同水稻材料的Pi2位点分为抗病基因型、杂合基因型和感病基因型,是一种高效鉴定抗稻瘟病基因Pi2的方法。利用标记Pi2-C3对阳江市病圃材料进行检测,结合表型调查结果发现,检测到含有Pi2基因的46份材料均表现出不同程度的稻瘟病抗性,表明该标记可以用于检测材料在病圃的发病情况。
结论本研究采用KASP技术,开发了能准确检测Pi2基因的特异性分子标记Pi2-C3,并建立一套水稻Pi2基因的KASP基因分型体系,对提高抗性育种效率,改良抗稻瘟病水稻品种具有重要应用价值。
Abstract:ObjectiveThe rice blast resistance gene Pi2 has broad spectrum resistance to physiological race of rice blast. Developing and evaluating KASP molecular markers for Pi2 will provide a convenient and reliable gene typing method for molecular breeding of rice varieties with blast resistance.
MethodTwo materials H-74 and H-78 with different resistance and genetic relationships selected from 593 natural populations were used to develop KASP marker for the SNP sites in the core region of the Pi2 gene, named Pi2-C3.
ResultUsing the marker Pi2-C3, 84 materials from the natural population were genotyped, and the results showed that the Pi2-C3 marker accurately distinguished the Pi2 loci of different rice materials into resistant, heterozygous, and susceptible genotypes, which was an efficient method for identifying the blast-resistant gene Pi2. The marker Pi2-C3 was used to detect the materials in Yangjiang disease nursery. Combined with the phenotypic investigation, it was found that 46 materials containing Pi2 gene showed different degrees of rice blast resistance, which indicated that the marker could be used to detect the incidence of materials in disease nursery.
ConclusionThis study develops a specific molecular marker Pi2-C3 for accurately detecting the Pi2 gene using the KASP technology, and establishes a KASP genotyping system for rice Pi2 gene. It has important application value for improving the efficiency of resistance breeding and improving blast-resistant rice varieties.
-
Keywords:
- Rice /
- Rice blast /
- Pi2 gene /
- KASP marker /
- Molecular marker /
- Resistance gene /
- Genotyping
-
沉香为一种高价值且具有芳香味的心材物质,主要由瑞香科Thymelaeaceae沉香属Aquilaria或拟沉香属Gyrinops包括19个树种在内的树体受胁迫产生[1]。它是一种非常名贵的中药,在东南亚、印度和中东各国也被奉为神药,对心脏病、肠胃疾病、中枢神经系统疾病,甚至皮肤病都有显著的疗效[2]。一些沉香制品是佛教、印度教和穆斯林祭祀典礼时必备的祭祀物,由其提取的精油也是东南亚各国所用香水中的重要成分[3]。天然的沉香树只有受到胁迫时,才能形成沉香,这是一个偶发的现象,而且需要经历一个漫长的过程。近年来,人们对沉香资源需求的增长和已有天然沉香的毁灭性采掘,导致天然的沉香资源已几近枯竭。为了保障沉香资源的合理和可持续利用,2004年开始,《濒危野生动植物种国际贸易公约》已将能够结香的树种全部列为了Ⅱ级受保护植物。白木香Aquilaria sinensis为我国特有产香树种,在海南、广东和广西等地均有广泛栽培[4]。
沉香资源的匮乏使得沉香树体结香机制的研究已势在必行。Nobuchi等[5]认为沉香形成首先表现为薄壁细胞内淀粉含量的降低,同时这些活细胞液泡化,进而有黄褐色液滴形成,物质检测发现液滴中含有酚类物质。沉香挥发油中的次生代谢物兼具抗菌和促进导管堵塞的功能,是最终沉香物质形成的关键因素[6]。沉香树体内次生代谢物的产生是抵抗胁迫的结果[1],而抗逆能力的强弱一定程度上依赖于过氧化物酶(POD)、过氧化氢酶(CAT)和超氧化物歧化酶(SOD)对活性氧(ROS)的清除作用[7-8]。一氧化氮(NO)的氧化和抗氧化的双重功能,决定了其在植物防御反应机制研究中的重要性[9]。
刘娟[10]将通体结香技术运用于4年生白木香幼树,分层采样测定结果表明,不同分层中淀粉及还原糖和油滴状物质呈显著相关关系。张兴丽[11]对3年生白木香幼树做修剪处理,探究沉香物质形成过程中淀粉、还原糖、丙二醛(MDA)含量、活性氧清除酶和一氧化氮合酶(NOS)活性等变化趋势,结果表明沉香形成过程中物质代谢途径发生了变化,有关酶活性发生急剧变化。但目前对大树抗逆性与结香关系的研究甚少,分析结香时树体变色部位的相关物质含量及酶活性的研究鲜见报道。本文通过对8年生白木香进行激素、盐、真菌和物理创伤处理,检测结香树体创伤部位抗活性氧酶、次生代谢酶活性和其他抗逆指标,分析其综合抗逆能力,探究不同处理沉香树体抗逆能力与其结香质量之间的关系,为沉香结香技术和机理的研究提供一定的理论依据。
1. 材料与方法
1.1 材料与试验地概况
试验材料为广东种源的8年生白木香,试验地位于广东省惠州市惠东县白盆珠镇,属莲花山,为花岗岩地质;南亚热带季风气候,年均气温22.0 ℃,年均日照2 038.9 h,≥10 ℃年积温7 947.9 ℃;年均降雨量1 935.7 mm;年均相对湿度80%,年蒸发量1 875 mm,常年基本无霜;土壤为山地红壤。试验林为8年生白木香人工林,林木胸径为9~10 cm。
1.2 试验方法
试验分4类15个处理和2个对照。试验所用激素为乙烯利(Et)、茉莉酸甲酯(MeJA)、六苄基嘌呤(6-BA)和脱落酸(ABA),处理1(MeJA+ABA),处理2(MeJA+ Et),处理3(6-BA + ABA),处理4(6-BA + Et),各激素的质量分数均为3‰;盐处理为亚硫酸氢钠(NaHSO3)、氯化钠(NaCl)和氯化亚铁(FeCl2)混合物,浓度为不平衡的均匀设计所得,处理5 ~8 NaHSO3、NaCl和FeCl2的质量分数组合分别为3.0‰+10.0‰+20.0‰、1.0‰+2.5‰+5.0‰、3.0‰+5.0‰+2.5‰、1.0‰+20.0‰+10.0‰;处理9为阴性对照(清水注射液);处理10~13为真菌处理,分别为黑绿木霉Trichoderma atroviride、腐皮镰孢Fusarium solani、葡萄座腔菌Botryosphaeria dothidea和龙眼焦腐病菌Lasiodiplodia theobromae,将不同真菌于28 ℃下恒温培养于马铃薯葡萄糖水(广东环凯)中,5 d后菌液经双层纱布过滤得处理液;处理14~16为物理创伤,处理14为敲皮:用橡皮锤敲击树体基部0.5 m以上,长度为60 cm,宽度为半个树直径的区域;处理15为开香门:用钢锯在树体基部0.5 m以上,每隔20 cm螺旋式开3个长度为10 cm,深度为1/3树干直径的“香门”;处理16为火烧孔:树干0.5 m以上部分,用烧红的铁钎,每隔20 cm螺旋式上升钻直径为1 cm的通透孔5个;处理17为空白对照(CK),不做任何处理。所有液体处理方法为:在目标树距地面50和60 cm处钻孔,孔径为0.5 cm,孔深6 cm,2孔呈90度交叉;选择晴朗无风的天气,将液体500 mL以最快的速度滴注入树干,滴注2次(2015年5月和7月)。
于2015年5月,采用随机区组方法选取试验目标树,每处理均为3株(单株重复),共51株。并调查目标树的初始特征。
1.3 测定指标和方法
2015年11月进行采样测定,敲皮处理将受伤树皮撕下,用凿子和手刀锯将“香门”面变色部分取下,火烧孔取孔周围变色部分。液体处理在每个孔上下各取厚度为3 cm、半径为5 cm的半圆盘2个。所有木材样品投入液氮中带回实验室,剔除白木和腐烂部分,用液氮磨成粉后放入超低温冰箱(-80 ℃)备用。挥发油提取采用超声波辅助溶剂萃取法,称取上述木粉3 g,60 ℃烘干48 h至恒质量,在60 ℃、37 kHz条件下,用体积分数为95%乙醇在超声波清洗器(德国,Elmasonic P300H)中萃取30 min,过滤后,在旋转蒸发仪中蒸干,计算挥发油质量分数。淀粉及还原糖采用改良的蒽酮-硫酸比色法测定[10],MDA含量采用硫代巴比妥法以及苯丙氨酸转氨酶(PAL)、POD、CAT的测定参照陈建勋[12]的方法,总酚含量测定采用福林法[13],SOD和NOS活性采用南京建成公司生产的试剂盒测定。
1.4 数据处理
运用Excel进行数据预处理,数据的统计分析采用SPSS18.0来进行,其中挥发油和可溶性糖含量在方差分析时分别进行反正弦和对数转换,目标树基本特征均值数据来源于3株目标树,多重比较采用Duncan’s法。
2. 结果与分析
2.1 不同处理目标树特征及挥发油质量分数分析
由表 1可知,各处理目标树胸径、树高和冠幅均值均无显著差异,且其最小值为最大值的0.93、0.89和0.70倍。
表 1 目标树基本特征1)Table 1. Basic characteristics of the sampling trees
1~17种处理挥发油质量分数依次为6.87%、8.48%、7.20%、6.57%、6.68%、7.02%、7.50%、9.86%、4.47%、12.46%、10.95%、12.15%、10.03%、4.76%、5.70%、6.21%和3.14%。其中敲皮处理、阴性对照(NK)和空白对照(CK)均小于5%,其他处理均显著高于空白对照,依次为空白对照组的2.09、2.70、2.30、2.19、2.13、2.39、2.24、3.14、3.97、3.19、3.87、3.49、1.98和1.82倍,其中真菌类处理挥发油质量分数均显著高于其他处理(除处理8外)。处理2、8、10和16白木香挥发油质量分数为8.48%、9.86%、12.46%和6.21%,接近或已达沉香入药标准(w > 10%),说明4类处理中,这4种处理最有利于沉香树体结香。
2.2 不同处理对白木香树体抗活性氧酶、NOS、PAL活性的影响
不同白木香树体抗活性氧酶活性变化如图 1所示。经方差分析可得:4种激素处理中,2号处理CAT、POD和SOD活性显著最高;盐类处理中,8号处理POD和SOD活性显著最高,其CAT活性高于7号,且显著高于同组其他处理;真菌类处理中,处理11的CAT活性高于处理13,并显著高于同类其他处理,处理10的POD和SOD活性为同类最高;物理创伤类处理中,16号处理的3种酶活性均为同类最高;其中激素类、盐类和真菌类所有处理3种酶活性显著高于空白对照和负对照。
不同处理NOS和PAL活性变化如图 2所示。方差分析可知,各处理间NOS和PAL活性差异显著。激素、盐、真菌和物理创伤类处理中,其NOS活性各自最高的处理依次为3、8、11和16,各类处理中NOS活性均有2个处理显著高于其他2个处理。各类处理中2、8、10和16号PAL活性为同类最高处理,且显著高于同类其他处理。
2.3 不同处理对白木香树体总酚、MDA、淀粉和可溶性糖含量的影响
总酚含量在激素类各处理间无显著差异;盐类处理中,处理8与处理7无显著差异,但显著高于处理5和6;真菌处理12与处理11和13无显著差异,但显著高于处理10;物理创伤类处理14显著高于处理15和16,负对照和空白对照均显著低于其他处理(图 3)。
各处理间MDA含量变化趋势较复杂:激素类处理2低于处理1,且显著低于处理3和4;盐类的4个处理MDA含量呈下降趋势,8号处理显著最低; 真菌类的11号处理显著最低; 物理创伤类除14号处理外,其他处理的MDA含量较高(图 3)。
处理2、8、13和14的淀粉含量为各类中最低(图 3),而处理2、8、13和14的可溶性糖含量为同类中显著最高,说明MeJA和Et处理,NaHSO3(w=1‰)、NaCl(w=20‰)和FeCl2(w=10‰)处理,黑绿木霉处理使白木香树体受胁迫较大,将淀粉转化成为了可溶性糖。
2.4 不同处理白木香树体抗逆能力与结香的关系
为了全面合理地评价各处理白木香树体抗逆能力,采用主成分分析法对其进行综合评价。以CAT活性、POD活性、SOD活性、NOS活性、PAL活性、MDA含量、总酚含量、可溶性糖含量和淀粉含量等9个抗逆指标为变量,以累积贡献率大于85%,确定主成分个数。本研究中,抽取主成分数为3时,累积贡献率达88.98%。分析可得,各处理(得分)依次为:1(0.01)、2(1.83)、3(0.70)、4(-0.29)、5(-0.26)、6(0.05)、7(1.09)、8(2.31)、9(-3.77)、10(2.10)、11(1.97)、12(2.07)、13(1.77)、14(-2.51)、15(-1.76)、16(-1.51)和17(-3.82),其中空白对照抗逆能力最差,负对照次之,各激素、盐类、真菌和物理创伤类处理中排名较高的处理依次为:处理2(MeJA和Et),处理8[NaHSO3(w=1‰)、NaCl(w=20‰)和FeCl2(w=10‰)]、处理10(黑绿木霉)和处理16(火烧孔)。对比各处理的挥发油含量可知,各处理中抗逆能力高者,挥发油含量也高。将两者进行线性拟合,可得拟合度大于0.8。说明白木香树体抗逆能力的高低与挥发油含量密切相关。
3. 讨论与结论
沉香形成是一个树体抗胁迫的过程,最初的人工促进手段,源于人们对天然结香方式的模仿和演化。物理创伤手段(砍伤、火烧等)促进结香的原因,被认为与开放的伤口以及氧化作用有关[14]。本研究中,物理创伤处理(除敲皮处理细胞受损严重)挥发油含量低和可溶性糖含量较高,是因为白木香树体受伤后,开放伤口可以满足伤口周围细胞活性氧增加时对氧的需求[15],较高活性的CAT、POD和SOD以及NOS,不足以完全清除这些有害物,且总酚物质含量不高,与活性氧的氧化交联作用不明显[16],而导致MDA含量较高,膜质过氧化,即抗逆能力不高, 导致薄壁细胞内次生代谢反应较弱(PAL活性低)和呼吸代谢的速率(如淀粉转化速率低)较低。
植物受胁迫时,首先是刺激信号的接收,最新研究认为脱落酸(ABA)和乙烯(ETH)是最有可能的信号分子[17]。基于此理论,有促进树体次生代谢物产生的研究中,将这些信号分子的类似物注入树体中[17]。王之胤[18]研究表明茉莉酸甲酯和乙烯利进入白木香树体后,水解为茉莉酸和乙烯,启动树体内防御反应,从而促进沉香物质积累。本研究中可见注入ABA的白木香树体韧皮部有明显的坏死现象,且结香部位呈深黑色,可能有部分细胞已经失活,所以各ABA处理酶活性和抗逆物质含量较低。6-BA和MeJA效果也不及MeJA和Et处理,原因是MeJA和Et可以促进树体防御反应的及时发生,抗活性氧酶活性较高,可以应对细胞过氧化(MDA含量低),同时NOS活性也最高,可以促进NO的合成,促使逆境信号的传导,抗逆能力提高,从而促进淀粉的代谢,可溶性糖含量增加和PAL活性提高[19],同时促进微生物之间的物质交换[20],使次生代谢产物积累[21]。
Blanchette等[22]研究表明NaHSO3、NaCl和FeCl2单独使用均可以促进沉香树结香。本研究采用均匀设计来检测盐处理对白木香树体的影响。分析显示NaHSO3(w=1‰)、NaCl(w=20‰)和FeCl2(w=10‰)综合处理抗逆能力最强,可能是此处理Na+供给最多,当树体受盐胁迫时,能保证活细胞内高渗状态的保持[23],使得淀粉含量降低,可溶性糖含量升高,所以白木香树体抗逆性增强,相关酶活性较高,次生代谢能力也提高。
研究表明一些沉香树体内生真菌,可以促进树体结香,但是其效果差异较大[24]。本研究中所用4种真菌抗逆能力在16个处理中排名均处于前列(排名2、4、3、6),这是因为真菌促使白木香树体木质部由白色变为棕褐色,是一个真菌和寄主(树体)相互作用的过程[25]。首先树体要感受真菌的刺激,真菌代谢液中可能存在诸多的信号分子,可以促使树体胁迫信号的转导,进而使得相关基因的表达,使得抗逆反应及时发生,最终在树体内积累一定量的次生代谢物[26]。本研究中挥发油质量分数(大于10%)和总酚质量分数(大于0.71 μg·g-1)等指标的变化与上述研究结果一致。
处理2(MeJA和Et)、处理8[NaHSO3(w=1‰)、NaCl(w=20‰)和FeCl2(w=10‰)]、处理10(黑绿木霉)和处理16(火烧孔)抗逆能力较强,可以有效促进白木香树体次生代谢物的积累,结香质量高(挥发油质量分数高),应为白木香树体诱导方式的优先选择。这几种激素、盐和真菌代谢液是否可以协同促进白木香树体结香,以及其混合时最佳浓度配比,还有待进一步的研究。
-
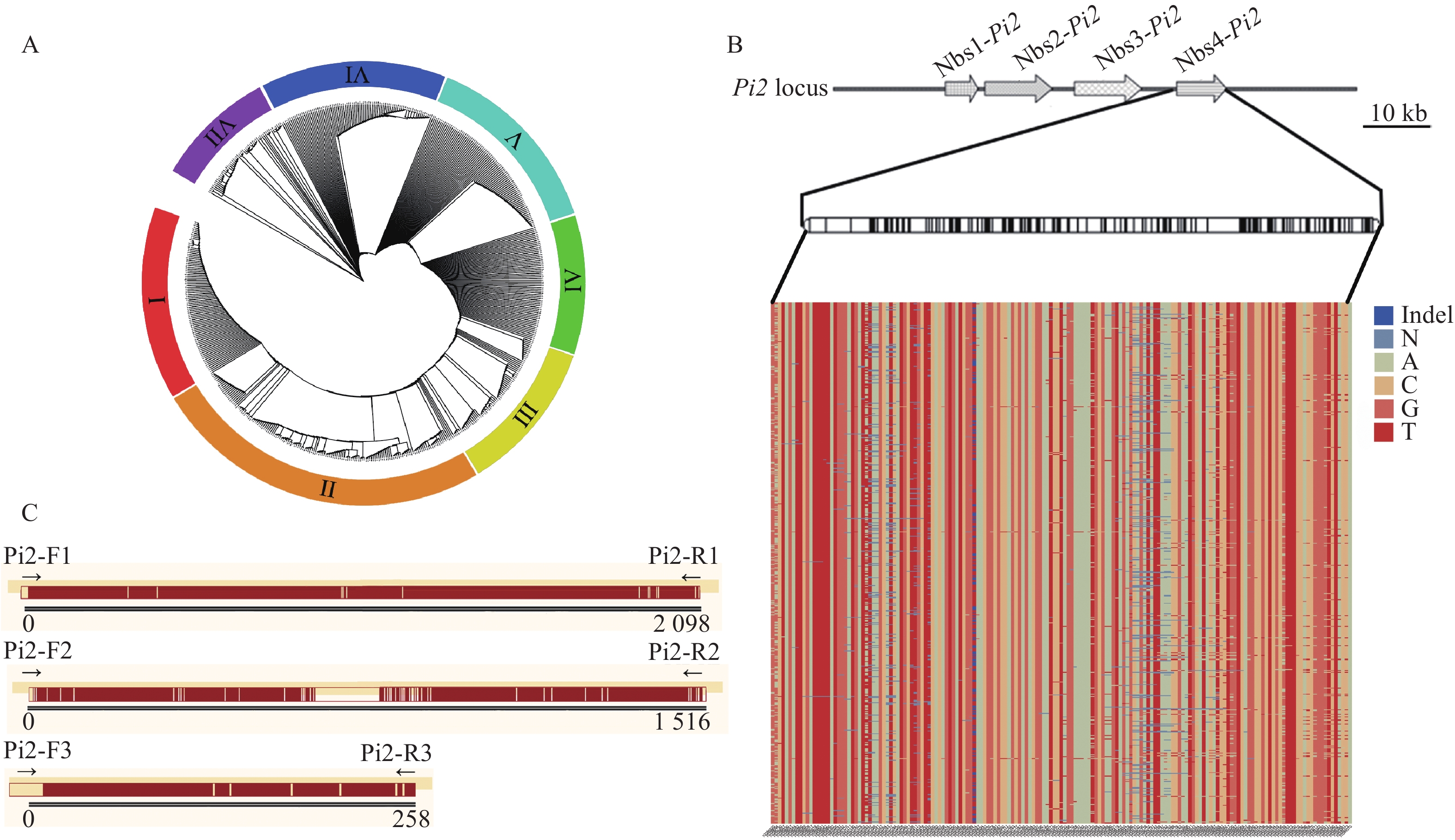
图 1 系统进化树及差异SNP位点分析
A:593份材料系统进化树(Ⅰ~Ⅶ:分布密度不同的7个部分);B:593份材料在Pi2抗性位点核心区域的差异SNP及其碱基分布情况;C:H-74和H-78材料在Pi2抗性位点核心区域差异SNP位点分布(黄色竖线区域表示两者差异SNP位点分布情况)
Figure 1. Phylogenetic tree and analysis of different SNP sites
A: Phylogenetic tree of 593 materials (Ⅰ−Ⅶ: Seven parts with different distribution density); B: Distributions of different SNPs and their bases in the core region of the Pi2 resistance locus for the 593 materials; C: Distribution of different SNP sites in the core region of the Pi2 resistance locus for H-74 and H-78 materials (The yellow vertical line area indicates the distribution of SNP sites that are different between them)
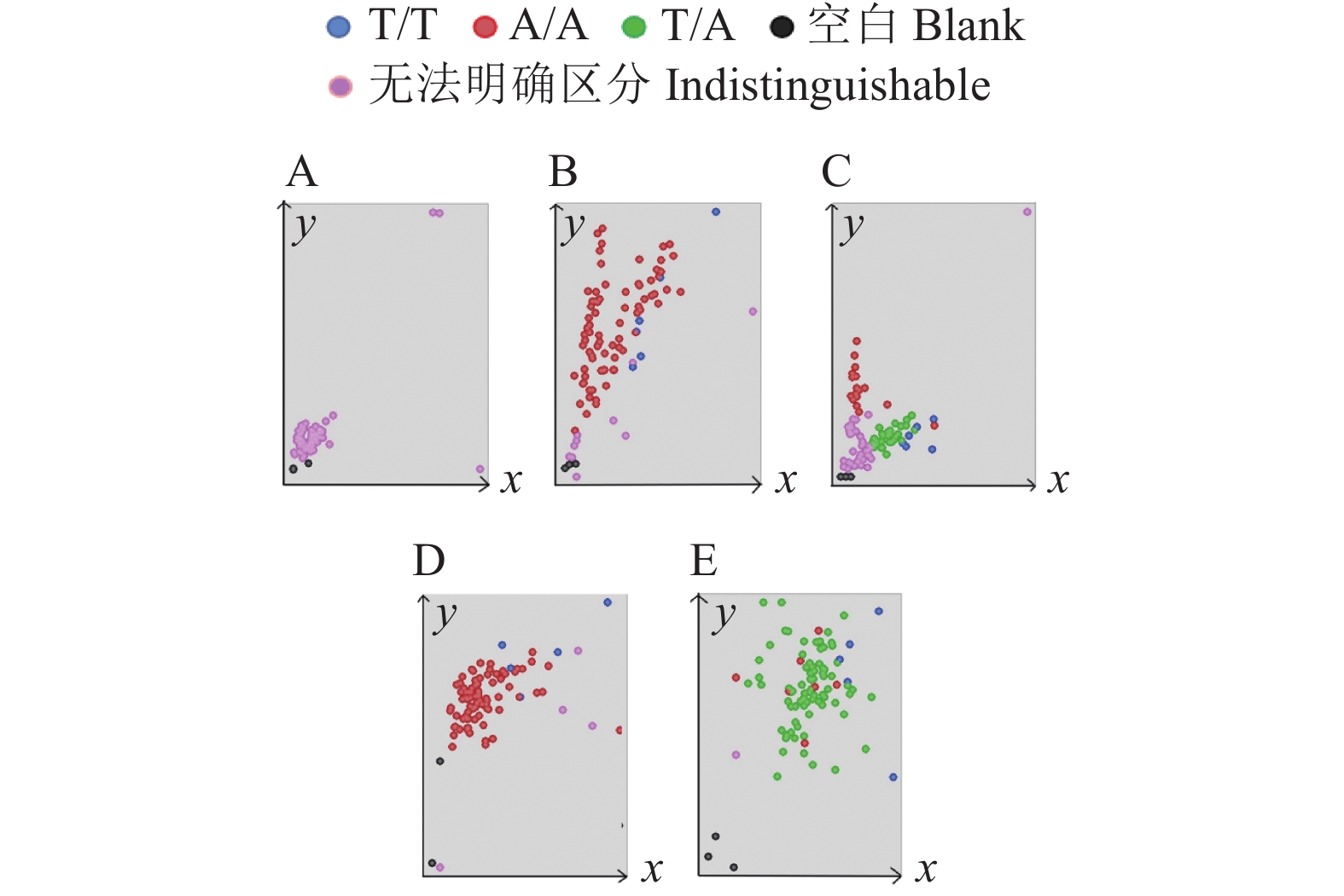
图 2 Pi2基因差异位点序列比对
a:H-74材料,b:包含Pi2基因的材料,c:H-78材料,d、e:确定没有Pi2基因的材料;1和2表示材料的2个重复
Figure 2. Sequence alignment analysis of the different sites of Pi2 gene
a: Material H-74, b: Material containing Pi2 gene, c: Material H-78, d and e: Material without Pi2 gene; 1 and 2 represent two repetitions of the material
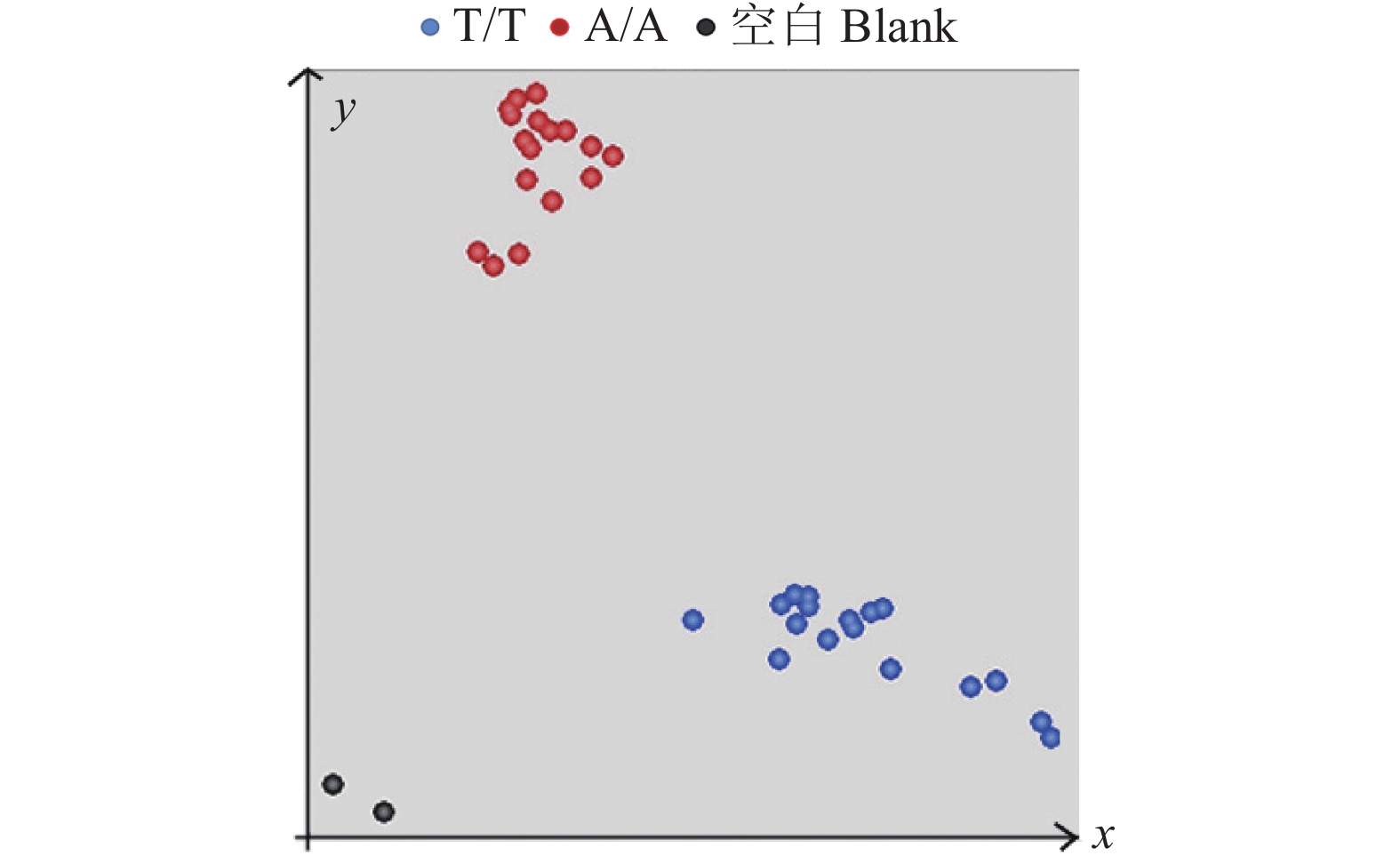
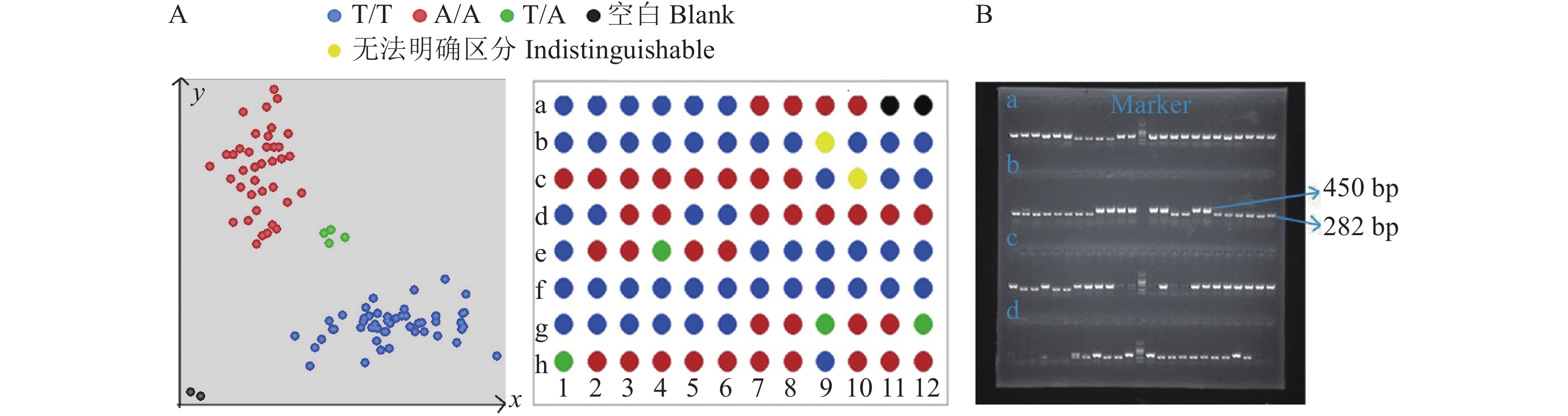
图 6 84个田间材料Pi2-C3 KASP分子标记的验证
A:Pi2 KASP基因分型检测结果;B:SSR标记检测结果(Marker位于胶图中央,大小为2 000 bp,a、 c、 d区域中相应位置片段大小与b区域标示相同)
Figure 6. Verification of Pi2-C3 KASP molecular marker for 84 field samples
A: KASP genotype detection results for Pi2; B: SSR marker detection results (marker is located in the center of the rubber map, with the size of 2 000 bp, and the corresponding fragment sizes in areas a, c and d are the same as that in area b)
表 1 测序引物
Table 1 Sequencing primers
引物
名称
Primer
name序列(5′→3′)
Sequence预期片段
大小/bp
Expected
fragment sizePi2-F1 AAGCCTATGATTGGTTTCT 2 098 Pi2-R1 ACTGCCCTTCTTATTGTTC Pi2-F2 AACAATAAGAAGGGCAGTC 1 516 Pi2-R2 GAGGAGGAGATGAAATAGAAT Pi2-F3 AAGGTGGTGGTGCAAGTAC 258 Pi2-R3 CAATGTTATGGCATCGTTC 表 2 KASP引物
Table 2 KASP primers
引物名称
Primer name检测位点
Detection site序列(5′→3′)
SequencePi2-C1-F1 A GAAGGTGACCAAGTTCATGCTCAGGTGTCAGAATGGGAGAAATTCTATGAACAA Pi2-C1-F2 C GAAGGTCGGAGTCAACGGATTCAGGTGTCAGAATGGGAGAAATTCTATGAACAC Pi2-C1-R A/C TGTCCTTAGTAGGGGAGGAGG Pi2-C2-F1 C GAAGGTGACCAAGTTCATGCTGTATGATTCAACGATCAAGAGTGGGCAC Pi2-C2-F2 T GAAGGTCGGAGTCAACGGATTAGTTATGTATTTAAAACACAGCATGGT Pi2-C2-R C/T CCTGTCTCGAGATTGAAACTGTG Pi2-C3-F1 T GAAGGTGACCAAGTTCATGCTCATGGGAGTATGTCCTGCAAAACT Pi2-C3-F2 A GAAGGTCGGAGTCAACGGATTCATGGGAGTATGTCCTGCAAAACA Pi2-C3-R T/A CAAACTGCATGTGCTAGACTCTTGGGTC Pi2-C4-F1 G GAAGGTGACCAAGTTCATGCTCATTGGTAAACTACAGGGCCTACAG Pi2-C4-F2 A GAAGGTCGGAGTCAACGGATTCATTGGTAAACTACAGGGCCTACAA Pi2-C4-R G/A CACTTGGTAGTGCTGCAATGTATGTGCTC Pi2-C5-F1 A GAAGGTGACCAAGTTCATGCTCAATGTCTGCATACTCTTCGTTGTATAA Pi2-C5-F2 G GAAGGTCGGAGTCAACGGATTCAATGTCTGCATACTCTTCGTTGTATAG Pi2-C5-R A/G AGGCATATTGTGTTAGTTATGCACTTCATTGGGTG 表 3 广东阳江病圃材料Pi2基因检测结果及抗性评价
Table 3 Pi2 gene detection results and resistance evaluation of materials from the Yangjiang disease nursery in Guangdong
编号
NumberPi2基因检测
Pi2 gene detection抗性评价
Resistance evaluation编号
NumberPi2基因检测
Pi2 gene detection抗性评价
Resistance evaluationJ-201 − 中感 J-217 + 抗 J-202 + 抗 J-218 + 抗 J-203 + 抗 J-219 − 抗 J-204 + 抗 J-220 + 中抗 J-205 + 抗 J-221 − 中抗 J-206 − 抗 J-222 − 中抗 J-207 + 抗 J-223 − 中抗 J-208 + 抗 J-224 + 抗 J-209 + 高抗 J-225 + 抗 J-210 + 高抗 J-226 − 中抗 J-211 + 抗 J-227 − 中抗 J-212 − 中感 J-228 − 中感 J-213 + 抗 J-229 − 中抗 J-214 − 抗 J-230 − 中抗 J-215 + 抗 J-231 − 中抗 J-216 + 高抗 J-232 − 中感 J-233 + 抗 J-259 + 高抗 J-234 + 抗 J-260 + 高抗 J-235 − 抗 J-261 + 抗 J-236 + 高抗 J-262 + 高抗 J-237 + 高抗 J-263 − 中感 J-238 + 中抗 J-264 − 高感 J-239 − 中抗 J-265 + 高抗 J-240 + 抗 J-266 − 高感 J-241 + 高抗 J-267 − 高感 J-242 − 高感 J-268 + 抗 J-243 + 抗 J-269 + 抗 J-244 − 感病 J-270 + 抗 J-245 + 中抗 J-271 − 抗 J-246 + 抗 J-272 + 抗 J-247 − 高感 J-273 + 抗 J-248 − 中抗 J-274 + 高抗 J-249 + 抗 J-275 − 抗 J-250 + 中抗 J-276 − 中抗 J-251 − 抗 J-277 − 中抗 J-252 + 高抗 J-278 − 感病 J-253 + 高抗 J-279 − 感病 J-254 − 中抗 J-280 − 感病 J-255 + 高抗 J-281 − 中抗 J-256 + 高抗 J-282 − 感病 J-257 + 高抗 J-283 + 抗 J-258 − 抗 J-284 − 感病 -
[1] 向聪, 雷东阳, 任西明, 等. 水稻抗稻瘟病遗传育种研究进展[J]. 作物研究, 2017, 31(5): 547-552. [2] 权水清. 水稻稻瘟病菌无毒基因AVR-Pik的共显性标记开发与应用[D]. 武汉: 武汉大学, 2017. [3] 温小红, 谢明杰, 姜健, 等. 水稻稻瘟病防治方法研究进展[J]. 中国农学通报, 2013, 29(3): 190-195. [4] MENG X L, XIAO G, TELEBANCO-YANORIA M J, et al. The broad-spectrum rice blast resistance (R) gene Pita2 encodes a novel R protein unique from Pita[J]. Rice, 2020, 13(1): 1-15. doi: 10.1186/s12284-019-0361-3
[5] ZHOU B, QU S H, LIU G F, et al. The eight amino-acid differences within three leucine-rich repeats between Pi2 and Piz-t resistance proteins determine the resistance specificity to Magnaporthe grisea[J]. Molecular Plant-Microbe Interactions, 2006, 19(11): 1216-1228. doi: 10.1094/MPMI-19-1216
[6] LIU G, LU G, ZENG L, et al. Two broad-spectrum blast resistance genes, Pi9(t) and Pi2(t), are physically linked on rice chromosome 6[J]. Molecular Genetics and Genomics, 2002, 267(4): 472-480. doi: 10.1007/s00438-002-0677-2
[7] 朱业宝, 方珊茹, 沈伟峰, 等. 国外引进水稻种质资源的稻瘟病抗性基因检测与评价[J]. 植物遗传资源学报, 2020, 21(2): 418-430. [8] 陆展华, 付魏魏, 刘维, 等. 广东省主栽水稻品种稻瘟病主效抗性基因的鉴定及分析[J]. 植物病理学报, 2020, 50(6): 711-722. [9] 沈新莲, 张天真. 作物分子标记辅助选择育种研究的进展与展望[J]. 高技术通讯, 2003, 13(2): 105-110. [10] SHABIR G, ASLAM K, KHAN A R, et al. Rice molecular markers and genetic mapping: Current status and prospects[J]. 农业科学学报: 英文, 2017, 16(9): 1879-1891. SHABIR G, ASLAM K, KHAN A R, et al. Rice molecular markers and genetic mapping: Current status and prospects[J]. Journal of Integrative Agriculture, 2017, 16(9): 1879-1891.
[11] 何元浩, 胡凤荣. 基于AFLP分子标记的30个风信子品种遗传多样性分析[J]. 分子植物育种, 2023, 21(9): 2955-2963. [12] 李建武. 马铃薯(Solanum tuberosum L. )块茎淀粉含量及植株熟性性状的QTL定位与遗传分析[D]. 武汉: 华中农业大学, 2019. [13] 刘传光, 张桂权. 水稻单核苷酸多态性及其应用[J]. 遗传, 2006, 28(6): 737-744. [14] BEGUM H, SPINDEL J E, LALUSIN A, et al. Genome-wide association mapping for yield and other agronomic traits in an elite breeding population of tropical rice (Oryza sativa)[J]. PLoS One, 2015, 10(3): e0119873. doi: 10.1371/journal.pone.0119873.
[15] 王彦云. 基于SNP标记的黄河鲤鱼溯源研究与应用[D]. 北京: 中国农业科学院, 2021. [16] SEMAGN K, BABU R, HEARNE S, et al. Single nucleotide polymorphism genotyping using Kompetitive Allele Specific PCR (KASP): Overview of the technology and its application in crop improvement[J]. Molecular Breeding, 2014, 33(1): 1-14. doi: 10.1007/s11032-013-9917-x
[17] 练云, 李海朝, 李金英, 等. 利用KASP标记筛选含rhg1和Rhg4位点的大豆抗病资源[J]. 植物遗传资源学报, 2021, 22(2): 399-406. [18] 王蕊, 施龙建, 田红丽, 等. 玉米杂交种纯度鉴定SNP核心引物的确定及高通量检测方案的建立[J]. 作物学报, 2021, 47(4): 770-779. [19] 张瑞, 王洋, HUSSAIN S, 等. 水培条件下水稻全生育期耐盐筛选鉴定[J]. 植物遗传资源学报, 2021, 22(6): 1567-1581. [20] 韩美丽, 陆荣生, 霍秀娟, 等. 水稻离体叶抗稻瘟病鉴定方法研究[J]. 安徽农业科学, 2009, 37(13): 6037-6039. [21] SU J, WANG W, HAN J, et al. Functional divergence of duplicated genes results in a novel blast resistance gene Pi50 at the Pi2/9 locus[J]. Theoretical and Applied Genetics, 2015, 128: 2213-2225.
[22] 汪文娟, 周继勇, 汪聪颖, 等. 八个抗稻瘟病基因在华南籼型杂交水稻中的分布[J]. 中国水稻科学, 2017, 31(3): 299-306. [23] 华丽霞, 汪文娟, 陈深, 等. 抗稻瘟病Pi2/9/z-t基因特异性分子标记的开发[J]. 中国水稻科学, 2015, 29(3): 305-310. [24] 金名捺, 陈竹锋, 丘式浚, 等. 基于HRM体系的稻瘟病抗性基因Pi2特异性分子标记的开发及应用[J]. 农业生物技术学报, 2018, 26(3): 365-373. [25] 高利军, 高汉亮, 颜群, 等. 4个抗稻瘟病基因分子标记的建立及在水稻亲本中的分布[J]. 杂交水稻, 2010, 25(S1): 294-298. [26] WU Y, XIAO N, YU L, et al. Combination patterns of major R genes determine the level of resistance to the M. oryzae in Rice (Oryza sativa L. )[J]. PLoS One, 2015, 10(6): e0126130. doi: 10.1371/journal.pone.0126130.
[27] 李潜龙. 水稻抗稻瘟病基因Pi2功能标记的开发及育种应用[D]. 长沙: 湖南农业大学, 2018. [28] 李冰, 李永聪, 刘芝妤, 等. 水稻抗稻瘟病基因Pi2特异分子标记的开发与应用[J]. 分子植物育种, 2021, 19(8): 2638-2643. [29] 杨义强, 朱林峰, 李晓芳, 等. 抗稻瘟病基因Pi2的基因特异性KASP标记开发与应用[J]. 植物遗传资源学报, 2021, 22(5): 1314-1321. [30] 邓钊, 江南, 符辰建, 等. 隆两优与晶两优系列杂交稻的稻瘟病抗性基因分析[J]. 作物学报, 2022, 48(5): 1071-1080.



 下载:
下载: