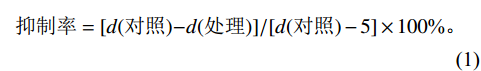Pathogen identification of lychee brown spot and screening of its biocontrol agents
-
摘要:目的
鉴定新发生的荔枝褐斑病病原种类,并进行病原菌生物学特性测定和生防菌的筛选,为该病发生规律研究及绿色防控提供依据。
方法2021年10月采集荔枝幼树褐斑病叶片,采用病组织分离获得菌株GZ1并依据柯赫氏法则确定其致病性。通过形态学比较及内转录间隔序列(ITS)、β−微管蛋白基因(Tub2)、RNA聚合酶II第二大亚基基因(rpb2)的多序列联合构建系统发育树,明确病原菌的种类。在不同碳源、温度、pH等培养条件下,测定GZ1的生物学特性。采用平板对峙法和菌丝生长速率法测定2种生防菌枯草芽孢杆菌Bacillus subtilis XX和贝莱斯芽孢杆菌B. velezensis BS对GZ1的抑制效果。
结果菌株GZ1是荔枝褐斑病的致病菌,其种名为嘴突凸脐蠕孢Exserohilum rostratum (Drechsler) K.J. Leonard & Sugg。该菌最适生长温度为28 ℃,最适生长pH为7,能利用多种碳源且蔗糖为碳源时菌丝生长最快;B. subtilis XX和B. velezensis BS均对该病原菌的生长有明显的抑制效果。
结论本研究报道了嘴突凸脐蠕孢引起荔枝褐斑病,为荔枝新病害,研究为嘴突凸脐蠕孢引起的荔枝病害防治提供了依据。
Abstract:ObjectiveTo identify the pathogen species of newly occurring lychee brown spot, determine the biological characteristics of the pathogen, and screen biocontrol agents, so as to provide a basis for understanding the occurrence patterns of lychee brown spot and green disease control.
MethodIn October, 2021, leaves with severe brown spot on young litchi trees were collected. A strain of GZ1 was obtained from diseased leaves and its pathogenicity was determined based on Koch’s postulates. Morphological analysis and a phylogenetic tree based on sequences of internal transcribed spacer (ITS), β-tubulin gene (Tub2), and RNA polymerase II second largest subunit gene (rpb2) were performed to clarify the taxonomic status of this pathogen. The biological characteristics of pathogen GZ1 were determined under various culture conditions including multiple carbon sources, temperatures, and pH. Antagonistic effects of two biocontrol agents, Bacillus subtilis XX and B. velezensis BS against GZ1 were evaluated using the dual culture method and hyphal growth rate method.
ResultThe strain GZ1 was confirmed as the causal agent of lychee brown spot, and it was identified as Exserohilum rostratum (Drechsler) K.J. Leonard & Suggs. The optimal temperature and pH for its growth were 28 ℃ and 7. It could utilize various carbon sources, with the fastest hyphal growth observed in the presence of sucrose. The biocontrol agents B. subtilis XX and B. velezensis BS exhibited significant inhibitory effects on the growth of pathogen GZ1.
ConclusionThis study reports that E. rostratum is the causal agent of lychee brown spot, thereby identifies a new lychee disease. The study can provide a basis for scientific control of lychee disease caused by E. rostratum.
-
荔枝Litchi chinensis为无患子科荔枝属,是典型的热带和亚热带多年生常绿果树,也是我国重要的经济果树,2023年全国荔枝种植面积为52.67万hm2,总产量达329.43万t [1]。随着现代栽培技术的发展,荔枝产量和品质不断提升,荔枝病害发生种类也在不断变化,迄今已记载的荔枝几十种病害中[2],荔枝霜疫病[3]、荔枝炭疽病[4]和荔枝干腐病[5]等是影响荔枝生产的重要因素。
凸脐蠕孢霉Exserohilum是一种子囊菌,在自然界中广泛分布并能引起植物发病[6]。2005年,在广西南宁发现了一种由嘴突凸脐蠕孢Exserohilum rostratum引起的新的香蕉叶斑病[7]。2020年,在埃及发现该菌可引起菜豆枯萎病[8];该菌还可侵染玉米引起玉米叶斑病[9]和穗腐病[10]。除了引起多种植物病害外,凸脐蠕孢还能引起人类的免疫系统疾病[11]。但嘴突凸脐蠕孢是否引起荔枝病害鲜见报道。
2021年9—10月,位于广东省茂名市高州某果园的荔枝幼龄树梢部叶斑病发生严重,发病初期出现褐色斑点,后扩展至整个叶片,症状与已报道的荔枝病害引起的症状均有所不同。为给生产上提供防治建议,及时鉴定其病原种类十分必要。为此,本研究采用组织分离法从病叶上获得分离菌株,依据科赫氏法则,经过致病性分析和再分离、形态学鉴定以及内转录间隔序列(Internal transcribed spacer,ITS)、β−微管蛋白基因(β-tubulin,Tub2)、RNA聚合酶II第二大亚基基因(RNA polymerase II second largest subunit gene,rpb2)的多基因联合的系统发育分析,方法参考文献[12],确定该褐斑病的病原菌。同时测定该病原菌在不同碳源、温度、pH等培养条件下的生物学特性;采用平板对峙法和菌丝生长速率法测定枯草芽孢杆菌Bacillus subtilis XX[13]和贝莱斯芽孢杆菌B. velezensis BS[14]对GZ1的抑制效果。本研究结果增加了荔枝病害种类的多样性并可为该病害的绿色精准防治提供理论依据。
1. 材料与方法
1.1 试验材料
2021年10月22日从广东省茂名市高州某荔枝园(东经111°0′37.213″,北纬21°46′44.789″)采集发病的荔枝叶片,选用马铃薯葡萄糖琼脂(Potato dextrose agar,PDA)培养基对荔枝发病叶片进行病原菌的分离、纯化和培养。枯草芽孢杆菌B. subtilis XX和贝莱斯芽孢杆菌 B. velezensis BS均分离并保藏于华南农业大学热带亚热带真菌研究室。
1.2 病原菌的分离与纯化
挑选典型发病的病叶,在病健交界处切取5 mm×5 mm的叶片组织块,于75%(φ)乙醇溶液中浸润10 s,随后用20 g/L的NaClO溶液表面消毒2~3 min,然后用无菌蒸馏水冲洗3次,每次5 s,于无菌滤纸上晾干水分,方法参考文献[15] 。用无菌镊子将组织块转移至PDA平板上,于28 ℃黑暗条件下培养。待菌落长出较多菌丝后,配制孢子悬浮液,并涂布于无菌的琼脂平板上,于显微镜下挑取含有单一分生孢子的琼脂培养块接种于新的PDA培养基获得单孢菌株。
1.3 致病性测定
将菌株接种于PDA培养基上28 ℃条件下培养7 d后,选取幼嫩的荔枝叶片,分无伤和刺伤2种处理,接种直径5 mm的菌饼,PDA培养基作为对照,每种处理接种10片荔枝叶片,并重复3次。将所有处理的叶片置于保鲜盒中,并在叶片上覆盖无菌水打湿的脱脂棉花进行保湿,24 h后去掉菌饼和棉花,持续观察3 d,直至出现明显发病症状,从病组织中再次分离病原菌,并与原接种菌株进行比较。
1.4 形态学鉴定
将单孢纯化的菌株接种于PDA培养基上,28 ℃黑暗培养3 d后观察菌落并拍照记录,7 d后用显微镜观察菌丝和分生孢子,随机选取100个分生孢子,测量分生孢子大小,观察分生孢子形态和统计分生孢子隔膜数量。
1.5 生物信息学分析
采用真菌基因组DNA提取试剂盒(Omega生物工程有限公司)提取菌丝DNA,用真菌通用引物ITS1、ITS4,特异引物T1、Bt2b和5F2、7cR共3对引物分别对菌株的ITS序列、Tub2、rpb2基因进行PCR扩增,PCR反应体系总体积为25 μL,包含DNA模板1 μL(72.8 ng/μL),正、反向引物各1 μL(10 μmol/L),2× Master Mix 12.5 μL(南京诺唯赞材料科技有限公司),以ddH2O补足至25 μL。反应条件为:94 ℃预变性3 min;94 ℃变性30 s,退火30 s(ITS和rpb退火温度:55 ℃;Tub2退火温度:54 ℃),72 ℃延伸45 s,共35个循环;最后72 ℃延伸10 min;于16 ℃保存。各序列扩增引物序列见表1。
表 1 分子鉴定引物序列Table 1. Primer sequences of molecular identification取7 μL上述PCR扩增产物于10 g/L琼脂糖凝胶电泳进行检测后将PCR产物送至生工生物工程(上海)股份有限公司测序。将测得的基因序列与GenBank中的序列进行比对,下载相似性高的序列,以玉蜀黍平脐蠕孢Bipolaris maydis CBS136.29和B. microlaenae CBS280.91作为外群。使用MEGA7软件剪切后按照ITS-Tub2-rpb2的顺序首尾拼接,分析系统发育关系,采用邻接法(Neighbor-joining,NJ)构建系统进化树,以自展法(Bootstrap)进行检测,共循环
1000 次。1.6 病原菌适宜生长条件筛选
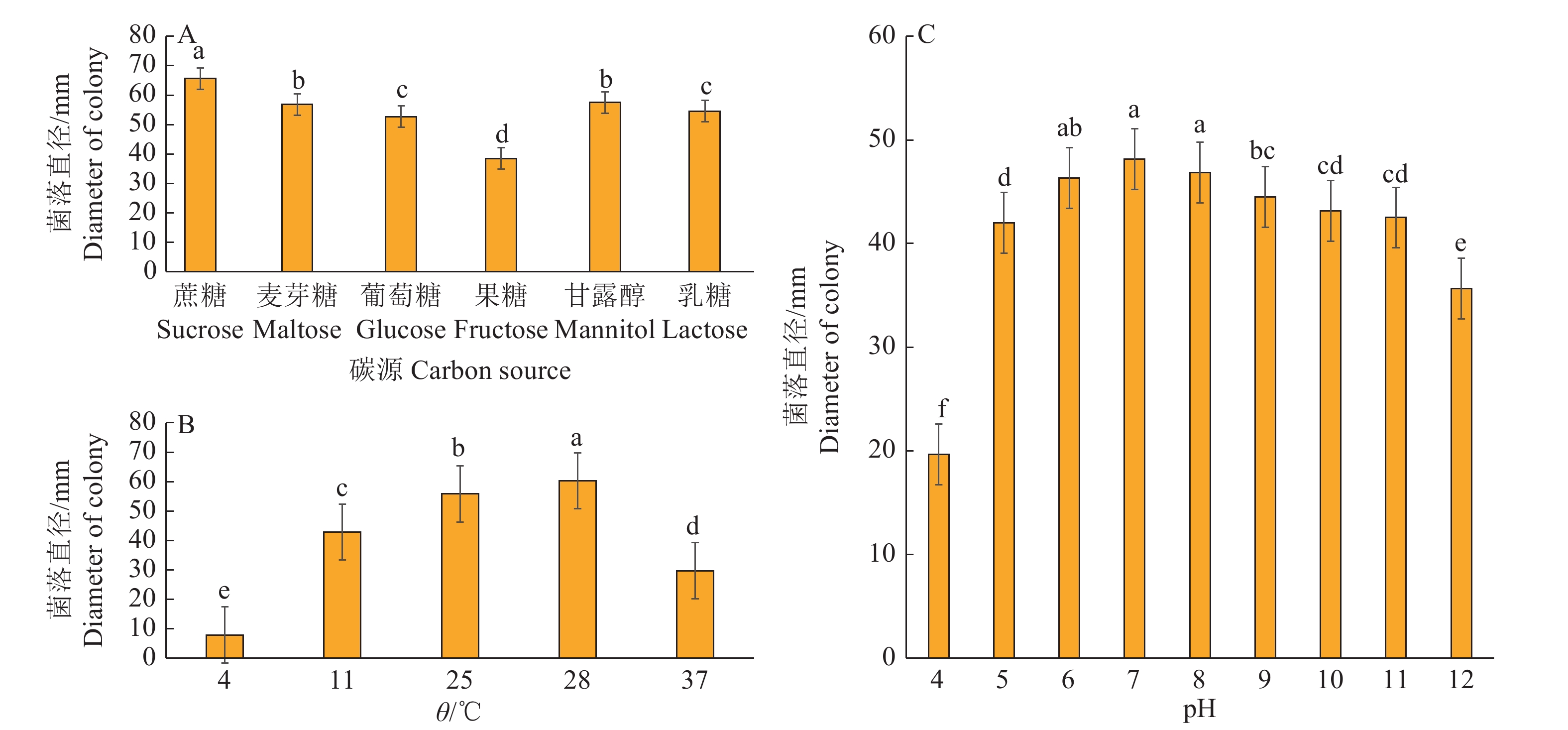
病原菌在PDA培养基上活化培养3 d后,在菌落边缘打取直径为5 mm的菌饼接种到如下试验所需的培养基上。采用单因子变量法测定病原菌生物学特性,测定不同温度(4、11、25、28、37 ℃)、pH(4、5、6、7、8、9、10、11、12)、碳源(麦芽糖、乳糖、果糖、葡萄糖、甘露醇、蔗糖)对菌丝生长的影响。每个处理重复3次,每天观察菌落生长情况,3 d后用十字交叉法测量菌落直径。
1.7 生防菌的抑制效果
以已鉴定的2株香蕉枯萎病菌生防细菌菌株[20]B. subtilis XX和B. velezensis BS对GZ1进行病原菌拮抗菌株的筛选。首先应用平板对峙法初步测定生防菌株对病原菌GZ1的生防效果,用接种环蘸取少许生防菌株的菌液在距离病原菌菌饼约5 cm处划线,置于28 ℃条件下倒置培养5 d,观察并记录抑菌效果。将生防菌株的菌液在LB固体培养基平板上划线,置于28 ℃恒温培养箱中培养24 h,分别挑取单菌落将其接种到10 mL LB液体培养基中,180 r/min培养16 h。将菌液和PDA按体积比1∶9混合制作平板,将菌饼接种于平板中央,对照组用LB液体培养基替代。28 ℃培养3 d后测量菌落直径(d),计算抑制率。
$$ \mathrm{抑制率=[} \mathit{d} \mathrm{(对照)-} \mathit{d} \mathrm{(处理)]/[} \mathit{d} \mathrm{(对照)-5]\times 100{\text{%}} 。} $$ (1) 2. 结果与分析
2.1 病害症状
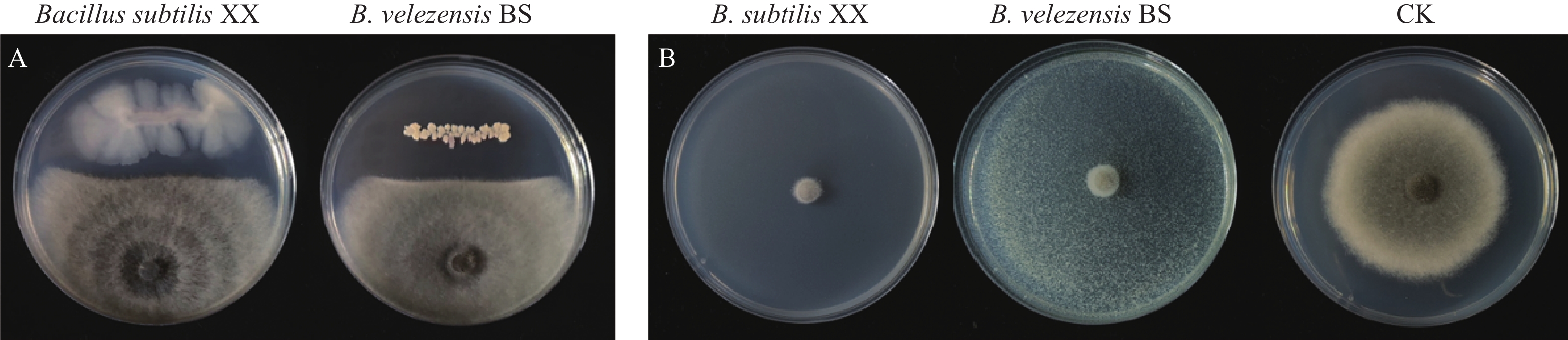
该病菌主要为害荔枝幼龄树,一般在幼嫩叶梢发病较多,叶片正反面均可发生。发病初期荔枝叶片出现褐色斑点,近圆形,直径2~4 mm,随着病情的发展斑点扩大或多个病斑相互融合,形成大的块状病斑;病斑颜色不均,初发病处暗褐色,边缘浅褐色或褐色(图1)。
2.2 致病性测定
从采集的病样中分离病原菌,并进行单孢纯化。随后,将纯化后的病原菌接种到PDA培养基上,经过7 d的培养取直径5 mm的菌饼分别通过刺伤和不刺伤的方式接种到新鲜的荔枝幼嫩叶片上。经过3 d的培养,接种GZ1菌株的叶片均发病,且形成直径6~12 mm的病斑,而以PDA培养基为对照的叶片则未发病(图2)。
2.3 病原菌的形态学鉴定
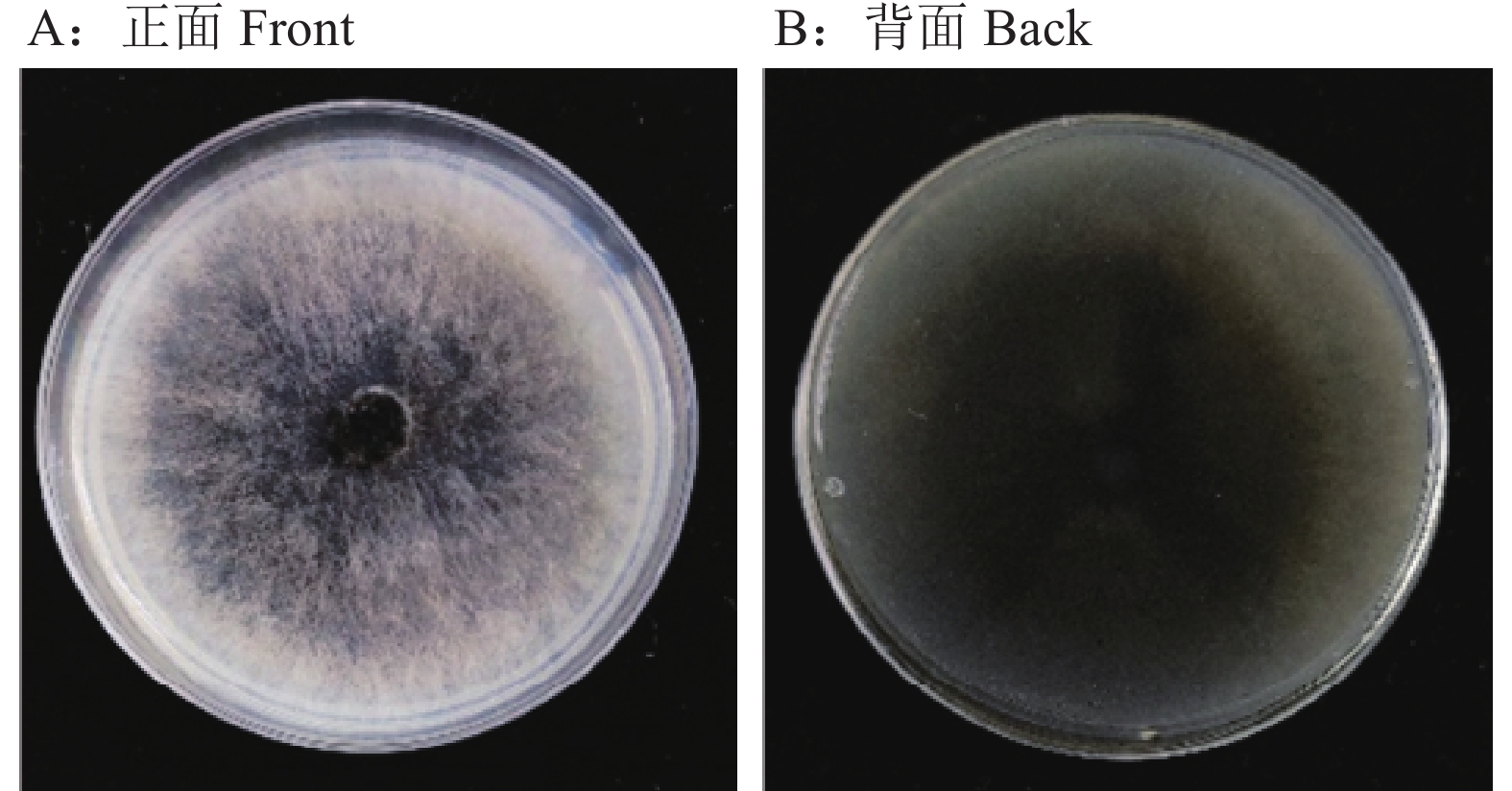
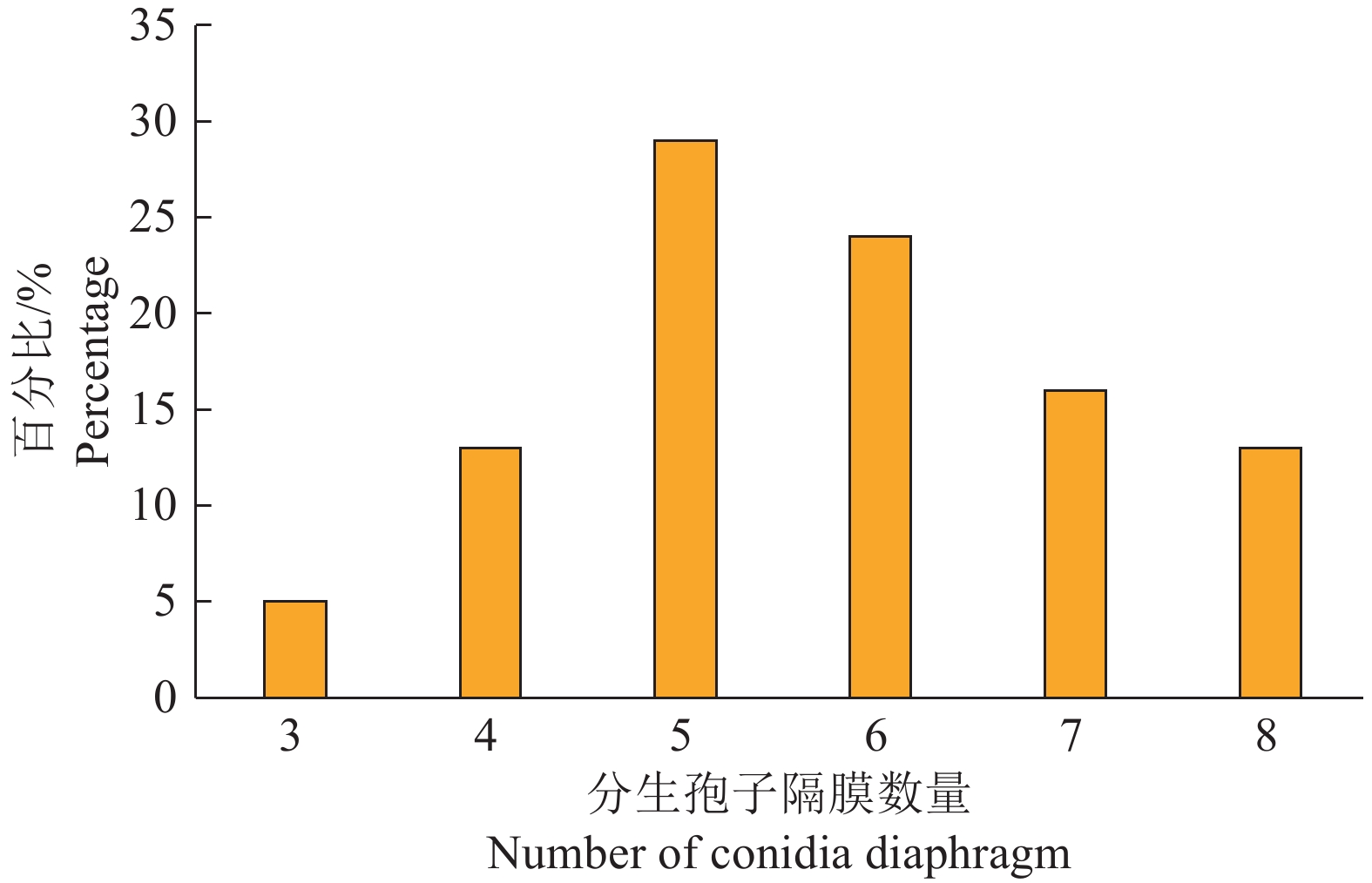
在PDA培养基上GZ1菌落呈棕褐色或灰橄榄色至橄榄黑色,呈棉絮状,边缘呈流苏状,气生菌丝丰富,产生色素(图3)。分生孢子梗有分隔,不分枝,近圆柱形,浅棕色至深棕色。分生孢子椭球状、棍棒状或倒棍棒状、直到中等弯曲,呈浅橄榄褐色到深橄榄褐色,基部和顶端的细胞通常被一深色隔膜隔开,脐点强烈突出(图4A~4F),分生孢子长18.64~87.36 µm,宽10.27~26.90 µm,平均大小为43.38 µm×16.00 µm(n=100),大多数(82%)为4~7隔(图5)。Lin等[8]观察到E. rostratum产生了不同形状的分生孢子,其中,在完全黑暗条件下产生的分生孢子为梨形至椭圆形、深棕色、0~8隔膜且大小为15.0~63.5 μm×11.0~20.0 μm,这一描述与本研究中观察到的GZ1分离株的形态及特性一致。这些形态学特征表明了该菌可能为嘴突凸脐蠕孢E. rostratum。
2.4 基于多序列系统发育的病原菌分子鉴定
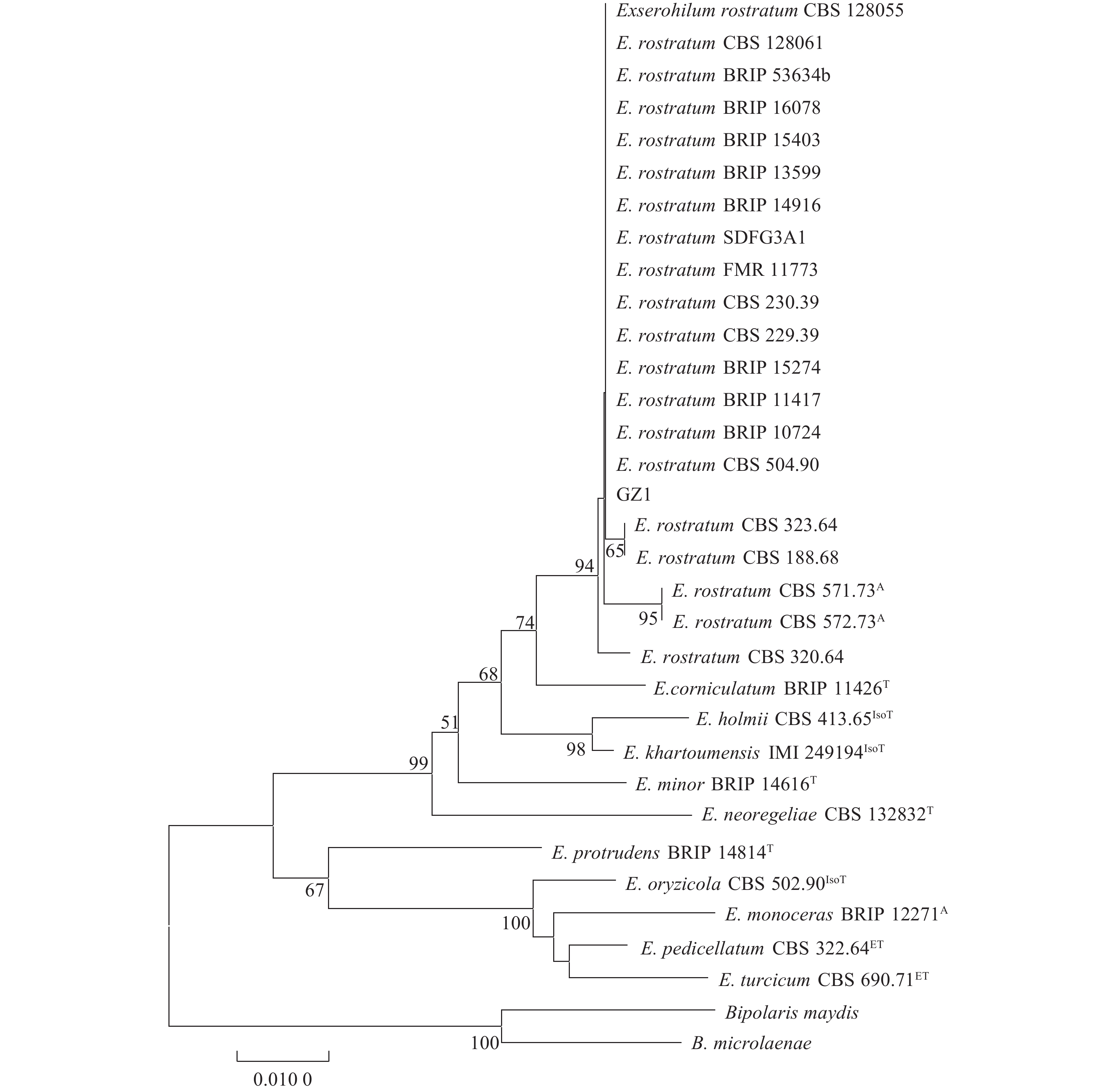
在NCBI中通过Blast查找并下载了相近种属及嘴突凸脐蠕孢其他分离株的ITS、Tub2和rpb2序列,对这些序列使用NJ法进行系统发育分析。从构建的系统发育树(图6)可以看出,本研究所分离的菌株GZ1与嘴突凸脐蠕孢E. rostratum的20个菌株共同聚在一起,形成一个单独分支。其中,GZ1与菌株E. rostratum BRIP
10724 的序列相似性最高,为99.25%。这些分子生物学分析充分说明了本研究中的荔枝褐斑病的病原菌为嘴突凸脐蠕孢。![]() 图 6 基于凸脐蠕孢ITS、Tub2和rpb2联合构建的NJ系统发育树上标中的T、ET、IsoT和A分别代表ex-type、ex-epistyle、ex-isotype和 authentic strains。Figure 6. Neighbor-joining phylogenetic tree constructed based on Exserohilum ITS, Tub2 and rpb2 sequencesIn superscript, T, ET, IsoT and A indicate ex-type, ex-epitype, ex-isotype and authentic strains, respectively.
图 6 基于凸脐蠕孢ITS、Tub2和rpb2联合构建的NJ系统发育树上标中的T、ET、IsoT和A分别代表ex-type、ex-epistyle、ex-isotype和 authentic strains。Figure 6. Neighbor-joining phylogenetic tree constructed based on Exserohilum ITS, Tub2 and rpb2 sequencesIn superscript, T, ET, IsoT and A indicate ex-type, ex-epitype, ex-isotype and authentic strains, respectively.2.5 荔枝嘴突凸脐蠕孢叶斑病菌的生物学特性
测定不同碳源对病原菌GZ1菌株生长的影响,结果(图7A)表明在查氏培养基的基础上,以蔗糖作为碳源时菌株GZ1生长最快,接种3 d菌落直径为65.7 mm,在以麦芽糖、葡萄糖、乳糖和甘露醇为碳源时,生长3 d后的菌落直径为52.7~57.5 mm,以果糖作为碳源时生长最慢,接种3 d菌落直径为38.5 mm。
不同温度对GZ1的生长测定结果表明,在25~28 ℃的环境温度下GZ1在PDA培养基上生长均较快速,4 ℃时生长缓慢,菌落直径仅为7.8 mm,4~28 ℃时,随着温度的升高,菌丝生长速率也随之增加,28 ℃为最适生长温度,接种3 d菌落直径可达63.0 mm;在28 ~ 37 ℃范围内,随着温度的升高,菌丝生长速率随之降低(图7B)。
菌株GZ1菌丝对pH的适应范围较广,在pH 4~12内均能生长,在pH 5~11有较好长势。GZ1生长最适pH为7,培养3 d后菌落直径达48.2 mm,除与pH为6和8处理的差异不显著外,其他pH处理均导致生长显著减慢(图7C)。以上结果说明菌株GZ1更适宜在近中性条件下生长。
2.6 生防细菌对嘴突凸脐蠕孢的抑制作用
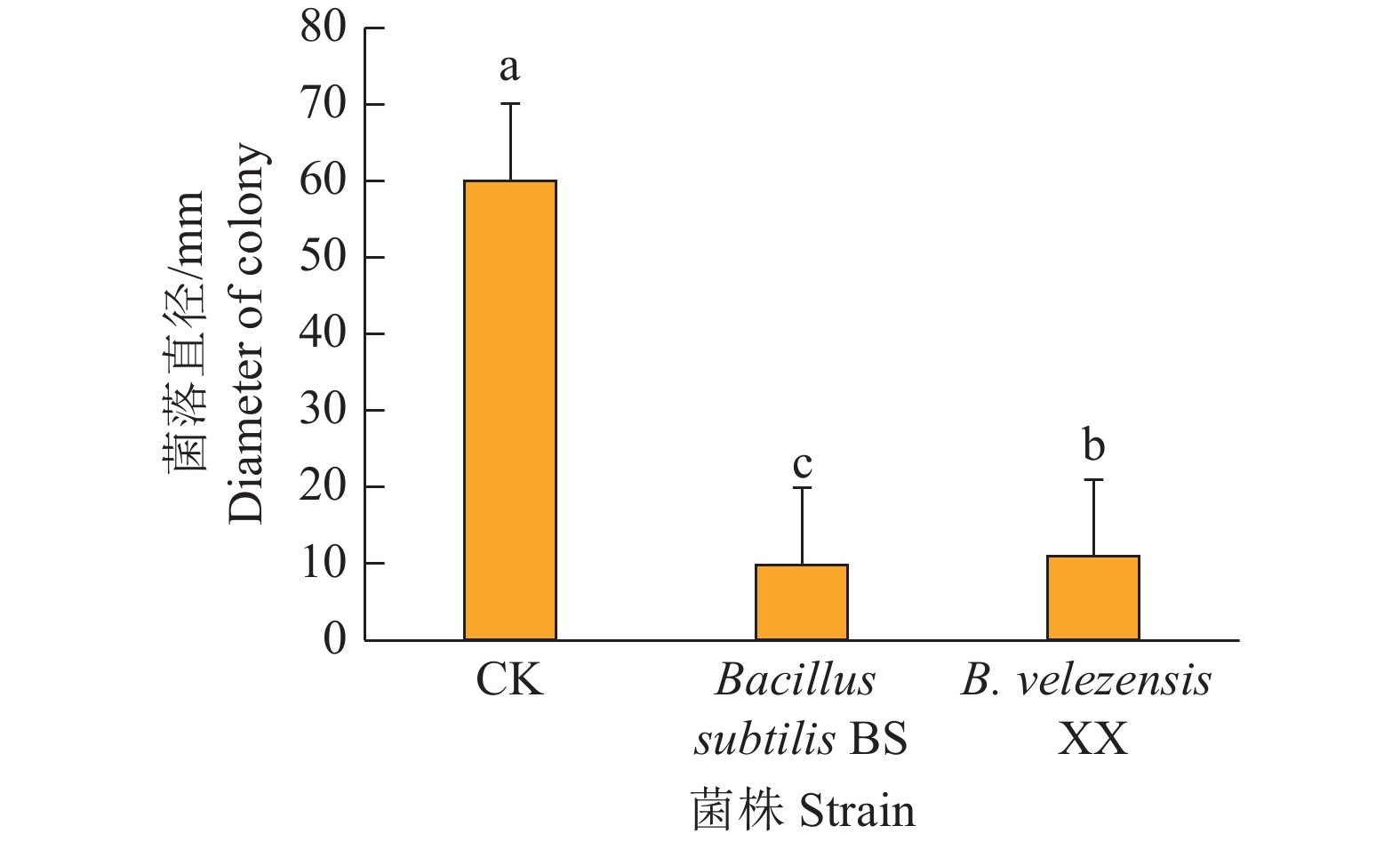
通过拮抗菌与GZ1的平板对峙培养筛选,结果发现供试的枯草芽孢杆菌XX和贝莱斯芽孢杆菌BS对病原菌GZ1均有明显的抑制效果(图8、9)。其中,图9为平板对峙量化结果。为进一步量化和比对这2株生防菌的生防效果,我们比较了生防菌BS和XX发酵菌液对病原菌GZ1的抑制生长试验,结果发现贝莱斯芽孢杆菌对病原菌GZ1的抑制生长效果最佳,抑制率达到91.3%;其次是枯草芽孢杆菌XX,抑制率为89.1%。
3. 结论与讨论
本研究分离了1种荔枝褐斑病病原菌并进行了单孢纯化得到菌株GZ1,通过形态学观察和分子生物学方法对GZ1菌株进行了鉴定。在PDA培养基上GZ1菌落呈棕褐色或灰橄榄色至橄榄黑色,呈棉絮状,边缘呈流苏状,气生菌丝丰富,产生色素;分生孢子梗有分隔,不分枝,近圆柱形,浅棕色至深棕色;分生孢子椭球状,棍棒状或倒棍棒状,直到中等弯曲,浅橄榄褐色到深橄榄褐色,基部和顶端的细胞通常被一深色隔膜隔开,分生孢子长18.64~87.36 µm,宽10.27~26.90 µm,平均大小为43.38 µm×16.00 µm,大多数(82%)为4~7隔。嘴突凸脐蠕孢物种表现出明显的形态多样性,要正确鉴定这些物种往往需要借助分子系统发育分析。本研究采用了3个基因片段串联进行了对比分析,结果显示本研究所分离的菌株GZ1与嘴突凸脐蠕孢E. rostratum聚在一起,形成一个明显的单独分支。其中,GZ1与菌株E. rostratum BRIP 10724序列相似性最高,为99.25%。综上,无论从形态学还是分子系统发育学,均将分离株GZ1鉴定为嘴突凸脐蠕孢E. rostratum。通过柯赫氏法则验证分离得到的菌株可侵染荔枝叶片,引起叶片褐斑的症状,是该荔枝褐斑病的病原。
嘴突凸脐蠕孢GZ1的生物学特性研究结果表明,蔗糖是该病原菌生长的最适碳源。该病原菌生长最佳温度为28 ℃,最佳pH=7。嘴突凸脐蠕孢适应的pH范围较广,中性偏弱碱的环境条件更适于其快速生长。本研究发现的GZ1的生物学特性研究结果与戴利铭等[20]和林善海等[21]研究嘴突凸脐蠕孢菌的结果比较一致。该菌株与已报到菌株的相似性表明了以上生物学特性可能在种内变异较小。
贝莱斯芽孢杆菌BS和枯草芽孢杆菌XX对番石榴枯萎病菌Nalanthamala psidii GS-1分别具有88.1%和77.8%的抑制率[22],这2株生防菌对植物病原菌的抑制可能具有广谱性。本研究测定这2株生防菌株对荔枝褐斑病菌GZ1的抑制作用,其中,贝莱斯芽孢杆菌BS的抑制效果最佳,室内筛选的抑制率达到91.3%;其次是枯草芽孢杆菌XX,抑制率为89.1%,说明其是荔枝褐斑病较为理想的生防材料,研究为荔枝病害的防控提供了参考。
嘴突凸脐蠕孢菌在自然界中分布广泛,既可以作为腐生真菌[23]生存在土壤中,也可以作为内生真菌[24]引起植物和人类的多种疾病。杂交狗牙根Cynodon dactylon、马唐Digitaria sanguinalis、牛筋草Eleusine indica、芒Miscanthus sinensis、玉米Zea mays、小麦Triticum aestivum、大蕉Musa×paradisiaca和千金子Leptochloa chinensis是已知的嘴突凸脐蠕孢菌E. rostratum的自然寄主[25-26],通过人工接种,大约有128种其他植物被确定为该菌的宿主[8],然而在双子叶植物中关于嘴突凸脐蠕孢菌E. rostratum致病的报道很少[27]。通过柯赫氏法则验证分离得到的菌株GZ1可侵染荔枝叶片,引起叶片叶斑症状,是该荔枝褐斑病的病原,因此本研究报道了凸脐蠕孢属真菌侵染并引起了荔枝褐斑病。
荔枝主要病害有荔枝霜疫病、荔枝炭疽病和荔枝干腐病等[28],但不同病害在侵染早期症状相近,该荔枝褐斑病的发现对荔枝病害的研究起到了补充作用。今后可以对该病的快速诊断和病害防治进行进一步研究,以期为荔枝褐斑病的防控提供新的技术支撑。
-
图 6 基于凸脐蠕孢ITS、Tub2和rpb2联合构建的NJ系统发育树
上标中的T、ET、IsoT和A分别代表ex-type、ex-epistyle、ex-isotype和 authentic strains。
Figure 6. Neighbor-joining phylogenetic tree constructed based on Exserohilum ITS, Tub2 and rpb2 sequences
In superscript, T, ET, IsoT and A indicate ex-type, ex-epitype, ex-isotype and authentic strains, respectively.
表 1 分子鉴定引物序列
Table 1 Primer sequences of molecular identification
-
[1] 陈厚彬, 苏钻贤, 杨胜男. 2023年全国荔枝生产调查与形势分析[J]. 中国热带农业, 2023(3): 13-22. doi: 10.3969/j.issn.1673-0658.2023.03.003 [2] 戚佩坤. 广东果树真菌病害志[M]. 北京: 中国农业出版社, 2000. [3] 孔广辉, 冯迪南, 李雯, 等. 荔枝霜疫病的研究进展[J]. 果树学报, 2021, 38(4): 603-612. [4] 凌金锋. 荔枝病果相关的四属菌物鉴定及分子系统发育分析[D]. 广州: 华南农业大学, 2019. [5] 廖美敬, 张湛辉, 习平根, 等. 增城荔枝干腐病的发生与防治[J]. 中国热带农业, 2021(4): 30-34. doi: 10.3969/j.issn.1673-0658.2021.04.007 [6] LEONARD K J. Synonymy of Exserohilum halodes with E. rostratum, and induction of the Ascigerous State, Setosphaeria rostrata[J]. Mycologia, 1976, 68(2): 402. doi: 10.2307/3759010
[7] LIN S H, HUANG S L, LI Q Q, et al. Characterization of Exserohilum rostratum, a new causal agent of banana leaf spot disease in China[J]. Australasian Plant Pathology, 2011, 40(3): 246-259. doi: 10.1007/s13313-011-0037-y
[8] MF F, FM A. A first record of Exserohilum rostratum as a new pathogen causing bean blight in Egypt[J]. Journal of Plant Pathology & Microbiology, 2020, 11(5): 496. doi: 10.35248/2157-7471.20.11.496
[9] XIE S N, LI B Y, RU Y Y, et al. First report of Exserohilum rostratum causing leaf spot on maize (Zea mays L. ) in Henan, China[J]. Plant Disease, 2022, 106(6): 1748. doi: 10.1094/pdis-4-21-0860-pdn.
[10] SUN H, GUO N, MA H X, et al. First report of maize ear rot caused by Exserohilum rostratum in Hainan Province in Southern China[J]. Plant Disease, 2022, 106(1): 314. doi: 10.1094/pdis-1-21-0044-pdn
[11] PENA AMAYA P, FLORES A, CHRISTMANN A, et al. Phaeohyphomycosis by Exserohilum rostratum in a pediatric patient with acute lymphoblastic leukemia after bone marrow transplantation[J]. Revista Argentina de Microbiologia, 2019, 52(3): 195-197.
[12] HERNÁNDEZ-RESTREPO M, MADRID H, TAN Y P, et al. Multi-locus phylogeny and taxonomy of Exserohilum[J]. Persoonia, 2018, 41(1): 71-108. doi: 10.3767/persoonia.2018.41.05
[13] 李敏慧, 曾敬, 魏玉清, 等. 一株枯草芽孢杆菌 XX及其在防治土传真菌病害中的应用: CN202111087271.1[P]. 2022-03-04. [14] 李敏慧, 曾敬, 苑曼琳, 等. 一株香蕉内生贝莱斯芽孢杆菌及其应用: CN201911413362.2[P]. 2022-03-25. [15] 方中达. 植病研究方法[M]. 3版. 北京: 中国农业出版社, 1998: 122-125. [16] WHITE T J, BRUNS T, LEE S, et al. Amplification and direct sequencing of fungal ribosomal RNA genes for phylogenetics[M]//ScienceDirect. PCR protocols. Amsterdam: Elsevier, 1990: 315-322.
[17] O’DONNELL K, CIGELNIK E. Two divergent intragenomic rDNA ITS2 types within a monophyletic lineage of the fungus Fusarium are nonorthologous[J]. Molecular Phylogenetics and Evolution, 1997, 7(1): 103-116. doi: 10.1006/mpev.1996.0376
[18] GLASS N L, DONALDSON G C. Development of primer sets designed for use with the PCR to amplify conserved genes from filamentous ascomycetes[J]. Applied and Environmental Microbiology, 1995, 61(4): 1323-1330. doi: 10.1128/aem.61.4.1323-1330.1995
[19] O’DONNELL K, SARVER B A J, BRANDT M, et al. Phylogenetic diversity and microsphere array-based genotyping of human pathogenic Fusaria, including isolates from the multistate contact lens-associated U. S. keratitis outbreaks of 2005 and 2006[J]. Journal of Clinical Microbiology, 2007, 45(7): 2235-2248. doi: 10.1128/JCM.00533-07
[20] 戴利铭, 刘一贤, 施玉萍, 等. 橡胶树嘴突凸脐蠕孢菌生物学特性研究[J]. 热带农业科技, 2020, 43(1): 1-4. [21] 林善海, 黄思良, 岑贞陆, 等. 环境因素对香蕉叶斑病菌喙突脐蠕孢生长和产孢的影响[J]. 菌物学报, 2013, 32(2): 226-238. [22] 黄荣, 曾敬, 杨雨婷, 等. 番石榴枯萎病菌生物学特性及生防菌和防治药剂的筛选[J]. 华南农业大学学报, 2024, 45(3): 364-370. doi: 10.7671/j.issn.1001-411X.202309006 [23] 刘会梅, 张天宇. 中国东部暖温带地区土壤中的皮司霉属(丝孢纲)真菌[J]. 菌物学报, 2007, 26(4): 484-489. doi: 10.3969/j.issn.1672-6472.2007.04.002 [24] SAPPAPAN R, SOMMIT D, NGAMROJANAVANICH N, et al. 11-hydroxymonocerin from the plant endophytic fungus Exserohilum rostratum[J]. Journal of Natural Products, 2008, 71(9): 1657-1659. doi: 10.1021/np8004024
[25] 栾丰刚, 羌松, 马德英, 等. 新疆小麦黑胚籽粒分离鉴定初报[J]. 新疆农业科学, 2004, 41(5): 357-360. doi: 10.3969/j.issn.1001-4330.2004.05.029 [26] SUN G, ZHANG R, ZHANG Y, ZHANG T. Identification of some Helminthosporium fungi from Taiwan province[J]. Acta Agriculturae Boreali-Sinica, 1997, 6(1): 92-93.
[27] FARR D F, ROSSMAN A Y. Fungal databases[DB]. U. S: National Fungus Collections, ARS, USDA. 2020.
[28] 李建国. 中国果树科学与实践: 荔枝[M]. 西安: 陕西科学技术出版社, 2022.



 下载:
下载: