Study on the mechanism of action of bicuculline on GABA receptor in Musca domestica
-
摘要:目的
探究荷包牡丹碱对杀虫剂重要靶标GABA受体抑制机理。
方法基于家蝇Musca domestica GABA受体亚基基因MdRdl在第3外显子(a或b)和第6外显子(c或d)交替拼接产生ac、ad、bc和bd剪接体,采用双电极电压钳技术研究荷包牡丹碱对MdRdl 4个剪接体离子电流的抑制效果,鉴定其敏感性是否与外显子交替拼接有关。并采用分子对接技术分析荷包牡丹碱与家蝇GABA受体的可能结合位点。同时,采用共刺激法验证荷包牡丹碱和GABA受体变构抑制剂溴虫氟苯双酰胺是否存在互作效应。
结果荷包牡丹碱对MdRdlac、MdRdlbc、MdRdlad和MdRdlbd 4个剪接体的IC50分别为1.274、0.948、4.702和3.698 mmol/L;对I274F突变体的IC50分别为15.46、21.67、42.83和52.33 mmol/L;与野生型剪接体相比,4个突变体 IC50 分别增大约11、22、8和13倍。荷包牡丹碱和溴虫氟苯双酰胺与GABA受体外显子6编码的氨基酸残基存在互作效应。
结论第274位异亮氨酸残基为荷包牡丹碱与家蝇GABA受体互作的关键靶点,且与外显子6编码的氨基酸残基一起,具有开发协同增效作用的昆虫GABA受体别构抑制剂的潜力。
Abstract:ObjectiveIn order to explore the inhibitory mechanism of bicuculline on GABA receptor, which was an important target of insecticide.
MethodBased on alternately splicing at exon 3 (a or b) and exon 6 (c or d), Musca domestica GABA receptor subunit gene MdRdl yields ac, ad, bc and bd spliceosomes. Two-electrode voltage clamp technique was used to study the inhibitory effect of bicuculline on the ion current of four spliceosomes of MdRdl, characterizing whether its sensitivity was related to alternate splicing of the exons. The molecular docking technique was used to analyze the possible binding sites of bicuculline and GABA receptor of M. domestica. The interaction effect between bicuculline and the allosteric inhibitor of GABA receptors, broflanilide, was verified using the co-stimulation method.
ResultThe IC50s of bicuculline on the four spliceosomes MdRdlac, MdRdlbc, MdRdlad and MdRdlbd were 1.274, 0.948, 4.702 and 3.698 mmol/L, on their I274F mutants were 15.46, 21.67, 42.83 and 52.33 mmol/L, respectively. The IC50s of four mutants increased by about 11, 22, 8 and 13 times compared to their wildtype spliceosomes, respectively. Bicuculline and broflanilide showed interactions with amino acid residues encoded by the exon 6 of the GABA receptor.
ConclusionThe isoleucine residue at position 274 on the GABA receptor was the key target for the interaction between bicuculline and GABA receptor of M. domestica. This isoleucine residue and the amino acid residues encoded by exon 6 together are potentially to be developed as the synergistic allosteric inhibitors of insect GABA receptors.
-
γ−氨基丁酸(Gamma-aminobutyric acid, GABA)是一种游离氨基酸,在动物神经系统中起着重要的抑制性神经递质作用,它可作用在细胞膜上的 GABA 受体门控氯离子通道(GABA-gated chloride channel, GABACl),将氯离子内流引起的过多负电荷累积于细胞内,导致细胞膜出现超极化,使生物体的神经活动被明显抑制[1]。根据GABA受体在功能、结构、药理特性等方面的差异,可将GABA受体分为3种亚型:离子型受体GABAARs、GABACRs以及代谢型受体GABABRs [2]。离子型受体GABAARs和GABACRs是一种五聚体跨膜糖蛋白,属于半胱氨酸环配体门控离子通道。作用于离子型GABA受体的杀虫剂主要分为非竞争拮抗剂、竞争性拮抗剂以及第2代阿维菌素(Avermectin)类杀虫剂三大类。第1代非竞争拮抗剂大多以多氯环烷烃类杀虫剂为主,如六六六与狄氏剂。非竞争拮抗剂可以阻止昆虫的GABA受体与配体结合,抑制神经活动以及氯离子内流导致昆虫出现麻痹、痉挛、兴奋甚至死亡等一系列症状[3]。第2代非竞争拮抗剂是苯基吡唑类杀虫剂,如氟虫腈,具有广谱高效的特点[4],苯基吡唑类杀虫剂通过占据细胞膜上的跨膜通道从而引起昆虫持续兴奋而死亡,氟虫腈的作用方式一般为触杀和胃毒[5]。非竞争拮抗剂最近报道了2种不同化学类型新型GABA受体拮抗剂,与氟虫腈完全抑制剂不同,异噁唑啉和苯甲酰胺(也称为间二酰胺)为部分抑制剂。为了确定非竞争拮抗剂与GABA受体结合位点,有试验将果蝇Drosophila melanogaster Ala274、Ala277和Thr281 3个位点突变为Ser或Val,与野生型相比,这些残基突变后会影响非竞争拮抗剂药剂效果[6]。GABA受体A299G/T348M 突变也让氟虫腈和氟雷拉纳的IC50增大[7]。荷包牡丹碱是 GABAA 受体的竞争性拮抗剂,它竞争性地抑制 GABA 与这些受体的结合,反过来GABA 也竞争性地抑制荷包牡丹碱与这些受体的结合[8]。荷包牡丹碱通过减少通道开放时间和开放频率来降低 GABA受体激活的传导[9]。研究表明,荷包牡丹碱与GABA正交位点外的其他位点相互作用,导致受体稳定在关闭状态,从这个意义上说,荷包牡丹碱被描述为一种别构抑制剂,鉴于荷包牡丹碱的分子大小约为 GABA 的3倍,因此荷包牡丹碱可以结合到 GABA 正交位点之外无法到达的位点[10]。本试验克隆家蝇Musca domestica GABA 受体亚基 MdRdl 的4个剪接体,并用双电极电压钳技术对荷包牡丹碱抑制效果进行研究,鉴定其敏感性是否与外显子交替拼接有关,并对剪接体进行 I274F 定点突变,最后通过电生理验证其作用位点[11],为明确荷包牡丹碱对家蝇GABA受体的作用机理提供理论依据。有试验证明,氟雷拉纳与家蝇GABA受体的结合靶点对阿维菌素敏感而对氟虫腈、硫丹和狄氏剂不敏感,说明氟雷拉纳的靶标作用位点与氟虫腈、硫丹和狄氏剂不同,可能与阿维菌素存在重叠[12]。本研究进一步采用共刺激荷包牡丹碱和GABA受体变构抑制剂溴虫氟苯双酰胺的方法,验证荷包牡丹碱和溴虫氟苯双酰胺是否存在互作效应,为开发与溴虫氟苯双酰胺无交互抗性的或协同增效作用的新型GABA受体别构抑制剂提供理论依据。
1. 材料与方法
1.1 供试材料
1.1.1 试验动物与基因
将家蝇GABA 受体4个剪接体 MdRdlac、MdRdlbc、MdRdlad和MdRdlbd 用1对同源臂引物F1和F2通过同源重组构建到载体PGH19上,引物为F1: GGATCTTCCAGAGATGGATCCATGAGTGATTCTATGCTATATCAAACACTG,F2:CTGCCGTTCGACGATTCTAGATTACTTTTCCTCACCCAGCAAGA。雌性非洲爪蟾购于东乐自然基因生命科学公司,非洲爪蟾置于16 ℃恒温培养水箱中饲养,养殖用水为静置2 d的去氯离子自来水,并且每2 d左右更换1次水。
1.1.2 试验试剂
(+)-荷包牡丹碱购于上海麦克林生化科技股份有限公司,Top10 感受态细胞购于上海唯地生物技术有限公司,Pure Link液体培养基、Midiprep Kits试剂盒和cDNA合成试剂盒(M-MLV frist strand cDNA Synthesis Kit TQ2501)购于美国赛默飞公司,Not I剪切酶购于美国NEB公司,LB培养基和电泳缓冲液购于上海生工生物工程股份有限公司,高纯度低电渗琼脂糖购于广州擎科生物技术有限公司,GoldView I型核酸染色剂购于北京中科瑞泰生物技术有限公司,RNA提取试剂盒(Total RNA Kit II R6934)和定点突变试剂盒(Phanta Max Super-Fidelity DNA Polymerase)购于南京诺唯赞生物科技股份有限公司。
1.1.3 试验仪器
HH-1数显恒温水浴锅购于常州澳华仪器有限公司,超低温冰箱、超高速低温离心机和NanoDrop2000微量紫外分光光度计购于美国赛默飞公司,微量注射仪购于美国Bio-Rad公司,双电极电压钳购于美国Molecular Devices公司,移液枪购于Pipetman公司,微电极拉制仪购于北京拜安吉科技有限公司。
1.2 合成亚基基因的cRNA
将测序比对成功的4个剪接体的菌液进行扩繁并提取质粒。根据目的基因的位置,选择合适的酶切位点,使用Not I酶在PCR仪中37 ℃的条件下酶切3 h。将酶切结果进行琼脂糖凝胶电泳,确保酶切产物的准确,然后将酶切产物纯化回收备用。冰上冻融T7 High Yield RNA Transcription kit试剂盒,合成cRNA的反应体系:酶切纯化产物1 μg,10 × Reaction Buffer 2 μL,2× NTP 10 μL ,T7 Enzyme Mix 2 μL,无酶水补足至20 μL,37 ℃条件下PCR仪反应2 h。将合成的cRNA取1 μL测浓度,−80 ℃保存备用。
1.3 亚基基因cRNA在非洲爪蟾卵母细胞中表达
1.3.1 卵母细胞处理液的准备
卵母细胞处理液的配制包括标准卵母细胞溶液(SOS)溶液、洗涤液和培养液的配制。首先配置含有100 mmol/L NaCl、2 mmol/L KCl、1.8 mmol/L CaCl2、1 mmol/L MgCl2和5 mmol/L HEPES (pH 7.6)的SOS。无Ca+洗涤液含有100 mmol/L NaCl、2 mmol/L KCl、1 mmol/L MgCl2和5 mmol/L HEPES (pH 7.6)。培养液的配制是在SOS溶液中再添加2.5 mmol/L磷酸钠、50 μg/mL庆大霉素和0.5 mmol/L茶碱。
1.3.2 卵母细胞的获取
将非洲爪蟾置于麻醉液中麻醉,使其仰卧放在碎冰上,同时爪蟾的前、后爪都用碎冰覆盖,保证其完全进入麻醉状态。在爪蟾的下腹部使用酒精棉球消毒,用无菌剪刀在爪蟾下腹部剪开1 cm左右的切口,剥开筋膜和肌肉,使卵巢组织暴露在视野范围内。使用无菌镊子探入卵巢组织,取出卵母细胞,放置在已经装好洗涤液的培养皿中,之后使用可降解手术线缝合。最后将爪蟾移至蒸馏水中使其苏醒,注意水的高度不淹没爪蟾,水位过高会导致爪蟾窒息死亡。
1.3.3 卵母细胞的处理
在显微镜下,用镊子将获取的卵母细胞群分散,便于后期消化。接着使用分析天平称取1 mg的1 A型胶原酶,放入15 mL的无菌离心管,并加入10 mL洗涤液,待其溶解。用吸管吸取爪蟾卵母细胞放入离心管后,置于微振荡仪缓慢振荡消化30 min,每间隔几分钟观察细胞是否完好,防止消化时间过长,细胞膜损坏,影响到细胞表达甚至直接导致细胞死亡。酶解完成后,用洗涤液彻底清洁细胞,去除表面所残留的胶原酶,使用镊子剥除滤泡膜。最后用吸管吸取黑白分明并且大小大致相同的细胞转入培养皿中,并将培养皿放入16 ℃培养箱。
1.3.4 cRNA的显微注射及细胞的培养
使用微电极拉制仪,将毛细管拉制成为显微注射针,使用镊子将注射针尖端斜剪,形成20~30 μm外径的截面,使其便于穿透卵母细胞。注射针内灌入矿物油,用显微注射仪吸取4 μL cRNA,然后在显微镜下将卵母细胞有序排列在培养皿的网膜上。接着调整仪器,让针尖能够刚好接触细胞表面,细胞针尖刺透细胞膜会有一定阻力,并在显微镜下可以观察到卵母细胞形成褶皱。最后将注射成功的卵母细胞转入培养皿,置于培养箱培养2~4 d,保持恒温16 ℃,每日对细胞进行2次检查,并更换培养液。对于成功表达出电流的细胞,将其收集在1.5 mL的离心管中并放入−80 ℃冰箱冷冻待用。然后将收集的一定量的卵母细胞在液氮中研磨,随后加入RNA-Solv® Reagent,按照RNA提取试剂盒(Total RNA Kit II R6934)操作步骤提取总RNA。使用NanoDrop微量核酸浓度测定仪测定RNA产物的浓度和纯度。将提取到的总 RNA按照cDNA合成试剂盒(M-MLV frist strand cDNA Synthesis Kit TQ2501)步骤合成,合成的cDNA于−20 ℃保存。用同源重组设计的同源臂引物F1和F2进行PCR反应。PCR反应体系为50 μL,包括cDNA模板1 μL,KOD OneTM PCR Master Mix 25 μL,正、反向引物各1.5 μL,ddH2O补足体积50 μL。PCR反应条件为:95 ℃ 3 min;95 ℃ 15 s,68 ℃ 15 s,72 ℃ 30 s,共35个循环;72 ℃延伸5 min,4 ℃保存。最后凝胶电泳检测PCR产物有无目的条带,确认是否注射成功或是否在细胞中成功表达。
1.4 双电极电压钳检测成功表达受体的细胞电流
使用电极拉制仪,将玻璃毛细管(外径1.2 mm,内径 0.69 mm,长10 cm)拉制成电极针,在其中灌入3 mol/L KCl。电极针与双电极电压钳两极相连,并将培养好的细胞转入SOS培养基记录室,使电压保持在−80 mV,电阻设置为0.5~2.0 MΩ,同时保持试验温度20 ℃,SOS培养液灌注细胞的速度设置为8~10 mL/min。单独刺激时,荷包牡丹碱溶解到DMSO溶液中,配置不同梯度并加入GABA溶液中,荷包牡丹碱浓度梯度分别使用0.1、1.0、5.0、10.0和50.0 mmol/L,并以100 μmol/L GABA溶液为对照,最后将配置好的药剂溶液每间隔30 s刺激细胞5 s,使用Axon Digidata 1550 A数据采集系统记录细胞的电流信号,得到两者的剂量–反应曲线以及IC50。混合刺激时,第1组固定溴虫氟苯双酰胺的浓度为0.0028 μmol/L,将其分别加至荷包牡丹碱浓度梯度刺激液中,并以100 μmol/L GABA + 0.0028 μmol/L溴虫氟苯双酰胺溶液为对照,计算混合时荷包牡丹碱单独的IC50。第2组固定荷包牡丹碱的浓度为0.1 mmol/L,将其分别加入至溴虫氟苯双酰胺浓度梯度为2.8000、0.2800、0.1400、0.0280、0.0028 μmol/L的刺激液中,并以100 μmol/L GABA + 0.1 mmol/L荷包牡丹碱溶液为对照,计算混合时溴虫氟苯双酰胺单独的IC50。
1.5 分子对接
使用SWISS-MODLE (https://swissmodel.expasy.org/)进行同源建模,将同源建模后得到的蛋白结构的PDB文件和荷包牡丹碱小分子配体的SDF文件导入Schrodinger软件中。首先使用软件中的Protein Preparation Wizard模块进行蛋白结构的准备与预处理,在模块中完成添加氢原子、设置pH、蛋白中原子能量的最小化等操作,其他参数均为默认值。然后使用软件中的LigPrep模块进行小分子配体结构的预处理,力场选择为OPLS4,离子化状态预测中pH设置为7.0±2.0,同时预测小分子配体可能的互变异构,其他参数均为默认值。接着进入Receptor Grid Generation模块,蛋白范德华半径缩放因子设置为0.8,将对接盒子的中心设置为274号残基,对接盒子大小为20×20×20,勾选对接盒子中心周围允许旋转的残基,其他参数均为默认值。最后进入Ligand Docking模块,配体范德华半径缩放因子设置为0.8,对接精度为SP级,其他参数均为默认值,随后运行对接。
1.6 定点突变
利用诺维赞官方引物设计网站CE Design (http://www.vazyme.com)设计突变引物,4个家蝇剪接体I274F定点突变引物分别为F3:CAGATTTACTTTCCCTCTGGACTGATCGTTGTTATATCATGGG,F4:TCCAGAGGGAAAGTAAATCTGTATAAGATAATAGCCCATAGAGCGCAC。使用Phanta Max Super-Fidelity DNA Polymerase试剂盒对目标质粒进行扩增,按试剂盒反应体系进行PCR,结束后取少量扩增产物进行琼脂糖凝胶电泳检测。在重组环化之前需进行Dpn I消化去除甲基化模板质粒,切胶回收后进行浓度测定。消化产物在Exnase II催化下进行高效重组,实现线性DNA的体外环化。最后进行重组产物转化,当重组反应转化平板上的克隆数目显著高于阴性对照时,挑取5个单克隆接种至含有适当抗生素的LB液体培养基中培养过夜,提取质粒进行一代测序比对。
2. 结果与分析
2.1 分子对接结果
2.1.1 同源建模
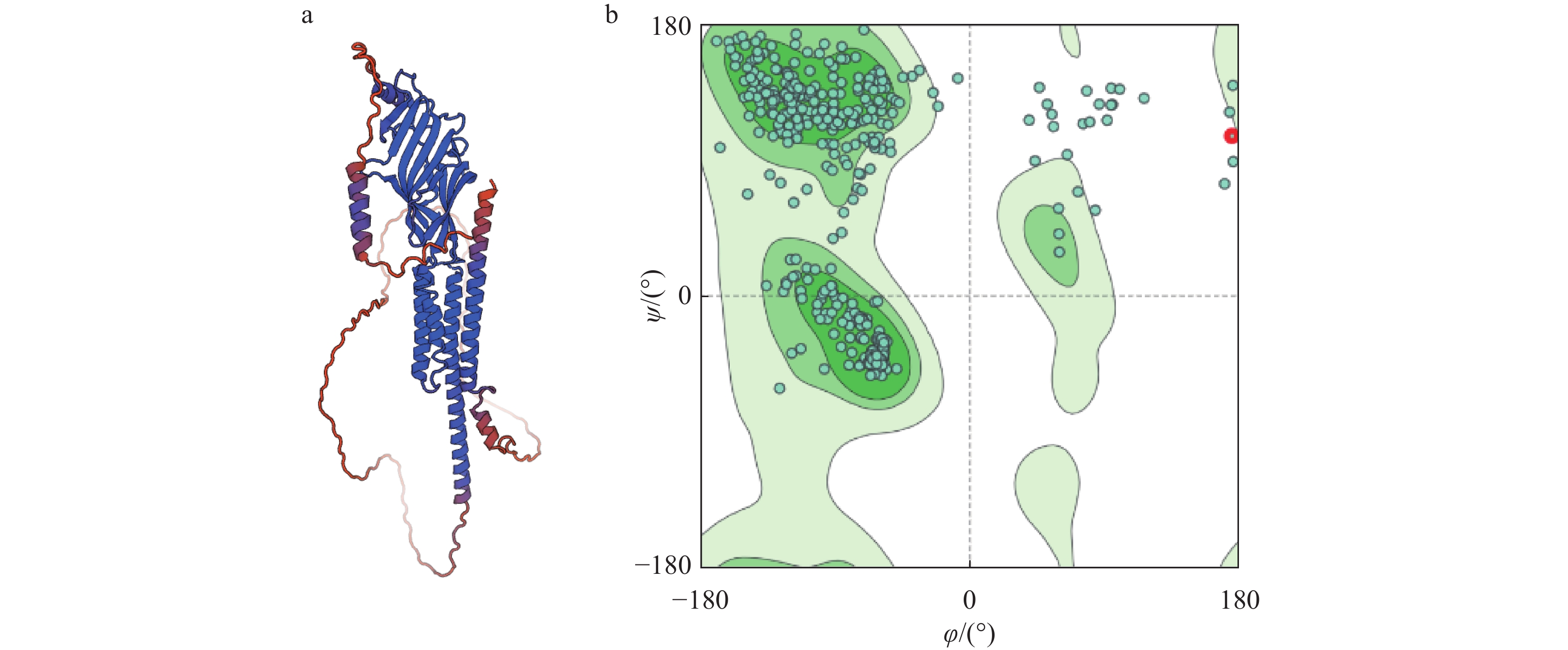
同源建模得到的最佳模板如图1a所示,序列相似度均达99.83%,随后对建模得到的蛋白结构进行检验,结果如图1b所示,该模板大部分残基都在绿色区域,代表这个建模的结果是可信的。
![]() 图 1 GABA受体蛋白同源建模相关数据a:同源建模后的蛋白结构模型;b:同源建模可信度检测,绿点代表氨基酸残基,所在区域颜色越绿代表氨基酸残基的能量越低,结构越稳定,φ表示1个肽单位中α碳左边C—N键的旋转角度,ψ表示α碳右边C—C键的旋转角度Figure 1. Homology modeling data of GABA receptor proteina: Protein structure model after homology modeling; b: Homology modeling credibility check, green dots represent amino acid residues, a darker green area indicates lower energy of the amino acid residues and a more stable structure,φ represents the angle of rotation of the C—N bond to the left of the α-carbon in a peptide unit, and ψ represents the angle of rotation of the C—C bond to the right of the α-carbon
图 1 GABA受体蛋白同源建模相关数据a:同源建模后的蛋白结构模型;b:同源建模可信度检测,绿点代表氨基酸残基,所在区域颜色越绿代表氨基酸残基的能量越低,结构越稳定,φ表示1个肽单位中α碳左边C—N键的旋转角度,ψ表示α碳右边C—C键的旋转角度Figure 1. Homology modeling data of GABA receptor proteina: Protein structure model after homology modeling; b: Homology modeling credibility check, green dots represent amino acid residues, a darker green area indicates lower energy of the amino acid residues and a more stable structure,φ represents the angle of rotation of the C—N bond to the left of the α-carbon in a peptide unit, and ψ represents the angle of rotation of the C—C bond to the right of the α-carbon2.1.2 分子对接分析
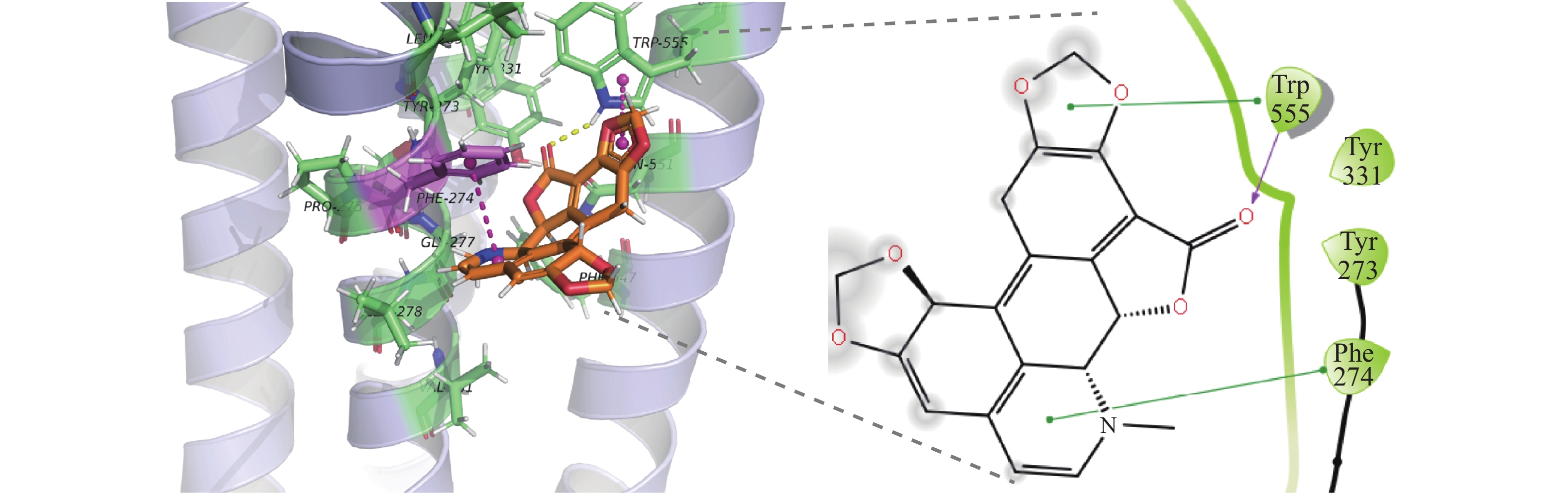
图2展示了家蝇GABA 剪接体的I274F突变后的对接情况,在输出的结果中选择了一个最优结果进行展示,荷包牡丹碱小分子配体与Trp-555形成1个氢键,与Trp-555和Phe-274共形成2个Pi-Pi相互作用,与Phe-274形成疏水相互作用。仅从分子对接的角度来看,小分子配体与274号残基直接产生相互作用。
2.2 剪接体亚基表达电流信号结果
用100 μmol/L的GABA溶液对已表达了GABA受体亚基MdRdl 4个剪接体的卵母细胞进行刺激,荷包牡丹碱浓度梯度分别使用0.1、1.0、5.0、10.0、50.0 mmol/L。由表1可知,卵母细胞已成功表达电流,并且随着荷包牡丹碱浓度越高,4个剪接体所表达的电流越小,也就是说电流抑制率与抑制剂浓度成负相关。4个剪接体亚基表达出的电流大小有差异,说明荷包牡丹碱对4个剪接体亚基的敏感性有差异,可以通过计算IC50加以验证。
表 1 荷包牡丹碱刺激表达不同GABA受体剪接体的细胞电流均值1)Table 1. Average currents of cells expressing different GABA receptor spliceosomes stimulated by bicucullinenA c(荷包牡丹碱)/(mmol·L−1)
Bicuculline concentrationMdRdlac MdRdlbc MdRdlad MdRdlbd 0.1 94.16±5.27 93.64±6.82 87.82±10.93 92.40±8.38 1.0 67.72±5.24 64.96±7.33 67.36±9.46 75.24±5.11 5.0 50.78±3.47 47.72±6.42 52.00±9.50 55.60±8.19 10.0 39.34±3.63 35.50±3.55 39.46±6.96 38.10±5.21 50.0 27.36±4.72 23.12±4.05 24.66±5.02 26.76±3.07 1) 表中数据是5个卵母细胞检测结果的平均值±标准误
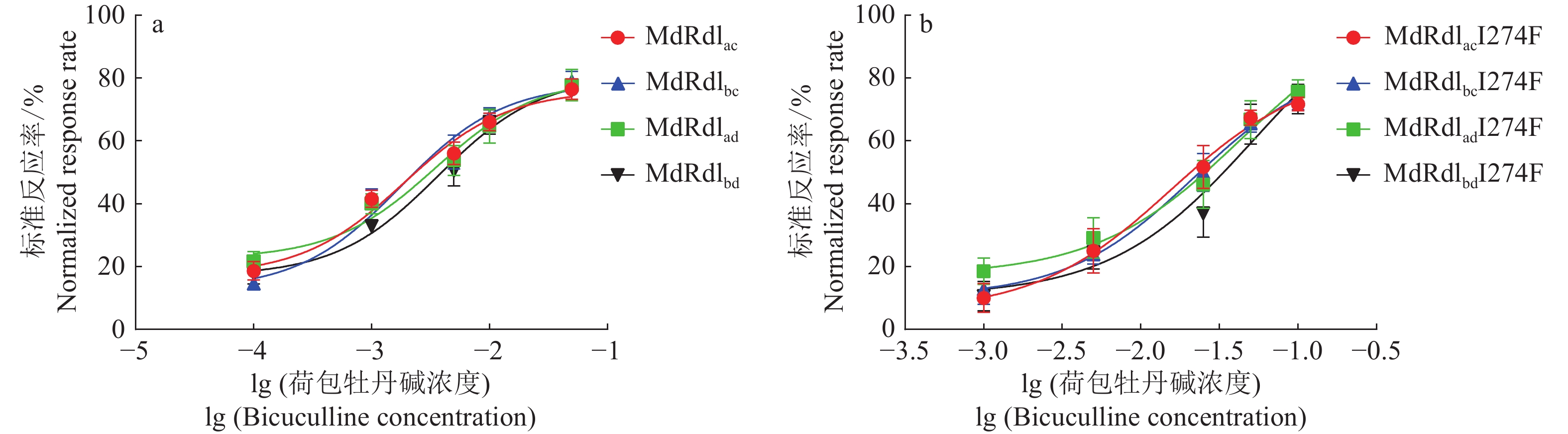
1) Data in the table is the mean ± standard error of the test results of five oocytes荷包牡丹碱抑制4个剪接体以及I274F突变体的剂量–反应曲线如图3所示。由图3a 可知,荷包牡丹碱对剪接体 MdRdlbc 最敏感,对剪接体 MdRdlad 最不敏感,由图3b 可知,I274F 定点突变后荷包牡丹碱对剪接体MdRdlac最敏感,对剪接体MdRdlbd 最不敏感。
RDL基因中外显子 3(a 和 b)和 6(c 和 d)的选择性剪接,可能解释了昆虫 GABA 受体的功能多样化[13]。在果蝇中枢神经系统的 cDNA 中发现,其主要变异是 bd (93.8%),其次是 ad (3.6%)、bc (2.3%) 和 ac (0.3%)[14]。 而RDL外显子6的选择性剪接残基位于环 F 和环 C 中,外显子6的剪接会影响细胞表达受体时对 GABA 的亲和力[15]。由IC50检测结果可知,荷包牡丹碱对 MdRdlac、MdRdlbc、MdRdlad和MdRdlbd 4个剪接体的IC50分别为1.274、0.948、4.702和3.698 mmol/L(表2),说明荷包牡丹碱对家蝇的 GABA 受体亚基 MdRdl 的4个剪接体都有抑制作用,但是与其他抑制剂溴虫氟苯双酰胺相比,荷包牡丹碱对 MdRdl 4个剪接体的抑制效果不明显(表2、3)。外显子3(a、b)的剪接导致2个剪接体(MdRdlac和MdRdlbc,MdRdlad和MdRdlbd)的IC50 差异较小,说明对荷包牡丹碱敏感性影响较小,外显子6的剪接会影响荷包牡丹碱溶液的敏感性。外显子6的剪接结果表明荷包牡丹碱对外显子6c抑制效果比外显子6d抑制效果强,同时也说明家蝇GABA受体亚基 MdRdl 的选择性剪接对荷包牡丹碱的抑制效果有影响。I274F残基突变后,与野生型剪接体相比,4个突变体 IC50 分别增大约11、22、8和13倍,表示该点突变后其药物敏感性下降(表2)。
表 2 GABA和荷包牡丹碱刺激4个野生剪接体和突变体的结果Table 2. Results of GABA and bicuculline stimulation of four wild-type splicesomes and mutants剪接体
SplicesomeGABA 荷包牡丹碱 Bicuculline EC50 /(μmol·L−1) 95%置信区间
95% Confidence intervalIC50 /(mmol·L−1) 95%置信区间
95% Confidence intervalMdRdlac 30.500 1.375~47.630 1.274 1.191~3.010 MdRdlbc 39.010 30.290~64.940 0.948 0.108~2.903 MdRdlad 86.740 70.490~114.300 4.702 2.626~5.074 MdRdlbd 84.610 70.070~105.800 3.698 1.964~5.840 MdRdlac I274F 44.320 17.790~133.500 15.460 9.641~24.900 MdRdlbc I274F 42.420 36.870~46.840 21.670 15.130~33.530 MdRdlad I274F 63.800 59.250~68.480 42.830 21.140~80.490 MdRdlbd I274F 69.750 66.500~73.130 52.330 23.700~111.900 黑腹果蝇RDL中G227M的突变使去甲基溴虫氟苯双酰胺的抑制活性消失,I218F和L222C突变也将去甲基溴虫氟苯双酰胺的抑制活性减弱了6倍[12]。本试验结果表明,I274F残基突变后,荷包牡丹碱变得更不敏感,274位异亮氨酸残基为荷包牡丹碱抑制家蝇GABA受体电流的关键作用靶点,具有开发昆虫GABA受体抑制剂的靶标位点的潜力(表2)。
2.3 荷包牡丹碱和溴虫氟苯双酰胺共同抑制电流的表达
固定浓度溴虫氟苯双酰胺分别和0.1、1.0、2.0、10.0和100.0 mmol/L的荷包牡丹碱共同刺激未突变的MdRdlac、MdRdlbc、MdRdlad、MdRdlbd 4个剪接体,和单独用荷包牡丹碱刺激GABA亚基MdRdl 4个剪接体所得的电流相比,抑制效果在溴虫氟苯双酰胺的作用下提升,电流表达均出现减小。接着又用固定浓度的荷包牡丹碱分别和2.8000、0.2800、0.1400、0.0280、0.0028 μmol/L的溴虫氟苯双酰胺共同刺激4个剪接体,和单独用溴虫氟苯双酰胺刺激GABA亚基MdRdl 4个剪接体的电流相比,抑制效果在荷包牡丹碱的作用下,电流变化不明显。对比单独和混合刺激的溴虫氟苯双酰胺的IC50差异发现,溴虫氟苯双酰胺与荷包牡丹碱有共抑制GABA受体的互作效应(表3),不同浓度溴虫氟苯双酰胺在和固定浓度荷包牡丹碱共同刺激作用下,对4个剪接体的抑制效果均增强。对比表2和表3结果可知,不同浓度荷包牡丹碱在和固定浓度溴虫氟苯双酰胺共同刺激作用下,对剪接体MdRdlad和MdRdlbd的抑制效果增强,却对剪接体MdRdlac和MdRdlbc的抑制效果减弱。根据这一现象,分析可能是外显子6编码的剪接变异体序列长度相同,但存在10个不同的氨基酸残基所引起的。
表 3 荷包牡丹碱和溴虫氟苯双酰胺单独和共同抑制剪接体的IC50Table 3. The IC50s of bicuculline and broflanilide for individual and combined inhibition of spliceosomes剪接体
Splicesome混合荷包牡丹碱1)
Mixed bicuculline溴虫氟苯双酰胺
Broflanilide混合溴虫氟苯双酰胺2)
Mixed broflanilideIC50/
(mmol·L−1)95%置信区间
95% Confidence intervalIC50/
(μmol·L−1)95%置信区间
95% Confidence intervalIC50/
(μmol·L−1)95%置信区间
95% Confidence intervalMdRdlac 1.824 1.235~2.823 0.118 0.016~0.230 0. 106 0.069~0.155 MdRdlbc 1.722 1.157~2.731 0.209 0.132~3.158 0. 165 0.102~0.210 MdRdlad 3.989 2.261~5.191 0.139 0.071~0.228 0. 111 0.037~0.556 MdRdlbd 2.567 1.690~3.636 0.151 0.079~0.250 0. 126 0.085~0.172 1)混合荷包牡丹碱表示不同浓度荷包牡丹碱与固定浓度溴虫氟苯双酰胺混合的溶液;2)混合溴虫氟苯双酰胺表示不同浓度溴虫氟苯双酰胺与固定浓度荷包牡丹碱混合的溶液
1) The mixed bicuculline represents a solution in which bicuculline of different concentrations are mixed with a fixed concentration of broflanilide; 2) The mixed broflanilide represents a solution in which broflanilide of different concentrations are mixed with a fixed concentration of bicuculline3. 讨论与结论
GABA RDL 亚基位点突变会导致果蝇、家蝇等昆虫对杀虫剂产生抗药性[16]。果蝇中A301S突变降低了拮抗剂防己毒素和氟虫腈的效力[17]。家蝇GABA受体 TM1中的271号位点突变会导致氟雷拉纳的效力显著降低[18]。此外,用甲硫氨酸、丝氨酸或丙氨酸替换家蝇GABA受体的TM3中的333号残基也导致氟雷拉纳的效力显著降低[19]。S313A和S314A突变体具有与野生型相似的氟雷拉纳敏感性。M312S突变体的敏感性比野生型低约7倍。值得注意的是,N316L突变体对氟雷拉纳几乎不敏感[20]。当溴虫氟苯双酰胺在昆虫体内被代谢为去甲基溴虫氟苯双酰胺,会作用于RDL GABA受体的一个新位点,即果蝇GABA受体 M3区的G336或其附近,去甲基溴虫氟苯双酰胺和非竞争性拮抗剂结合位点的差异可能使溴虫氟苯双酰胺有效对抗携带A20突变的环二烯和氟虫腈抗性害虫[21]。间苯二酰胺类杀虫剂对GABA-Cl受体的抑制活性与昆虫RDL亚基TM2上A2′和T6′是否发生突变无关,但与TM3上突变的G336 (斜纹夜蛾的等效位点为G319) 及其附近TM1上的突变相关[22]。间苯二酰胺类杀虫剂似乎与大环内酯类杀虫剂在GABA-Cl受体上的作用位点存在重叠,但二者与该受体结合方式不同,受TM1上的I277F和L281C、TM3上的V340Q和V340N以及TM2上的A2′的突变的影响也不同[23]。本试验通过对I274F突变后的4个剪接体进行电生理检测,发现I274F突变对荷包牡丹碱敏感性存在影响。
为了提高作物生产力和资源利用效率,需要开发比现有农药具有更高特异性和针对性的农药。所以需要了解当前杀虫剂的分子作用模式,利用分子对接软件模拟预测,会使开发符合标准的下一代杀虫剂更容易实现[24]。针对害虫的防治,RDL亚基在杀虫剂作用中起着重要作用,荷包牡丹碱作为昆虫GABA受体别构抑制剂,新作用靶点的出现对开发新型杀虫剂具有重要的推动作用。本研究表明,外显子的交替拼接对荷包牡丹碱的抑制作用产生影响,这为后续研究新型GABA受体别构抑制剂打下基础。 I274F突变对荷包牡丹碱的抑制效果影响明显,其为荷包牡丹碱关键作用位点,且与外显子6编码的氨基酸残基具有互作效应,表明昆虫GABA受体上的这些氨基酸残基具有开发协同增效作用的别构抑制剂的潜力。溴虫氟苯双酰胺的作用位点独特,因其独特的作用机制,溴虫氟苯双酰胺与现有杀虫剂无交互抗性,本试验发现其与荷包牡丹碱有协同增效作用,可被用于抗药性害虫的防治,这为解决害虫对杀虫剂的抗性问题提供了新的方向。
-
图 1 GABA受体蛋白同源建模相关数据
a:同源建模后的蛋白结构模型;b:同源建模可信度检测,绿点代表氨基酸残基,所在区域颜色越绿代表氨基酸残基的能量越低,结构越稳定,φ表示1个肽单位中α碳左边C—N键的旋转角度,ψ表示α碳右边C—C键的旋转角度
Figure 1. Homology modeling data of GABA receptor protein
a: Protein structure model after homology modeling; b: Homology modeling credibility check, green dots represent amino acid residues, a darker green area indicates lower energy of the amino acid residues and a more stable structure,φ represents the angle of rotation of the C—N bond to the left of the α-carbon in a peptide unit, and ψ represents the angle of rotation of the C—C bond to the right of the α-carbon
表 1 荷包牡丹碱刺激表达不同GABA受体剪接体的细胞电流均值1)
Table 1 Average currents of cells expressing different GABA receptor spliceosomes stimulated by bicuculline
nA c(荷包牡丹碱)/(mmol·L−1)
Bicuculline concentrationMdRdlac MdRdlbc MdRdlad MdRdlbd 0.1 94.16±5.27 93.64±6.82 87.82±10.93 92.40±8.38 1.0 67.72±5.24 64.96±7.33 67.36±9.46 75.24±5.11 5.0 50.78±3.47 47.72±6.42 52.00±9.50 55.60±8.19 10.0 39.34±3.63 35.50±3.55 39.46±6.96 38.10±5.21 50.0 27.36±4.72 23.12±4.05 24.66±5.02 26.76±3.07 1) 表中数据是5个卵母细胞检测结果的平均值±标准误
1) Data in the table is the mean ± standard error of the test results of five oocytes表 2 GABA和荷包牡丹碱刺激4个野生剪接体和突变体的结果
Table 2 Results of GABA and bicuculline stimulation of four wild-type splicesomes and mutants
剪接体
SplicesomeGABA 荷包牡丹碱 Bicuculline EC50 /(μmol·L−1) 95%置信区间
95% Confidence intervalIC50 /(mmol·L−1) 95%置信区间
95% Confidence intervalMdRdlac 30.500 1.375~47.630 1.274 1.191~3.010 MdRdlbc 39.010 30.290~64.940 0.948 0.108~2.903 MdRdlad 86.740 70.490~114.300 4.702 2.626~5.074 MdRdlbd 84.610 70.070~105.800 3.698 1.964~5.840 MdRdlac I274F 44.320 17.790~133.500 15.460 9.641~24.900 MdRdlbc I274F 42.420 36.870~46.840 21.670 15.130~33.530 MdRdlad I274F 63.800 59.250~68.480 42.830 21.140~80.490 MdRdlbd I274F 69.750 66.500~73.130 52.330 23.700~111.900 表 3 荷包牡丹碱和溴虫氟苯双酰胺单独和共同抑制剪接体的IC50
Table 3 The IC50s of bicuculline and broflanilide for individual and combined inhibition of spliceosomes
剪接体
Splicesome混合荷包牡丹碱1)
Mixed bicuculline溴虫氟苯双酰胺
Broflanilide混合溴虫氟苯双酰胺2)
Mixed broflanilideIC50/
(mmol·L−1)95%置信区间
95% Confidence intervalIC50/
(μmol·L−1)95%置信区间
95% Confidence intervalIC50/
(μmol·L−1)95%置信区间
95% Confidence intervalMdRdlac 1.824 1.235~2.823 0.118 0.016~0.230 0. 106 0.069~0.155 MdRdlbc 1.722 1.157~2.731 0.209 0.132~3.158 0. 165 0.102~0.210 MdRdlad 3.989 2.261~5.191 0.139 0.071~0.228 0. 111 0.037~0.556 MdRdlbd 2.567 1.690~3.636 0.151 0.079~0.250 0. 126 0.085~0.172 1)混合荷包牡丹碱表示不同浓度荷包牡丹碱与固定浓度溴虫氟苯双酰胺混合的溶液;2)混合溴虫氟苯双酰胺表示不同浓度溴虫氟苯双酰胺与固定浓度荷包牡丹碱混合的溶液
1) The mixed bicuculline represents a solution in which bicuculline of different concentrations are mixed with a fixed concentration of broflanilide; 2) The mixed broflanilide represents a solution in which broflanilide of different concentrations are mixed with a fixed concentration of bicuculline -
[1] GAO Y, ZHANG Y C, WU F S, et al. Exploring the interaction mechanism of desmethyl-broflanilide in insect GABA receptors and screening potential antagonists by In silico simulations[J]. Journal of Agricultural and Food Chemistry, 2020, 68(50): 14768-14780. doi: 10.1021/acs.jafc.0c05728
[2] TAYLOR-WELLS J, HAWKINS J, COLOMBO C, et al. Cloning and functional expression of intracellular loop variants of the honey bee (Apis mellifera) RDL GABA receptor[J]. NeuroToxicology, 2017, 60: 207-213. doi: 10.1016/j.neuro.2016.06.007
[3] SIMON-DELSO N, AMARAL-ROGERS V, BELZUNCES L P, et al. Systemic insecticides (neonicotinoids and fipronil): Trends, uses, mode of action and metabolites[J]. Environmental Science and Pollution Research, 2015, 22: 5-34. doi: 10.1007/s11356-014-3470-y
[4] MÉNARD C, LIBERT Y, CANIVET D, et al. Development of the multi-dimensional analysis of patient outcome predictions (MD. POP) during medical encounters[J]. Patient Education and Counseling, 2018, 101(1): 52-58. doi: 10.1016/j.pec.2017.07.004
[5] HISANO K, OZOE F, HUANG J, et al. The channel-lining 6′ amino acid in the second membrane-spanning region of ionotropic GABA receptors has more profound effects on 4′-ethynyl-4-n-propylbicycloorthobenzoate binding than the 2′ amino acid[J]. Invertebrate Neuroscience, 2007, 7: 39-46. doi: 10.1007/s10158-006-0035-x
[6] OZOE Y, OZOE F, KITA T, et al. Multiple sites of insecticidal action in ionotropic GABA receptors[M]//Discovery and synthesis of crop protection products. Washington, DC: American Chemical Society, 2015: 431-446.
[7] ANDREWS P R, JOHNSTON G A R. GABA agonists and antagonists[J]. Biochemical Pharmacology, 1979, 28(18): 2697-2702. doi: 10.1016/0006-2952(79)90549-5
[8] MACDONALD R L, ROGERS C J, TWYMAN R E. Kinetic properties of the GABAA receptor main conductance state of mouse spinal cord neurones in culture[J]. The Journal of Physiology, 1989, 410(1): 479-499. doi: 10.1113/jphysiol.1989.sp017545
[9] UENO S, BRACAMONTES J, ZORUMSKI C, et al. Bicuculline and gabazine are allosteric inhibitors of channel opening of the GABAA receptor[J]. The Journal of Neuroscience, 1997, 17(2): 625-634. doi: 10.1523/JNEUROSCI.17-02-00625.1997
[10] JOHNSTON G A. Advantages of an antagonist: Bicuculline and other GABA antagonists[J]. British Journal of Pharmacology, 2013, 169(2): 328-336. doi: 10.1111/bph.12127
[11] LIU G Y, OZOE F, FURUTA K, et al. 4, 5-substituted 3-isoxazolols with insecticidal activity act as competitive antagonists of housefly GABA receptors[J]. Journal of Agricultural and Food Chemistry, 2015, 63(28): 6304-6312. doi: 10.1021/acs.jafc.5b01843
[12] 宋璐璐, 艾大朋, 巨修练, 等. 新型双酰胺类杀虫剂: 溴虫氟苯双酰胺[J]. 农药学学报, 2022, 24(4): 671-681. [13] KITA T, MINO H, OZOE F, et al. Spatiotemporally different expression of alternatively spliced GABA receptor subunit transcripts in the housefly Musca domestica[J]. Archives of Insect Biochemistry and Physiology, 2019, 101(1): e21541. doi: 10.1002/arch.21541
[14] JONES A K, BUCKINGHAM S D, PAPADAKI M, et al. Splice-variant- and stage-specific RNA editing of the Drosophila GABA receptor modulates agonist potency[J]. The Journal of Neuroscience, 2009, 29(13): 4287-4292. doi: 10.1523/JNEUROSCI.5251-08.2009
[15] HOSIE A M, SATTELLE D B. Agonist pharmacology of two Drosophila GABA receptor splice variants[J]. British Journal of Pharmacology, 1996, 119(8): 1577-1585. doi: 10.1111/j.1476-5381.1996.tb16075.x
[16] NAKAO T, NAOI A, KAWAHARA N, et al. Mutation of the GABA receptor associated with fipronil resistance in the whitebacked planthopper, Sogatella furcifera[J]. Pesticide Biochemistry and Physiology, 2010, 97(3): 262-266. doi: 10.1016/j.pestbp.2010.03.006
[17] LEES K, MUSGAARD M, SUWANMANEE S, et al. Actions of agonists, fipronil and ivermectin on the predominant in vivo splice and edit variant (RDLbd, I/V) of the Drosophila GABA receptor expressed in Xenopus laevis oocytes[J]. PLoS One, 2014, 9(5): e97468. doi: 10.1371/journal.pone.0097468
[18] YAMATO K, NAKATA Y, TAKASHIMA M, et al. Effects of intersubunit amino acid substitutions on GABA receptor sensitivity to the ectoparasiticide fluralaner[J]. Pesticide Biochemistry and Physiology, 2020, 163: 123-129. doi: 10.1016/j.pestbp.2019.11.001
[19] KONO M, OZOE F, ASAHI M, et al. State-dependent inhibition of GABA receptor channels by the ectoparasiticide fluralaner[J]. Pesticide Biochemistry and Physiology, 2022, 181: 105008. doi: 10.1016/j.pestbp.2021.105008
[20] ASAHI M, YAMATO K, OZOE F, et al. External amino acid residues of insect GABA receptor channels dictate the action of the isoxazoline ectoparasiticide fluralaner[J]. Pest Management Science, 2023, 79(10): 4078-4082. doi: 10.1002/ps.7606
[21] NAKAO T, BANBA S. Broflanilide: A meta-diamide insecticide with a novel mode of action[J]. Bioorganic & Medicinal Chemistry, 2016, 24(3): 372-377.
[22] NAKAO T, BANBA S, NOMURA M, et al. Meta-diamide insecticides acting on distinct sites of RDL GABA receptor from those for conventional noncompetitive antagonists[J]. Insect Biochemistry and Molecular Biology, 2013, 43(4): 366-375. doi: 10.1016/j.ibmb.2013.02.002
[23] NAKAO T, BANBA S, HIRASE K. Comparison between the modes of action of novel meta-diamide and macrocyclic lactone insecticides on the RDL GABA receptor[J]. Pesticide Biochemistry and Physiology, 2015, 120: 101-108. doi: 10.1016/j.pestbp.2014.09.011
[24] RAISCH T, RAUNSER S. The modes of action of ion-channel-targeting neurotoxic insecticides: Lessons from structural biology[J]. Nature Structural & Molecular Biology, 2023, 30(10): 1411-1427.



 下载:
下载: