Effects of intercropping soybeans with different root architecture and sweet maize on crop growth and phosphorus uptake
-
摘要:目的
研究不同磷水平下不同根构型大豆与甜玉米间作对作物磷吸收与生长的影响,探究间作体系内根系形态、构型及根际土壤磷有效性等的关系。
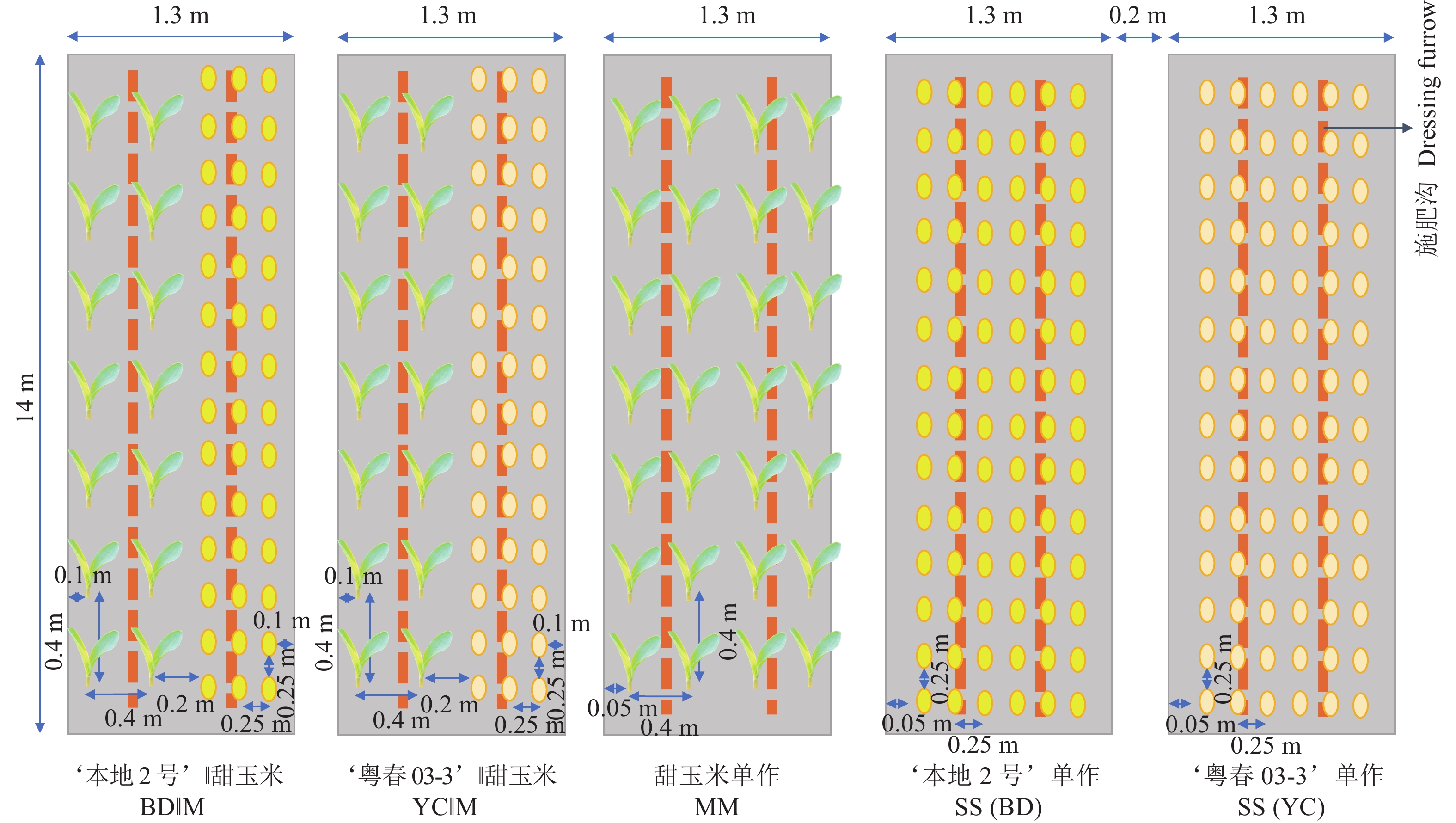
方法田间试验于2022年8月在广东省广州市增城区华南农业大学教学试验基地进行。以2个不同根构型的大豆品种‘本地2号’(深根型)和‘粤春03-3’(浅根型)为材料,采用裂区设计,主区为施磷(+P:大豆40 kg·hm−2、甜玉米120 kg· hm−2)和不施磷(−P:大豆0 kg·hm−2、甜玉米0 kg·hm−2) 2种施磷水平,副区为甜玉米单作、‘本地2号’‖甜玉米、‘粤春03-3’‖甜玉米、‘本地2号’单作和‘粤春03-3’单作5种种植模式。测定甜玉米和大豆的产量、生物量、磷吸收量以及根系形态和构型的相关指标,计算间作系统的土地当量比和种间竞争力。
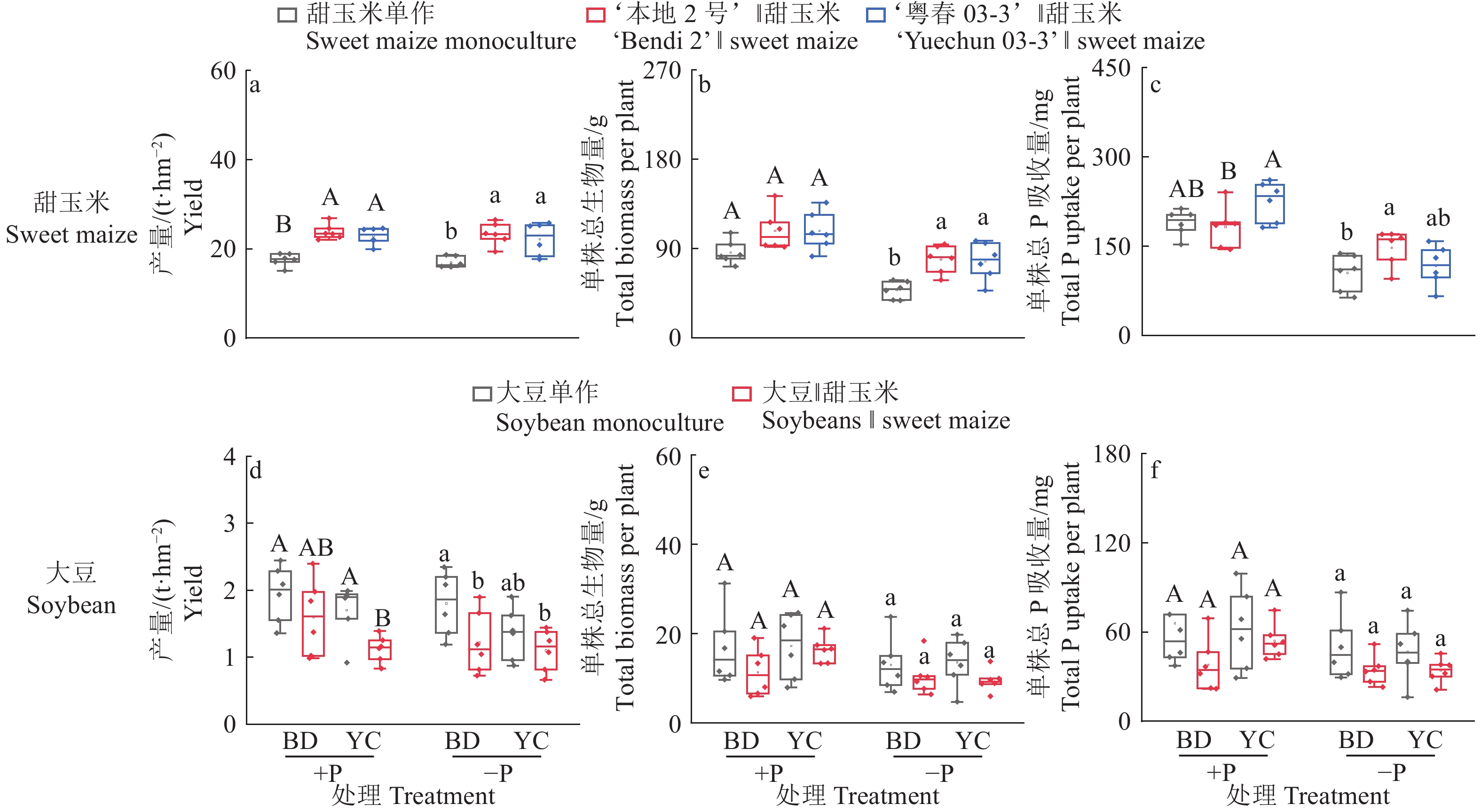
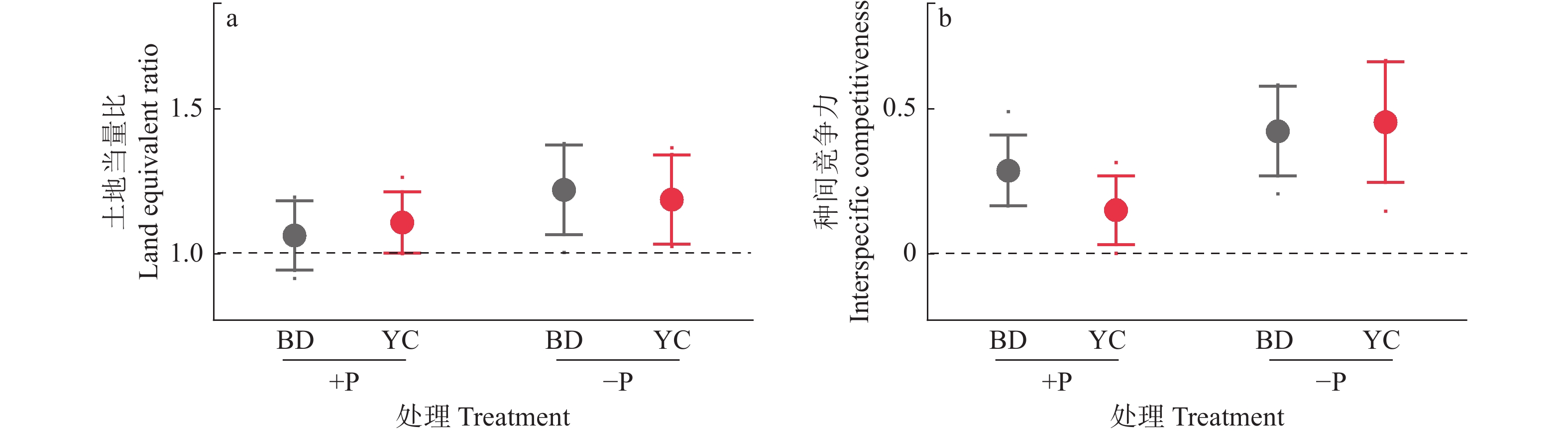
结果无论施磷还是不施磷条件下,间作大豆显著增加甜玉米产量,平均增产33.4%;不施磷条件下,间作大豆显著增加甜玉米生物量,平均增加62.7%。甜玉米和大豆间作具有间作优势,且受施磷水平影响;施磷条件下甜玉米与大豆间作的土地当量比为1.08,而不施磷条件下为1.21。种间竞争力分析表明,间作体系中,甜玉米竞争力显著强于大豆(种间竞争力>0),这种竞争优势在不施磷条件下更明显。此外,不施磷条件下间作深根型大豆‘本地2号’显著促进甜玉米磷吸收,平均增加40.6%。进一步分析发现,不施磷间作改变深根型大豆细根(直径≤0.5 mm)占比,同时诱导其根系拓宽,并显著提升甜玉米根际土壤有效磷含量。对间作体系内大豆和甜玉米性状的相关性分析发现,甜玉米的生物量与其总根长、大豆根宽和大豆根际土壤有效磷含量呈显著正相关;大豆的生物量与其磷吸收量、总根长、根宽以及根际土壤有效磷含量呈显著正相关,与其细根占比(直径≤0.5 mm)呈显著负相关。
结论不施磷条件下,间作深根型大豆可有效促进甜玉米生长与磷吸收,提高甜玉米产量。研究结果为充分挖掘甜玉米‖大豆间作系统磷素利用潜力、筛选适合间作的大豆品种、实现磷肥减施增效提供了重要理论依据。
Abstract:ObjectiveTo study the effects of intercropping soybeans with different root architecture and sweet maize on crop phosphorus (P) uptake and growth under different P levels, and explore the relationship among root morphology, root architecture, P availability in rhizospheric soil and so on within the intercropping system.
MethodField experiments were conducted in August 2022 at the Teaching and Experimental Base of South China Agricultural University in Zengcheng District, Guangzhou City, Guangdong Province. Two different soybean cultivars, namely ‘Bendi 2’ (deep-rooted genotype) and ‘Yuechun 03-3’ (shallow-rooted genotype) were selected as experimental materials. The field experiment employed a split-plot design, with the main plots comprising two P application levels: With P (+P: 40 kg·hm−2 for soybean, 120 kg·hm−2 for sweet maize) and without P (−P: 0 kg·hm−2 for both soybean and sweet maize). The subplots consisted of five different planting patterns as follows: Sweet maize monocropping, soybean ‘Bendi 2’ ‖ sweet maize, soybean ‘Yuechun 03-3’ ‖ sweet maize, soybean ‘Bendi 2’ monocropping and soybean ‘Yuechun 03-3’ monocropping. The yield, biomass, P uptake, root morphology and architecture of sweet maize and soybean were measured, and the land equivalent ratio (LER) and interspecific competitiveness of the intercropping system were calculated.
ResultIntercropping soybean significantly increased the yield of sweet maize by average of 33.4% under both P levels. Under −P condition, intercropping soybean significantly increased the biomass of sweet maize by average of 62.7%. Intercropping sweet maize and soybean exhibited advantages, influencing by P application levels. Under +P condition, the average LER for intercropped sweet maize and soybean was 1.08, while under −P condition, the average LER increased to 1.21. Interspecific competition analysis indicated that in the intercropping system, sweet maize showed significantly stronger competitiveness than soybean (interspecitic competitiveness > 0). This competitive advantage was more pronounced under −P condition. In addition, intercropping with deep-rooted soybean genotype (‘Bendi 2’) significantly promoted P uptake in sweet maize under −P condition by average of 40.6%. Further analysis revealed that for deep-rooted soybean ‘Bendi 2’, intercropping with sweet maize under −P condition widened its root width, altered the proportion of fine roots (diameter ≤ 0.5 mm), and significantly increased P availability in the rhizosphere of intercropping maize. The correlation analysis of traits of soybean and sweet maize in the intercropping system revealed a significant positive correlation between the biomass of sweet maize and its total root length, root width of soybean, and available P content in the soybean rhizosphere soil. The biomass of soybean showed a significant positive correlation with its P uptake, total root length, root width, and available P content in the rhizosphere soil. However, it exhibited a significant negative correlation with its proportion of fine roots (diameter ≤ 0.5 mm).
ConclusionIntercropping with deep rooting soybean under −P condition can effectively promote the growth and P absorption of sweet maize, and increase its yield. These findings provide important theoretical basis for fully exploring the P utilization potential in the sweet maize‖soybean intercropping system, screening suitable soybean varieties for crop intercropping, and achieving reduced P fertilization rate with increased P use efficiency.
-
Keywords:
- Phosphorus level /
- Intercropping /
- Soybean /
- Sweet maize /
- Root configuration /
- Phosphorus uptake
-
花生Arachis hypogaea L.是我国重要的油料作物与经济作物。中国是世界上最大的花生生产国,自2010年起,花生年均种植面积超460万hm2,约占世界花生种植总面积的20%,年均产量超1 600万t,占全球总产量的40%[1]。当下我国花生主要用于生产食用油,其加工量约占花生总产量的50%[2]。花生油的品质与脂肪酸组成紧密相关,其中油酸和亚油酸为主要的不饱和脂肪酸,二者总和约占脂肪酸总量的80%。其中,油酸不但有助于降低低密度脂蛋白、维持高密度脂蛋白水平,而且能够保护心脑血管健康[3]。因此,培育高油酸花生品种对于推动花生产业发展至关重要。此外,花生籽仁中富含优质蛋白,含有人体必需的8种氨基酸,消化系数高达90%以上[4];因此,提高花生蛋白质含量对于花生品质改良具有深远意义。近年来,花生消费呈现多元化趋势,花生食品加工产品的需求量不断增加[5],国内外对花生的食用需求亦有所不同。我国鲜食和烘烤花生的消费比例由30%左右逐渐提升至40%[6],而欧美发达国家鲜食和用作食品加工原料的花生比例高达70%以上,仅有13%用于榨油[7]。花生籽仁的甜度与食味品质密切相关,其中蔗糖是主要的甜味成分[8]。当蔗糖含量超过5%时,烘烤花生的口感显著改善;而当蔗糖含量超过6%时,水煮鲜食花生更受欢迎[9-10]。提升蔗糖含量和选育高糖花生品种已成为食用花生品质改良的新方向,以适应多样化的加工需求。
在花生品质性状检测中,传统化学分析方法存在过程繁琐、耗时耗力,且成本较高等不足。这些方法需要破坏性地处理样本,如磨碎种子。在育种早期,材料有限,这种方法既不经济也不实用,检测效率低,而且会延迟育种工作,不利于快速、高效且无损的品质性状初步评估和筛选。因此,实现对育种材料品质性状高通量、规模化的检测是选育优质花生品种的关键[7]。目前,检测花生脂肪、蛋白质、蔗糖、脂肪酸含量的方法分别为索氏抽提法、凯氏定氮法、比色法和气相色谱法,均是传统化学分析方法,均存在上述缺点。而近红外分析技术具有无损检测、结果准确、分析速度快、高通量检测、样品不需预处理等优点。在近红外光波长范围内,样品间分子高能振动,吸收光谱产生光谱信息,主要为含氢基团,这些优势基团能量跃迁产生倍频、组合频和共振,据此获取样品的化学信息。
目前近红外分析技术已在不同作物和行业中广泛应用[7, 11-19]。花生蔗糖、蛋白质、油酸和亚油酸等品质性状的近红外光谱分析模型已经建立;然而,大多数模型仅针对单一性状[20-24]。如果能构建一个集合多种重要品质性状的近红外光谱分析模型,将能满足早期育种材料的高效筛选需求。
结合广东花生产业的需求,高品质花生品种选育尤为重要,亟需构建一种高效的花生营养品质检测方法,切实地缩短育种周期、推动育种进程。本研究旨在构建一个涵盖花生主要品质性状的近红外光谱分析模型,为花生品质性状突变体的筛选提供一种便捷且高效的鉴定手段,并为花生育种及品质研究工作提供技术支撑与保障。
1. 材料与方法
1.1 试验材料
本研究的花生材料由2部分构成。第1部分为近红外光谱模型建模材料,为来自全国各地的115份育成品种,涵盖不同粒型、种皮颜色(图1)和丰富的品质性状变异。从中随机挑选100份作为定标集样本,剩余的15份作为验证集样本。第2部分为“神舟十三号”航天诱变材料,野生型为广东省河源市的地方品种‘火豆’。
1.2 花生光谱采集
采用瑞典波通公司生产的近红外光谱品质分析仪(DA7200)采集定标集样品的光谱数据,扫描波长范围为950~1 650 nm。由于温度对光谱采集有明显影响,为保障光谱准确性,确保样品温度恒定在25 ℃。采集前先经40 ℃烘干样品(100 g),然后置于25 ℃环境下静置48 h后上机,以稳定样品状态,减少温度因素干扰[25]。
上机检测时样品盘需尽可能装满,由于定标集花生籽仁大小来源丰富,因此每份材料上机的籽仁数量会有所不同,约15~28粒。
1.3 花生品质性状的传统化学分析方法
将采集好光谱信息的花生籽仁,取约50 g研磨成粉末状,用于后续不同品质指标检测。
1.3.1 药品和试剂
石油醚、硫酸、过氧化氢、氢氧化钠、乙酸锌、亚铁氰化钾、盐酸、硼酸、乙酸锌、亚铁氰化钾、硫酸铜、酒石酸钾钠、脂肪酸标品(Sigma-Aldrich)、甲醇、正己烷、氢氧化钾、乙醚石油醚混合液(体积比1∶1)。
1.3.2 试验仪器
索氏抽提器、鼓风干燥箱、石墨消解仪、全自动凯氏定氮仪、恒温水浴锅、可调温电炉、气质联用仪。
1.3.3 脂肪含量测定
参考《食品安全国家标准 食品中脂肪的测定》(GB 5009.6—2016)[26]第一法索氏抽提法进行脂肪含量测定,即用低沸点有机溶剂石油醚回流抽提,除去样品中的粗脂肪,以样品与残渣质量之差,计算脂肪含量。计算公式如下:
$$ \text{脂肪含量}=\dfrac{({m_2}-{m_0})}{m_1} \times 100{\text{%}}{{\text{,}}} $$ (1) 式中:m0为抽提前抽提瓶和滤纸套干燥后的质量;m1为每次称取样品的质量,8.000 g,记录好每份样品称取的质量(精确至0.001 g) ,分多次称取;m2为抽提后,含有石油醚的抽提瓶干燥后的质量。
1.3.4 蛋白质含量测定
参考《食品安全国家标准 食品中蛋白质的测定》(GB 5009.5—2016)[27]第一法凯氏定氮法进行蛋白质含量测定。称取
0.200 g(精确至0.001 g)花生样品,加入浓硫酸消煮得到样品消解液,将消解液加入全自动凯氏定氮仪测定。仪器在使用前加入氢氧化钠溶液、盐酸标准溶液以及含有混合指示剂的硼酸溶液,在全自动仪器上实现蒸馏、滴定和记录滴定数据。计算公式如下:$$ {\text{蛋白质含量}} = \dfrac{c \times (V - V_0) \times 14 \times D}{m_3} \times 6.25 \times 100 {\text{%}}\mathrm{\text{,}} $$ (2) 式中:c为盐酸标准溶液的浓度,mol/L;V为滴定试样所用盐酸标准溶液的体积,mL;V0为滴定空白处理所用盐酸标准溶液的体积,mL;14为氮元素的摩尔质量,g/mol;m3为样品质量,g;D为分取倍数;6.25为氮含量换算为蛋白质含量的换算系数。
1.3.5 总糖和蔗糖含量测定
参考《食品安全国家标准 食品中果糖、葡萄糖、蔗糖、麦芽糖、乳糖的测定》(GB 5009.8—2016)[28]第二法酸水解−莱因−埃农氏法进行总糖与蔗糖含量的测定。称取样品
3.000 g(精确到0.001 g),加入乙酸锌和亚铁氰化钾溶液去除蛋白质,过滤后进行酸水解将蔗糖转化为具有还原性的单糖。分别测定总糖与蔗糖含量,其中蔗糖经盐酸水解转化为还原糖,以水解转化前后的差值乘以相应的系数0.95即为蔗糖含量。计算公式如下:$$ R = \dfrac{A}{m_4 \times \dfrac{50}{250} \times \dfrac{V_1}{100} \times 1\;000} \times 100{\text{%}}\mathrm{\text{,}} $$ (3) $$ X=\left(R_{2}-R_{1}\right) \times 0.95 \text{,} $$ (4) 式中:R1为样品转化前转化糖的质量分数,%;R2为样品转化后转化糖的质量分数,%;A为碱性酒石酸铜溶液相当于葡萄糖的质量,mg;m4为样品质量,g;50为酸水解时吸取样品溶液的体积,mL;250为样品去除蛋白质时定容体积,mL;V1为滴定时消耗试样溶液体积,mL;100为酸水解时定容体积,mL;1 000为换算系数;X为试样中蔗糖质量分数;0.95为转化糖(以葡萄糖计)换算为蔗糖的系数。由此先求出转化后转化糖的质量分数即为总糖的质量分数,再根据公式求出蔗糖的质量分数X。
1.3.6 脂肪酸含量测定
参考《食品安全国家标准 食品中脂肪酸的测定》(GB 5009.168—2016)[29]第三法归一化法进行脂肪酸含量的测定,样品经水解、乙醚溶液提取其中的脂肪后,在碱性条件下皂化和甲酯化,生成脂肪酸甲酯,经毛细管柱气相色谱分析,采用面积归一化法定量测定脂肪酸百分含量。第一步为样品水解及提取。称取样品
0.2000 g(精确至0.000 1 g)至烧瓶中,加入盐酸进行酸水解提取,水解后加入10 mL的95%(φ)乙醇溶液混匀,将烧瓶中的水解液转移到分液漏斗中,用50 mL乙醚石油醚混合液冲洗烧瓶和塞子,冲洗液并入分液漏斗中,加盖;振动摇匀5 min,静置10 min;将醚层提取液收集到250 mL烧瓶中;按照以上步骤重复提取水解液3次,最后用乙醚石油醚混合液冲洗分液漏斗,并将清洗液收集到250 mL烧瓶中。旋转蒸发仪浓缩至干,残留物为脂肪提取物。第二步进行甲酯化。加入1 mL正己烷复溶,加入1 mL 20 g/L氢氧化钾甲醇溶液为甲酯化试剂;涡旋振荡,静止反应1 h;再次涡旋振荡,加入2 mL去离子水,静置30 min分层,以4 500 r/min离心2 min,取上清液稀释20倍后,用气相色谱−质谱联用仪测定。各脂肪酸含量计算公式如下:$$ Y_i = \dfrac{A_{i} \times F_{{{\mathrm{FAME}}_{i}}-{{\mathrm{FA}}_{i}}}} {\displaystyle\sum( A_{i}\times F_{{{\mathrm{FAME}}_{i}} - {{\mathrm{FA}}_{i}}})} \times 100{\text{%}}{\text{,}} $$ (5) 式中:Yi为样品中某个脂肪酸含量占总脂肪酸含量的比例,%;Ai为样品测定溶液中各脂肪酸甲酯的峰面积;FFAMEi-FAi为脂肪酸甲酯i转化成脂肪酸的系数。
1.4 花生品质性状近红外光谱分析模型的构建
利用近红外光谱分析仪自带的建模软件The Unscrambler X 10.4构建模型,将各个建模指标的光谱数据与化学测定结果输入分析软件中进行拟合。在此过程中,选择用于模型构建的光谱波段,排除异常波段。此外,对模型进行精细化调整,以减少噪声干扰,并剔除无显著吸收特征或吸收饱和的波段。为最大程度从光谱中获取与化学成分有关的信息,采用标准正态变量(Standard normal variate,SNV)、Savitzky-Golay滤波拟合法(Savitzky-Golay derivative)、基准化(Baseline)和去趋势(De-trending)的预处理方法,分别对光谱进行单一和组合预处理,利用偏最小二乘回归法进行模型构建。通过剔除异常值后反复计算,对比模型的决定系数(R2)和校准均方根误差(Root mean square error of calibration,RMSEC)筛选最优模型[30]。
1.5 近红外光谱模型的外部验证
本研究选取了15个未参与模型构建的花生样本作为验证集,利用已建立的模型,对15个验证样本的品质性状进行预测。同时,利用传统化学分析方法测定验证集样本的品质指标,通过比较模型预测值和化学测定值,评估模型的准确性。
1.6 近红外光谱分析模型的应用
为了改善现有花生品种的品质,2021年搭载“神舟十三号”对花生种子进行空间诱变处理,诱变后的种子为航天诱变一代(SP1)。将SP1发育良好的种子单粒播种、单株收获得到SP2种子,对SP2单粒播种、单株收获得到805份SP3单株材料,采用构建的近红外光谱分析模型对其品质性状指标进行检测,参照《高油酸花生》(NY/T 3250—2018)[31],以籽粒油酸含量>60%为初步筛选标准得到SP3种植材料,收获后再次通过模型检测进行筛选。
2. 结果与分析
2.1 花生定标样品光谱特征
如图2所示,定标样品的光谱在950~1 640 nm整体一致,且样品在多个波段表现出不同的吸收峰;在1 160~1 230 nm存在1处明显的吸收峰,吸光度为0.17~0.27,说明不同样品的成分含量存在差异,适于近红外光谱分析模型的构建。
2.2 花生定标样品品质性状化学测定值
定标集花生样品各品质性状指标测定结果如表1所示。其中,变异系数排名前5的指标分别为亚油酸、花生一烯酸、蔗糖、总糖、油酸含量。亚油酸含量的分布范围为2.43%~42.29%,平均23.29%;花生一烯酸含量分布范围为0.49%~1.75%,平均0.96%;蔗糖含量分布范围为2.50%~10.00%,平均4.07%;总糖含量分布范围为3.00%~11.00%,平均4.48%:油酸含量分布范围为34.73%~80.62%,平均55.24%。以上结果表明,本研究定标集花生样品不同营养组分含量存在广泛的分布和明显差异,满足近红外光谱分析模型的构建要求。
表 1 定标集花生籽仁营养组分含量化学测定值Table 1. Chemical determination values of nutrient component contents for peanut seed kernels in calibration set$\omega $ /%特征
Characteristic脂肪
Fat蛋白质
Protein蔗糖
Sucrose总糖
Total sugar油酸
Oleic acid亚油酸 Linoleic acid 棕榈酸Palmitic acid 硬脂酸 Stearic acid 山嵛酸
Behenic acid花生酸
Arachidic acid花生一烯酸Eicosenoic acid 二十四烷酸 Tetracosanoic acid 最大值
Maximum value52.70 27.70 10.00 11.00 80.62 42.29 17.31 4.58 10.60 3.48 1.75 2.20 最小值
Minimum value40.50 18.10 2.50 3.00 34.73 2.43 6.08 1.81 1.95 1.07 0.49 0.82 平均值
Average value47.15 22.98 4.07 4.48 55.24 23.29 10.19 2.60 4.19 1.69 0.96 1.37 标准差
Standard deviation2.74 1.93 1.40 1.51 0.17 0.15 0.03 0.01 0.01 0.00 0.00 0.00 变异系数/%
Coefficient of variation5.80 8.39 34.36 33.74 30.61 62.15 27.42 18.07 26.85 17.43 34.38 19.98 2.3 花生品质性状近红外光谱分析模型构建
2.3.1 光谱预处理方法的选择
由于近红外光谱分析仪在工作过程中对环境等因素敏感,需对采集的原始光谱信息进行预处理,以减少环境干扰。最佳预处理方法下各指标模型的RMSEC和R2如表2所示。
表 2 定标集花生籽仁各品质性状最佳光谱预处理方法Table 2. The optimal spectral pretreatment method for each quality trait of peanut seed kernels in calibration set品质性状
Quality trait预处理方法
Preprocessing method校准均方根误差
RMSEC决定系数
R2脂肪含量 Fat content 去趋势+基准化 1.512 0.609 蛋白质含量 Protein content 去趋势+基准化 0.340 0.968 蔗糖含量 Sucrose content 基准化 0.307 0.952 总糖含量 Total sugar content 去趋势 0.321 0.955 油酸含量 Oleic acid content 原始光谱 0.026 0.977 硬脂酸含量 Stearic acid content 标准正态变量(SNV) 0.001 0.895 亚油酸含量 Linoleic acid content Savitzky-Golay 滤波拟合法+SNV+去趋势 0.033 0.950 棕榈酸含量 Palmitic acid content SNV+去趋势+基准化 0.008 0.906 山嵛酸含量 Behenic acid content SNV+去趋势 0.003 0.859 花生酸含量 Arachidic acid content SNV+去趋势 0.001 0.803 花生一烯酸含量 Eicosenoic acid content SNV+去趋势+基准化 0.001 0.923 二十四烷酸含量 Tetracosanoic acid content SNV+去趋势 0.001 0.881 2.3.2 花生品质性状指标模型预测值验证
将15份验证集样品的近红外光谱分析模型预测值与化学测定值进行拟合并计算两者的R2,以验证所构建近红外光谱分析模型的置信水平,结果如图3所示。除脂肪与花生酸含量外,其余性状的R2均大于0.85,表明构建的模型可用于预测花生材料各营养品质性状含量,且准确度较高。
2.3.3 近红外光谱预测模型在花生品质性状突变体筛选中的应用
以“神舟十三号”搭载花生种子进行诱变处理,共获得805份SP3单株材料,采用近红外光谱模型预测其品质性状指标,结果如图4所示。野生型对照组的油酸含量为43.40%。805份SP3单株材料的油酸含量呈正态分布,分布范围为27.20%~71.40%,平均44.37%,略高于对照组。其中,油酸含量大于43.40%的SP3材料有350份,油酸含量大于60%的有16份。本研究选取油酸含量大于60%的16份花生材料为突变体,作为SP3种植材料进行单株播种、单株收获,利用近红外光谱模型对SP3收获的花生材料再次进行模型预测筛选,结果如图5所示。16份材料的油酸含量与对照组存在极显著差异(P<0.001),其中4份材料油酸含量极显著降低,可能由环境因素导致。上述结果表明,在育种实践中,本研究构建的模型适用于花生突变体、种质资源以及杂交后代等材料籽仁品质性状检测筛选工作,可以提高优质花生品种的育种效率。
3. 讨论与结论
花生作为重要的经济作物,品质直接影响市场价值。目前花生品质育种的主要方向集中在高含油量、高蛋白质含量、优质脂肪酸组成、良好风味和低黄曲霉毒素含量等方面。传统花生品质检测基于化学分析法,为了克服化学分析法的缺点,针对花生早期育种材料样品数量多、单个样品样本量少的特点,建立一种无损、高效且高通量的花生品质性状分析方法具有重要的研究和应用价值。近年来,花生品质性状检测的研究逐渐集中于近红外光谱技术领域,许多研究已经建立了单一品质性状的分析模型。例如,韩宏伟等[23]利用80份单粒花生材料构建了9种脂肪酸含量分析模型;李振等[32]利用290份花生材料构建了黄酮近红外光谱分析模型,为μg/g级物质含量近红外光谱模型的构建提供了参考;赵星等[20]利用325份花生材料建立了蔗糖含量近红外光谱分析模型;王志伟等[33]用31份花生材料建立了食用感官品质近红外光谱分析模型;吕建伟等[22]用50份花生材料构建了花生油酸和亚油酸含量近红外光谱分析模型,且利用该模型成功选育了高油酸含量品系。但目前所构建的近红外模型大多针对单一性状,本研究利用同一定标集材料同时检测花生12种不同品质性状指标并构建相应的近红外光谱分析模型。其中,脂肪和花生酸含量模型的R2未能达到预期,无法满足检测需求,需要进一步完善。造成该结果的原因可能是定标集脂肪含量变异系数(5.80%)过低导致其所涵盖的范围过于狭小;但可通过增加定标集样品数量或通过二进制蜻蜓算法(Binary dragonfly algorithm,BDA)[34]挑选代表性样品来提高模型的准确度。除了变异系数过低会对模型结果造成影响之外,还会有其他影响因素,如尽管花生酸变异系数已经达到17.43%,但花生酸含量较低,最小值只有1.07%,对于含量过低的物质,近红外光谱技术受信号自身灵敏度较低这一固有特性影响,检测时会存在一定的局限性[35]。有研究将预浓缩技术与近红外光谱技术结合,能够检测到含量低至10−6甚至接近10−9级别的物质[36]。这表明通过适当的样品预处理和分析方法,近红外光谱技术可以检测低含量的化学物质,进一步提高近红外光谱分析模型的工作效率。为了校正颜色对模型的影响,提高近红外分析模型的稳定性,在模型定标集中引入了多种颜色的花生样本。
花生作为一种重要油料作物,其脂肪酸组成是影响花生油品质的重要因素,增加油酸含量、降低亚油酸含量不仅可以维护人体健康,而且可以延长花生制品货架期[37]。本研究针对育种需求所建立的近红外光谱分析模型的分析指标包含脂肪、蛋白质、蔗糖、总糖与8种常见脂肪酸含量,以满足花生不同品质性状检测需求以及花生突变体的快速筛选。另外,花生还包含其他29种含量较低的脂肪酸,由于这些脂肪酸在花生籽仁中含量较低,对建模定标样品的要求较高,需选择该脂肪酸含量变异丰富的材料或对样品进行预处理(物质富集技术、粉碎和混合)[38],以满足该类型脂肪酸近红外光谱模型的构建需求,其他低含量的性状亦是如此。花生还有许多有价值的品质性状,如花青素、白藜芦醇、氨基酸、维生素含量等[39],后续可以针对这些品质性状开发对应的近红外光谱分析模型,更加全面地满足花生品质性状的检测需求。随着时间的推移和条件的变化,模型还需要更新和验证,未来研究中可以通过增加样本数量,使模型充分学习不同样品的特征信息,从而提高模型准确性和可靠性[40]。
本研究利用所构建模型对搭载“神舟十三号”进行诱变处理的花生材料进行品质性状预测,在SP3代快速筛选出12份油酸含量极显著高于野生型的突变体,已知花生高油酸性状由位于A09染色体的ah FAD2A和B09染色体的ah FAD2B控制[41-42];常规杂交育种中高油酸性状(aabb)与普通油酸性状(AABB)杂交后代(AaBb)的分离后代在理论上会产生9种基因型[43],这9种基因型隐性基因位点的个数分别为0~4个。当隐性基因位点数量逐步增加时,与之相对应基因型个体的油酸含量呈上升趋势。这种现象表明,隐性基因位点数量在油酸含量的调控方面具有基因加性效应[44-45],由此推断出含ah FAD2A和ah FAD2B这2对基因的隐性位点越多,个体油酸含量就越高,其中基因型为aabb个体的油酸含量最高。当检测到油酸含量为60%~75%时,推测其油酸性状基因型应为杂合型(AaBb、Aabb、aaBb),将这些基因型个体自交,后续通过花生单粒检测还有机会筛选出高油酸含量后代(aabb)[46]。因此在育种过程中,对于F4以下低世代,应予以保留,避免淘汰综合性状好的个体,以推进后续育种进程。
本研究构建的花生近红外光谱分析模型在对12个花生品质性状的检测中,有10个性状的定标集R2大于0.85,预测效果较好,在花生突变体、种质资源及杂交后代筛选中具备应用潜力。利用该模型从SP3诱变后代中筛选12个油酸含量>60%、极显著高于野生型的突变体材料,有望为高油酸含量品种花生选育工作提供候选材料,提高高品质花生的育种效率,并为未来花生品质育种工作提供有效的技术手段。
-
图 3 不同根构型大豆与甜玉米间作对作物产量、生物量及磷吸收量的影响
+P:施磷处理,−P:不施磷处理;BD:‘本地2号’,YC:‘粤春03-3’;箱体上不同大写和小写字母分别表示施磷和不施磷条件下不同种植模式之间差异显著(P<0.05,Duncan’s法)
Figure 3. Effects of intercropping of soybean with different root architecture and sweet maize on crop yield, biomass and phosphorus uptake
+P: Treatment with phosphate fertilizer, −P: Treatment without phosphate fertilizer; BD: ‘Bendi 2’, YC: ‘Yuechun 03-3’; Different capital and lowercase letters on the boxes indicate significant differences among different planting modes under +P and −P conditions respectively (P<0.05, Duncan’s method)
图 4 不同根构型大豆与甜玉米间作的间作优势(A)和种间竞争力(B)
+P:施磷处理,−P:不施磷处理;BD:‘本地2号’,YC:‘粤春03-3’
Figure 4. Intercropping advantages (A) and interspecific competitiveness (B) of soybean with different root architecture intercropping with sweet maize
+P: Treatment with phosphate fertilizer, −P: Treatment without phosphate fertilizer; BD: ‘Bendi 2’, YC: ‘Yuechun 03-3 ’
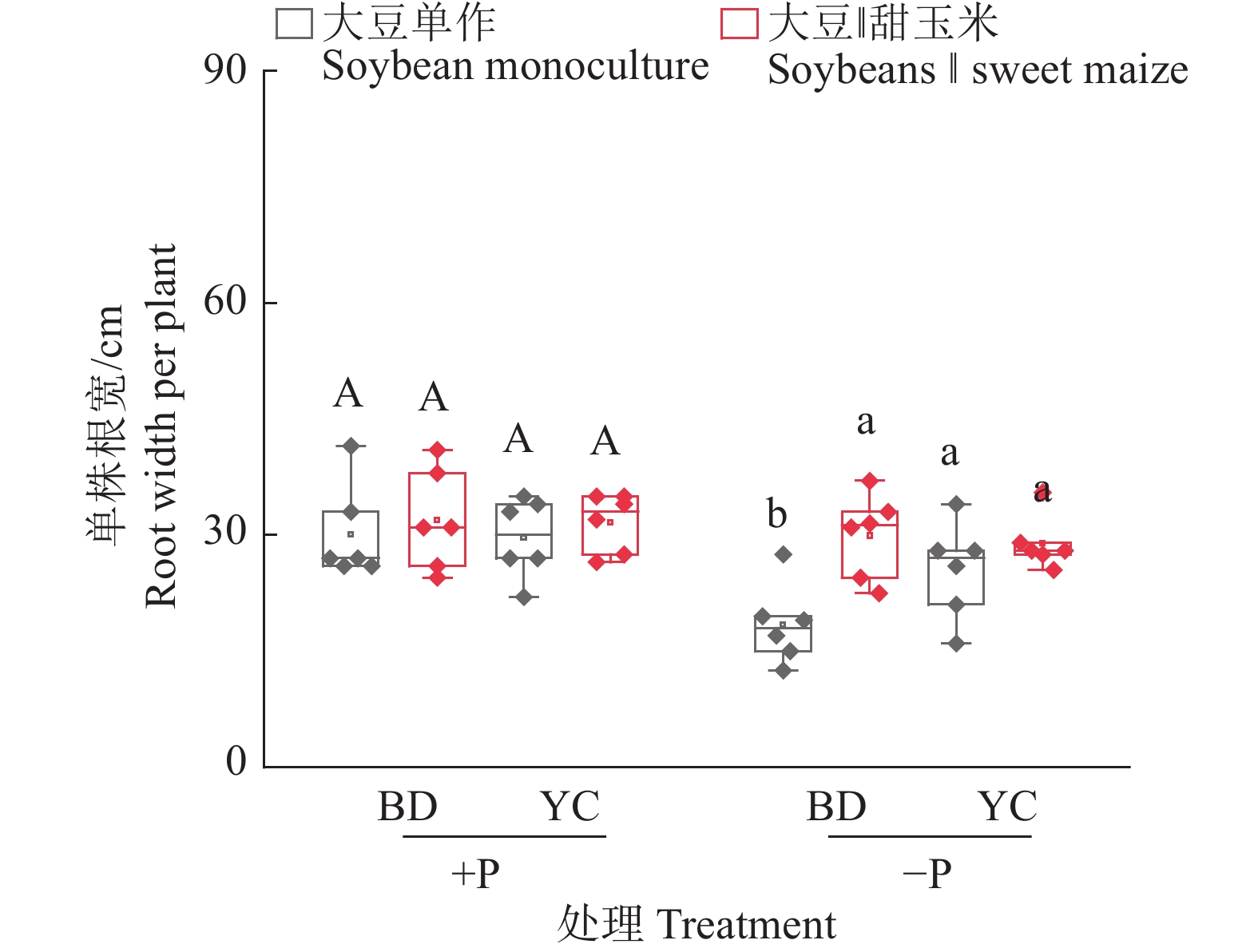
图 5 不同根构型大豆与甜玉米间作对大豆根宽的影响
+P:施磷处理,−P:不施磷处理;BD:‘本地2号’,YC:‘粤春03-3’;箱体上不同大写和小写字母分别表示施磷和不施磷条件下不同种植模式之间差异显著(P<0.05,Duncan’s法)
Figure 5. Effects of intercropping soybean with different root architecture and sweet maize on root width of soybeans
+P: Treatment with phosphate fertilizer, −P: Treatment without phosphate fertilizer; BD: ‘Bendi 2’, YC: ‘Yuechun 03-3’; Different capital and lowercase letters on the boxes indicate significant differences among different planting modes under +P and −P conditions respectively (P<0.05, Duncan’s method)
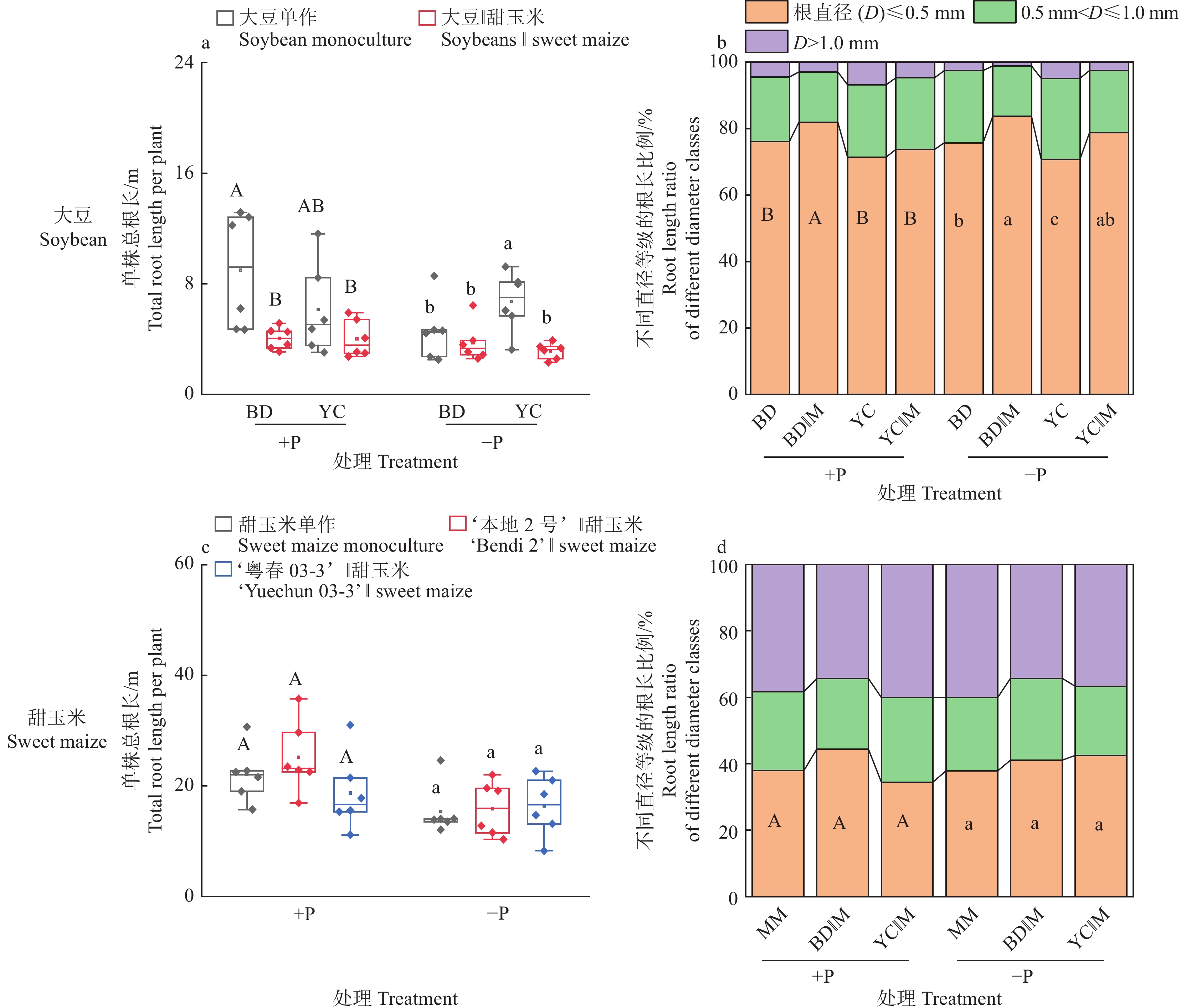
图 6 不同根构型大豆与甜玉米间作对植株根系形态的影响
+P:施磷处理,−P:不施磷处理;BD:‘本地2号’,YC:‘粤春03-3’;箱体上不同大写和小写字母分别表示施磷和不施磷条件下不同种植模式之间差异显著(P<0.05,Duncan’s法)
Figure 6. Effects of intercropping soybean with different root architecture and sweet maize on root morphology of plants
+P: Treatment with phosphate fertilizer, −P: Treatment without phosphate fertilizer; BD: ‘Bendi 2’, YC: ‘Yuechun 03-3’; Different capital and lowercase letters on the boxes indicate significant differences among different planting modes under +P and −P conditions respectively (P<0.05, Duncan’s method)
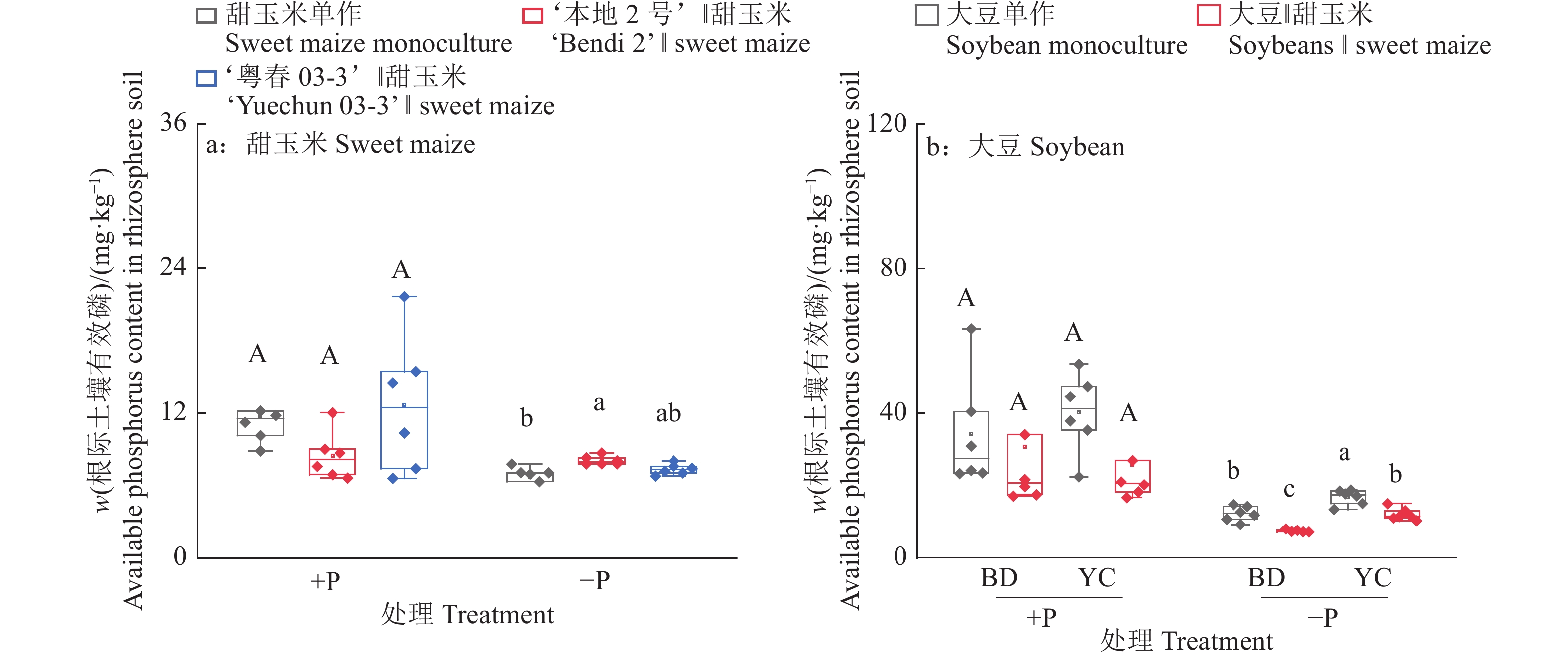
图 7 不同根构型大豆与甜玉米间作对植株根际土壤有效磷含量的影响
+P:施磷处理,−P:不施磷处理;BD:‘本地2号’,YC:‘粤春03-3’;箱体上不同大写和小写字母分别表示施磷和不施磷条件下不同种植模式之间差异显著(P<0.05,Duncan’s法)
Figure 7. Effects of intercropping soybean with different root architecture and sweet maize on available phosphorus content in rhizospheric soil of plants
+P: Treatment with phosphate fertilizer, −P: Treatment without phosphate fertilizer; BD: ‘Bendi 2’, YC: ‘Yuechun 03-3’; Different capital and lowercase letters on the boxes indicate significant differences among different planting modes under +P and −P conditions respectively (P<0.05, Duncan’s method)
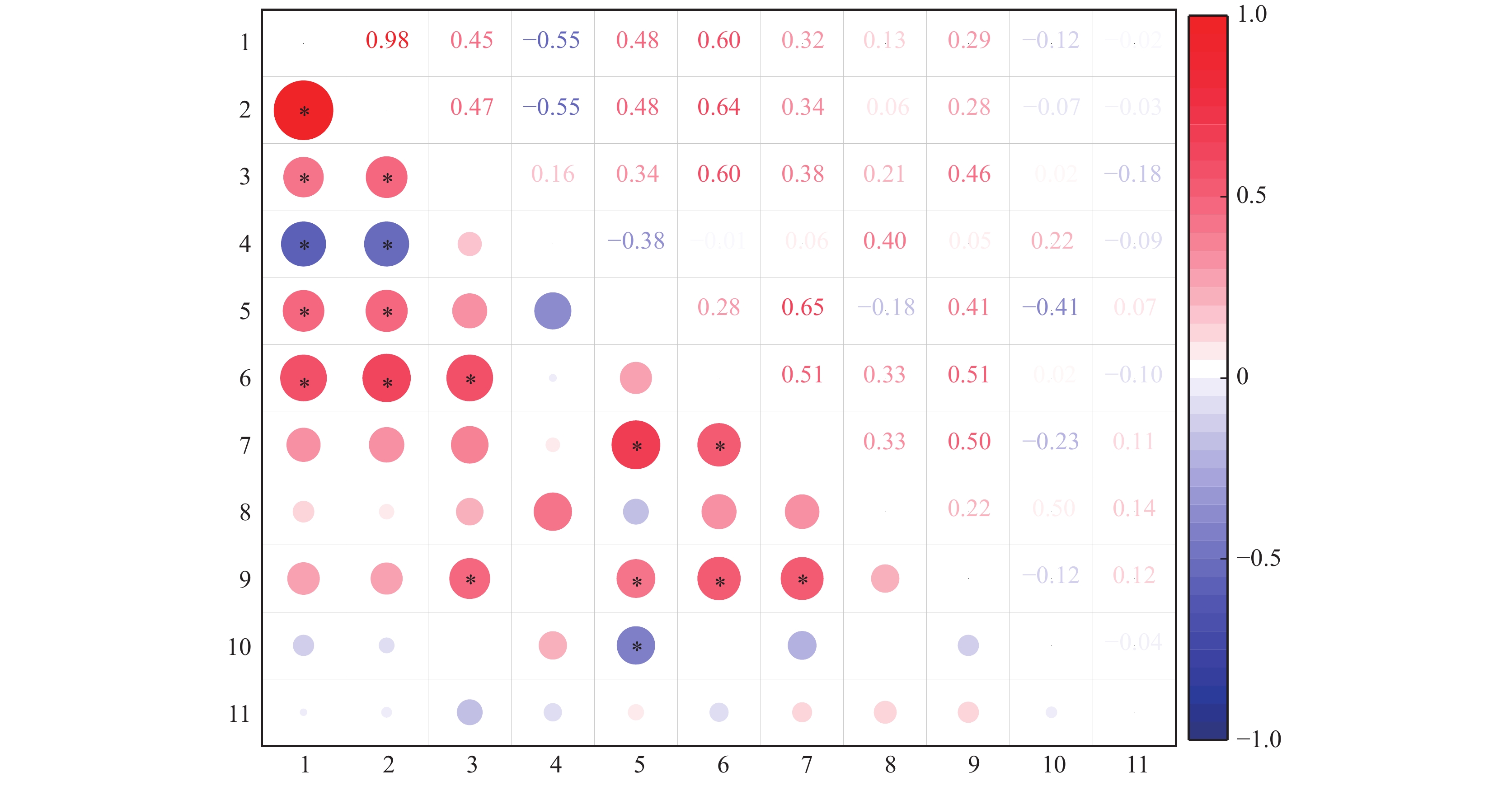
图 8 间作大豆和甜玉米表型参数间的相关性分析
1:大豆总生物量,2:大豆总磷吸收量,3:大豆总根长,4:大豆直径≤0.5 mm细根占比,5:大豆根际土壤有效磷含量,6:大豆根宽,7:甜玉米总生物量,8:甜玉米总磷吸收量,9:甜玉米总根长,10:甜玉米直径≤0.5 mm细根占比,11:甜玉米根际土壤有效磷含量;相关系数(R)在图中以不同颜色展示,右侧图例是不同R值的颜色区间,红色表示正相关,蓝色表示负相关;“*”表示在P<0.05水平显著相关(Spearman法)
Figure 8. Correlation analysis of phenotypic parameters in intercropped soybean and sweet maize
1: Total biomass of soybean, 2: Total phosphorus uptake of soybean, 3: Total root length of soybean, 4: Proportion of diameter ≤0.05 mm fine roots to total roots in soybean, 5: Available phosphorus content in soybean rhizospheric soil, 6: Root width of soybean, 7: Total biomass of sweet maize, 8: Total phosphorus uptake of sweet maize, 9: Total root length of sweet maize, 10: Proportion of diameter ≤0.05 mm fine roots to total roots in sweet maize, 11: Available phosphorus content in sweet maize rhizospheric soil; Colors in the heatmap indicate different correlation coefficients (R) and the color interval is shown in the right legend, red indicates positive correlation, blue indicates negative correlation; “*” indicates significant correlation at P<0.05 level (Spearman method)
-
[1] SHEN J, YUAN L, ZHANG J, et al. Phosphorus dynamics: From soil to plant[J]. Plant Physiology, 2011, 156(3): 997-1005. doi: 10.1104/pp.111.175232
[2] 刘瑾, 杨建军. 近三十年农田土壤磷分子形态的研究进展[J]. 土壤学报, 2021, 58(3): 558-567. [3] 赵学强, 潘贤章, 马海艺, 等. 中国酸性土壤利用的科学问题与策略[J]. 土壤学报, 2023, 60(5): 1248-1263. [4] REID J B, TAN Y, GRIFFIN W B, et al. Root system plasticity as a factor in crop breeding for improved nutrient uptake[C]//Agronomy New Zealand. 40th Agronomy Society Conference. Lincoln, 2010, 40: 51-64.
[5] KARLOVA R, BOER D, HAYES S, et al. Root plasticity under abiotic stress[J]. Plant Physiology, 2021, 187(3): 1057-1070. doi: 10.1093/plphys/kiab392
[6] HALING R E, BROWN L K, BENGOUGH A G, et al. Root hairs improve root penetration, root-soil contact, and phosphorus acquisition in soils of different strength[J]. Journal of Experimental Botany, 2013, 64(12): 3711-3721. doi: 10.1093/jxb/ert200
[7] SOUMYA P R, SHARMA S, MEENA M K, et al. Response of diverse bread wheat genotypes in terms of root architectural traits at seedling stage in response to low phosphorus stress[J]. Plant Physiology Reports, 2021, 26(1): 152-161. doi: 10.1007/s40502-020-00540-6
[8] HALING R E, YANG Z, SHADWELL N, et al. Root morphological traits that determine phosphorus-acquisition efficiency and critical external phosphorus requirement in pasture species[J]. Functional Plant Biology, 2016, 43(9): 815-826. doi: 10.1071/FP16037
[9] 刘鹏, 区伟贞, 王金祥, 等. 磷有效性与植物侧根的发生发育[J]. 植物生理学通讯, 2006(3): 395-400. [10] MIGUEL M A, POSTMA J A, LYNCH J P. Phene synergism between root hair length and basal root growth angle for phosphorus acquisition[J]. Plant Physiology, 2015, 167(4): 1430-1439. doi: 10.1104/pp.15.00145
[11] YI K, LI X, CHEN D, et al. Shallower root spatial distribution induced by phosphorus deficiency contributes to topsoil foraging and low phosphorus adaption in sugarcane (Saccharum officinarum L. )[J]. Frontiers in Plant Science, 2022, 12: 797635. doi: 10.3389/fpls.2021.797635
[12] XIA H, ZHAO J, SUN J, et al. Dynamics of root length and distribution and shoot biomass of maize as affected by intercropping with different companion crops and phosphorus application rates[J]. Field Crops Research, 2013, 150: 52-62. doi: 10.1016/j.fcr.2013.05.027
[13] LI L, LIU Y X, LI X F. Intercropping to maximize root-root interactions in agricultural plants: Agronomic aspects[M]//The root systems in sustainable agricultural intensification. 2021: 309-328. doi: 10.1002/9781119525417.ch12.
[14] 覃潇敏, 潘浩男, 肖靖秀, 等. 不同磷水平下玉米−大豆间作系统根系形态变化[J]. 应用生态学报, 2021, 32(9): 3223-3230. [15] AN R, YU R, XING Y, et al. Enhanced phosphorus-fertilizer-use efficiency and sustainable phosphorus management with intercropping[J]. Agronomy for Sustainable Development, 2023, 43(5): 57. doi: 10.1007/s13593-023-00916-6
[16] 雍太文, 刘小明, 宋春, 等. 种植方式对玉米−大豆套作体系中作物产量、养分吸收和种间竞争的影响[J]. 中国生态农业学报, 2015, 23(6): 659-667. [17] 唐劲驰, ISMAEL A M, 佘丽娜, 等. 大豆根构型在玉米/大豆间作系统中的营养作用[J]. 中国农业科学, 2005(6): 1196-1203. [18] 赵静, 付家兵, 廖红, 等. 大豆磷效率应用核心种质的根构型性状评价[J]. 科学通报, 2004, 49(13): 1249-1257. [19] 朱同林, 方素琴, 李志垣, 等. 基于图像重建的根系三维构型定量分析及其在大豆磷吸收研究中的应用[J]. 科学通报, 2006, 51(16): 1885-1893. [20] 郑林生, 刘志强, 陈康, 等. 基因型影响磷镁互作下大豆生长及根瘤和菌根性状[J]. 植物营养与肥料学报, 2022, 28(9): 1685-1698. [21] BURRIDGE J, JOCHUA C N, BUCKSCH A, et al. Legume shovelomics: High-throughput phenotyping of common bean (Phaseolus vulgaris L.) and cowpea (Vigna unguiculata subsp, unguiculata) root architecture in the field[J]. Field Crops Research, 2016, 192: 21-32.
[22] WALK T C, JARAMILLO R, LYNCH J P. Architectural tradeoffs between adventitious and basal roots for phosphorus acquisition[J]. Plant and Soil, 2006, 279(1/2): 347-366.
[23] AO J, FU J, TIAN J, et al. Genetic variability for root morph-architecture traits and root growth dynamics as related to phosphorus efficiency in soybean[J]. Functional Plant Biology, 2010, 37(4): 304-312. doi: 10.1071/FP09215
[24] 阮文亮, 彭松, 祝晓慧, 等. 减量施氮与间作大豆对甜玉米土壤团聚体及有机碳含量的影响[J]. 四川农业大学学报, 2023, 41(5): 811-819. [25] 白伟, 孙占祥, 郑家明, 等. 东北风沙半干旱区仁用杏作物间作对作物产量和土地生产力的影响[J]. 生态学杂志, 2017, 36(9): 2521-2528. [26] 董宛麟, 张立祯, 于洋, 等. 向日葵和马铃薯间作模式的生产力及水分利用[J]. 农业工程学报, 2012, 28(18): 127-133. [27] YANG W, LI Z, WANG J, et al. Crop yield, nitrogen acquisition and sugarcane quality as affected by interspecific competition and nitrogen application[J]. Field Crops Research, 2013, 146: 44-50. doi: 10.1016/j.fcr.2013.03.008
[28] BARRY K E, MOMMER L, VAN RUIJVEN J, et al. The future of complementarity: Disentangling causes from consequences[J]. Trends in Ecology & Evolution, 2019, 34(2): 167-180.
[29] LI C, HOFFLAND E, KUYPER T W, et al. Syndromes of production in intercropping impact yield gains[J]. Nature Plants, 2020, 6(6): 653-660 doi: 10.1038/s41477-020-0680-9
[30] YU X, XIAO S, YAN T, et al. Interspecific competition as affected by nitrogen application in sweet corn-soybean intercropping system[J]. Agronomy, 2023, 13(9): 2268. doi: 10.3390/agronomy13092268
[31] 刘天学, 张绍芬, 赵霞, 等. 我国玉米主要间作技术研究进展[J]. 河南农业科学, 2008(5): 14-17. [32] BETENCOURT E, DUPUTEL M, COLOMB B, et al. Intercropping promotes the ability of durum wheat and chickpea to increase rhizosphere phosphorus availability in a low P soil[J]. Soil Biology and Biochemistry, 2012, 46: 181-190. doi: 10.1016/j.soilbio.2011.11.015
[33] TANG X, PLACELLA S A, DAYDÉ F, et al. Phosphorus availability and microbial community in the rhizosphere of intercropped cereal and legume along a P-fertilizer gradient[J]. Plant and Soil, 2016, 407(1/2): 119-134.
[34] BEDOUSSAC L, JUSTES E. The efficiency of a durum wheat-winter pea intercrop to improve yield and wheat grain protein concentration depends on N availability during early growth[J]. Plant and Soil, 2010, 330(1/2): 19-35.
[35] ADAMS A E, BESOZZI E M, SHAHROKHI G, et al. A case for associational resistance: Apparent support for the stress gradient hypothesis varies with study system[J]. Ecology Letters, 2022, 25(1): 202-217. doi: 10.1111/ele.13917
[36] LI L, LI S, SUN J, et al. Diversity enhances agricultural productivity via rhizosphere phosphorus facilitation on phosphorus-deficient soils[J]. Proceedings of the National Academy of Sciences of the United States of America, 2007, 104(27): 11192-11196. doi: 10.1073/pnas.0704591104
[37] 安迪, 杨令, 王冠达, 等. 磷在土壤中的固定机制和磷肥的高效利用[J]. 化工进展, 2013, 32(8): 1967-1973. [38] HODGE A, BERTA G, DOUSSAN C, et al. Plant root growth, architecture and function[J]. Plant and Soil, 2009, 321(1/2): 153-187.
[39] 任媛媛, 李朝怡, 闫敏飞, 等. 黄土塬区玉米||大豆间作对根系形态的影响[J]. 草业科学, 2021, 38(12): 2449-2459. [40] 李隆. 间套作强化农田生态系统服务功能的研究进展与应用展望[J]. 中国生态农业学报, 2016, 24(4): 403-415. [41] LUO W, NI M, WANG Y, et al. Limited evidence of vertical fine-root segregation in a subtropical forest[J]. New Phytologist, 2021, 231(6): 2308-2318. doi: 10.1111/nph.17546
[42] ZHANG D, LI H, SHEN J. Strategies for root’s foraging and acquiring soil nutrient in high efficiency under intensive cropping systems[J]. Journal of Plant Nutrition and Fertilizers, 2017, 23(6): 1547-1555.
-
期刊类型引用(1)
1. 李万芬. 水稻稻瘟病的发生与防治. 特种经济动植物. 2025(02): 113-115 .  百度学术
百度学术
其他类型引用(0)




 下载:
下载: