Induction and ploidy identification of autotetraploid black wax gourd
-
摘要:目的
探索高效的同源四倍体黑皮冬瓜Benincasa hispida诱变方法组合和寻求简便、快速、大通量、准确的倍性鉴定方法。
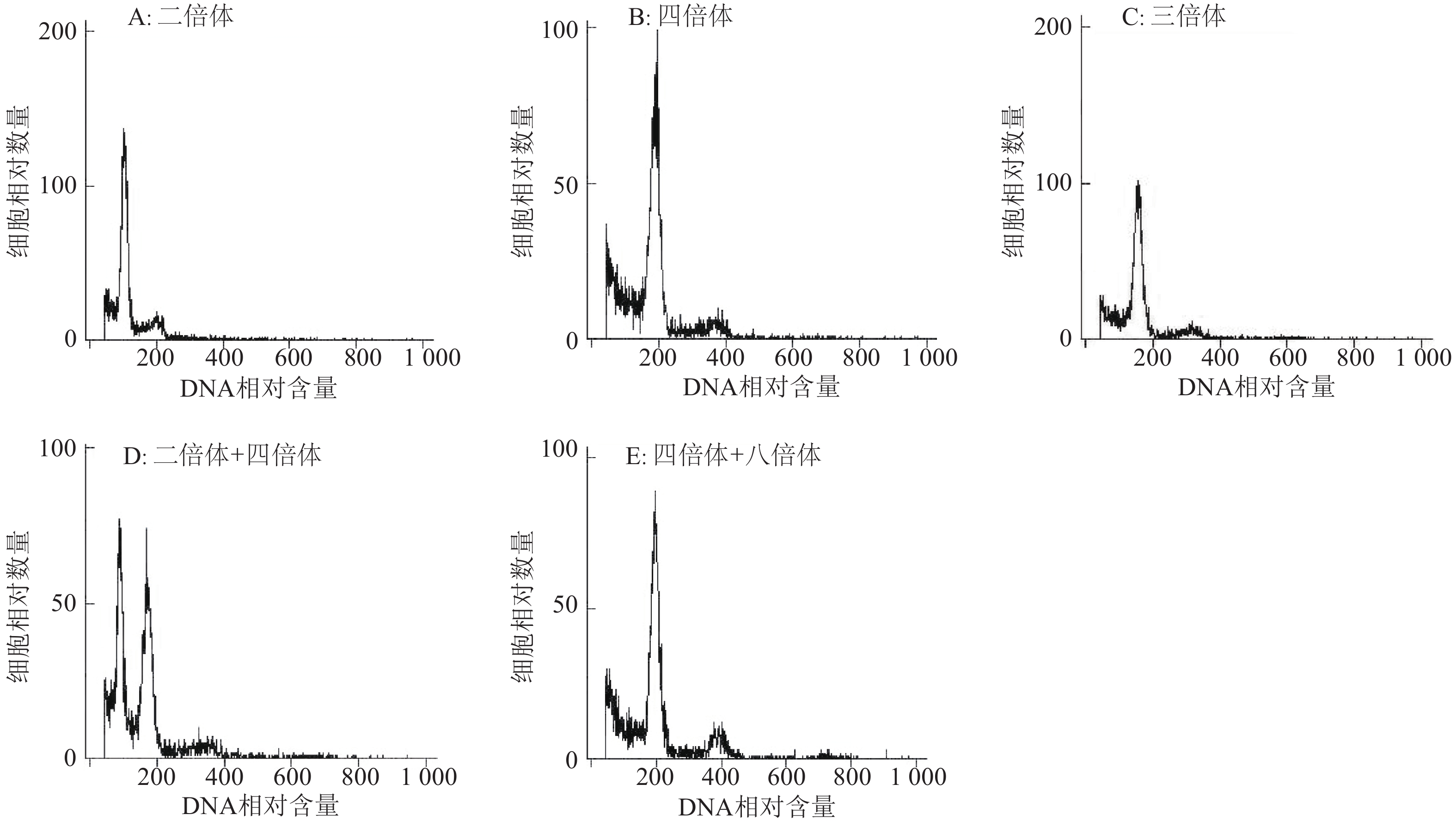
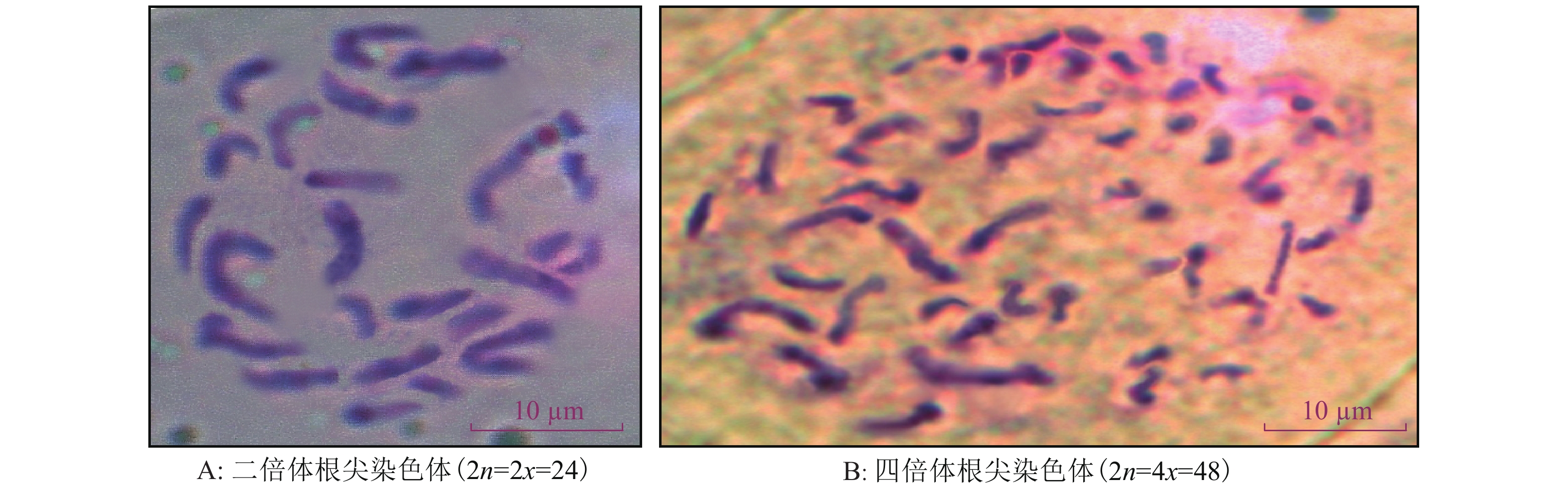
方法以二倍体自交系幼苗为材料,利用不同浓度的秋水仙素和Oryzalin在06:00—07:00、12:00—13:00、17:00—18:00 共3个时间段“剥滴”处理幼苗生长点来诱变产生同源四倍体黑皮冬瓜,利用植株形态学、细胞学及流式细胞术鉴定法与根尖染色体计数鉴定法对变异株进行倍性鉴定。
结果不同浓度的秋水仙素和Oryzalin在不同时间段处理幼苗,均有一定的诱变效果,但秋水仙素的诱变率整体高于Oryzalin处理,且以2 g·L–1的秋水仙素在06:00—07:00处理的诱变率最高,达32.18%;集成植株形态学、细胞学及流式细胞术鉴定的结果与根尖染色体计数法倍性鉴定的结果一致。
结论2 g·L–1的秋水仙素在06:00—07:00“剥滴”处理为最高效的诱变组合方法;集成植株形态学、细胞学及流式细胞术鉴定方法能简便、快速、大通量、准确地进行倍性鉴定。
Abstract:ObjectiveTo explore efficient induction method of autotetraploid Benincasa hispida and seek a simple, convenient, large flux and accurate method of ploidy level identification.
MethodThe seedlings of diploid B. hispida inbred lines were used as materials. Autotetraploid B. hispida was induced using different concentrations of colchicine and oryzalin at different times including 06:00 to 07:00, 12:00 to 13:00 and 17:00 to 18:00 to treat the growth points of seedlings. Ploidy levels of mutated plants were determined by using the methods based on plant morphology, cytology, flow cytometric analysis and chromosome numbers of root tips.
ResultThere were certain induction effects by using different concentrations of colchicine and oryzalin at different times, but the induction rate of colchicine was overall higher than that of oryzalin, and the highest induction rate was 32.18% using 2 g·L–1 colchicine from 06:00 to 07:00. The ploidy identification result from the combination of methods based on plant morphology, cytology and flow cytometric analysis was the same as the result based on chromosome numbers of root tips.
ConclusionThe optimum method of obtaining autotetraploid was using 2 g·L–1 colchicine from 06:00 to 07:00. The combination of plant morphology, cytology and flow cytometric analysis was a simple, convenient, large flux and accurate way to identify ploidy level.
-
Keywords:
- Benincasa hispida /
- autotetraploid /
- induction /
- ploidy identification /
- flow cytometric analysis
-
-
表 1 秋水仙素和Oryzalin不同处理组合对二倍体冬瓜的诱变效果1)
Table 1 Induction effect on diploid Benincasa hispida by different treatments of colchicine and Oryzalin
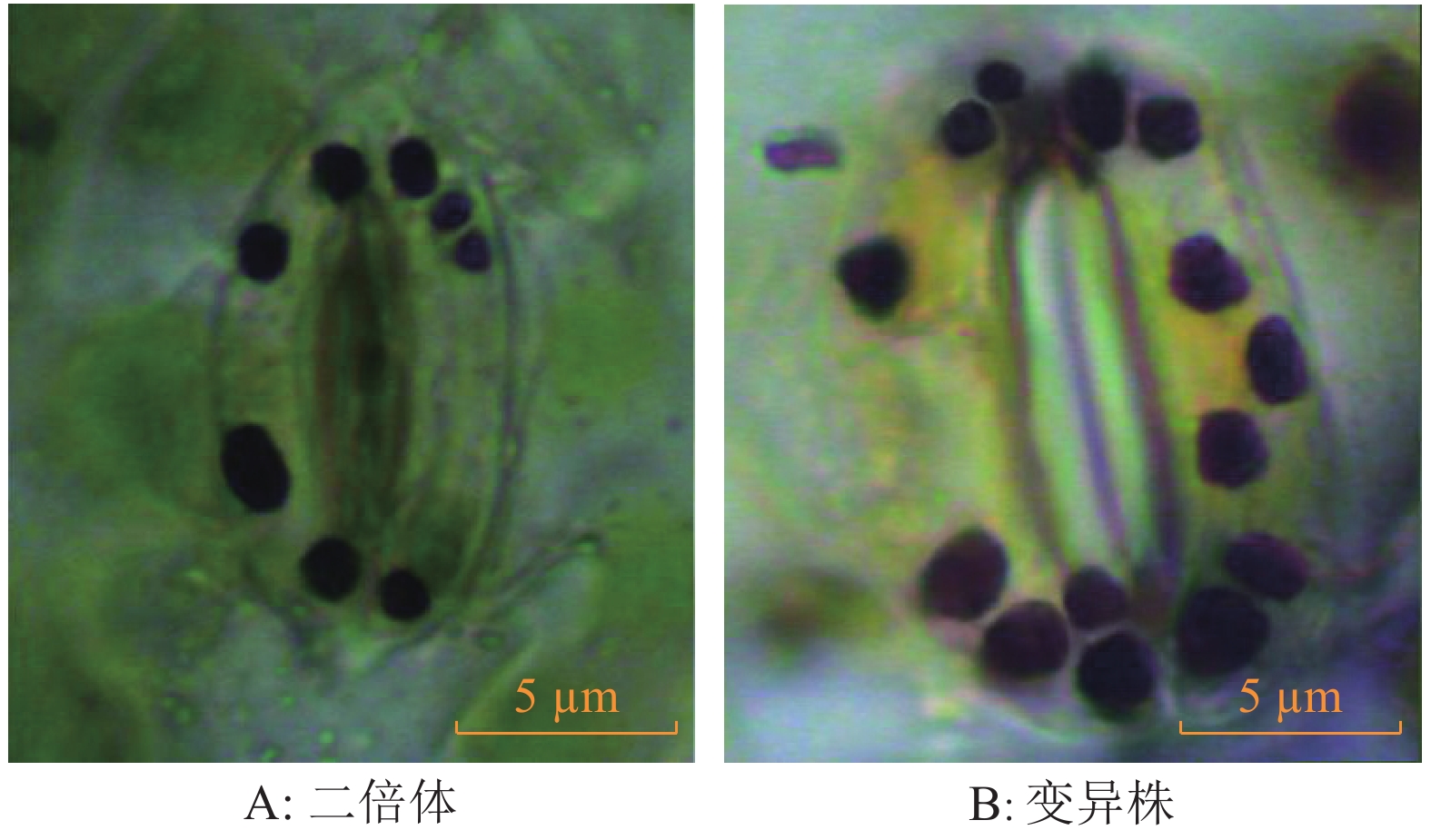
处理时间 处理 变异率/% 四倍体诱导率/% 06:00—07:00 对照 0±0e 0±0d 1 g·L–1秋水仙素 32.56±1.63c 13.95±1.72c 2 g·L–1秋水仙素 70.11±3.45a 32.18±2.35a 4 g·L–1秋水仙素 22.99±1.51d 11.49±1.31c 20 μmol·L–1 Oryzalin 26.74±1.62d 12.79±1.25c 40 μmol·L–1 Oryzalin 41.38±1.93b 22.99±1.78b 60 μmol·L–1 Oryzalin 42.22±1.95b 12.22±1.14c 12:00—13:00 对照 0±0e 0±0f 1 g·L–1秋水仙素 11.63±0.37d 4.65±1.03c 2 g·L–1秋水仙素 25.29±0.59a 9.20±0.75a 4 g·L–1秋水仙素 12.94±0.45d 1.18±0.32e 20 μmol·L–1 Oryzalin 17.44±1.14c 3.49±0.95d 40 μmol·L–1 Oryzalin 24.10±0.47b 8.43±0.34b 60 μmol·L–1 Oryzalin 29.41±1.06a 2.35±0.21de 17:00—18:00 对照 0±0d 0±0e 1 g·L–1秋水仙素 17.86±1.64c 9.52±1.23c 2 g·L–1秋水仙素 32.94±2.07a 17.64±1.57a 4 g·L–1秋水仙素 19.54±1.79c 6.90±0.89d 20 μmol·L–1 Oryzalin 25.29±3.42b 9.20±1.17c 40 μmol·L–1 Oryzalin 35.63±2.15a 14.94±1.05b 60 μmol·L–1 Oryzalin 37.50±2.37a 5.68±0.75d 1)相同处理时间、同列数据后凡具有一个相同小写字母者,表示差异不显著(P>0.05,Duncan’s 法) 表 2 抽蔓期变异株与正常株气孔保卫细胞大小、密度及叶绿体数比较1)
Table 2 The comparison on size, density and number of chloroplast of stomata guard cell between normal and mutated plants at vine growth stage
材料 保卫细胞纵径/μm 保卫细胞横径/μm 保卫细胞密度2) 叶绿体个数 二倍体 11.28±1.35 7.17±0.58 30.0±2.5 8.1±1.8 变异株 16.57±1.58* 9.57±0.89* 18.0±2.1* 14.6±2.1* 1) “*”表示与二倍体差异显著(P<0.01,t 检验);2)保卫细胞密度为单个视野内的保卫细胞个数 -
[1] 孔素萍, 段乃彬, 刘冰江, 等. 不同诱变剂对大蒜四倍体诱导的影响[J]. 核农学报, 2016, 30(6): 1067-1073. [2] 王红娟, 杨岚, 李雅婷, 等. 茅苍术同源四倍体离体诱导与鉴定[J]. 核农学报, 2015, 29(6): 1030-1036. [3] 储丽红, 彭佳佳, 王钊, 等. 氨磺灵、氟乐灵和秋水仙素诱导安祖花多倍体的研究[J]. 园艺学报, 2014, 41(11): 2275-2280. [4] 王友平, 朱金英, 徐光东, 等. 西瓜多倍体研究应用进展[J]. 长江蔬菜, 2010(20): 8-12. [5] MOREJOHN L C, BUREAU T E, MOLE-BAJER J, et al. Oryzalin, a dinitroaniline herbicide, binds to plant tubulin and inhibits microtubule polymerization in vitro[J]. Planta, 1987, 172(2): 252-264.
[6] 董飞, 陈运起, 刘世琦, 等. 秋水仙素诱导大葱多倍体的研究[J]. 园艺学报, 2011, 38(12): 2381-2386. [7] 乔永刚, 马璐琳, 赵晓明, 等. 秋水仙素诱导党参四倍体[J]. 核农学报, 2009, 23(4): 566-571. [8] 赵璘, 刘文革, 郭金丽, 等. 除草剂在植物离体染色体加倍上的应用[J]. 长江蔬菜, 2008(1): 30-33. [9] 阎志红, 刘文革, 赵胜杰, 等. 利用二硝基苯胺类除草剂离体诱导西瓜四倍体[J]. 园艺学报, 2008, 35(11): 1621-1626. [10] ZHANG N, ZENG H X, SHI X F, et al. Selection of tetraploid of a yellow flesh mini-watermelon using oryzalin[J]. Adv Mater Res, 2014, 838/839/840/841: 2449-2454.
[11] 赵胜杰, 刘文革, 阎志红, 等. 秋水仙素和胺磺灵除草剂诱导小型西瓜四倍体研究[J]. 长江蔬菜, 2010(8): 12-13. [12] 赵依杰, 张小红, 吴宇芬, 等. 除草剂Oryzalin诱变西瓜四倍体及倍性鉴定[J]. 云南农业大学学报, 2011, 26(4): 515-518. [13] 韩毅科, 杜胜利, 张桂华, 等. 利用抗微管除草剂胺磺灵诱导黄瓜四倍体[J]. 华北农学报, 2006, 21(4): 27-30. [14] SAKHANOKHO H F, RAJASEKARAN K, KELLEY R Y, et al. Induced polyploidy in diploid ornamental ginger (Hedychium muluense R. M. Simth) using colchicine and oryzalin[J]. Hortscience, 2009, 44(7): 1809-1814.
[15] WANG K, HE L C, YAN H L, et al. Induction of tetraploidity with antimicrotubule agents in oriental melon (Cucumis melo var. makuwa)[J]. Isr J Plant Sci, 2015, 62(3): 198-207.
[16] 刘泽发, 闵子杨, 孙小武, 等. 印度南瓜四倍体诱变及其特性研究[J]. 华北农学报, 2015, 30(5): 125-129. [17] REGO M M, REGO E R, BRUCKNER C H, et al. In vitro induction of autotetraploids from diploid yellow passion fruit mediated by colchicine and oryzalin[J]. Plant Cell Tiss Org, 2011, 107(3): 451-459.
[18] LEHRER J M, BRAND M K, LUBELL J D. Induction of tetraploidy in meristematically active seeds of Japanese barberry (Berberis thunbergii var. atropurpurea) through exposure to colchicine and oryzalin[J]. Sci Hortic, 2008, 119(1): 67-71.
[19] 王惠林, 张慧林, 周志成. ORYZALIN 不同处理方法对西瓜四倍体诱变效果的影响[J]. 新疆农业大学学报, 2008, 31(6): 21-25. [20] 谢大森, 张钢, 彭庆务, 等. 秋水仙素诱导冬瓜多倍体的初步研究[J]. 热带作物学报, 2011, 32(11): 2094-2098. [21] 施先锋, 彭金光, 汪李平. 用西瓜叶片气孔保卫细胞叶绿体数鉴定西瓜染色体倍性[J]. 湖南农业大学学报(自然科学版), 2009, 35(6): 640-642. [22] 田新民, 周香艳, 弓娜, 等. 流式细胞术在植物学研究中的应用:检测植物核DNA含量和倍性水平[J]. 中国农学通报, 2011, 27(9): 21-27. [23] 张永兵, 陈劲枫, 伊鸿平, 等. 甜瓜有丝分裂染色体制片技术及核型分析[J]. 西北植物学报, 2005, 25(9): 1735-1739. [24] 全国无子西瓜科研协作组. 无子西瓜栽培与育种[M]. 北京: 中国农业出版社, 2001: 46-48. [25] 梁倩倩, 张显, 顾桂兰. 温度和处理时间段对西瓜四倍体诱导的影响及其倍性鉴定[J]. 西北农业学报, 2009, 18(4): 301-305. [26] 徐道娜, 薛志强, 李世栋, 等. 西瓜幼苗多倍体诱导方法研究[J]. 安徽农业科学, 2007, 35(28): 8847-8849. [27] 彭尽晖, 张良波, 彭晓英. 秋水仙素在植物倍性育种中的应用进展[J]. 湖南农业科技, 2004, 31(5): 22-25. [28] 李立志, 何毅, 卢焜光. 黄皮西瓜化学诱变及四倍体利用研究初报[J]. 中国蔬菜, 2002(3): 8-11. [29] 谭素英. 西瓜不同倍体叶保卫细胞中的叶绿体数观察[J]. 果树科学, 1985(4): 34-36. [30] 刘文革, 阎志红, 饶小莉. 不同倍性西瓜的叶表皮微形态特征比较[J]. 果树学报, 2005, 22(1): 31-34. [31] 邵冰洁, 万思琦, 刘江淼, 等. 黑果枸杞和宁夏枸杞的多倍体诱导和鉴定[J/OL]. 分子植物育种, (2017-10-25)[2018-01-15]. http://kns.cnki.net/kcms/detail/46.1068.S.20171025.1644.008.html. [32] 王康, 何林池, 魏小云, 等. 利用二甲戊乐灵创制薄皮甜瓜同源四倍体[J]. 西北农业学报, 2015, 24(4): 114-119. [33] 葛志东, 李海真, 王惠林, 等. 氟乐灵诱导西葫芦染色体加倍研究[J]. 中国农学通报, 2009, 25(8): 215-218.




 下载:
下载: