Characterization of long chain 3-ketoacyl-ACP synthase in Xanthomonas campestris
-
摘要:目的
研究野油菜黄单胞菌Xanthomonas campestris 8004基因组中3个标注为3-酮脂酰ACP合成酶的基因XcfabF1、XcfabF2和XcfabB在脂肪酸合成过程中的功能.
方法将这3个基因分别克隆到表达载体pBAD24M, 然后转化大肠埃希菌Escherichia coli的fabB和fabF温敏型突变株CY242和CY244,同时利用体外无细胞抽提物酶学分析FabF1、FabF2和FabB蛋白活性.
结果和结论XcfabF1和XcfabB基因分别能遗传互补大肠埃希菌fabF和fabB突变,而XcfabF2基因则不能互补大肠埃希菌fabF或fabB突变.体外无细胞抽提物酶学分析表明FabF1和FabB都能完成辛脂酰-ACP的延伸,但FabF2则不能完成该酶促反应.XcfabB基因编码3-酮脂酰ACP合成酶Ⅰ,XcfabF1基因编码3-酮脂酰ACP合成酶Ⅱ,而fabF2基因不参与中长链脂肪酸的合成.
-
关键词:
- 野油菜黄单胞菌 /
- 3-酮脂酰ACP合成酶 /
- 遗传互补
Abstract:ObjectiveThe functions of the three genes XcfabF1, XcfabF2 and XcfabB, which were annotated as encodes putative 3-ketoacyl-ACP synthase in fatty acid synthesis in Xanthomonas campestris 8004 genome, were studied.
MethodThree genes coloned into expression plasmid pBAD24M separately were transformed into the fabB and fabF temperature sensitive mutant CY242 and CY244 of Escherichia coli. The activity of XcFabF1, XcFabF2 and XcFabB in vitro was assayed by cell-free extracts.
Result and conclusionThe genetic complementary revealed that XcfabB and XcfabF1 genes could restore the growth of mutant CY242 and CY244 respectively, but XcfabF2 could not restore the growth of mutant CY242 or CY244. The cell-free extracts of XcFabF1 and XcFabB could elongate octanoyl-ACP to longer acyl-ACP, while XcFabF2 could not catalyse the elongation in vitro assay. The above results demonstrate that XcfabB and XcfabF1 encode 3-ketoacyl-ACP sysnthase Ⅰ and 3-ketoacyl-ACP sysnthase Ⅱ respectively, but XcfabF2 is not involved in long chain fatty acid synthesis in X.campestris.
-
黄单胞菌属是植物病原菌中较大的类群,能侵染超过11科70属124种单子叶植物和57科170属268种双子叶植物.该属几种主要的致病菌有野油菜黄单胞菌Xanthomonas campestris pv. campestris(Xcc)、水稻白叶枯菌X. oryzae pv. oryzae(Xoo)和柑橘溃疡病菌X. axonopodis pv. citri, (Xac)等,能造成包括十字花科作物、水稻、豆类作物、番茄和柑橘等的重大经济损失[1].随着分子生物学和细菌基因组学的发展,多种黄单胞菌的基因组得到测序,这为深入研究黄单胞菌的致病机理、开发新的防治药物或手段提供了有力条件.
研究细菌脂肪酸合成代谢,寻找新的抗菌药物作用靶点,开发新的抗菌药物是微生物学研究的热点领域[2-3].细菌以酰基载体蛋白(Acyl carrier protein, ACP)为载体,利用Ⅱ型脂肪酸合成酶系通过聚合、还原、脱水和再还原,从头合成脂肪酸,其特点是每一步反应均由独立的酶催化[4].在模式细菌大肠埃希菌中聚合反应由3-酮脂酰ACP合成酶(KAS)催化[5].根据生理功能的差异,大肠埃希菌Escherichia coli 的3-酮脂酰ACP合成酶可分为3种类型:3-酮脂酰ACP合成酶Ⅲ(FabH)在脂肪酸合成的起始反应中起作用,而3-酮脂酰ACP合成酶Ⅰ和Ⅱ(FabB和FabF)则是脂肪酸合成循环反应中的关键酶,被称做长链3-酮脂酰ACP合成酶[6-7],其中FabB是大肠埃希菌合成不饱和脂肪酸的关键酶之一,参与不饱和脂肪酸的从头合成[8], FabF能将棕榈油酸延伸为顺-11-十八烯酸,参与受温度控制的脂肪酸组成调节[9].
植物病原菌野油菜黄单胞菌X.campestris 8004脂肪酸合成代谢的研究尚未完全展开,通过比对发现,其基因组中有XcfabF1(Xc3225)、XcfabF2(Xc4087)和XcfabB(Xc3652)这3个基因标注为3-酮脂酰ACP合成酶,其功能尚未得到鉴定.本论文主要通过遗传互补和体外分析等手段,研究以上3个基因在野油菜黄单胞菌脂肪酸合成代谢中的作用.
1. 材料与方法
1.1 材料
1.1.1 菌株、质粒和培养基
所用细菌菌株和质粒见表 1.LB用作培养大肠埃希菌的丰富培养基,RB作为检测脂肪酸合成突变菌株的培养基.培养基中的常用试剂和抗生素有100 mg·L-1氨苄青霉素、30 mg·L-1卡那霉素、0.2 g·L-1的L-阿拉伯糖、1 mmol·L-1异丙基-β-D-硫代半乳糖苷(IPTG).体积分数为20%的油酸(Oleate)用无水乙醇配制,并用KOH将pH调至中性,在RB培养基中油酸的最终体积分数为0.1 mL·L-1.
表 1 试验相关的菌株和质粒Table 1. The strains and plasmids used in this work
1.1.2 主要试剂来源
限制性内切酶、T4连接酶、Taq、pfu DNA聚合酶、DNA marker DL2000、标准蛋白质等试剂、T-载体克隆、质粒提取和DNA凝胶回收等试剂盒均购自TaKaRa公司;氨苄青霉素、卡那霉素、IPTG、L-阿拉伯糖、各种脂肪酸等试剂购自Sigma公司;PCR扩增引物寡核苷酸由上海Sangon公司合成.
1.2 方法
1.2.1 质粒构建和重组DNA技术
以野油菜黄单胞菌基因组DNA为模板,PCR扩增XcfabF1、XcfabF2 和XcfabB.扩增XcfabF1的引物为:5′-CAATCATATGAGTCGTCGTGTTG-3′和5′-CTTGAAGCTTTCAGATGCGCTTGAACA-3′;扩增XcfabF2的引物为:5′-CAATCATATGGCCCCGGTGCCAT-3′和5′-CAATAAGCTTTAGCGTGCCTGCCCGA-3′;扩增XcfabB的引物为:5′-CTTACATATGCGCCGTGTTGTC-3′和5′-CTTGAAGCTTTTACAGGCCGAACA-3′(下划线处分别代表限制性内切酶NdeⅠ和HindⅢ酶切位点).PCR扩增产物分别连接至pMD19-T载体,通过测序验证获得的质粒pHJ1(fabF1)、pHJ2(fabF2)和pHJ3(fabB).使用NdeⅠ和HindⅢ分别消化pHJ1(fabF1)、pHJ2(fabF2)和pHJ3(fabB),获得的基因片段分别克隆到用阿拉伯糖诱导表达的载体pBAD24M上,得到互补载体pHJ4(fabF1)、pHJ5(fabF2)和pHJ6(fabB).用同样的方法将3个基因分别克隆到pET28(b)上,得到表达载体pHJ7(fabF1)、pHJ8(fabF2)和pHJ9(fabB).
所采用的DNA操作,包括DNA的酶切、片段回收、连接、转化等方法,参照文献[12].
1.2.2 制备无细胞抽提物
根据Heath等[13]的方法制备脂肪酸合成无细胞提取物.用Bradford方法,以牛血清白蛋白为标准,确定蛋白质浓度.分装并添加甘油至体积分数为10%,-80 ℃条件下保存备用.
1.2.3 蛋白质的表达与分离纯化
将表达载体pHJ7(fabF1)、pHJ8(fabF2)和pHJ9(fabB)分别转化大肠埃希菌BL21(DE3)后,野油菜黄单胞菌的FabF1、FabF2和FabB蛋白的表达和纯化参照文献[14-15]进行.同时分离纯化哈氏弧菌脂酰ACP合成酶(AasS)和大肠埃希菌holo-ACP蛋白[14-15].
1.2.4 3-酮脂酰ACP合成酶体外活性分析
体外检测野油菜黄单胞菌FabF1、FabF2和FabB蛋白在细菌脂肪酸合成延伸中的功能, 参照文献[14-15].具体做法:总反应体系为50 μL,其中含有100 mmol·L-1 Tris-HCl(pH8.0),20 μmol·L-1 ACP,10 mmol·L-1 ATP,10 mmol·L-1 MgSO4,5 mmol·L-1 DTT,300 μmol·L-1脂肪酸,脂酰ACP合成酶1 μg,100 μmol·L-1丙二酸单酰CoA,再添加100 μmol·L-1 NADH和100 μmol/L NADPH,加入无细胞抽提物0.2 μg,根据不同反应需要加入0.2 μg酶蛋白,37 ℃保温培养2~3 h.反应结束后,用20%非变性聚丙烯酰胺凝胶(含2.5 mol·L-1尿素)电泳分析脂酰ACP[16].
1.2.5 脂肪酸组成分析
在合适的条件下培养细菌10 mL,离心收集菌体,按照文献[15]的方法,提取细菌的脂肪酸,并转化为脂肪酸甲酯.样品送华南农业大学测试中心,进行脂肪酸组成GC-MS分析.
2. 结果与分析
2.1 野油菜黄单胞菌XcfabF1、XcfabF2和XcfabB基因的克隆及酶蛋白表达与纯化
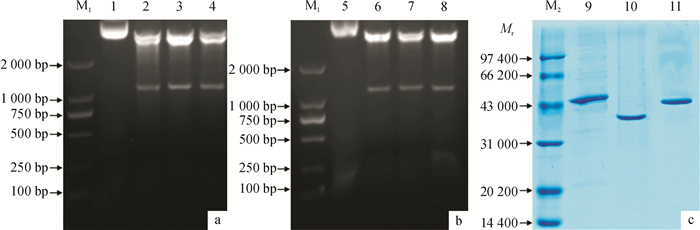
通过PCR扩增获得野油菜黄单胞菌XcfabF1、XcfabF2和XcfabB基因,并克隆到受外源阿拉伯糖诱导调控的质粒载体pBAD24M(图 1a),得到功能检测质粒pHJ4(fabF1)、pHJ5(fabF2)和pHJ6(fabB).同时将上述基因克隆到表达载体pET-28(b)上, 构建能在大肠埃希菌BL21(DE3)菌株中高效表达的载体:pHJ7(fabF1)、pHJ8(fabF2)和pHJ9(fabB)(图 1b).可溶性表达分析显示,3个蛋白均为可溶性蛋白(结果未列).然后采用Ni-NTA琼脂糖亲和层析,分别分离纯化了N端融合有His-tag标签的FabF1、FabF2和FabB蛋白,如图 1c所示.
![]() 图 1 表达质粒的构建与FabF1、FabF2和FabB蛋白的纯化M1: DNA marker DL 2000; 1: pBAD24M/NdeⅠ&HindⅢ; 2: pHJ4/NdeⅠ&HindⅢ; 3: pHJ5/NdeⅠ&HindⅢ; 4: pHJ6/NdeⅠ&HindⅢ; 5: pET28(b)/NdeⅠ&HindⅢ; 6: pHJ7/NdeⅠ&HindⅢ; 7: pHJ8/NdeⅠ&HindⅢ; 8: pHJ9/NdeⅠ&HindⅢ; M2:蛋白marker; 9: XcFabF1; 10: XcFabF2; 11: XcFabB.
图 1 表达质粒的构建与FabF1、FabF2和FabB蛋白的纯化M1: DNA marker DL 2000; 1: pBAD24M/NdeⅠ&HindⅢ; 2: pHJ4/NdeⅠ&HindⅢ; 3: pHJ5/NdeⅠ&HindⅢ; 4: pHJ6/NdeⅠ&HindⅢ; 5: pET28(b)/NdeⅠ&HindⅢ; 6: pHJ7/NdeⅠ&HindⅢ; 7: pHJ8/NdeⅠ&HindⅢ; 8: pHJ9/NdeⅠ&HindⅢ; M2:蛋白marker; 9: XcFabF1; 10: XcFabF2; 11: XcFabB.
a:构建pHJ4(fabF1)、pHJ5(fabF2)和pHJ6(fabB)质粒载体; b:构建pHJ7(fabF1)、pHJ8(fabF2)和pHJ9(fabB)质粒载体; c:纯化Xanthomonas campestris 8004 FabF1、FabF2和FabB蛋白.Figure 1. Construction of expression vector and purification of Xanthomonas campestris 8004 FabF1, FabF2 and FabB2.2 野油菜黄单胞菌XcfabF1、XcfabF2和XcfabB基因互补大肠埃希菌突变株
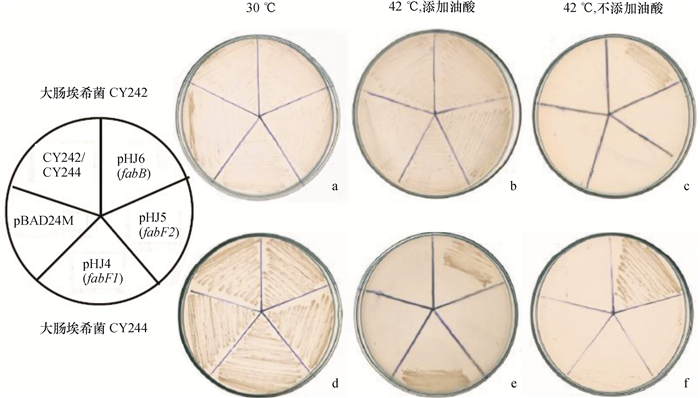
为了检测野油菜黄单胞菌fabF1、fabF2和fabB基因的功能,首先用质粒pHJ4(fabF1)、pHJ5(fabF2)和pHJ6(fabB)分别转化大肠埃希菌fabB温度敏感突变株CY242(fabB(ts)).该菌株在30 ℃时,能够正常生长(图 2a),42 ℃时由于FabB蛋白失活, 成为fabB的营养缺陷型菌株, 因此如果外源基因能够在不添加油酸的条件下恢复CY242菌株42 ℃的生长表型,表明该基因编码的蛋白具有大肠埃希菌FabB活性,即3-酮脂酰ACP合成酶Ⅰ的活性.遗传互补检测结果(图 2b、2c)表明,质粒pHJ6(fabB)能够互补CY242,说明黄单胞菌XcfabB编码的蛋白具有3-酮脂酰ACP合成酶Ⅰ的活性,而pHJ4(fabF1)和pHJ5(fabF2)不能恢复CY242的生长性状,则表明XcfabF1和XcfabF2编码的蛋白不具有3-酮脂酰ACP合成酶Ⅰ的活性.接着用质粒pHJ4(fabF1)、pHJ5(fabF2)和pHJ6(fabB)分别转化大肠埃希菌fabBfabF双突变菌株CY244(fabF fabB(ts)).在30 ℃时,虽然该菌株的fabF发生突变,但是fabB基因编码的蛋白仍具有长链3-酮脂酰ACP聚合酶活性,故能正常生长(图 2d).在42 ℃条件下,fabB基因编码的蛋白也失去活性,此时即使培养基中添加油酸, 菌株也无法生长(图 2e).因此,在42 ℃条件下,如果外源基因在添加油酸平板上,能够恢复CY244的生长,表明该基因编码的蛋白具有3-酮脂酰ACP合成酶Ⅱ(FabF)的活性;如果外源基因在不添加油酸平板上,能够恢复CY244的生长,表明该基因具有3-酮脂酰ACP合成酶Ⅰ(FabB)的活性.结果如图 2所示,42 ℃条件下,在只添加有阿拉伯糖的RB平板上,pHJ6(fabB)能使大肠埃希菌CY242和CY244恢复生长(图 2c、2f);而在添加有阿拉伯糖和体积分数为0.1%油酸的RB平板上,pHJ4(fabF1)能使大肠埃希菌CY244恢复生长(图 2e).这再次表明野油菜黄单胞菌的FabB具有3-酮脂酰ACP合成酶Ⅰ的活性,同时表明FabF1具有3-酮脂酰ACP合成酶Ⅱ的活性,而FabF2则不具有以上活性.
2.3 野油菜黄单胞菌FabF1、FabF2和FabB蛋白体外活性检测
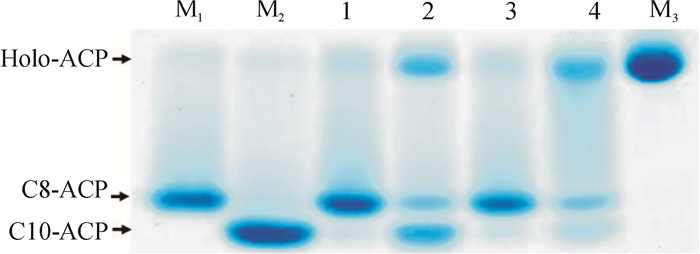
体内互补试验表明野油菜黄单胞菌XcfabF1具有3-酮脂酰ACP合成酶Ⅱ的活性,fabB具有3-酮脂酰ACP合成酶Ⅰ的活性,即两者均具有长链3-酮脂酰ACP合成酶活性.为了确定上述结论,对XcfabB、XcfabF1和XcfabF2基因编码的蛋白进行了体外酶活性检测.首先制备大肠埃希菌CY244菌株携带不同质粒[pBAD24M、pHJ4(fabF1)、pHJ5(fabF2]和pHJ6(fabB)]和野生型MG1655的无细胞抽提物,并在体外进行脂肪酸合成反应.结果如图 3所示,含有pHJ4(fabF1)和pHJ6(fabB)的CY244无细胞抽提物与阳性对照MG1655类似,能以辛脂酰-ACP(C8-ACP)为底物延伸,产生长链脂酰-ACP(LC-ACP),说明FabF1和FabB具有3-酮脂酰-ACP合成酶活性,而含有pHJ5(fabF2)的CY244无细胞抽提物与阴性对照类似,不能催化辛脂酰-ACP的延伸,这表明FabF2不具有酮脂酰-ACP合成酶活性,与体内遗传互补的试验结果相印证.
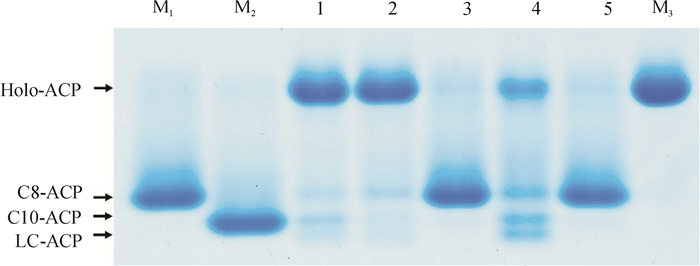
为进一步体外验证活性,将“2.1”纯化获得的野油菜黄单胞菌FabF1、FabF2和FabB蛋白分别加入CY244无细胞抽提物中,体外进行脂肪酸合成反应.非变性凝胶电泳(图 4)显示,添加了FabF1和FabB的无细胞抽提物能将辛脂酰-ACP(C8-ACP)延伸为癸脂酰-ACP(C10-ACP)(图 4泳道2和4),而添加FabF2则不能完成延伸反应(图 4泳道3).这一结果同样表明FabF1和FabB具有3-酮脂酰-ACP合成酶活性,而FabF2不具有3-酮脂酰-ACP合成酶活性,与体内互补试验结果一致。
2.4 脂肪酸组成分析
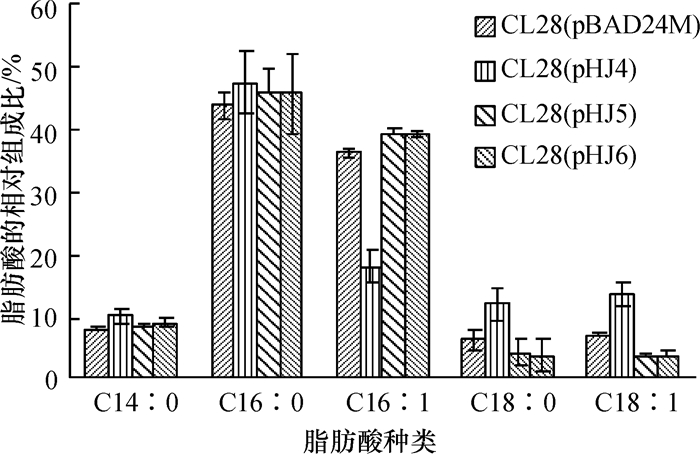
3-酮基脂酰ACP聚合酶Ⅱ的显著特点是能够延伸棕榈油酸为顺-11-十八烯酸.为了进一步确定野油菜黄单胞菌FabF1的活性,将pHJ4(fabF1)、pHJ5(fabF2)和pHJ6(fabB)分别转化大肠埃希菌fabF突变菌株CL28(fabF: :kan),并提取了大肠埃希菌CL28携带不同质粒[pBAD24M、pHJ4(fabF1)、pHJ5(fabF2)和pHJ6(fabB)]的细菌脂肪酸,利用GC-MS测定各菌株脂肪酸的组成, 结果如图 5所示.
与CL28(pBAD24M)相比,CL28[pHJ4(fabF1)]的脂肪酸中棕榈油酸(C16: 1)含量明显下降,而顺-11-十八烯酸含量明显上升,说明野油菜黄单胞菌的FabF1具有将棕榈油酸延伸为顺-11-十八烯酸的活性,具有典型的3-酮脂酰ACP合成酶Ⅱ的功能,而CL28[pHJ5(fabF2)]和CL28[pHJ6(fabB)]的脂肪酸中棕榈油酸含量没有下降,说明野油菜黄单胞菌的FabF2和FabB都不具有3-酮脂酰ACP合成酶Ⅱ的功能.
3. 讨论与结论
生物信息学分析表明,野油菜黄单胞菌基因组中脂肪酸合成酶系基因集中在3个区域,其中fabB与fabA在同一区域,fabF1、fabG、fabD和fabH在同一区域,而fabF2单独在一区域.相似性比较发现,野油菜黄单胞菌XcFabF1与大肠埃希菌的EcFabF蛋白相似性达到60.1%,而XcFabF2只有36.3%,野油菜黄单胞菌XcFabB与EcFabB具有62.1%的相似性.此外,大肠埃希菌长链3-酮基脂酰ACP合成酶(FabF和FabB)拥有的催化活性位点Cys163/His303/His340在野油菜黄单胞菌XcFabF1、XcFabB和XcFabF2中也同样保守[17-22].因此,推测XcfabF1、XcfabF2和XcfabB基因编码的蛋白可能具有长链3-酮基脂酰ACP合成酶活性.然而研究结果表明在野油菜黄单胞菌中只有XcFabF1和XcFabB具有长链3-酮基脂酰ACP合成酶活性,XcFabF2不拥有3-酮基脂酰ACP合成酶活性.进一步研究表明野油菜黄单胞菌的XcFabF1具有3-酮基脂酰ACP聚合酶Ⅱ的活性,而XcFabB具有3-酮基脂酰ACP聚合酶Ⅰ的活性.另外,野油菜黄单胞菌的XcFabF2是否具有其他方面功能,如参与次级代谢产物聚酮体合成或影响菌体生长等方面,还有待进一步研究.此研究也为深入研究黄单胞菌的致病机理,开发新的防治药物提供了一定的理论依据.
-
图 1 表达质粒的构建与FabF1、FabF2和FabB蛋白的纯化
M1: DNA marker DL 2000; 1: pBAD24M/NdeⅠ&HindⅢ; 2: pHJ4/NdeⅠ&HindⅢ; 3: pHJ5/NdeⅠ&HindⅢ; 4: pHJ6/NdeⅠ&HindⅢ; 5: pET28(b)/NdeⅠ&HindⅢ; 6: pHJ7/NdeⅠ&HindⅢ; 7: pHJ8/NdeⅠ&HindⅢ; 8: pHJ9/NdeⅠ&HindⅢ; M2:蛋白marker; 9: XcFabF1; 10: XcFabF2; 11: XcFabB.
a:构建pHJ4(fabF1)、pHJ5(fabF2)和pHJ6(fabB)质粒载体; b:构建pHJ7(fabF1)、pHJ8(fabF2)和pHJ9(fabB)质粒载体; c:纯化Xanthomonas campestris 8004 FabF1、FabF2和FabB蛋白.Figure 1. Construction of expression vector and purification of Xanthomonas campestris 8004 FabF1, FabF2 and FabB
表 1 试验相关的菌株和质粒
Table 1 The strains and plasmids used in this work

-
[1] CHAN J W, GOODWIN P H. The molecular genetics of virulence of Xanthomonas campestris[J]. Biotechnol Adv, 1999, 17(6): 489-508. doi: 10.1016/S0734-9750(99)00025-7
[2] HEATH R J, ROCK C O. Fatty acid biosynthesis as a target for novel antibacterials[J]. Curr Opin Investig Drugs, 2004, 5(2): 146-153. http://cn.bing.com/academic/profile?id=d351162286d6fceb2cdde7e574abb25d&encoded=0&v=paper_preview&mkt=zh-cn
[3] ZHANG Y M, WHITE S W, ROCK C O. Inhibiting bacterial fatty acid synthesis[J]. J Biol Chem, 2006, 281(26): 17541-17544. doi: 10.1074/jbc.R600004200
[4] WHITE S W, ZHENG J, ZHANG Y M, et al. The structural biology of type Ⅱ fatty acid biosynthesis[J]. Annu Rev Biochem, 2005, 74: 791-831. http://www.researchgate.net/publication/7789711_The_structural_biology_of_type_II_fatty_acid_biosynthesis
[5] HEATH R J, WHITE S W, ROCK C O. Lipid biosynthesis as a target for antibacterial agents[J]. Prog Lipid Res, 2001, 40(6): 467-497. doi: 10.1016/S0163-7827(01)00012-1
[6] HEATH R J, ROCK C O. Inhibition of beta-ketoacyl-acyl carrier protein synthase Ⅲ (FabH) by acyl-acyl carrier protein in Escherichia coli[J]. J Biol Chem, 1996, 271(18): 10996-11000. doi: 10.1074/jbc.271.18.10996
[7] ROCK C O, CRONAN J E. Escherichia coli as a model for the regulation of dissociable (type Ⅱ) fatty acid biosynthesis[J]. Biochim Biophys Acta, 1996, 1302(1): 1-16.
[8] DE MENDOZA D, KLAGES U A, CRONAN J E Jr, et al. Thermal regulation of membrane fluidity in Escherichia coli:Effects of overproduction of beta-ketoacyl-acyl carrier protein synthase Ⅰ[J]. J Biol Chem, 1983, 258(4): 2098-2101.
[9] GARWIN J L, KLAGES A L, CRONAN J E Jr. Beta-ketoacyl-acyl carrier protein synthase Ⅱ of Escherichia coli:Evidence for function in the thermal regulation of fatty acid synthesis[J]. J Biol Chem, 1980, 255(8): 3263-3265.
[10] ULRICH A K, DE MENDOZA D, GARWIN J L, et al. Genetic and biochemical analyses of Escherichia coli mutants altered in the temperature-dependent regulation of membrane lipid composition[J]. J Bacteriol, 1983, 154(1): 221-230. http://d.old.wanfangdata.com.cn/OAPaper/oai_pubmedcentral.nih.gov_217450
[11] LAI C Y, CRONAN J E.Isolation and characterization of beta-ketoacyl-acyl carrier protein reductase (fabG)mutants of Escherichia coli and Salmonella enterica serovar Typhimurium[J]. J Bacteriol, 2004, 186(6): 1869-1878. doi: 10.1128/JB.186.6.1869-1878.2004
[12] SAMBROOK J, FRITSCH E F, MANIATIS T. Molecular cloning[M]. New York :Cold Spring Harbor Laboratory Press, 1989.
[13] HEATH R J, ROCK C O. Regulation of fatty acid elongation and initiation by acyl-acyl carrier protein in Escherichia coli [J]. J Biol Chem, 1996, 271(4): 1833-1836. doi: 10.1074-jbc.271.4.1833/
[14] ZHU L, CHENG J, LUO B, et al. Functions of the Clostridium acetobutylicium FabF and FabZ proteins in unsaturated fatty acid biosynthesis[J]. BMC Microbiol, 2009, 9: 119. doi: 10.1186/1471-2180-9-119
[15] ZHU L, LIN J, MA J, et al. Triclosan resistance of Pseudomonas aeruginosa PAO1 is due to FabV, a triclosan-resistant enoyl-acyl carrier protein reductase[J]. Antimicrob Agents Chemother, 2010, 54(2): 689-698. doi: 10.1128/AAC.01152-09
[16] HEATH R J, ROCK C O. Roles of the FabA and FabZ beta-hydroxyacyl-acyl carrier protein dehydratases in Escherichia coli fatty acid biosynthesis[J]. J Biol Chem, 1996, 271(44): 27795-27801. doi: 10.1074/jbc.271.44.27795
[17] HEATH R J, ROCK C O. Enoyl-acyl carrier protein reductase (fabI) plays a determinant role in completing cycles of fatty acid elongation in Escherichia coli[J]. J Biol Chem, 1995, 270(44): 26538-26542. doi: 10.1074/jbc.270.44.26538
[18] HUANG W, JIA J, EDWARDS P, et al. Crystal structure of beta-ketoacyl-acyl carrier protein synthase Ⅱ from E.coli reveals the molecular architecture of condensing enzymes[J]. EMBO J, 1998, 17(5): 1183-1191.
[19] MOCHE M, SCHNEIDER G, EDWARDS P, et al. Structure of the complex between the antibiotic cerulenin and its target, beta-ketoacyl-acyl carrier protein synthase[J]. J Biol Chem, 1999, 274(10): 6031-6034. doi: 10.1074-jbc.274.10.6031/
[20] OLSEN J G, KADZIOLA A, VON WETTSTEIN-KNOW-LES P, et al. The X-ray crystal structure of beta-ketoacyl [acyl carrier protein] synthase Ⅰ[J]. FEBS Lett, 1999, 460(1): 46-52. doi: 10.1016/S0014-5793(99)01303-4
[21] DAVIES C, HEATH R J, WHITE S W, et al. The 1.8 a crystal structure and active-site architecture of beta-ketoacyl-acyl carrier protein synthase Ⅲ (FabH) from Escherichia coli [J]. Structure, 2000, 8(2): 185-195. doi: 10.1016/S0969-2126(00)00094-0
[22] MOCHE M, DEHESH K, EDWARDS P, et al. The crystal structure of beta-ketoacyl-acyl carrier protein synthase Ⅱ from Synechocystis sp. at 1.54 A resolution and its relationship to other condensing enzymes[J]. J Mol Biol, 2001, 305(3): 491-503. doi: 10.1006/jmbi.2000.4272



 下载:
下载: