Responses of maize growth to low phosphorus and phosphorus fertilizer application in different types of soil
-
摘要:目的
通过在酸性和石灰性土壤上种植玉米,探究在不同类型土壤上,缺磷和施用磷肥对玉米生长、磷吸收、根系性状、菌根侵染率以及根际指标的影响。
方法分别利用2种不同来源的酸性土壤(NX和WY)与2种不同来源的石灰性土壤(SP和CP)进行不施磷肥(低磷,LP)与施磷肥(高磷,HP)的玉米盆栽试验,对玉米的植株干质量、磷质量、根系性状(总根长、根表面积、根体积、平均根直径)、菌根侵染率、以及根际指标(根际pH、根际磷酸酶活性、根际羧酸盐含量)进行测定分析。
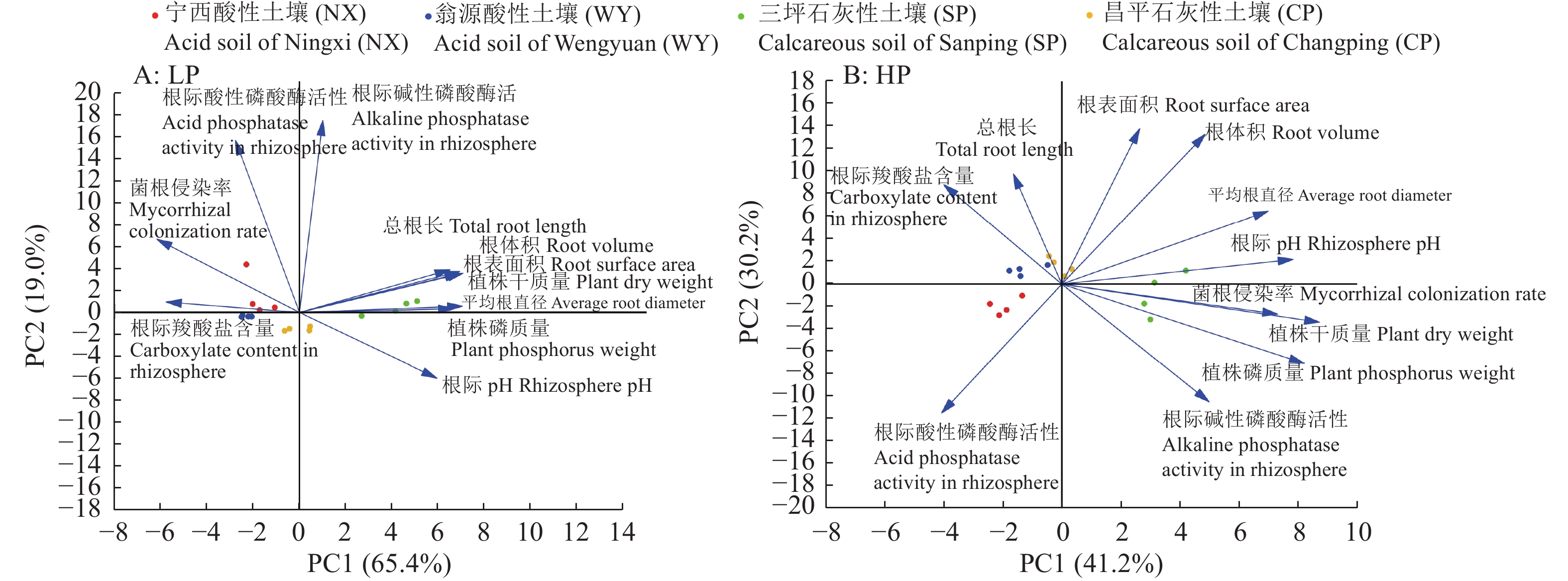
结果缺磷严重影响玉米植株生长,施磷显著增加了酸性和石灰性土壤上玉米植株干质量和磷质量;在2种酸性土壤和CP石灰性土壤中,施磷显著增加了玉米总根长、根表面积、根体积、平均根直径,降低了玉米菌根侵染率和根际羧酸盐含量;施磷显著降低了NX酸性土壤中根际酸性磷酸酶活性和CP石灰性土壤根际pH。主成分分析表明,在低磷条件下,根系性状与植株干质量和磷质量呈正相关关系,根际羧酸盐含量、菌根侵染率与植株干质量和磷质量均呈负相关关系;在高磷条件下,菌根侵染率、碱性磷酸酶活性、根际pH、平均根直径与植株干质量和磷质量均呈正相关关系。
结论施用磷肥可促进不同类型土壤上玉米植株的生长和磷吸收,玉米对施磷的响应很大程度上受到土壤本底养分含量的影响,有效磷含量低的土壤对施用磷肥的响应更加明显。在低磷条件下,玉米主要通过改变根系性状促进磷吸收。
Abstract:ObjectiveTo investigate the effects of phosphorus (P) deficiency and P fertilizer application on maize growth, P uptake, root traits, mycorrhizal colonization rate, and rhizosphere indexes in acid or calcareous soil.
MethodTwo different sources of acid soil (NX and WY) and two different sources of calcareous soil (SP and CP) were used in the pot experiment for maize with no P fertilization (low P, LP) or P fertilization (high P, HP) treatment. Maize plant dry weight, P weight, root traits (total root length, root surface area, root volume, average root diameter), mycorrhizal colonization rate, and rhizosphere indexes (rhizosphere pH, rhizosphere phosphatase activity, rhizosphere carboxylate content) were determined.
ResultP deficiency seriously affected plant growth, and P application significantly increased plant dry weight and P weight of maize in acid or calcareous soil. P application significantly increased total root length, root surface area, root volume, and average root diameter, and reduced mycorrhizal colonization rate and rhizosphere carboxylate content of maize in both acid soil and CP calcareous soil. P application also significantly reduced rhizosphere acid phosphatase activity in NX acid soil and rhizosphere pH in CP calcareous soil. Principal component analysis showed that, under low P condition, maize root traits were positively correlated with plant dry weight and P weight, while rhizosphere carboxylate content and mycorrhizal colonization rate were negatively correlated with plant dry weight and P weight. Under high P condition, mycorrhizal colonization rate, alkaline phosphatase activity, rhizosphere pH, and average root diameter of maize were all positively correlated with plant dry weight and P weight.
ConclusionP fertilization can promote plant growth and P uptake of maize in different type of soil. The response of maize to P application is largely influenced by the background nutrient content in soil, and the soil with low P availability is more responsive to P fertilization. Maize mainly alters root traits to promote P uptake under low P condition.
-
Keywords:
- Maize /
- Acid soil /
- Calcareous soil /
- Phosphorus treatment /
- Low phosphorus
-
中国非金属矿产资源硅藻土已探明储量4亿t多,远景储量超过20亿t,位居亚洲首位和世界第2[1]。吉林省临江硅藻土资源现已探明储量2.1亿t,远景储量6亿t,占全国储量的56.7%,目前是我国最大的硅藻土生产加工基地[2]。随着社会发展,市场对优质硅藻土的需求量逐年递增,在硅藻土矿开采中,低品位的硅藻土常常被丢弃,在露天堆放,形成尾矿,既造成硅藻土资源的极大浪费又污染自然环境[3]。目前,有关硅藻土与化学元素之间的吸附解吸性能研究主要集中于硅藻土对重金属的吸附性能[4],以及对氮[5]和磷[6]的吸附解吸性能的研究;对于钾,则是以硅藻土作为包裹剂制作缓释肥,再进行淋失试验[7-8],而关于硅藻土对钾的吸附解吸原理有待于深入探讨。本文以吉林省临江硅藻土矿区的硅藻土尾矿为原料、以同矿区的优质硅藻土原矿作对比,探讨硅藻土尾矿对钾的吸附解吸性能,为更好地开发和利用硅藻土尾矿提供理论依据。
1. 材料与方法
1.1 试验材料
本试验于2015年3—4月在吉林农业大学资源与环境学院实验室进行。FP640火焰光度计购自上海欣益仪器仪表有限公司。试验所用硅藻土采自吉林省临江市硅藻土矿区,为硅藻土尾矿(阳离子交换量12.28 cmol·kg-1),以同一矿区的优质硅藻土原矿(阳离子交换量9.28 cmol·kg-1)为对照。样品经风干后过60目筛,备用。以分析纯KCl为钾源,配成不同浓度的溶液使用,以分析纯CaCl2为解吸剂。
1.2 试验方法
1.2.1 吸附动力学试验
采用静态摇床试验法,将每种硅藻土各称7份(每份1 g,3个重复)置于离心管中,分别加入初始质量浓度为50 mg·L-1的K+溶液50 mL,(25±1) ℃恒温条件下,以200 r·min-1分别振荡1、5、10、20、30、60、90、120和240 min,以4 500 r·min-1离心5 min,倾出上清液,用火焰光度计测定K+ 的含量,再用差减法计算2种硅藻土对K+的吸附量。
1.2.2 吸附热力学试验
采用静态摇床试验法,将每种硅藻土各9份(每份1 g,3个重复)分别加入到50 mL初始质量浓度为100、200、400、600、1 000、2 000、4 000、5 000和6 000 mg·L-1的KCl溶液中,置于振荡器上,在25 ℃条件下振荡30 min,放置于25 ℃恒温培养箱中静止培养48 h,离心分离,采用火焰光度计测定上清液中K+浓度,计算各K+平衡浓度下每种硅藻土对K+的吸附量,确定单位质量硅藻土对K+的饱和吸附量,并进行拟合分析。
1.2.3 解吸动力学试验
将每种硅藻土各称9份(每份1 g,3个重复)置于离心管中,分别加入50 mL初始质量浓度5.0 g· L-1的KCl溶液,置于振荡器上,恒温(25±1) ℃条件下,以200 r· min-1振荡2 h后,25 ℃恒温条件下静止培养48 h,离心分离,采用火焰光度计测定上清液中K+的浓度,然后分别向离心管中加入0.01 mol· L-1的CaCl2溶液50 mL,用以解吸吸附的K+,恒温(25±1)℃条件下,以200 r· min-1分别振荡1、5、10、20、30、60、90、120和240 min,以4 500 r·min-1离心5 min,倾出上清液,用火焰光度计测定K+的含量,根据吸附平衡后的浓度、残留液体积和不同时间的解吸液浓度计算2种硅藻土的解吸量。
1.2.4 测定方法
化学组成测试方法:非晶质氧化硅的测定采用氨基萘酚磺酸比色法[9],铝的测定采用氟化钾取代-EDTA容量法, 钛的测定采用过氧化氢比色法,铁、钙、镁的测定采用原子吸收分光光度法,烧失量的测定采用减量法[10]。
矿物组成鉴定方法:采用粉末法制片[11],经自然风干后,用X射线衍射仪(岛津7000型)在CuKα辐射、Ni滤波器、40.0 kV、30.0 mA、扫描速度2 °· min-1(2θ)、扫描范围为5~40 °,步长为0.06 °条件下测定其矿物组成。
1.3 数据处理
1.3.1 吸附量
2种硅藻土对K+的吸附量按下式计算:

(1) 式中,qta为t时刻的吸附量(mg·kg-1),ρ0为吸附溶液的初始质量浓度(mg·L-1),t表示吸附反应时间(min),ρt为t时刻上清液质量浓度(mg·L-1), V为吸附初始液的体积(L),m为土样质量(kg)。
1.3.2 解吸量
2种硅藻土对K+的解吸量按下式计算:

(2) 式中,qtd为t时刻的解吸量(mg·kg-1),Va为t时刻解吸溶液体积(L),ρa为t时刻解吸溶液的质量浓度(mg· L-1),ρe为吸附平衡溶液的质量浓度(mg·L-1), Vc为吸附平衡溶液残留土样中的总体积(L),m为土样质量(kg)。Vc的数值与土样残留液质量的数值可视为近似相等,即吸附试验倾出上清液后离心管和内容物的质量减去土样和离心管的质量[12]。
1.3.3 吸附解吸率
2种硅藻土对K+的解吸率(Ra)按下式计算:

(3) 1.3.4 Langmuir模型
Langmuir模型的吸附平衡常数(RL)的计算公式如下:

(4) 式中,KL为Langmuir常数[4]。
1.3.5 数据统计与分析
试验数据采用Excel 2007软件进行统计分析;X射线衍射(XRD)分析结果采用MDIJade6.0进行匹配,对获得的XRD衍射谱进行叠加对比并分析鉴定。吸附解吸试验数据通过Origin8.0软件进行拟合,得到各参数值。
2. 结果与分析
2.1 优质硅藻土及硅藻土尾矿的性质差异
2.1.1 化学组成差异
2种供试硅藻土主要化学成分组成分析结果(表 1)表明,硅藻土尾矿与优质硅藻土的本质差异是SiO2含量,硅藻土尾矿SiO2质量分数为78.57%,优质硅藻土SiO2质量分数高达89.29%,按我国目前执行的由国家建筑材料工业局2001年批准实施的硅藻土行业标准JC/T414-2000的划分,硅藻土尾矿属3级硅藻土,优质硅藻土属1级硅藻土[3, 12-13]。硅藻土尾矿中Al2O3、Fe2O3、CaO、MgO、TiO2和烧失量的数值均高于优质硅藻土。这说明硅藻土尾矿比优质硅藻土含有相对较多的矿物杂质和有机质等成分。这与以往研究结果相似[14]。
表 1 硅藻土的化学成分Table 1. Chemical compositions of diatomite
2.1.2 矿物组成差异
图 1是优质硅藻土及尾矿的X射线衍射图,由图 1可知,供试优质硅藻土及其尾矿在2θ角为18~28°之间均有1个较宽的不对称衍射峰,这是非晶质蛋白石的衍射特征[6],由此可知,2种硅藻土的矿物组成主要是非晶质蛋白石。由图 1可以看出,优质硅藻土的X射线衍射峰主要出现在0.334和0.710 nm, 硅藻土尾矿的X射线衍射峰主要出现在0.307、0.333、0.334、0.426和0.720 nm。0.307和0.333 nm为云母的衍射峰,0.334和0.426 nm为石英的衍射峰,0.710和0.720 nm为高岭石的衍射峰[9]。由此可知,硅藻土尾矿比优质硅藻土含有更多的石英、高岭石和云母等杂质矿物。
2.2 优质硅藻土及硅藻土尾矿对K+的吸附性能
2.2.1 动力学吸附特征
由图 2可知,2种硅藻土对K+的吸附动力学曲线具有共同的趋势:吸附开始阶段,吸附量急剧增加,随着时间的延长,吸附量的增加趋于缓和。硅藻土尾矿大致在1 min时就达吸附平衡,即呈现瞬时吸附平衡的性质,优质硅藻土对K+的吸附1 min之后趋于缓和,在5 min之后基本平衡,可见,2种硅藻土对K+的吸附都能在很短时间内达到吸附平衡。在本试验设定的平衡时间范围内,硅藻土尾矿对K+的最大吸附量为1 036 mg·kg-1,最大吸附率为41.46%;优质硅藻土对K+的最大吸附量为1 149 mg·kg-1,最大吸附率为45.96%。硅藻土尾矿对K+的最大吸附量可以达到优质硅藻土的90.17%。
将K+在2种硅藻土上的吸附过程分别用伪一阶动力学方程[15]、伪二阶动力学方程[16]以及粒内扩散模型(Weber和Morris模型)[17]进行拟合,从表 2可知,伪二阶动力学方程拟合后的r最大,说明2种硅藻土对K+的吸附最优模型为伪二阶动力学模型。
表 2 硅藻土对K+动力吸附曲线的拟合结果1)Table 2. Fitting results of K+ kinetic adsorption curves
2.2.2 热力学吸附特征
图 3为2种硅藻土对K+ 的等温吸附曲线,由图 3中的优质硅藻土对K+的吸附曲线可以看出,整个吸附过程大体可以分为3个吸附阶段:图中前3个点形成的吸附过程可看作第1个吸附阶段,吸附过程由快速吸附到慢速吸附;图中第3点到第6点可看作第2个吸附阶段,随着溶液中K+浓度的增加,优质硅藻土对K+的吸附又由快速吸附再到缓慢吸附;图中第6点到第9点可看作第3个吸附阶段,优质硅藻土随溶液中K+质量浓度的增大,吸附量呈先快速吸附后达饱和吸附状态。
已有研究表明,黏土矿物对重金属离子的吸附过程受液膜扩散、颗粒扩散和吸附反应3个步骤吸附速率的影响[18]。本试验的3个阶段可能分别对应着优质硅藻土对K+吸附的不同主导过程。与图 3中优质硅藻土对K+的吸附曲线相比,硅藻土尾矿对K+的吸附呈现单一化吸附过程,这可能是由于尾矿中的杂质堵塞了硅藻土微孔, 阻碍了溶液中离子进入硅藻土骨架, 从而限制了硅藻土的吸附能力[18]。
通过物质的阳离子交换量计算的理论吸附值与物质的实际吸附值进行比较,可判断吸附过程是否以阳离子交换吸附为主[19]。由图 3可知,本试验条件下,硅藻土尾矿对K+的饱和吸附量为3.251 mg·g-1,优质硅藻土对K+的饱和吸附量为6.709 mg·g-1。按照硅藻土尾矿和优质硅藻土的阳离子交换吸附量计算的K+交换吸附量理论值分别为4.789和3.619 mg·g-1。相比较可知,理论上优质硅藻土的阳离子交换吸附量小于硅藻土尾矿,而试验测得的优质硅藻土饱和吸附量却大于硅藻土尾矿,这说明,理论上优质硅藻土对K+的吸附不以阳离子交换吸附为主,可能由于硅藻土本身的多孔结构性质[3],使得优质硅藻土对K+的吸附还有物理吸附。
这与已有研究累托石对K+的吸附以阳离子交换为主的结果不同[19]。硅藻土尾矿对K+的饱和吸附量小于阳离子交换吸附量的理论计算值,这可能是由于硅藻土尾矿含有的杂质物质覆盖其表面,堵塞其微孔,而降低了硅藻土尾矿的吸附性能所致[3]。硅藻土尾矿的阳离子交换量为12.28 cmol·kg-1,大于同一矿区的优质硅藻土的阳离子交换量(9.28 cmol·kg-1)。这可能是由于硅藻土尾矿中含有较多杂质物质(表 1)所致。这与已有研究表明的阳离子交换量与其固相组成高度相关,并估计有机质和无机组分对胶体阳离子交换量的相对贡献分别为31%和69%的结果相似[20]。
使用Langmuir等温吸附模型[21]、Freundlich等温吸附模型[22]和Temkin等温吸附模型[23]对K+的热力学吸附的全过程进行整体拟合,结果见表 3。比较3个拟合模型的相关系数(r),可以看出,2种硅藻土对K+的热力学吸附过程更适合Freundlich等温吸附方程。
表 3 硅藻土对K+热力吸附曲线的拟合结果1)Table 3. Fitting results of K+ thermodynamic adsorption curves
根据已有研究[4, 24-26], 由Langmuir模型的吸附平衡常数KL计算RL,RL的大小可反映吸附的难易程度: RL=0为吸附过程不可逆;0<RL<1为吸附反应容易进行;RL=1为吸附过程呈线性表达;RL>1为吸附过程很难进行。Freundlich模型中的吸附常数n可以反映吸附反应的理化属性:当n<1时,表示以化学吸附过程为主;当n=1时,表示呈线性吸附趋势;当n>1时,表示以物理吸附过程为主。
由RL公式可计算出硅藻土尾矿和优质硅藻土对K+的RL区间,当ρ0<1 000 mg·L-1时,RL均为1,说明吸附过程呈线性表达;当ρ0>1 000 mg·L-1时,RL分别为0.997~0.999和0.998~0.999,均在0~1之间, 说明K+在2种硅藻土表面的吸附容易进行。由表 3可知,硅藻土尾矿、优质硅藻土对K+的等温吸附拟合方程Freundlich模型中吸附常数n分别为1.565、1.548,均大于1,表明硅藻土尾矿和优质硅藻土对K+的吸附以物理过程为主,即主要靠库仑力或范德华力发生吸附。这与已有研究中硅藻土对其他阳离子的吸附研究结果相似[4]。
2.3 优质硅藻土及硅藻土尾矿对K+的解吸
2.3.1 对K+的解吸特征
解吸量作为吸附强度的表征指标,通常用来说明表面活性吸附位与金属离子结合的牢固程度[21]。由图 4可知,解吸过程可划分为3个阶段: 0~10 min为快速解吸阶段;10~60 min解吸速率下降,解吸缓慢进行;60 min之后,解吸量趋于平衡状态。本试验所设置的反应时间范围内,硅藻土尾矿最大解吸量为1 303 mg·kg-1,优质硅藻土最大解吸量为1 678 mg·kg-1。硅藻土尾矿对K+的最大解吸量为优质硅藻土的77.65%。这说明,硅藻土尾矿对K+有一定的保蓄能力,若应用于土壤,可能会对K+具有调控作用,减少K+短时间内的交换损失。
将K+在2种硅藻土上的解吸过程分别用Elovic方程、指数方程、抛物线扩散方程和一级动力学方程[27]进行拟合,拟合结果见表 4。
表 4 硅藻土对K+动力解吸曲线的拟合结果1)Table 4. Fitting results of K+kinetic desorption curves
由表 4的r可知:4种模型描述硅藻土尾矿对K+解吸适用性关系为Elovich方程(0.927) > 指数方程(0.896) > 抛物线扩散方程(0.719) > 一级动力学方程(0.545);4种模型描述优质硅藻土对K+解吸适用性关系为:Elovich方程(0.931) > 指数方程(0.852) > 一级动力学方程(0.845) > 抛物线扩散方程(0.708)。结果表明,Elovich方程为描述2种硅藻土K+解吸的最优动力学模型,其次为指数方程。
2.3.2 对K+的解吸速率
2种硅藻土对K+的不同反应阶段解吸速率与时间的关系可以用双常数速率方程[28]描述,由表 5可知,K+的解吸速率Vd的自然对数与时间t的自然对数存在良好的线性关系。已有研究结果表明,双常数速率方程中,b反映了反应速率随时间降低的快慢趋势,b < 0表示随着解吸时间的延长,解吸速率在降低[28]。优质硅藻土的b为-0.689,硅藻土尾矿的b为-0.748,两者b的大小不同,且均小于0,说明2种硅藻土对K+解吸速率随时间而降低的趋势不同,硅藻土尾矿降低较快,优质硅藻土降低较慢。
表 5 反应速度(lnVd)与反应时间(lnt)的回归方程1)Table 5. The regression equation of reaction velocity(lnVd) and reaction time(lnt)
3. 讨论与结论
硅藻土尾矿与优质硅藻土相比较,本质差异是SiO2含量,硅藻土尾矿SiO2质量分数为78.57%,优质硅藻土SiO2质量分数为89.29%,两者矿质组成均以非晶质SiO2为主。硅藻土尾矿比优质硅藻土含有更多的石英、高岭石、云母等矿物杂质和有机质等成分。这与孙志明[3]、朱健等[14]、赵芳玉等[29]的研究结果相似。已有研究结果表明,与硅藻伴生的杂质矿物还有水云母、蒙脱石、长石[3]。本试验所检测出的矿物种类较少,可能与使用粉末法制片,所含黏粒较少而不易检测有关。
已有研究结果表明,硅藻土对重金属离子的动力学吸附符合伪二阶动力学方程,热力学吸附符合Freundlich方程[29]。朱健[18]研究表明,天然硅藻土对各重金属离子的吸附容易进行, 以物理过程为主。本试验研究表明,硅藻土尾矿及优质硅藻土对K+的动力学吸附特性均符合伪二阶动力学模型。优质硅藻土对K+的热力学吸附主导过程复杂于硅藻土尾矿,硅藻土尾矿对K+的热力学吸附过程可能受杂质影响而吸附过程单一,吸附量少于优质硅藻土。2种硅藻土对K+的热力学吸附特性均符合Freundlich等温吸附方程,RL值反映出吸附反应容易进行,n值反映出吸附以物理过程为主。
就硅藻土尾矿对K+的饱和吸附量小于由阳离子交换量计算的理论值而言,饱和吸附的K+是否就是n值反映的以物理吸附为主还有待于深入研究。一方面可能与模型的适用性有关,另一方面有关硅藻土对K+吸附机理的研究鲜有报道,影响吸附量的因素与主要吸附机理的关系还有待于进一步明确。
硅藻土尾矿及优质硅藻土对K+的解吸特性均符合Elovich方程,这与已有研究表明黄壤原土和各粒级组分对K+的解吸特性用Elovich方程拟合较好的结果相似[27]。已有研究表明,潮土对K+的解吸反应达平衡前,不同时段的解吸率与反应时间的对数(lnt)有极显著的线性相关[28],本试验研究表明,2种硅藻土解吸过程达到平衡之前,K+的解吸率与反应时间的对数(lnt)均存在良好的线性关系。
-
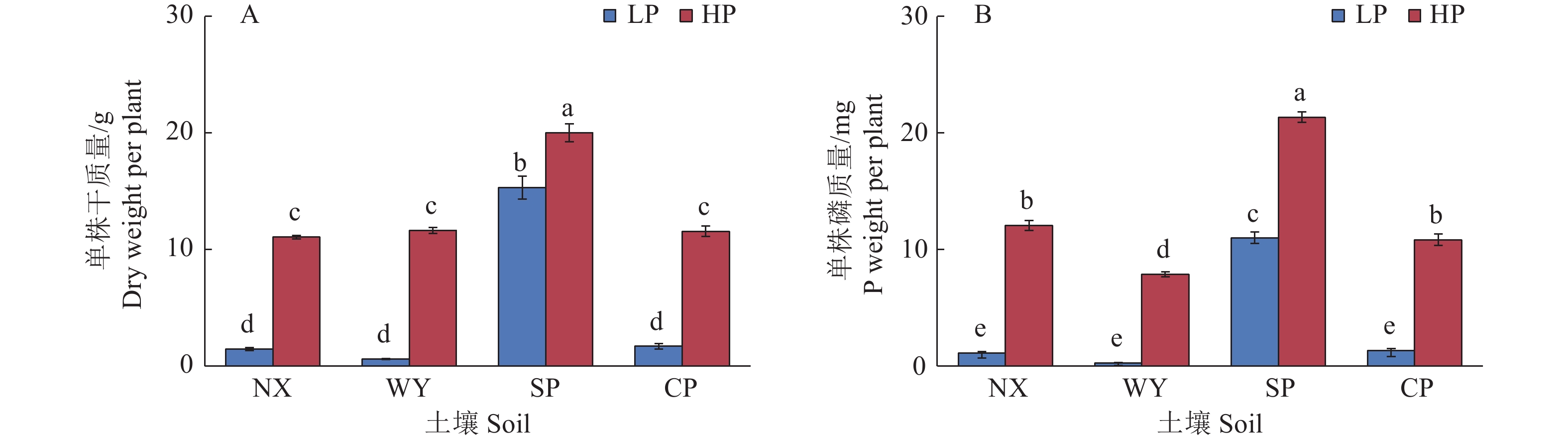
图 1 不同土壤类型和磷处理对玉米植株干质量和磷质量的影响
LP:不施磷;HP:施磷;NX:宁西酸性土壤;WY:翁源酸性土壤;SP:三坪石灰性土壤;CP:昌平石灰性土壤;各图中柱上不同小写字母代表处理间差异显著(P<0.05,Duncan’s法)
Figure 1. Effects of different soil types and phosphorus treatments on plant dry weight and P weight in maize
LP: No P added; HP: P fertilizer added; NX: Acid soil of Ningxi; WY: Acid soil of Wengyuan; SP: Calcareous soil of Sanping; CP: Calcareous soil of Changping; In each figure, different lowercase letters on the column represent significant differences among different treatments (P< 0.05, Duncan’s method)
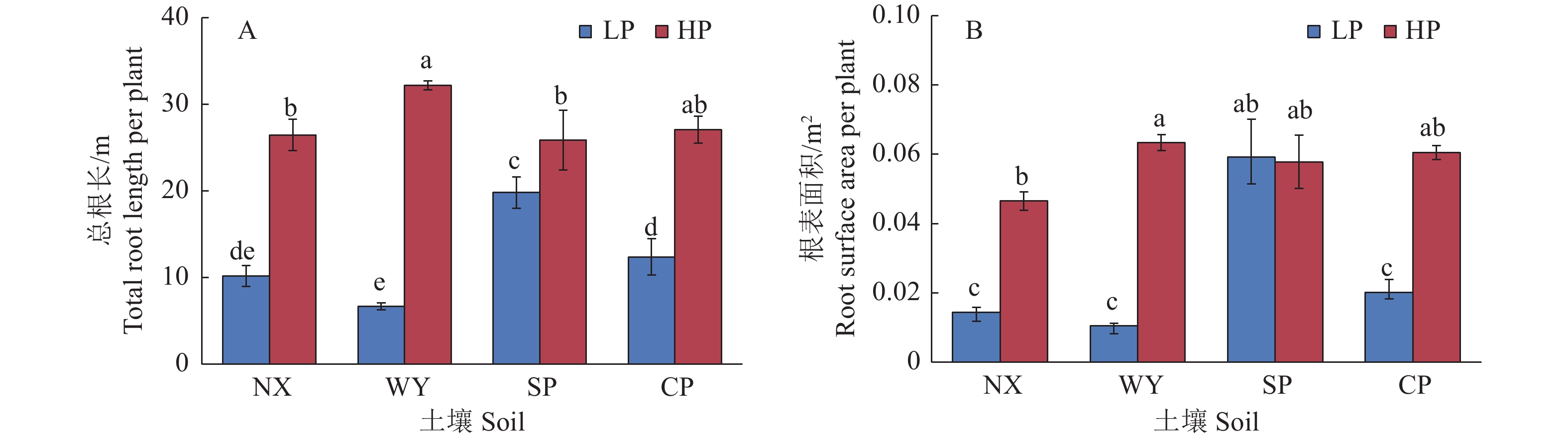
图 2 不同土壤类型和磷处理对玉米总根长和根表面积的影响
LP:不施磷;HP:施磷;NX:宁西酸性土壤;WY:翁源酸性土壤;SP:三坪石灰性土壤;CP:昌平石灰性土壤;各图中柱上不同小写字母代表不同处理间差异显著(P<0.05,Duncan’s法)
Figure 2. Effects of different soil types and phosphorus treatments on total root length and root surface area in maize
LP: No P added; HP: P fertilizer added; NX: Acid soil of Ningxi; WY: Acid soil of Wengyuan; SP: Calcareous soil of Sanping; CP: Calcareous soil of Changping; In each figure, different lowercase letters on the column represent significant differences among different treatments (P<0.05, Duncan’s method)
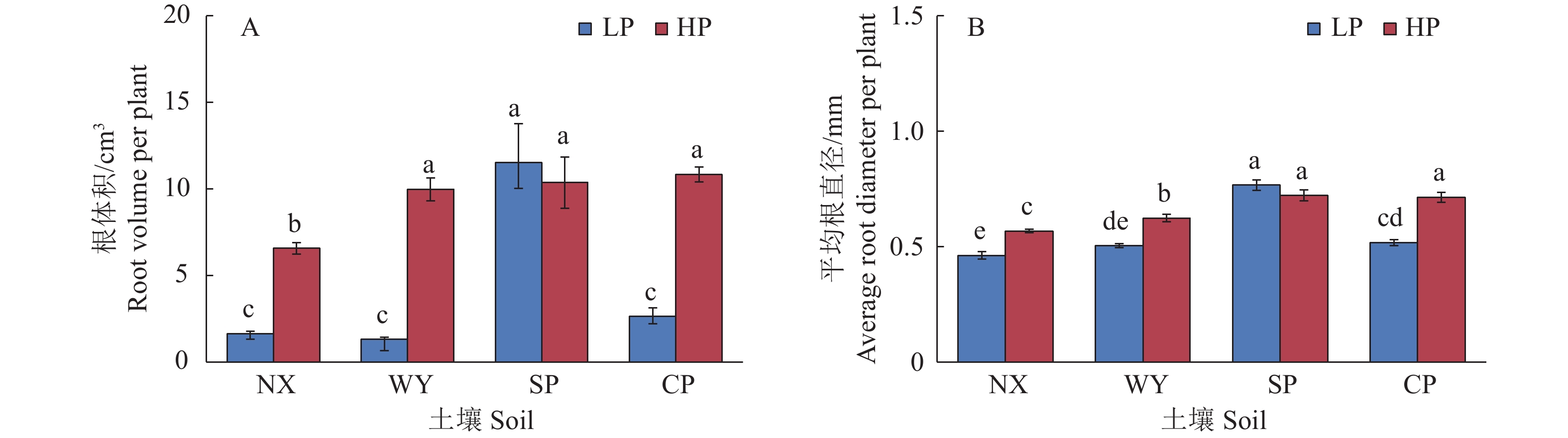
图 3 不同土壤类型和磷处理对玉米单株根体积和平均根直径的影响
LP:不施磷;HP:施磷;NX:宁西酸性土壤;WY:翁源酸性土壤;SP:三坪石灰性土壤;CP:昌平石灰性土壤;各图中柱上不同小写字母代表不同处理间差异显著(P<0.05,Duncan’s法)
Figure 3. Effects of different soil types and phosphorus treatments on root volume and average root diameter in maize
LP: No P added; HP: P fertilizer added; NX: Acid soil of Ningxi; WY: Acid soil of Wengyuan; SP: Calcareous soil of Sanping; CP: Calcareous soil of Changping; In each figure, different lowercase letters on the column represent significant differences among different treatments (P<0.05, Duncan’s method)
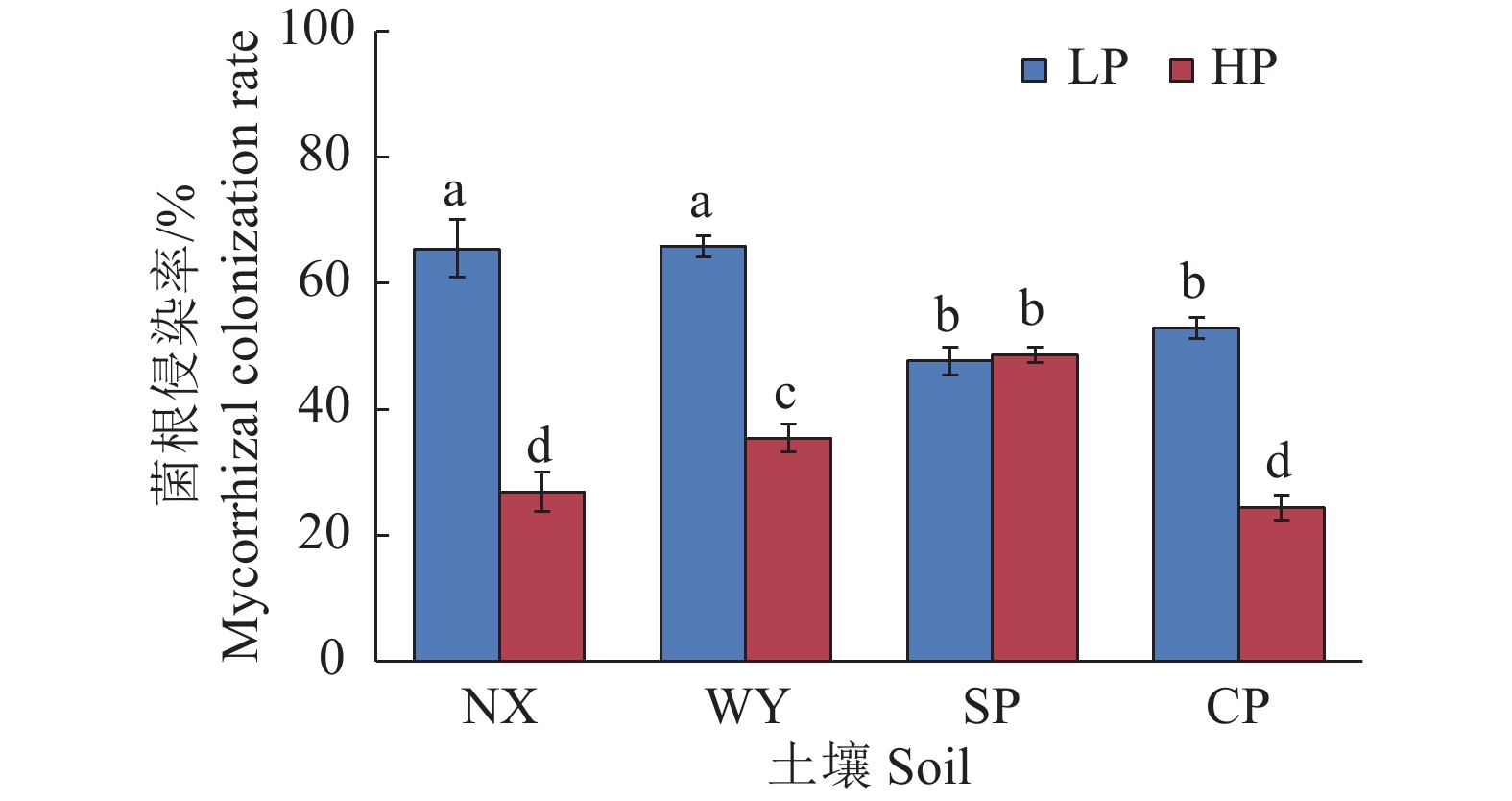
图 4 不同土壤类型和磷处理对玉米菌根侵染率的影响
LP:不施磷;HP:施磷;NX:宁西酸性土壤;WY:翁源酸性土壤;SP:三坪石灰性土壤;CP:昌平石灰性土壤;柱上不同小写字母代表不同处理间差异显著(P<0.05,Duncan’s法)
Figure 4. Effects of different soil types and phosphorus treatments on mycorrhizal colonization rate in maize
LP: No P added; HP: P fertilizer added; NX: Acid soil of Ningxi; WY: Acid soil of Wengyuan; SP: Calcareous soil of Sanping; CP: Calcareous soil of Changping; Different lowercase letters on the column represent significant differences among different treatments (P<0.05, Duncan’s method)
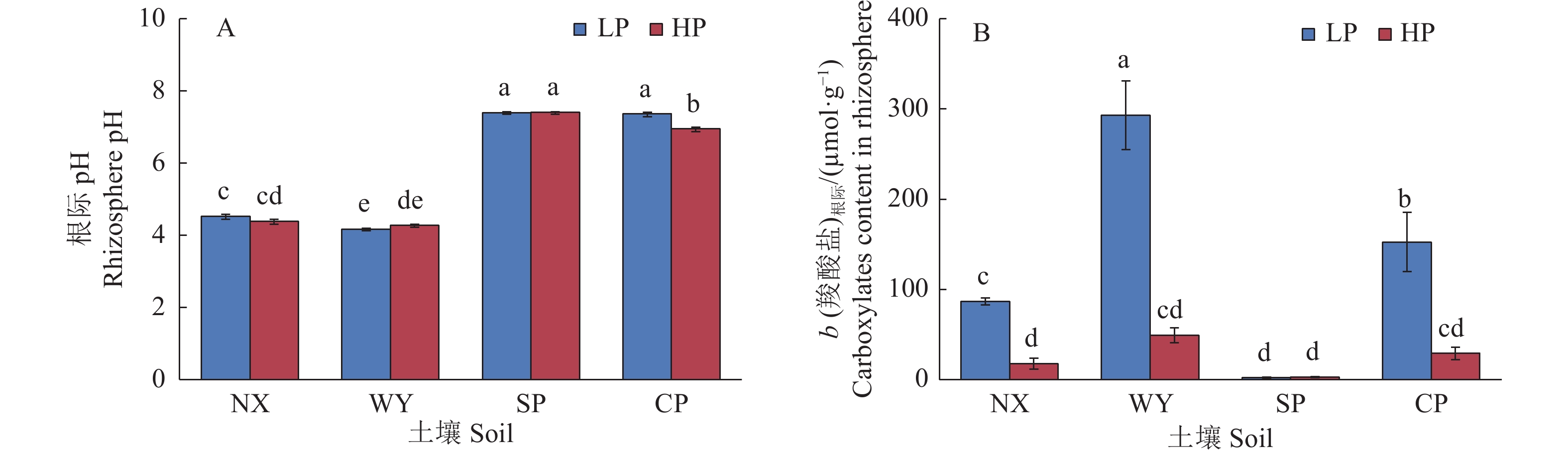
图 5 不同土壤类型和磷处理对玉米根际pH和根际羧酸盐含量的影响
LP:不施磷;HP:施磷;NX:宁西酸性土壤;WY:翁源酸性土壤;SP:三坪石灰性土壤;CP:昌平石灰性土壤;各图中柱上不同小写字母代表不同处理间差异显著(P<0.05,Duncan’s法)
Figure 5. Effects of different soil types and phosphorus treatments on rhizosphere pH and carboxylate content in maize
LP: No P added; HP: P fertilizer added; NX: Acid soil of Ningxi; WY: Acid soil of Wengyuan; SP: Calcareous soil of Sanping; CP: Calcareous soil of Changping; In each figure, different lowercase letters on the column represent significant differences among different treatments (P<0.05, Duncan’s method)
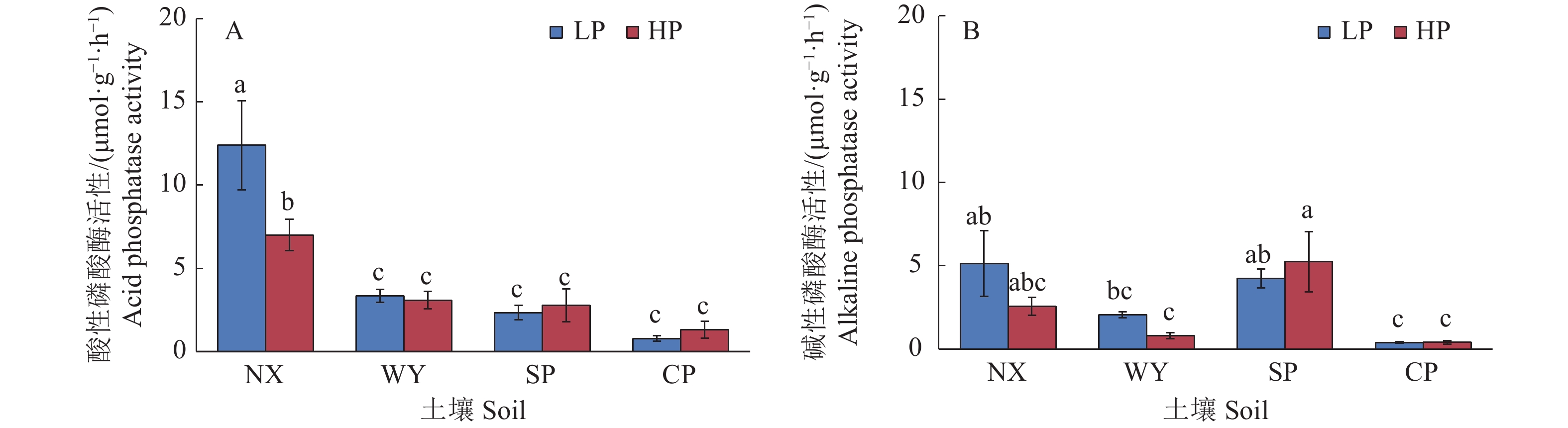
图 6 不同土壤类型和磷处理对玉米根际磷酸酶活性的影响
LP:不施磷;HP:施磷;NX:宁西酸性土壤;WY:翁源酸性土壤;SP:三坪石灰性土壤;CP:昌平石灰性土壤;各图中柱上不同小写字母代表不同处理间差异显著(P<0.05,Duncan’s法)
Figure 6. Effects of different soil types and phosphorus treatments on rhizosphere phosphatase activities in maize
LP: No P added; HP: P fertilizer added; NX: Acid soil of Ningxi; WY: Acid soil of Wengyuan; SP: Calcareous soil of Sanping; CP: Calcareous soil of Changping; In each figure, different lowercase letters on the column represent significant differences among different treatments (P<0.05, Duncan’s method)
表 1 土壤类型(S)和磷处理(P)对玉米植株生长以及根际指标影响的方差分析1)
Table 1 Analysis of variance of effects of soil types (S) and phosphorus treatments (P) on plant growth and rhizosphere indexes in maize
性状(指标) Trait (Indicator) S P S×P 植株干质量 Plant dry weight 261.50*** 632.72*** 16.00*** 植株磷质量 Plant phosphorus weight 16.79*** 632.72*** 1.36*** 总根长 Total root length 2.23ns 145.28*** 9.46*** 根表面积 Root surface area 10.94*** 73.06*** 10.21*** 根体积 Root volume 16.58*** 51.40*** 9.90*** 平均根直径 Average root diameter 64.82*** 59.14*** 16.92*** 菌根侵染率 Mycorrhizal colonization rate 8.25** 181.10*** 23.27*** 根际 pH Rhizosphere pH 1553.68*** 7.54* 5.91** 根际羧酸盐含量 Carboxylate content in rhizosphere 12.57*** 35.30*** 6.56** 根际酸性磷酸酶活性 Acid phosphatase activity in rhizosphere 12.45*** 2.93ns 3.53* 根际碱性磷酸酶活性 Alkaline phosphatase activity in rhizosphere 8.48** 1.01ns 1.25ns 1)“*”:0.01≤P<0.05;“**”:0.001≤P<0.01; “***”:P<0.001; “ns”:不显著
1) “*”: 0.01≤P<0.05; “**”: 0.001≤P<0.01; “***”: P<0.001; “ns”: No significance -
[1] LIU D. Root developmental responses to phosphorus nutrition[J]. Journal of Integrative Plant Biology, 2021, 63(6): 1065-1090. doi: 10.1111/jipb.13090
[2] 吕春香. 玉米种植现状与新技术应用的效率[J]. 农家参谋, 2021(20): 30-31. [3] 孙军兰. 磷肥用量对玉米产量的影响[J]. 农业工程技术, 2022, 42(8): 17. [4] BARBER S, MACKAY A. Root growth and phosphorus and potassium uptake by two corn genotypes in the field[J]. Fertilizer Research, 1986, 10(3): 217-230. doi: 10.1007/BF01049351
[5] 高文龙, 张赢心, 卢英进, 等. 不同磷素用量对玉米生长及生理生化指标的影响[J]. 山东农业科学, 2022, 54(4): 90-94. [6] 赵军霞. 土壤酸碱性与植物的生长[J]. 内蒙古农业科技, 2003(6): 33-42. [7] WANG Y, CHEN Y F, WU W H. Potassium and phosphorus transport and signaling in plants[J]. Journal of Integrative Plant Biology, 2021, 63(1): 34-52. doi: 10.1111/jipb.13053
[8] LYU Y, TANG H, LI H, et al. Major crop species show differential balance between root morphological and physiological responses to variable phosphorus supply[J]. Frontiers in Plant Science, 2016, 7: 1939. doi: 10.3389/fpls.2016.01939
[9] XIA Z, HE Y, ZHU Z, et al. Covariations and trade-offs of phosphorus (P) acquisition strategies in dioecious Populus euphratica as affected by soil water availability[J]. Functional Ecology, 2022, 36(12): 3188-3199. doi: 10.1111/1365-2435.14193
[10] MADRID-DELGADO G, OROZCO-MIRANDA M, CRUZ-OSORIO M, et al. Pathways of phosphorus absorption and early signaling between the mycorrhizal fungi and plants[J]. Phyton-International Journal of Experimental Botany, 2021, 90(5): 1321-1338.
[11] 周文利. 不同品种磷肥对土壤有效磷及玉米苗期生长的影响[J]. 磷肥与复肥, 2022, 37(11): 45-48. doi: 10.3969/j.issn.1007-6220.2022.11.019 [12] HASHMI Z U H, KHAN M J, AKHTAR M, et al. Enhancing phosphorus uptake and yield of wheat with phosphoric acid application in calcareous soil[J]. Journal of the Science of Food and Agriculture, 2017, 97(6): 1733-1739. doi: 10.1002/jsfa.7921
[13] 习娟, 杨修一, 耿计彪, 等. 不同施磷量对盐渍化土壤玉米磷素吸收及产量的影响[J]. 中国土壤与肥料, 2022(7): 58-63. doi: 10.11838/sfsc.1673-6257.21233 [14] 王晓锋, 张磊, 袁兴中. 施磷与接种耐酸根瘤菌对酸性黄壤中紫花苜蓿生长、结瘤的影响[J]. 三峡生态环境监测, 2018, 3(1): 59-65. [15] 王倩倩, 刘志强, 陈康, 等. 不同土壤施磷和接种根瘤菌对大豆| | 玉米间作系统氮磷吸收的影响[J]. 中国生态农业学报(中英文), 2022, 30(12): 1913-1924. doi: 10.12357/cjea.20220124 [16] SARDANS J, PEÑUELAS J, ESTIARTE M. Warming and drought alter soil phosphatase activity and soil P availability in a Mediterranean shrubland[J]. Plant and Soil, 2006, 289(1/2): 227-238.
[17] PEARSE S J, VENEKLAAS E J, CAWTHRAY G R, et al. Carboxylate release of wheat, canola and 11 grain legume species as affected by phosphorus status[J]. Plant and Soil, 2006, 288: 127-139. doi: 10.1007/s11104-006-9099-y
[18] HOCKING P J, JEFFERY S. Cluster-root production and organic acid exudation in a group of old-world lupins and a new-world lupin[J]. Plant and Soil, 2004, 258: 135-150. doi: 10.1023/B:PLSO.0000016544.18563.86
[19] 盛萍萍, 刘润进, 李敏. 丛枝菌根观察与侵染率测定方法的比较[J]. 菌物学报, 2011, 30(4): 519-525. [20] QIAO L, WANG X, SMITH P, et al. Soil quality both increases crop production and improves resilience to climate change[J]. Nature Climate Change, 2022, 12(6): 574-580. doi: 10.1038/s41558-022-01376-8
[21] EREL R, BÉRARD A, CAPOWIEZ L, et al. Soil type determines how root and rhizosphere traits relate to phosphorus acquisition in field-grown maize genotypes[J]. Plant and Soil, 2017, 412: 115-132. doi: 10.1007/s11104-016-3127-3
[22] PEREZ V J C, DE SOUZA J C L, NARRO L A, et al. Genetic effects for maize traits in acid and non-acid soils[J]. Genetics and Molecular Biology, 2008, 31(1): 89-97.
[23] WEN Z H, SHEN J B, BLACKWELL M, et al. Combined applications of nitrogen and phosphorus fertilizers with manure increase maize yield and nutrient uptake via stimulating root growth in a long-term experiment[J]. Pedosphere, 2016, 26(1): 62-73. doi: 10.1016/S1002-0160(15)60023-6
[24] JAFARIKOUHINI N, KAZEMEINI S A, SINCLAIR T R. Sweet corn nitrogen accumulation, leaf photosynthesis rate, and radiation use efficiency under variable nitrogen fertility and irrigation[J]. Field Crops Research, 2020, 257: 107913. doi: 10.1016/j.fcr.2020.107913
[25] RAFAT N, YARNIA M, HASSANPANAH D. Effect of drought stress and potassium humate application on grain yield-related traits of corn (cv. 604)[J]. Journal of Food Agriculture & Environment, 2012, 10(2): 580-584.
[26] NIELSEN K L, ESHEL A, LYNCH J P. The effect of phosphorus availability on the carbon economy of contrasting common bean (Phaseolus vulgaris L.) genotypes[J]. Journal of Experimental Botany, 2001, 52: 329-339.
[27] HERMANS C, HAMMOND J P, WHITE P J, et al. How do plants respond to nutrient shortage by biomass allocation?[J]. Trends in Plant Science, 2006, 11(12): 610-617. doi: 10.1016/j.tplants.2006.10.007
[28] KIRCHGESSER J, HAZARIKA M, BACHMANN-PFABE S, et al. Phenotypic variation of root-system architecture under high P and low P conditions in potato (Solanum tuberosum L.)[J]. BMC Plant Biology, 2023, 23: 68. doi: 10.1186/s12870-023-04070-9
[29] FITTER A H, HELGASON T, HODGE A. Nutritional exchanges in the arbuscular mycorrhizal symbiosis: Implications for sustainable agriculture[J]. Fungal Biology Reviews, 2011, 25(1): 68-72. doi: 10.1016/j.fbr.2011.01.002
[30] 刘灵, 廖红, 王秀荣, 等. 磷有效性对大豆菌根侵染的调控及其与根构型、磷效率的关系[J]. 应用生态学报, 2008, 19(3): 564-568. [31] FAY P, MITCHELL D T, OSBORNE B A. Photosynthesis and nutrient-use efficiency of barley in response to low arbuscular mycorrhizal colonization and addition of phosphorus[J]. The New Phytologist, 1996, 132(3): 425-433. doi: 10.1111/j.1469-8137.1996.tb01862.x
[32] TIAN Y, XU J, LIAN X, et al. Effect of Glomus intraradices on root morphology, biomass production and phosphorous use efficiency of Chinese fir seedlings under low phosphorus stress[J]. Frontiers in Plant Science, 2022, 13: 1095772.
[33] WEN Z H, LI H G, SHEN J B, et al. Maize responds to low shoot P concentration by altering root morphology rather than increasing root exudation[J]. Plant and Soil, 2017, 416: 377-389. doi: 10.1007/s11104-017-3214-0



 下载:
下载: