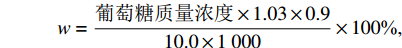Identification of resistant starch related genes in rice by single segment substitution lines
-
摘要:目的
发掘稻米淀粉合成相关基因SBEIIb、SSIIa和ISA1的高抗性淀粉等位基因。
方法利用分子标记筛选携带SBEIIb、SSIIa或ISA1的单片段代换系(Single segment substitution lines,SSSLs),利用改良的AOAC法测定SSSLs材料的抗性淀粉含量(w),通过Sanger测序分析不同SSSLs的SBEIIb、SSIIa和ISA1基因序列,结合基因型和表型连锁分析,鉴定影响抗性淀粉含量的等位基因。
结果SBEIIb编码区的1个SNP(Ex4-96G/A)引起1个氨基酸的替换(196-Arg/His),从而产生2种等位基因SBEIIb-1和SBEIIb-2。其中,SBEIIb-1的Ex4-96G导致第196位氨基酸为Arg,表现为高抗性淀粉含量,为1.72%。SSIIa第8外显子的2个SNPs(Ex8–334G/A和Ex8–865C/T)引起2个氨基酸替换(604-Gly/Ser和781-Leu/Phe),从而产生3种等位基因SSIIa-1、SSIIa-2和SSIIa-3。其中,SSIIa-1的Ex8–334G和Ex8–865C导致第604和781位氨基酸为Gly和Leu,表现为高抗性淀粉含量,为3.37%。ISA1编码区序列的1个Indel(AGG/---)和1个SNP(Ex17–117C/T)导致第70位氨基酸Glu缺失和第717位氨基酸由Thr变为Met,从而产生3种等位基因ISA1-1、ISA1-2和ISA1-3。其中,ISA1-1编码区的AGG插入和Ex17–117C导致第70和717位氨基酸为Glu和Thr,表现为高抗性淀粉含量,为2.09%。
结论SBEIIb、SSIIa和ISA1是影响水稻抗性淀粉形成的重要基因,这3个基因编码区的SNPs和Indels引起了氨基酸的改变,继而影响了抗性淀粉的含量,鉴定到了3个高抗性淀粉含量的等位基因SBEIIb-1、SSIIa-1和ISA1-1。
Abstract:ObjectiveTo discover the alleles for high resistance starch in starch-synthesis-related genes SBEIIb, SSIIa and ISA1.
MethodThe single segment substitution lines (SSSLs) carrying the starch-synthesis-related genes SBEIIb, SSIIa or ISA1 were detected using molecular markers. Then, the resistant starch contents of the SSSLs were measured using an improved AOAC method. Sanger sequencing and sequence alignment were performed to analyze the sequence variations of SBEIIb, SSIIa and ISA1 in different SSSLs. Through linkage analysis of genotypes and phenotypes, the alleles affecting resistance starch content were identified.
ResultFor SBEIIb gene, a single nucleotide polymorphism (SNP) (Ex4-96G/A) in the coding region results in an amino acid substitution (196-Arg/His), generating two alleles SBEIIb-1 and SBEIIb-2. SBEIIb-1 carrying the Ex4-96G causes Arg at 196th residue, which shows high-resistant starch content of 1.72%. For SSIIa gene, two SNPs (Ex8-334G/A and Ex8-865C/T) in the 8th exon cause two amino acid substitutions (604-Gly/Ser and 781-Leu/Phe), generating three alleles SSIIa-1,SSIIa-2 and SSIIa-3. SSIIa-1 carrying the Ex8-334G and Ex8-865C causes Gly and Leu at 604th and 781th residue respectively, which shows high-resistant starch content of 3.37%. One Indel (AGG/---) and one SNP (C/T) in ISA1 coding region sequence generate three alleles ISA1-1, ISA1-2 and ISA1-3. ISA1-1 carrying AGG-insertion and Ex17-117C causes Glu and Thr at 70th and 717th residue respectively, which shows high-resistant starch content of 2.09%.
ConclusionSBEIIb, SSIIa and ISA1 are key genes regulating resistant starch formation in rice. The SNPs and Indels in coding regions of the three genes lead to amino acid variations, which subsequently affects the resistance starch content. The three alleles SBEIIb-1, SSIIa-1 and ISA1-1 for high-resistant starch content are identified.
-
Keywords:
- Rice /
- Single segment substitution line /
- Resistant starch /
- Allele
-
水稻是人类最重要的粮食作物之一,稻米的主要成分是淀粉,为人类提供了丰富的碳水化合物[1]。随着社会经济的发展和生活水平日益提升,高热量食物在饮食中的占比逐渐增大,从而导致高血糖、高血压和肥胖等慢性疾病的发病率越来越高;糖尿病现已成为威胁人类健康的重大疾病之一[2]。抗性淀粉是指不能在人的健康小肠中被消化和吸收的淀粉及其降解物,是一种有益于健康的膳食纤维[3]。抗性淀粉在大肠中可以经过肠道微生物群发酵产生大量对肠道健康有益的短链脂肪酸,以及改善肠道健康。抗性淀粉被认为是一种有益于预防和控制炎症性肠病、Ⅱ型糖尿病和肥胖等慢性疾病的功能性食品[4-6]。目前,大多数水稻品种的抗性淀粉含量(w)低于1%,只有极个别品种的抗性淀粉含量接近3%,籼稻品种的抗性淀粉含量高于粳稻[7-8]。因此,培育高抗性淀粉含量的功能性水稻新品种具有重要的现实意义。
抗性淀粉的形成与水稻胚乳淀粉的生物合成紧密相关,胚乳淀粉是由颗粒结合淀粉合酶、可溶性淀粉合酶、淀粉分支酶和淀粉去分支酶等淀粉合成相关酶协同合成的,抗性淀粉含量同样受到这类酶的调控[9-11]。这些淀粉合成相关酶的活性直接影响了胚乳直链淀粉和支链淀粉的含量以及淀粉分子链的结构特性,表现出不同胚乳淀粉的理化特性,进而影响了抗性淀粉的形成[11-13]。相关研究表明,直链淀粉比例较高的胚乳淀粉消化率低,抗性淀粉含量与直链淀粉含量呈正相关[14]。支链淀粉的链长也是影响抗性淀粉形成的重要因素,抗性淀粉含量与短支链比例呈显著负相关[15],与中长支链比例呈正相关,这是因为中长支链在淀粉晶体结构中形成更稳定的螺旋(B−型淀粉晶体),从而降低淀粉的消化率[15-17]。
SBEIIb基因位于水稻第2号染色体上,编码淀粉分支酶IIb,SBEIIb在淀粉合成过程中支链淀粉簇内的短链形成中起关键作用。‘降糖稻1号’是一个高抗性淀粉水稻突变系,‘降糖稻1号’的SBEIIb的1个SNP引起第599位的Leu突变为Pro,导致SBEIIb酶活性降低,结果促进了抗性淀粉含量的增加[10]。利用CRISPR/Cas9基因编辑获得‘日本晴’和‘IR36’的SBEIIb突变体,其抗性淀粉含量较野生型增加了将近10倍。SBEIIb突变体具有更高的直链淀粉含量及更多的支链淀粉长链,从而具有更高的抗性淀粉含量。SSIIa基因位于水稻第6号染色体上,编码可溶性淀粉合成酶IIa,主要负责合成中等长度的支链淀粉分支,SSIIa第8外显子内有3个SNPs,引起氨基酸的改变,并导致了SSIIa酶活性的变化,进而影响了淀粉的理化性质[13, 18]。ISA1基因位于水稻第8号染色体上,编码淀粉去分支酶,去除α−D−1,6糖苷键,参与支链淀粉的合成,影响了直链淀粉和支链淀粉的比例[19-21]。Bao等[7]通过对105个水稻品种进行全基因组关联分析,鉴定出4个水稻抗性淀粉含量候选基因Wx、SSIIa、ISA1和AGPS1,这些基因都是水稻胚乳淀粉生物合成相关基因。综上,SBEIIb、SSIIa和ISA1等水稻胚乳淀粉合成相关基因对抗性淀粉的影响十分显著,因此发掘这些基因中高抗性淀粉含量的等位基因对功能稻分子育种具有非常重要的意义。
染色体单片段代换系(Single segment substitution line, SSSL)是指在受体遗传背景中只代换供体的某一段染色体片段,其他遗传背景与受体亲本完全一致。SSSL排除了遗传背景的干扰,是复杂性状基因定位、克隆以及挖掘有利等位基因的理想材料[22]。广东省植物分子育种重点实验室以‘华粳籼74(HJX74)’为受体,构建了43个不同供体来源的2360份SSSLs,利用这些SSSLs定位和克隆了很多与水稻产量和品质相关基因,并利用有利等位基因进行分子设计育种,定向改良水稻产量和品质[22]。本研究利用携带淀粉合成相关基因SBEIIb、SSIIa或ISA1的SSSLs,分析SBEIIb、SSIIa或ISA1基因的等位变异与抗性淀粉含量的关系,发掘高抗性淀粉含量等位基因,为高抗性淀粉含量的水稻新品种培育提供理论基础和基因资源。
1. 材料与方法
1.1 试验材料与种植
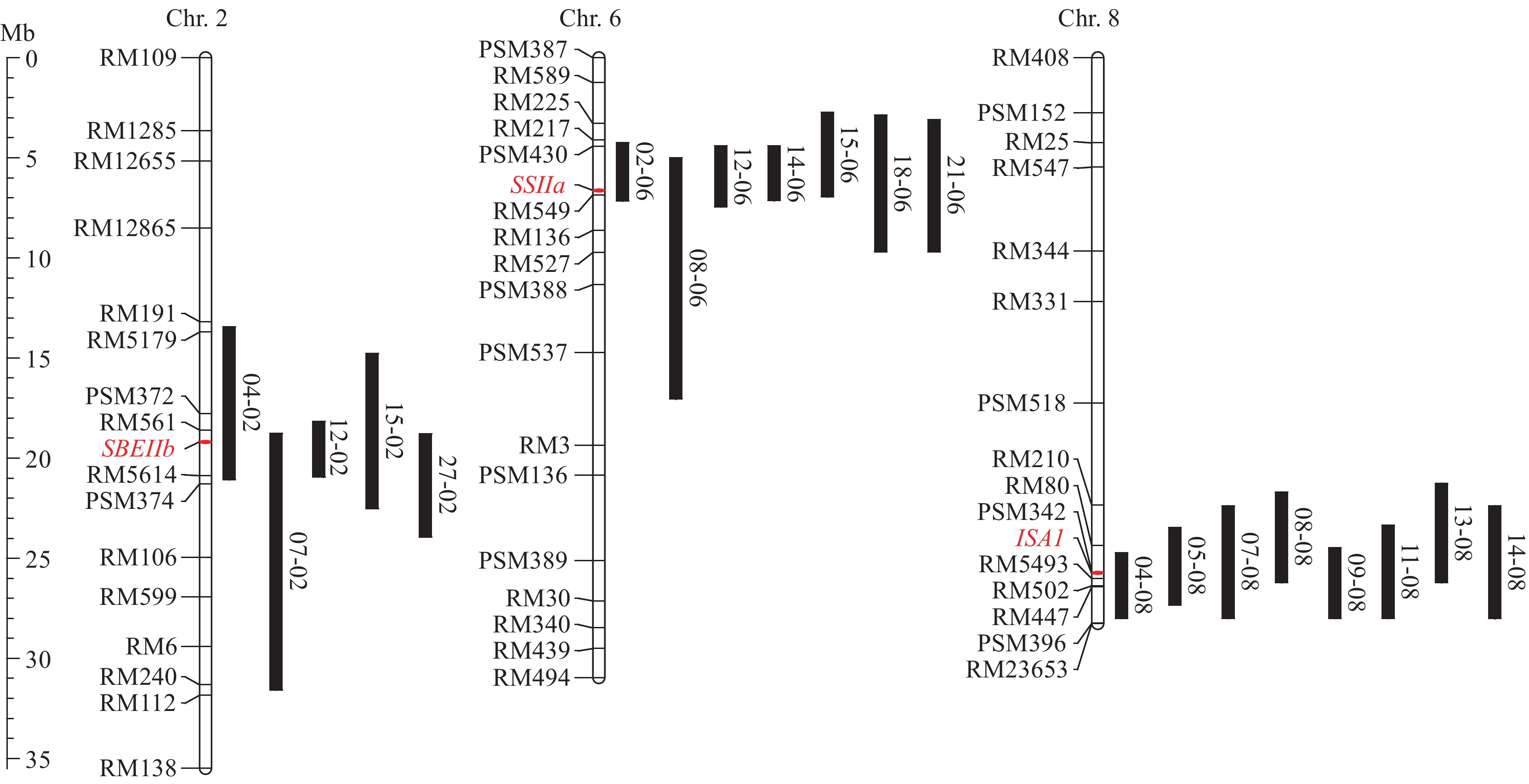
受体亲本‘华粳籼74(HJX74)’是广东省植物分子育种重点实验室培育的华南地区高产籼稻品种;利用HJX74与供体亲本多态性分子标记进行代换片段检测,从HJX74-SSSL文库中筛选到20份SSSLs分别携带淀粉合成相关基因SBEIIb、SSIIa或ISA1,其代换片段来源于不同品种(表1)。所有试验材料于2021年早季(2月下旬至7月上旬)和晚季(7月中旬至11月上旬)在华南农业大学科研农场(中国广州,北纬23°07′ 东经113°15′)种植。每个材料种植3个重复小区,完全随机区组,每个小区2行,每行10株,株距为16.7 cm,单株插秧,根据广州地区的常规栽培管理措施进行田间栽培和病虫害防治。
表 1 用于本研究的单片段代换系信息Table 1. The information of SSSLs used in this study编号
Code单片段代换系名称
SSSL name染色体
Chr.携带的基因
Carrying gene供体亲本
Donor亚种类型
Subspecies04-02 W04-47-61-02-04 2 SBEIIb BG367 籼稻 Indica 07-02 W07-11-06-04-07-03 2 SBEIIb 苏御糯 Suyunuo 粳稻 Japonica 12-02 W12-09-28-04-01-07-01 2 SBEIIb IR58025B 籼稻 Indica 15-02 W15-12-10-11-07 2 SBEIIb American Jasmine 籼稻 Indica 27-02 W27-18-05-08-01 2 SBEIIb IAPAR9 粳稻 Japonica 02-06 W02-15-01-08-02-05 6 SSIIa Amol 3 籼稻 Indica 08-06 W08-18-09-09-06-02 6 SSIIa IR64 籼稻 Indica 12-06 W12-42-42-08-02-04-02 6 SSIIa IR58025B 籼稻 Indica 14-06 W14-12-03-06-04-08 6 SSIIa 联鉴33 Lianjian33 籼稻 Indica 15-06 W15-06-06-21 6 SSIIa American Jasmine 籼稻 Indica 18-06 W18-11-01-02-06-06-04 6 SSIIa IRAT 261 粳稻 Japonica 21-06 W21-23-36-06-07-04-06 6 SSIIa IR65598 粳稻 Japonica 04-08 W04-10-04-10-07-06 8 ISA1 BG367 籼稻 Indica 05-08 W05-36-75-01-01-06 8 ISA1 籽恢100 Zihui100 籼稻 Indica 07-08 W07-18-05-01-09-03-05 8 ISA1 苏御糯 Suyunuo 粳稻 Japonica 08-08 W08-15-06-05-11 8 ISA1 IR64 籼稻 Indica 09-08 W09-38-60-07-07-11-06 8 ISA1 Basmati 385 籼稻 Indica 11-08 W11-15-08-09-04 8 ISA1 Basmati 370 籼稻 Indica 13-08 W13-30-45-01-10-02-06 8 ISA1 江西丝苗 Jiangxisimiao 籼稻 Indica 14-08 W14-09-06-09-12 8 ISA1 联鉴33 Lianjian33 籼稻 Indica 1.2 SSSLs的代换片段检测和目标基因测序分析
秧苗移栽10 d后,针对20个SSSLs以及受体亲本HJX74和供体亲本,每种材料取5个单株的幼叶,采用CTAB法提取基因组DNA。以合格的DNA样品作为模板,利用SSR标记进行PCR扩增,利用60 g/L的聚丙烯酰胺凝胶电泳分离PCR产物,银染显影后,以受体亲本HJX74和供体亲本为对照,根据SSR的带型来确定SSSLs的代换片段位置及长度。然后,根据目标基因的位置,筛选出分别携带SBEIIb、SSIIa或ISA1的SSSLs。
以‘日本晴’基因组序列为参考序列,利用引物设计软件Primer3Plus对SBEIIb、SSIIa和ISA1基因序列分别设计特异扩增引物,然后利用PCR扩增HJX74和SSSLs上的目标基因,将测序引物和HJX74及SSSLs目标基因的PCR产物送至擎科生物公司进行测序,利用SeqMan软件进行序列拼接和比对分析。
1.3 抗性淀粉含量的测定
利用改良的AOAC法[9]测定水稻抗性淀粉含量,具体步骤如下:1)取0.01 g干燥米粉与0.4 mL混合工作液(10 mg/mL胰α−淀粉酶、3 U/mL淀粉葡萄糖苷酶)充分混匀后,在37 ℃恒温震荡摇床中孵育12 h(200 r/min);2)加入0.4 mL无水乙醇充分混匀后离心10 min(13000 r/min,4 ℃);3)倒去上清液,加入0.8 mL体积分数为 50%的乙醇溶液充分混匀后离心10 min(13000 r/min,4 ℃);4)重复步骤3) 1次,倒尽上清液后烘干沉淀;5)加入钢珠和2 mol/L的KOH溶液0.2 mL碾磨60 s,冷却10 min后再次碾磨60 s;6)加入0.8 mL醋酸钠缓冲液(1.2 mol/L,pH = 3.8)和0.01 mL 淀粉葡萄糖苷酶溶液(1650 U/mL),在50 ℃水浴中孵育30 min,每隔10 min摇匀1次;7)离心10 min(13000 r/min,4 ℃),收集上清液;8)利用GOPOD法测定上清液中的葡萄糖质量浓度,再用如下公式计算样品抗性淀粉含量(w)。
$$ w = \dfrac{\mathrm{葡}\mathrm{萄}\mathrm{糖}\mathrm{质量浓}\mathrm{度}\times 1.03\times 0.9}{10.0\times 1\;000}\times 100\mathrm{{\text{%}}}, $$ 式中:葡萄糖质量浓度单位为µg/mL;1.03为溶液体积,单位为mL;0.9为淀粉的水解系数;10.0为样品的质量,单位为mg;1000是将样品质量单位mg转变为µg的转换系数。
1.4 数据分析和作图
利用Microsoft Excel 2016和SPSS 23.0进行数据收集和统计分析;用MapChart、Origin 2018 、Microsoft PowerPiont 2016和Adobe Illustrator 2018进行绘图。采用Dunnett’s t-test比较分析每个SSSLs抗性淀粉含量与对照HJX74的差异显著性;采用Duncan’s法多重比较分析携带同一基因座的不同SSSLs间的抗性淀粉含量差异显著性。利用SMART数据库(http://smart.embl-heidelberg.de/)预测蛋白的功能结构域,利用SWISS-MODEDL数据库(https://swissmodel.expasy.org/)进行蛋白的三维同源性建模绘图。
2. 结果与分析
2.1 携带SBEIIb、SSIIa或ISA1的SSSLs鉴定及抗性淀粉含量分析
2021年早季对筛选到的20份分别携带了不同供体来源的SBEIIb、SSIIa或ISA1的SSSLs的代换片段进行检测分析。其中:5份SSSLs(04-02、07-02、12-02、15-02和27-02)的代换片段位于第2号染色体上,与SBEIIb基因座位重叠,这5份SSSLs的代换片段长度分别为7.64、12.81、2.77、7.74和5.17 Mb(图1);7份SSSLs(02-06、08-06、12-06、14-06、15-06、18-06和21-06)的代换片段位于第6号染色体上,与SSIIa基因座位重叠,这7份SSSLs的代换片段长度分别为2.92、12.05、3.03、2.73、4.22、6.82和6.59 Mb(图1);8份SSSLs(04-08、05-08、07-08、08-08、09-08、11-08、13-08和14-08)的代换片段位于第8号染色体上,与ISA1基因座位重叠,这8份SSSLs的代换片段长度分别为3.28、3.86、5.63、4.54、3.53、4.66、4.97和5.64 Mb(图1)。
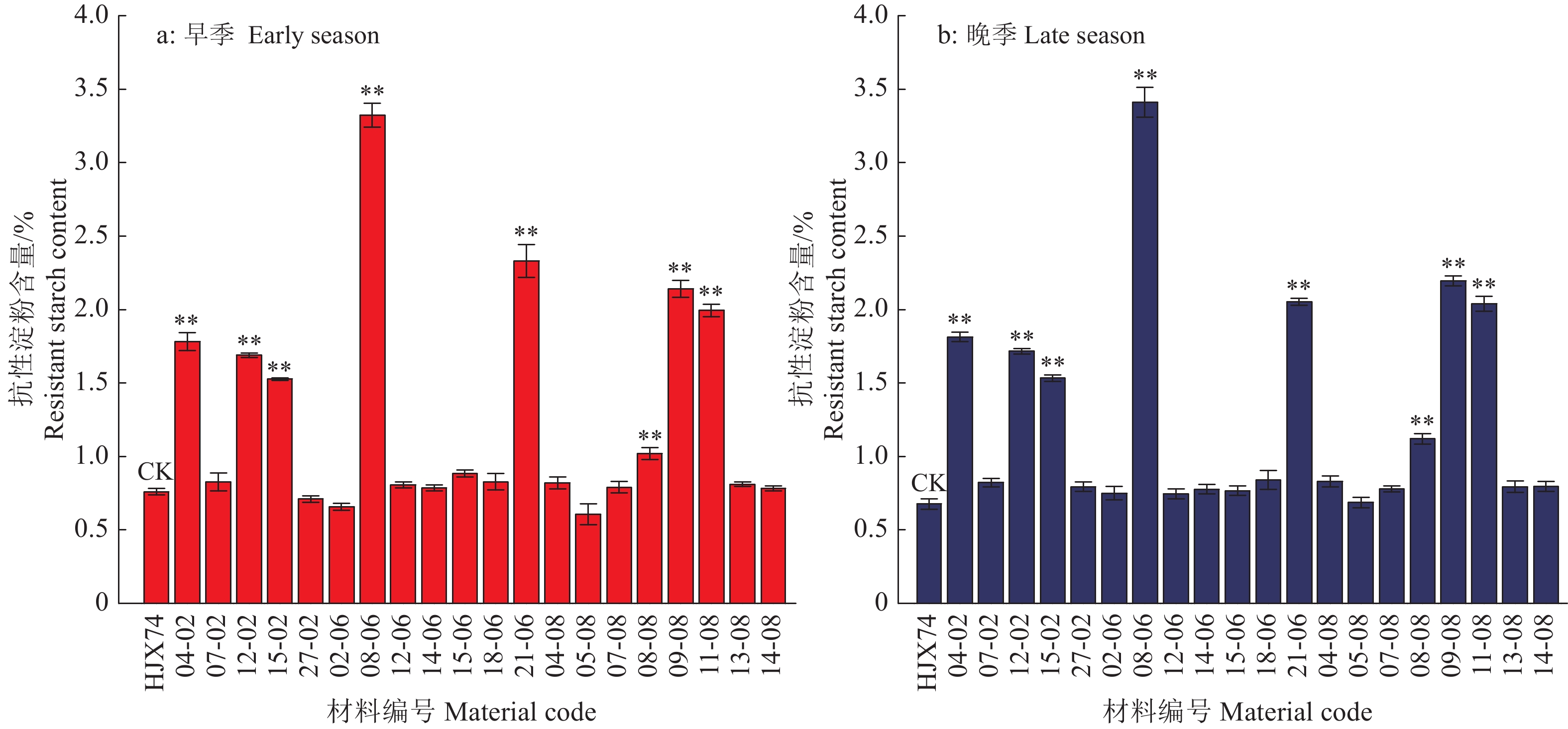
在2021年早季和晚季,分别对这20份SSSLs和HJX74进行抗性淀粉含量检测分析。HJX74在早季和晚季的抗性淀粉含量分别为0.76%和0.68%,20份SSSLs的抗性淀粉含量的差异很大,在早季和晚季的变异范围分别为0.61%~3.32%和0.67%~3.41%。其中,12份SSSLs的抗性淀粉含量与HJX74一样低,没有显著差异;8份SSSLs(04-02、12-02、15-02、08-06、21-06、08-08、09-08和11-08)的抗性淀粉含量都极显著高于HJX74,在早季和晚季分别在1.02%~3.32%和1.12%~3.41%(图2)。结果表明,这20份SSSLs的抗性淀粉含量存在丰富的变异,SBEIIb、SSIIa和ISA1基因影响稻米抗性淀粉的形成,不同供体来源的SBEIIb、SSIIa和ISA1对抗性淀粉含量的影响差异很大。
![]() 图 2 分别携带SBEIIb、SSIIa和ISA1的SSSLs的抗性淀粉含量“**”表示SSSLs的抗性淀粉含量与受体亲本HJX74差异显著(P < 0.01,Dunnett’s t 测验,n = 3)Figure 2. The resistant starch contents of the SSSLs carrying SBEIIb, SSIIa and ISA1, respectively“**” represents significant difference of the resistant starch between SSSLs and recipient HJX74 (P < 0.01, Dunnett’s t-test, n = 3)
图 2 分别携带SBEIIb、SSIIa和ISA1的SSSLs的抗性淀粉含量“**”表示SSSLs的抗性淀粉含量与受体亲本HJX74差异显著(P < 0.01,Dunnett’s t 测验,n = 3)Figure 2. The resistant starch contents of the SSSLs carrying SBEIIb, SSIIa and ISA1, respectively“**” represents significant difference of the resistant starch between SSSLs and recipient HJX74 (P < 0.01, Dunnett’s t-test, n = 3)2.2 SBEIIb的等位变异对抗性淀粉含量的影响
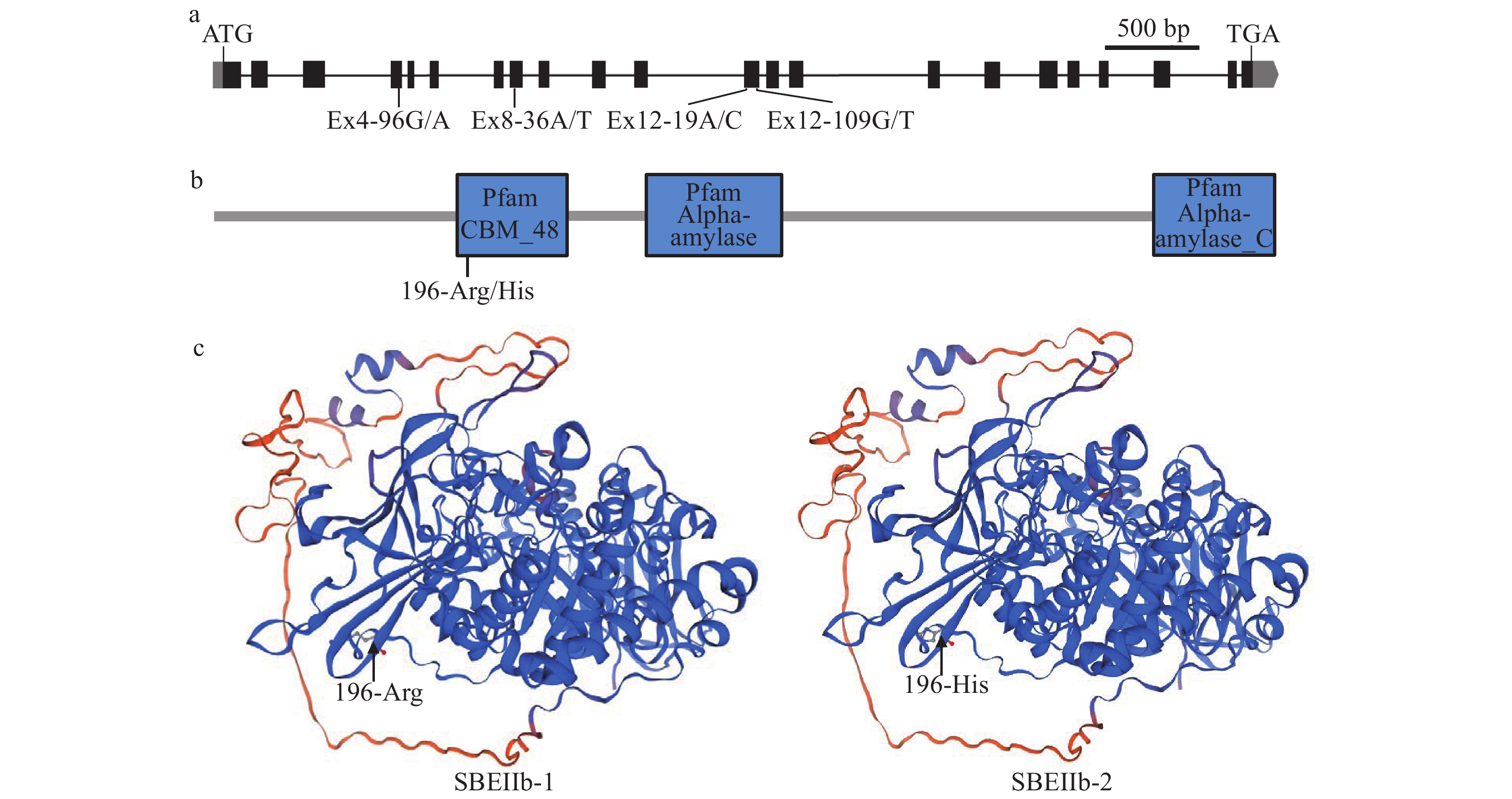
对HJX74和位于第2号染色体上的5份SSSLs(04-02、07-02、12-02、15-02和27-02)的SBEIIb基因序列进行测序分析。结果发现,HJX74和这5份SSSLs在SBEIIb的编码区序列中存在4个单核苷酸差异(SNPs),可分为3种单倍型。4个SNPs中,只有位于第4外显子的第96碱基由G变为A,导致第196位氨基酸由Arg变为His。结合HJX74和5份SSSLs的SBEIIb基因序列和表型变异连锁分析,可将这6个材料的3种单倍型分为2种等位基因,分别为SBEIIb-1和SBEIIb-2。携带SBEIIb-1的04-02、12-02和15-02的抗性淀粉含量在1.63%~1.82%之间;携带SBEIIb-2的HJX74、07-02和27-02的抗性淀粉含量在0.72%~0.82%之间(表2、图3a)。结果表明,SBEIIb-1的抗性淀粉含量显著高于SBEIIb-2。SBEIIb蛋白有3个功能结构域CBM_48、Alpha-amylase和Alpha-amylase_C,功能域CBM_48具有水解酶活性功能,196-Arg/His氨基酸变异位于功能域CBM_48中,可能影响了SBEIIb酶活性(图3b)。SBEIIb-1和SBEIIb-2编码的两个等位变异蛋白的三级结构没有差异(图3c)。
表 2 SSSLs中的不同SBEIIb等位基因的基因型和表型Table 2. Genotypes and phenotypes of different SBEIIb alleles in SSSLs编号
CodeEx4-96
(P.196)Ex8-36
(P.270)Ex12-19
(P.412)Ex12-109
(P.442)单倍型
Haplotype等位基因
Allelew(抗性淀粉)1)/%
Resistant starch content04-02 CGC (Arg) TCA (Ser) ACA (Thr) CTG (Leu) HT-1 SBEIIb-1 1.82±0.03A 12-02 CGC (Arg) TCA (Ser) ACA (Thr) CTG (Leu) HT-1 SBEIIb-1 1.71±0.01A 15-02 CGC (Arg) TCA (Ser) ACA (Thr) CTG (Leu) HT-1 SBEIIb-1 1.63±0.05A HJX74 CAC (His) TCA (Ser) ACA (Thr) CTG (Leu) HT-2 SBEIIb-2 0.72±0.03B 07-02 CAC (His) TCT (Ser) ACC (Thr) CTT (Leu) HT-3 SBEIIb-2 0.82±0.03B 27-02 CAC (His) TCT (Ser) ACC (Thr) CTT (Leu) HT-3 SBEIIb-2 0.75±0.03B 1) 抗性淀粉含量数据为早、晚季的平均值±标准误(n = 6);该列数据后的不同大写字母表示显著差异(P < 0.01,Duncan’s法)
1) The data of resistant starch content are represented as mean ± SE of the early and late seasons (n = 6); Different uppercase letters of this column indicate significant differences (P < 0.01, Duncan’s test)![]() 图 3 SSSLs中的SBEIIb等位变异a:SBEIIb的基因结构示意图;b:SBEIIb蛋白的功能结构域示意图;c:SBEIIb的等位变异蛋白的三维同源性建模Figure 3. The allelic variations of SBEIIb in SSSLsa: Gene structure schematic of SBEIIb; b:The schematic illustration of SBEIIb protein functional domains; c: Three-dimensional homology modeling of allelic variant proteins of SBEIIb
图 3 SSSLs中的SBEIIb等位变异a:SBEIIb的基因结构示意图;b:SBEIIb蛋白的功能结构域示意图;c:SBEIIb的等位变异蛋白的三维同源性建模Figure 3. The allelic variations of SBEIIb in SSSLsa: Gene structure schematic of SBEIIb; b:The schematic illustration of SBEIIb protein functional domains; c: Three-dimensional homology modeling of allelic variant proteins of SBEIIb2.3 SSIIa的等位变异影响抗性淀粉含量
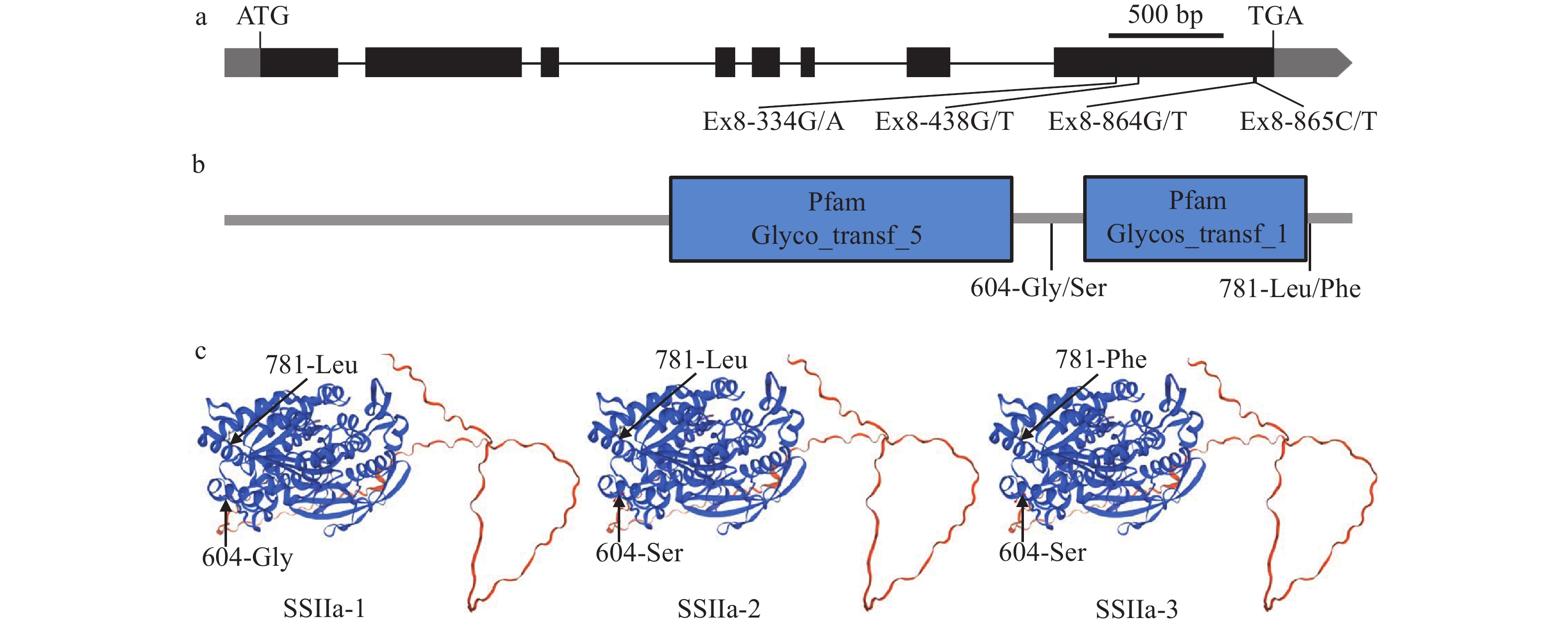
对HJX74和位于第6号染色体上的7份SSSLs(02-06、08-06、12-06、14-06、15-06、18-06和21-06)的SSIIa基因序列进行测序分析。结果发现HJX74和这7份SSSLs在SSIIa的第8外显子中有4个SNPs,即G/A、G/T、G/T和C/T,可分为3种单倍型。在第8外显子的4个SNPs中,位于第334碱基由G变为A,导致第604位氨基酸由Gly变为Ser;位于第865碱基由C变为T,导致第781位氨基酸由Leu变为Phe。结合HJX74和7份SSSLs的SSIIa基因序列和表型变异连锁分析,可将这8个材料的3种单倍型分为3种等位基因,分别为SSIIa-1、SSIIa-2和SSIIa-3。携带SSIIa-1等位基因的08-06抗性淀粉含量为3.37%,显著高于其他材料;携带SSIIa-2等位基因的21-06抗性淀粉含量次之,为2.19%;携带SSIIa-3等位基因的02-06、12-06、14-06、15-06、18-06和HJX74的抗性淀粉含量最低,在0.71%~0.83%之间(表3、图4a)。SSIIa蛋白有2个功能结构域Glyco_transf_5和Glycos_transf_1,Glyco_transf_5为淀粉合成酶的催化结构域,Glycos_transf_1具有糖基转移酶的作用,604-Gly/Ser位于2个功能域之间,781-Leu/Phe紧挨着功能域Glycos_transf_1的C端(图4b)。SSIIa-1、SSIIa-2和SSIIa-3编码的3个等位变异蛋白的三级结构没有差异(图4c)。
表 3 SSSLs中的不同SSIIa等位基因的基因型和表型Table 3. Genotypes and phenotypes of different SSIIa alleles in SSSLs编号
CodeEx8-334
(P.604)Ex8-438
(P.638)Ex8-864
(P.780)Ex8-865
(P.781)单倍型
Haplotype等位基因
Allelew(抗性淀粉)1)/%
Resistant starch content08-06 GGC (Gly) GGG (Gly) GGG (Gly) CTC (Leu) HT-1 SSIIa-1 3.37±0.06A 21-06 AGC (Ser) GGT (Gly) GGG (Gly) CTC (Leu) HT-2 SSIIa-2 2.19±0.08B 02-06 AGC (Ser) GGT (Gly) GGT (Gly) TTC (Phe) HT-3 SSIIa-3 0.71±0.03C 12-06 AGC (Ser) GGT (Gly) GGT (Gly) TTC (Phe) HT-3 SSIIa-3 0.77±0.02C 14-06 AGC (Ser) GGT (Gly) GGT (Gly) TTC (Phe) HT-3 SSIIa-3 0.78±0.02C 15-06 AGC (Ser) GGT (Gly) GGT (Gly) TTC (Phe) HT-3 SSIIa-3 0.82±0.03C 18-06 AGC (Ser) GGT (Gly) GGT (Gly) TTC (Phe) HT-3 SSIIa-3 0.83±0.04C HJX74 AGC (Ser) GGT (Gly) GGT (Gly) TTC (Phe) HT-3 SSIIa-3 0.72±0.03C 1) 抗性淀粉含量数据为早、晚季的平均值±标准误(n = 6);该列数据后的不同大写字母表示显著差异(P < 0.01,Duncan’s法)
1) The data of resistant starch content are represented as mean ± SE of the early and late seasons (n = 6); Different uppercase letters of this column indicate significant differences (P < 0.01, Duncan’s test)![]() 图 4 SSSLs中的SSIIa等位变异a:SSIIa的基因结构示意图;b:SSIIa蛋白的功能结构域示意图;c:SSIIa的等位变异蛋白的三维同源性建模Figure 4. The allelic variations of SSIIa in SSSLsa: Gene structure schematic of SSIIa; b:The schematic illustration of SSIIa protein functional domains; c: Three-dimensional homology modeling of allelic variant proteins of SSIIa
图 4 SSSLs中的SSIIa等位变异a:SSIIa的基因结构示意图;b:SSIIa蛋白的功能结构域示意图;c:SSIIa的等位变异蛋白的三维同源性建模Figure 4. The allelic variations of SSIIa in SSSLsa: Gene structure schematic of SSIIa; b:The schematic illustration of SSIIa protein functional domains; c: Three-dimensional homology modeling of allelic variant proteins of SSIIa2.4 ISA1的等位变异及对抗性淀粉含量的影响
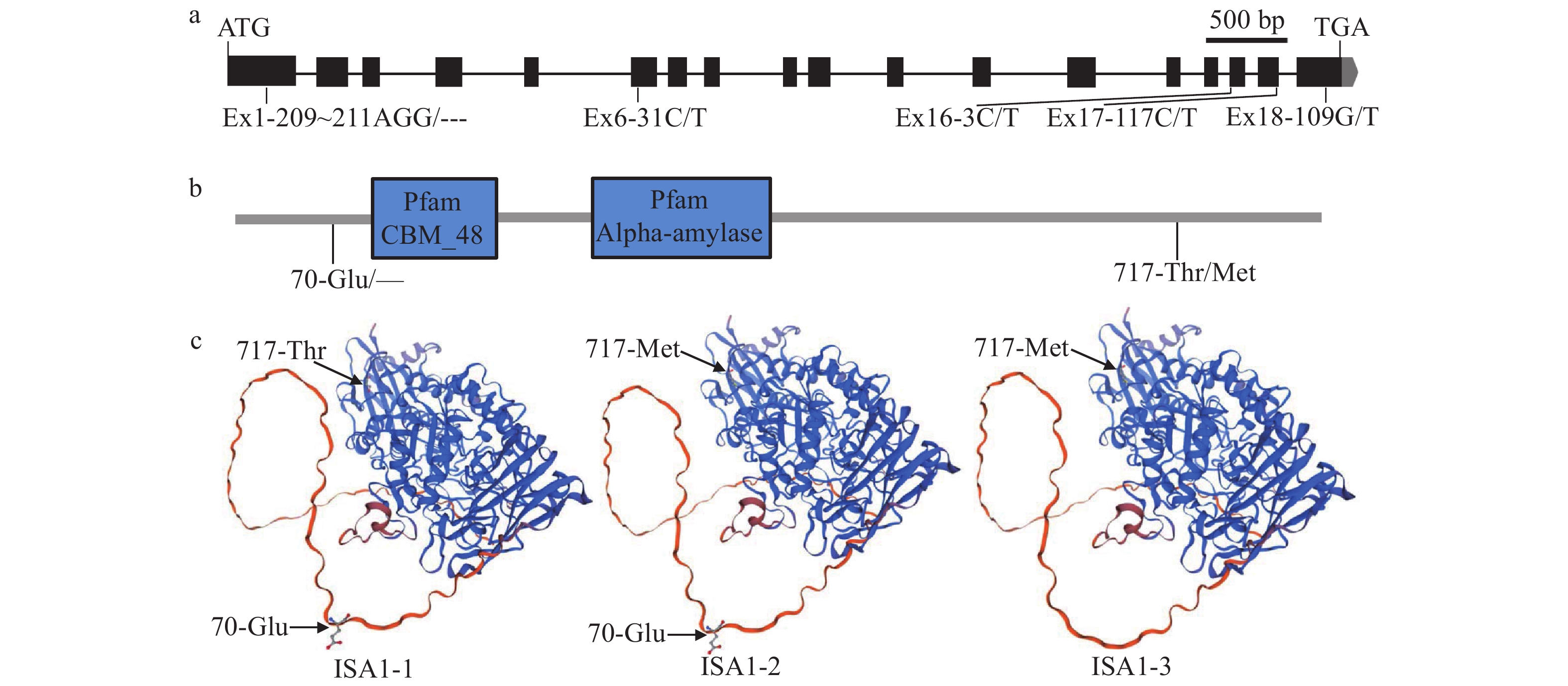
对HJX74和位于第8号染色体的8份SSSLs(04-08、05-08、07-08、08-08、09-08、11-08、13-08和14-08)的ISA1基因序列进行测序分析。结果发现HJX74和这8份SSSLs的ISA1编码区序列存在1个Indel和4个SNPs,即AGG/---、C/T、C/T、C/T和G/T,可分为4种单倍型。第1外显子的第209~211的3个碱基缺失,导致第70位氨基酸Glu缺失;位于第17外显子的第117碱基由C变为T,导致第717位氨基酸由Thr变为Met。结合HJX74和这8份SSSLs的ISA1基因序列和表型变异连锁分析,可将这9个材料的4种单倍型分为3种等位基因,分别为ISA1-1、ISA1-2和ISA1-3。携带ISA1-1等位基因的09-08和11-08抗性淀粉含量分别为2.17%和2.02%,显著高于其他材料;携带ISA1-2等位基因的08-08抗性淀粉含量为1.07%;携带ISA1-3等位基因的05-08、13-08、14-08、04-08、07-08和HJX74的抗性淀粉含量在0.65%~0.83%之间(表4、图5a)。ISA1蛋白有2个功能结构域CBM_48和Alpha-amylase,CBM_48具有水解酶活性,Alpha-amylase是催化活性功能域,70-Glu/—紧挨着功能域CBM_48的N端,717-Thr/Met位于ISA1蛋白的C端(图5b)。ISA1-3编码的蛋白缺失了1个氨基酸Glu,与ISA1-1、ISA1-2编码的等位变异蛋白的三级结构有略微差异(图5c)。
表 4 SSSLs中的不同ISA1等位基因的基因型和表型Table 4. Genotypes and phenotypes of different ISA1 alleles in SSSLs编号
CodeEx1-209~211
(P.70~71)Ex6-31
(P.336)Ex16-3
(P.353)Ex17-117
(P.717)Ex18-109
(P.777)单倍型
Haplotype等位基因
Allelew(抗性淀粉)1)/%
Resistant starch content09-08 GAGGGT (Glu-Gly) AAC (Asn) GTC (Val) ACG (Thr) CTG (Leu) HT-1 ISA1-1 2.17±0.03A 11-08 GAGGGT (Glu-Gly) AAC (Asn) GTC (Val) ACG (Thr) CTG (Leu) HT-1 ISA1-1 2.02±0.04A 08-08 GAGGGT (Glu-Gly) AAT (Asn) GTT (Val) ATG (Met) CTG (Leu) HT-2 ISA1-2 1.07±0.03B HJX74 G---GT (Gly) AAT (Asn) GTT (Val) ATG (Met) CTG (Leu) HT-3 ISA1-3 0.72±0.03C 05-08 G---GT (Gly) AAT (Asn) GTT (Val) ATG (Met) CTG (Leu) HT-3 ISA1-3 0.65±0.04C 13-08 G---GT (Gly) AAT (Asn) GTT (Val) ATG (Met) CTG (Leu) HT-3 ISA1-3 0.81±0.02C 14-08 G---GT (Gly) AAT (Asn) GTT (Val) ATG (Met) CTG (Leu) HT-3 ISA1-3 0.79±0.03C 04-08 G---GT (Gly) AAT (Asn) GTT (Val) ATG (Met) CTT (Leu) HT-4 ISA1-3 0.83±0.02C 07-08 G---GT (Gly) AAT (Asn) GTT (Val) ATG (Met) CTT (Leu) HT-4 ISA1-3 0.77±0.02C 1) 抗性淀粉含量数据为早、晚季的平均值±标准误(n = 6);该列数据后的不同大写字母表示显著差异(P < 0.01,Duncan’s法)
1) The data of resistant starch content are represented as mean ± SE of the early and late seasons (n = 6); Different uppercase letters of this column indicate significant differences (P < 0.01, Duncan’s test)![]() 图 5 SSSLs中的ISA1等位变异a:ISA1的基因结构示意图;b:ISA1蛋白的功能结构域示意图;c:ISA1的等位变异蛋白的三维同源性建模Figure 5. The allelic variations of ISA1 in SSSLsa: Gene structure schematic of ISA1; b:The schematic illustration of ISA1 protein functional domains; c: Three-dimensional homology modeling of allelic variant proteins of ISA1
图 5 SSSLs中的ISA1等位变异a:ISA1的基因结构示意图;b:ISA1蛋白的功能结构域示意图;c:ISA1的等位变异蛋白的三维同源性建模Figure 5. The allelic variations of ISA1 in SSSLsa: Gene structure schematic of ISA1; b:The schematic illustration of ISA1 protein functional domains; c: Three-dimensional homology modeling of allelic variant proteins of ISA13. 讨论与结论
前人利用突变体材料研究表明,SBEIIb、SSIIa和ISA1等水稻胚乳淀粉生物合成相关基因影响了胚乳淀粉的理化性质,进而影响了抗性淀粉的形成[10-11, 14, 23]。本研究利用HJX74-SSSL文库材料筛选到20份SSSLs分别携带了供体来源的SBEIIb、SSIIa或ISA1的基因座位。这20份SSSLs的抗性淀粉含量在0.61%~3.41%之间,其中有8份SSSLs的抗性淀粉含量显著高于HJX74,在1.02%~3.41%之间,表现出高抗性淀粉含量。综上结果表明,淀粉生物合成相关基因SBEIIb、SSIIa和ISA1与抗性淀粉含量密切相关,而且存在不同的自然等位变异,影响抗性淀粉含量。SBEIIb对支链淀粉短链的合成至关重要,同时也是影响抗性淀粉形成的关键基因[24-25]。很多研究者利用T-DNA或CRISPR/Cas9等技术获得SBEIIb功能缺失的高抗性淀粉突变体,SBEIIb酶活性丧失,使得支链淀粉短链合成受阻,导致直链淀粉含量显著增加,中长支链淀粉链比例增加,继而导致抗性淀粉含量增加10倍左右,说明SBEIIb负调控抗性淀粉含量[12, 26-28]。本研究鉴定到2种影响抗性淀粉含量的SBEIIb等位基因SBEIIb-1和SBEIIb-2。SBEIIb-1和SBEIIb-2在第4外显子的第96碱基G/A突变,引起196-Arg变为196-His,196-Arg/His位于功能域CBM_48,与水解酶活性相关。196-Arg可能导致SBEIIb-1酶活性降低,支链淀粉短链比例降低,继而提高抗性淀粉含量。
SSIIa基因编码可溶性淀粉合成酶IIa,是一个控制稻米糊化温度的主效基因(ALK)[29]。根据第8外显子的2个SNPs(G/A和C/T)将ALK分为3种等位基因,ALKa(A-C)和ALKb(G-T)等位基因编码的SSIIa酶具有约10%的活性,而ALKc(G-C)等位基因编码强活性的SSIIa酶,2个SNPs影响了SSIIa酶活性[29-30]。SSIIa酶负责合成支链淀粉中的中长分支,中长支链比例高的淀粉更容易形成高结晶度的淀粉晶体(B−型淀粉晶体),很难被消化降解,进而增加抗性淀粉含量[7, 11, 31]。本研究鉴定到SSIIa的3种等位基因SSIIa-1、SSIIa-2和SSIIa-3影响抗性淀粉含量,这3个等位基因在第8外显子存在2个SNPs(Ex8-334G/A和Ex8–865C/T)引起2个氨基酸的序列变异(604-Gly/Ser和781-Leu/Phe)。其中,SSIIa-1的Ex8-334G和Ex8-865C导致第604和781位氨基酸分别为Gly和Leu,表现为高抗性淀粉含量,为3.37%。以上结果表明,2个位点(604-Gly/Ser和781-Leu/Phe)的氨基酸变异影响了抗性淀粉的含量。781-Leu/Phe紧挨着功能域Glycos_transf_1的C端。有研究表明,781-Leu/Phe是影响SSIIa酶催化活性的关键位点,781-Leu的酶活性显著高于781-Phe;604-Gly/Ser对SSIIa酶催化活性起到修饰作用,604-Gly的酶活性要略高于604-Ser[32]。SSIIa-1表现出高抗性淀粉含量,可能是因为SSIIa-1编码的SSIIa酶(604-Gly和781-Leu)具有较强的催化活性,促进了支链淀粉中的中长链比例显著增加,继而导致抗性淀粉含量增加。
Bao等[7]通过全基因组关联分析,鉴定到抗性淀粉相关候选基因ISA1。ISA1编码淀粉去分支酶,去除α−D−1,6−糖苷键,影响和修饰支链淀粉的链长分布和分子特性,增加了直链淀粉和支链淀粉的比例,从而影响抗性淀粉的含量,进而推测ISA1与抗性淀粉有关[7, 21, 23]。本研究鉴定到ISA1的3种等位基因ISA1-1、ISA1-2和ISA1-3,其抗性淀粉含量分别为2.09%、1.07%和0.76%。这3个等位基因编码区序列的1个Indel(AGG/---)和1个SNP(Ex17-117C/T),导致第70位氨基酸Glu缺失和第717位氨基酸由Thr变为Met,ISA1蛋白N端的70-Glu缺失引起了蛋白三级结构的微小差异。ISA1-1编码区的AGG插入和Ex17-117C导致第70和717位氨基酸为Glu和Thr,表现为高抗性淀粉含量。综上结果表明,ISA1的2个变异位点Indel(AGG/---)和SNP(Ex17-117C/T)都影响了ISA1蛋白功能,进而影响抗性淀粉含量,产生3种不同的等位基因。
目前,大多数水稻品种的抗性淀粉含量低于1%,只有极个别品种的抗性淀粉含量能接近3%[7, 33]。近年来,通过理化诱变、RNA干扰和基因编辑技术创制了多个与SBEIIa、SBEIIb和SSIIIa等淀粉合成相关基因突变的高抗性淀粉材料和品系,其抗性淀粉含量大都在10% 左右,高抗性淀粉突变体材料往往表现出产量低和较差的蒸煮食味品质,很难直接应用于培育新品种[10-12, 14]。广东省植物分子育种重点实验室已构建了HJX74-SSSL分子设计育种平台,设计聚合了不同优异性状的等位基因,培育了多个高产、优质和多抗的新品种(系)[22]。因此,基于HJX74-SSSL分子设计育种平台,利用本研究鉴定到的3个自然变异的高抗性淀粉含量的等位基因SBEIIb-1、SSIIa-1和ISA1-1对高产、优质和多抗的水稻品种(系)再进行定向改良,将是培育高抗性淀粉含量水稻新品种的有效途径。
-
图 2 分别携带SBEIIb、SSIIa和ISA1的SSSLs的抗性淀粉含量
“**”表示SSSLs的抗性淀粉含量与受体亲本HJX74差异显著(P < 0.01,Dunnett’s t 测验,n = 3)
Figure 2. The resistant starch contents of the SSSLs carrying SBEIIb, SSIIa and ISA1, respectively
“**” represents significant difference of the resistant starch between SSSLs and recipient HJX74 (P < 0.01, Dunnett’s t-test, n = 3)
图 3 SSSLs中的SBEIIb等位变异
a:SBEIIb的基因结构示意图;b:SBEIIb蛋白的功能结构域示意图;c:SBEIIb的等位变异蛋白的三维同源性建模
Figure 3. The allelic variations of SBEIIb in SSSLs
a: Gene structure schematic of SBEIIb; b:The schematic illustration of SBEIIb protein functional domains; c: Three-dimensional homology modeling of allelic variant proteins of SBEIIb
图 4 SSSLs中的SSIIa等位变异
a:SSIIa的基因结构示意图;b:SSIIa蛋白的功能结构域示意图;c:SSIIa的等位变异蛋白的三维同源性建模
Figure 4. The allelic variations of SSIIa in SSSLs
a: Gene structure schematic of SSIIa; b:The schematic illustration of SSIIa protein functional domains; c: Three-dimensional homology modeling of allelic variant proteins of SSIIa
图 5 SSSLs中的ISA1等位变异
a:ISA1的基因结构示意图;b:ISA1蛋白的功能结构域示意图;c:ISA1的等位变异蛋白的三维同源性建模
Figure 5. The allelic variations of ISA1 in SSSLs
a: Gene structure schematic of ISA1; b:The schematic illustration of ISA1 protein functional domains; c: Three-dimensional homology modeling of allelic variant proteins of ISA1
表 1 用于本研究的单片段代换系信息
Table 1 The information of SSSLs used in this study
编号
Code单片段代换系名称
SSSL name染色体
Chr.携带的基因
Carrying gene供体亲本
Donor亚种类型
Subspecies04-02 W04-47-61-02-04 2 SBEIIb BG367 籼稻 Indica 07-02 W07-11-06-04-07-03 2 SBEIIb 苏御糯 Suyunuo 粳稻 Japonica 12-02 W12-09-28-04-01-07-01 2 SBEIIb IR58025B 籼稻 Indica 15-02 W15-12-10-11-07 2 SBEIIb American Jasmine 籼稻 Indica 27-02 W27-18-05-08-01 2 SBEIIb IAPAR9 粳稻 Japonica 02-06 W02-15-01-08-02-05 6 SSIIa Amol 3 籼稻 Indica 08-06 W08-18-09-09-06-02 6 SSIIa IR64 籼稻 Indica 12-06 W12-42-42-08-02-04-02 6 SSIIa IR58025B 籼稻 Indica 14-06 W14-12-03-06-04-08 6 SSIIa 联鉴33 Lianjian33 籼稻 Indica 15-06 W15-06-06-21 6 SSIIa American Jasmine 籼稻 Indica 18-06 W18-11-01-02-06-06-04 6 SSIIa IRAT 261 粳稻 Japonica 21-06 W21-23-36-06-07-04-06 6 SSIIa IR65598 粳稻 Japonica 04-08 W04-10-04-10-07-06 8 ISA1 BG367 籼稻 Indica 05-08 W05-36-75-01-01-06 8 ISA1 籽恢100 Zihui100 籼稻 Indica 07-08 W07-18-05-01-09-03-05 8 ISA1 苏御糯 Suyunuo 粳稻 Japonica 08-08 W08-15-06-05-11 8 ISA1 IR64 籼稻 Indica 09-08 W09-38-60-07-07-11-06 8 ISA1 Basmati 385 籼稻 Indica 11-08 W11-15-08-09-04 8 ISA1 Basmati 370 籼稻 Indica 13-08 W13-30-45-01-10-02-06 8 ISA1 江西丝苗 Jiangxisimiao 籼稻 Indica 14-08 W14-09-06-09-12 8 ISA1 联鉴33 Lianjian33 籼稻 Indica 表 2 SSSLs中的不同SBEIIb等位基因的基因型和表型
Table 2 Genotypes and phenotypes of different SBEIIb alleles in SSSLs
编号
CodeEx4-96
(P.196)Ex8-36
(P.270)Ex12-19
(P.412)Ex12-109
(P.442)单倍型
Haplotype等位基因
Allelew(抗性淀粉)1)/%
Resistant starch content04-02 CGC (Arg) TCA (Ser) ACA (Thr) CTG (Leu) HT-1 SBEIIb-1 1.82±0.03A 12-02 CGC (Arg) TCA (Ser) ACA (Thr) CTG (Leu) HT-1 SBEIIb-1 1.71±0.01A 15-02 CGC (Arg) TCA (Ser) ACA (Thr) CTG (Leu) HT-1 SBEIIb-1 1.63±0.05A HJX74 CAC (His) TCA (Ser) ACA (Thr) CTG (Leu) HT-2 SBEIIb-2 0.72±0.03B 07-02 CAC (His) TCT (Ser) ACC (Thr) CTT (Leu) HT-3 SBEIIb-2 0.82±0.03B 27-02 CAC (His) TCT (Ser) ACC (Thr) CTT (Leu) HT-3 SBEIIb-2 0.75±0.03B 1) 抗性淀粉含量数据为早、晚季的平均值±标准误(n = 6);该列数据后的不同大写字母表示显著差异(P < 0.01,Duncan’s法)
1) The data of resistant starch content are represented as mean ± SE of the early and late seasons (n = 6); Different uppercase letters of this column indicate significant differences (P < 0.01, Duncan’s test)表 3 SSSLs中的不同SSIIa等位基因的基因型和表型
Table 3 Genotypes and phenotypes of different SSIIa alleles in SSSLs
编号
CodeEx8-334
(P.604)Ex8-438
(P.638)Ex8-864
(P.780)Ex8-865
(P.781)单倍型
Haplotype等位基因
Allelew(抗性淀粉)1)/%
Resistant starch content08-06 GGC (Gly) GGG (Gly) GGG (Gly) CTC (Leu) HT-1 SSIIa-1 3.37±0.06A 21-06 AGC (Ser) GGT (Gly) GGG (Gly) CTC (Leu) HT-2 SSIIa-2 2.19±0.08B 02-06 AGC (Ser) GGT (Gly) GGT (Gly) TTC (Phe) HT-3 SSIIa-3 0.71±0.03C 12-06 AGC (Ser) GGT (Gly) GGT (Gly) TTC (Phe) HT-3 SSIIa-3 0.77±0.02C 14-06 AGC (Ser) GGT (Gly) GGT (Gly) TTC (Phe) HT-3 SSIIa-3 0.78±0.02C 15-06 AGC (Ser) GGT (Gly) GGT (Gly) TTC (Phe) HT-3 SSIIa-3 0.82±0.03C 18-06 AGC (Ser) GGT (Gly) GGT (Gly) TTC (Phe) HT-3 SSIIa-3 0.83±0.04C HJX74 AGC (Ser) GGT (Gly) GGT (Gly) TTC (Phe) HT-3 SSIIa-3 0.72±0.03C 1) 抗性淀粉含量数据为早、晚季的平均值±标准误(n = 6);该列数据后的不同大写字母表示显著差异(P < 0.01,Duncan’s法)
1) The data of resistant starch content are represented as mean ± SE of the early and late seasons (n = 6); Different uppercase letters of this column indicate significant differences (P < 0.01, Duncan’s test)表 4 SSSLs中的不同ISA1等位基因的基因型和表型
Table 4 Genotypes and phenotypes of different ISA1 alleles in SSSLs
编号
CodeEx1-209~211
(P.70~71)Ex6-31
(P.336)Ex16-3
(P.353)Ex17-117
(P.717)Ex18-109
(P.777)单倍型
Haplotype等位基因
Allelew(抗性淀粉)1)/%
Resistant starch content09-08 GAGGGT (Glu-Gly) AAC (Asn) GTC (Val) ACG (Thr) CTG (Leu) HT-1 ISA1-1 2.17±0.03A 11-08 GAGGGT (Glu-Gly) AAC (Asn) GTC (Val) ACG (Thr) CTG (Leu) HT-1 ISA1-1 2.02±0.04A 08-08 GAGGGT (Glu-Gly) AAT (Asn) GTT (Val) ATG (Met) CTG (Leu) HT-2 ISA1-2 1.07±0.03B HJX74 G---GT (Gly) AAT (Asn) GTT (Val) ATG (Met) CTG (Leu) HT-3 ISA1-3 0.72±0.03C 05-08 G---GT (Gly) AAT (Asn) GTT (Val) ATG (Met) CTG (Leu) HT-3 ISA1-3 0.65±0.04C 13-08 G---GT (Gly) AAT (Asn) GTT (Val) ATG (Met) CTG (Leu) HT-3 ISA1-3 0.81±0.02C 14-08 G---GT (Gly) AAT (Asn) GTT (Val) ATG (Met) CTG (Leu) HT-3 ISA1-3 0.79±0.03C 04-08 G---GT (Gly) AAT (Asn) GTT (Val) ATG (Met) CTT (Leu) HT-4 ISA1-3 0.83±0.02C 07-08 G---GT (Gly) AAT (Asn) GTT (Val) ATG (Met) CTT (Leu) HT-4 ISA1-3 0.77±0.02C 1) 抗性淀粉含量数据为早、晚季的平均值±标准误(n = 6);该列数据后的不同大写字母表示显著差异(P < 0.01,Duncan’s法)
1) The data of resistant starch content are represented as mean ± SE of the early and late seasons (n = 6); Different uppercase letters of this column indicate significant differences (P < 0.01, Duncan’s test) -
[1] KHUSH G S. What it will take to feed 5.0 billion rice consumers in 2030[J]. Plant Molecular Biology, 2005, 59(1): 1-6. doi: 10.1007/s11103-005-2159-5
[2] ZOU W, BUTARDO V M, TOUTOUNJI M, et al. Harnessing particle disintegration of cooked rice grains for predicting glycaemic index[J]. Carbohydrate Polymers, 2020, 248: 116789. doi: 10.1016/j.carbpol.2020.116789
[3] RAIGOND P, EZEKIEL R, RAIGOND B. Resistant starch in food: A review[J]. Journal of the Science of Food and Agriculture, 2015, 95(10): 1968-1978. doi: 10.1002/jsfa.6966
[4] 胡时开, 胡培松. 功能稻米研究现状与展望[J]. 中国水稻科学, 2021, 35(4): 311-325. [5] 郑宝东, 王琦, 郑亚凤, 等. 抗性淀粉的生物学功效及在食品加工中的应用[J]. 食品科学技术学报, 2015, 33(5): 1-7. doi: 10.3969/j.issn.2095-6002.2015.05.001 [6] 朱平, 孔祥礼, 包劲松. 抗性淀粉在食品中的应用及功效研究进展[J]. 核农学报, 2015, 29(2): 327-336. doi: 10.11869/j.issn.100-8551.2015.02.0327 [7] BAO J, ZHOU X, XU F, et al. Genome-wide association study of the resistant starch content in rice grains[J]. Starch - Stärke, 2017, 69(7/8): 1600343.
[8] 林静, 张云辉, 张所兵, 等. 水稻地方品种高抗性淀粉含量QTL挖掘与定位[J]. 江苏农业科学, 2021, 49(23): 58-61. [9] 魏霞, 徐延浩, 丁保淼, 等. 抗性淀粉及其遗传改良研究进展[J]. 长江大学学报(自然科学版), 2019, 16(8): 101-107. [10] YANG R, BAI J, FANG J, et al. A single amino acid mutation of OsSBEIIb contributes to resistant starch accumulation in rice[J]. Breeding Science, 2016, 66(4): 481-489. doi: 10.1270/jsbbs.16037
[11] SHEN L, LI J, LI Y. Resistant starch formation in rice: Genetic regulation and beyond[J]. Plant Communications, 2022, 3(3): 100329. doi: 10.1016/j.xplc.2022.100329
[12] SUN Y, JIAO G, LIU Z, et al. Generation of high-amylose rice through CRISPR/Cas9-mediated targeted mutagenesis of starch branching enzymes[J]. Frontiers in Plant Science, 2017, 8: 298.
[13] ZHANG G, CHENG Z, ZHANG X, et al. Double repression of soluble starch synthase genes SSIIa and SSIIIa in rice (Oryza sativa L. ) uncovers interactive effects on the physicochemical properties of starch[J]. Genome, 2011, 54(6): 448-459. doi: 10.1139/g11-010
[14] ZHOU H, WANG L, LIU G, et al. Critical roles of soluble starch synthase SSIIIa and granule-bound starch synthase Waxy in synthesizing resistant starch in rice[J]. Proceedings of the National Academy of Sciences of the United States of America, 2016, 113(45): 12844-12849.
[15] PAN L, CHEN F, YANG Y, et al. The underlying starch structures of rice grains with different digestibilities but similarly high amylose contents[J]. Food Chemistry, 2022, 379: 132071. doi: 10.1016/j.foodchem.2022.132071
[16] LEHMANN U, ROBIN F. Slowly digestible starch–its structure and health implications: A review[J]. Trends in Food Science & Technology, 2007, 18(7): 346-355.
[17] RAMADOSS B R, GANGOLA M P, AGASIMANI S, et al. Starch granule size and amylopectin chain length influence starch in vitro enzymatic digestibility in selected rice mutants with similar amylose concentration[J]. Journal of Food Science and Technology, 2019, 56(1): 391-400. doi: 10.1007/s13197-018-3500-8
[18] 姚姝, 张亚东, 路凯, 等. 水稻可溶性淀粉合成酶基因SSIIa和SSⅢa的功能、等位变异及其互作研究进展[J]. 中国水稻科学, 2022, 36(3): 227-236. [19] 方结红, 张明洲, 刘军, 等. 水稻ISA1基因的克隆与分析[J]. 安徽农业科学, 2010, 38(9): 4440-4441. [20] CHAO S F, CAI Y C, FENG B B, et al. Editing of rice isoamylase gene ISA1 provides insights into its function in starch formation[J]. Rice Science, 2019, 26(2): 77-87. doi: 10.1016/j.rsci.2018.07.001
[21] FUJITA N, KUBO A, SUH D, et al. Antisense inhibition of isoamylase alters the structure of amylopectin and the physicochemical properties of starch in rice endosperm[J]. Plant and Cell Physiology, 2003, 44(6): 607-618. doi: 10.1093/pcp/pcg079
[22] 张桂权. 基于SSSL文库的水稻设计育种平台[J]. 遗传, 2019, 41(8): 754-760. [23] KAWAGOE Y, KUBO A, SATOH H, et al. Roles of isoamylase and ADP-glucose pyrophosphorylase in starch granule synthesis in rice endosperm[J]. The Plant Journal, 2005, 42(2): 164-174. doi: 10.1111/j.1365-313X.2005.02367.x
[24] SAWADA T, ITOH M, NAKAMURA Y. Contributions of three starch branching enzyme isozymes to the fine structure of amylopectin in rice endosperm[J]. Frontiers in Plant Science, 2018, 9: 1536. doi: 10.3389/fpls.2018.01536
[25] MIURA S, KOYAMA N, CROFTS N, et al. Generation and starch characterization of non-transgenic BEI and BEIIb double mutant rice (Oryza sativa) with ultra-high level of resistant starch[J]. Rice, 2021, 14(1): 3. doi: 10.1186/s12284-020-00441-0
[26] GUO D, LING X, ZHOU X, et al. Evaluation of the quality of a high-resistant starch and low-glutelin rice (Oryza sativa L.) Generated through CRISPR/Cas9-mediated targeted mutagenesis[J]. Journal of Agricultural and Food Chemistry, 2020, 68(36): 9733-9742. doi: 10.1021/acs.jafc.0c02995
[27] YANG R, SUN C, BAI J, et al. A putative gene sbe3-rs for resistant starch mutated from SBE3 for starch branching enzyme in rice (Oryza sativa L. )[J]. PLoS One, 2012, 7(8): e43026. doi: 10.1371/journal.pone.0043026
[28] BUTARDO V M, FITZGERALD M A, BIRD A R, et al. Impact of down-regulation of starch branching enzyme IIb in rice by artificial microRNA- and hairpin RNA-mediated RNA silencing[J]. Journal of Experimental Botany, 2011, 62(14): 4927-4941. doi: 10.1093/jxb/err188
[29] GAO Z, ZENG D, CHENG F, et al. ALK, the key gene for gelatinization temperature, is a modifier gene for gel consistency in rice[J]. Journal of Integrative Plant Biology, 2011, 53(9): 756-765.
[30] CHEN Z, LU Y, FENG L, et al. Genetic dissection and functional differentiation of ALKa and ALKb, two natural alleles of the ALK/SSIIa gene, responding to low gelatinization temperature in rice[J]. Rice, 2020, 13(1): 39. doi: 10.1186/s12284-020-00393-5
[31] YOU H, LIANG C, ZHANG O, et al. Variation of resistant starch content in different processing types and their starch granules properties in rice[J]. Carbohydrate Polymers, 2022, 276: 118742. doi: 10.1016/j.carbpol.2021.118742
[32] NAKAMURA Y, FRANCISCO P B, HOSAKA Y, et al. Essential amino acids of starch synthase IIa differentiate amylopectin structure and starch quality between japonica and indica rice varieties[J]. Plant Molecular Biology, 2005, 58(2): 213-227. doi: 10.1007/s11103-005-6507-2
[33] 张风琴, 于雪然, 李玲, 等. 基于高密度遗传图谱对水稻抗性淀粉QTL定位及分析[J]. 植物遗传资源学报, 2023, 24(4): 1075-1084. -
期刊类型引用(1)
1. 杨雪丽,欧旭华,付澳秋,肖武名,郭涛,林悦龙,郭谦麒,杨瑰丽,孟丽君. 高抗性淀粉水稻的遗传育种研究进展. 广东农业科学. 2025(01): 135-145 .  百度学术
百度学术
其他类型引用(0)



 下载:
下载: