Analysis of germination characteristics and differential gene expression in neo-tetraploid rice under NaCl stress
-
摘要:目的
评价新型四倍体水稻在不同浓度NaCl处理下的种子萌发特性、幼苗建成期形态指标和根部细胞结构差异,评估盐胁迫相关基因的表达差异。
方法在不同浓度NaCl (0、50、100、150、200和250 mmol/L)处理下,以‘华多1号’为研究材料,统计其种子在萌发时间、发芽势、发芽率和萌发指数指标的差异。在幼苗形成期,统计和比较‘华多1号’在不同浓度NaCl处理下的总根数、幼苗苗长、根长、幼苗鲜质量、含水率和根冠比参数的差异。利用WE-CLSM和塑料半薄切片技术观察根尖组织细胞的形态。利用基因组重测序、生物信息学分析和qRT-PCR技术对‘华多1号’与双亲相关的盐胁迫基因进行分析和定量验证。
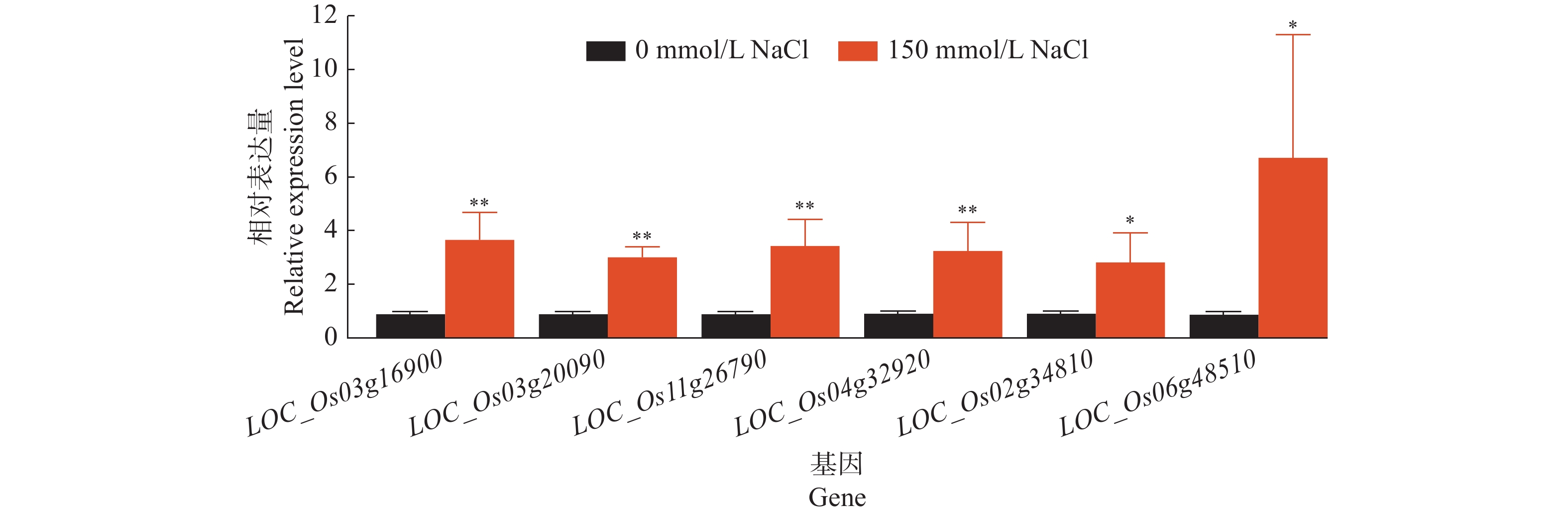
结果当NaCl浓度升高时,‘华多1号’种子发芽率和萌发指数呈递减趋势,但相对盐害率和平均发芽时间呈递增趋势。当NaCl浓度高达250 mmol/L时,‘华多1号’种子相对盐害率为35%,表明其具有较强的耐盐性。在NaCl处理8~20 d后,‘华多1号’幼苗随着NaCl浓度升高,总根数呈减少趋势,同时幼苗苗长、根长、幼苗鲜质量和含水率呈下降趋势,但根冠比呈上升趋势。NaCl胁迫会抑制‘华多1号’幼苗生长,导致其根尖细胞体积变小,细胞皱缩和细胞排列松散;盐胁迫条件下,根尖伸长区的表皮和外皮层的细胞会增厚,中间皮层的细胞层数增加,中柱直径缩小,木质部导管分化数目增加。在‘华多1号’中发现有85个盐胁迫基因在CDS区中较双亲存在差异,包括53个盐敏感相关基因、32个盐胁迫抗性相关基因。qRT-PCR结果表明:与对照相比,‘华多1号’的4个盐敏感基因(LOC_Os03g16900、LOC_Os06g48510、LOC_Os02g34810和LOC_Os04g32920)和2个耐盐性基因(LOC_Os03g20090和LOC_Os11g26790)表达量显著上升。
结论该研究可为后续系统评价四倍体水稻种质资源的耐盐性、揭示四倍体水稻的耐盐性调控机理,以及后续筛选耐盐多倍体水稻品种提供理论依据。
Abstract:ObjectiveThe purpose of this research was to evaluate differences in seed germination characteristics, morphological indexes, and root cell structure in ‘Huaduo1’ under different concentrations of NaCl and to evaluate the gene expression differences of salt stress related genes in ‘Huaduo1’.
MethodUsing ‘Huaduo1’ as the research material, the differences in seed germination time, germination potential, germination rate, and germination index under various concentrations of NaCl (0, 50, 100, 150, 200, and 250 mmol/L) were analyzed. The differences in total root number, seedling length, root length, seedling fresh weight, water content, and root-to-head ratio of ‘Huaduo1’ at seedling forming stage under various concentrations of NaCl were summarized and compared. Root tip cell morphology of ‘Huaduo1’ was observed by the WE-CLSM and semi-thin section analysis. Genomic resequencing, bioinformatics analysis, and qRT-PCR analysis were conducted to analyze and quantify the expression of the salt stress genes in ‘Huaduo1’ related to its parents.
ResultThe seed germination rate and germination index of ‘Huaduo1’ decreased with increased NaCl concentration, while the relative salt damage rate and average germination time increased. ‘Huaduo1’ showed a strong salt tolerance with the relative salt damage rate reached 35% under 250 mmol/L NaCl treatment. After 8 to 20 days of NaCl treatment, the total root number of ‘Huaduo1’ seedlings decreased with increased NaCl concentration. Meanwhile, the seedling length, root length, fresh weight and water content of seedlings under NaCl stress showed a decreasing trend, and the root-to-head ratio showed an increasing trend. NaCl stress inhibited the growth of the ‘Huaduo1’ seedlings, resulting in smaller cell volume, cell shrinkage, and loose cell arrangement in the root tip elongation zone. Moreover, the cells of the epidermis and outer cortex layer in the root tip elongation zone were thickened, the number of cell layers in the mesocortex increased, the diameter of the middle column decreased, and the number of xylem ductal differentiation increased under salt stress. Totally 85 salt stress-related genes of ‘Huaduo1’ showed variance in the CDS region compared with its two parents, including 53 salt sensitivity related genes and 32 salt stress tolerance related genes. The qRT-PCR results showed that the expressions of four salt sensitivity genes (LOC_Os03g16900, LOC_Os06g48510, LOC_Os02g34810, and LOC_Os04g32920) and two salt tolerance genes (LOC_Os03g20090 and LOC_Os11g26790) were significantly increased compared with the control.
ConclusionThe study can be used to evaluate the salt tolerance of tetraploid rice germplasm, reveal the regulation mechanism of salt tolerance in tetraploid rice, and provide a theoretical basis of the salt-tolerant germplasm selection in polyploidy rice.
-
Keywords:
- Neo-tetraploid rice /
- NaCl stress /
- Seed germination /
- Gene expression
-
水稻是我国主要的粮食作物,其增产和稳产具有重要战略意义。近年来,由于耕地面积减少和环境污染等问题的加剧,如何在现有基础上进一步稳定并提升水稻产量,已成为水稻育种家亟需解决的问题。其中,多倍体水稻具有强大的生物学优势,有望成为未来水稻育种的一种途径[1]。目前研究的多倍体水稻主要是由二倍体水稻经过染色体加倍获得的同源四倍体水稻。与二倍体水稻相比,同源四倍体水稻在形态和主要农艺性状方面变化明显,具体表现为植株变得粗壮、叶片增厚增宽、分蘖减少、有芒和籽粒变大等,这些变化有利于水稻的抗倒伏、光合作用的增强以及产量的提高,并且在许多农艺性状方面表现出了明显的杂种优势[2-4]。此外,同源四倍体水稻在籽粒大小、千粒质量、蛋白质及氨基酸含量等性状方面也有明显变化[1,5-6]。
籼型和粳型同源四倍体水稻杂交获得的杂种F1具有强大的生物学优势和增产潜力,显示了很强的应用前景[7-9],但育性偏低是制约其应用的主要原因。为解决该问题,华南农业大学刘向东教授团队于1999至2008年间利用不同类型同源四倍体水稻进行广泛的杂交,组配杂种F1并在杂交后代开展高育性的定向选择研究,于2009年成功选育出结实率超过80%的新型四倍体水稻,其中‘华多1号’和‘华多2号’于2016年获得国家植物新品种权。新型四倍体水稻是刘向东教授研究团队在国际首次报道的多倍体水稻新材料,育性高达80%,与低育性同源四倍体水稻杂交F1相比,其育性正常并可产生强大的产量优势,已显示出广阔的应用前景。同时,新型四倍体水稻还具有携带多种优异基因、基因组中存在丰富的DNA变异、类型独特(偏粳)、杂种优势强且可保持多代等特点[8-12]。
与同源四倍体水稻相似,新型四倍体水稻具有较高的蛋白质和脂质含量、光合效率和氮利用效率等优点[6,13-14]。基于此,在发挥其产量优势的基础上,新型四倍体水稻可以在短期内作为特用稻,在特定的区域进行应用,如作为饲用稻和耐盐碱稻等,创制遗传多样性品种和含有新变异的遗传育种新材料等,丰富水稻遗传变异资源[15]。为进一步了解和揭示新型四倍体水稻的材料特性,本研究以新型四倍体水稻‘华多1号’为材料,采用不同浓度梯度的NaCl溶液对‘华多1号’种子的萌发与幼苗建成过程进行比较研究,旨在明确‘华多1号’在种子萌发及幼苗阶段对盐胁迫的耐受能力,进而为新型四倍体水稻耐盐能力的评价及抗性育种提供理论依据。
1. 材料与方法
1.1 试验材料及预处理
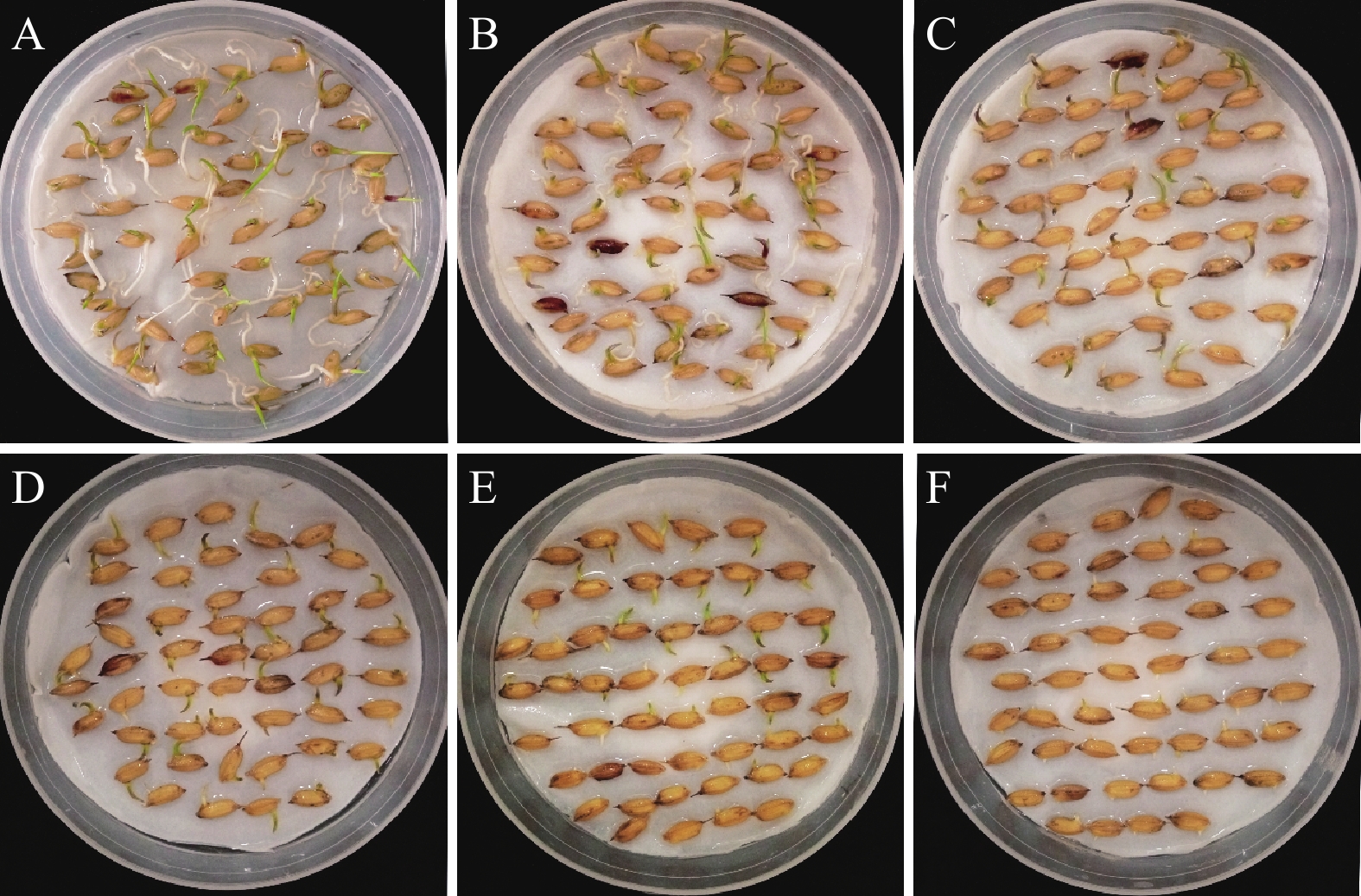
供试水稻材料为新型四倍体水稻‘华多1号’。试验共设6个NaCl溶液浓度梯度处理,每个处理随机挑选籽粒饱满、大小一致的种子,经过2.5%(φ)次氯酸钠溶液消毒15 min后,蒸馏水冲洗干净,将种子分别置于9 cm、铺有2层滤纸的培养皿内,分别加入0、50、100、150、200和250 mmol/L的NaCl溶液进行浸种和催芽。其中0 mmol/L的NaCl处理为对照,每个处理设3个重复,每个重复100粒种子。培养皿置于人工气候箱,每隔12 h检查和更换1次溶液,保持培养皿内水分充足且对应NaCl溶液浓度不变。
1.2 种子萌发特性指标鉴定
NaCl溶液处理2 d后,观察和统计水稻种子萌发情况。待NaCl溶液连续处理14 d后,分别计算平均发芽时间、发芽起始时间、发芽终止时间、发芽率、发芽指数及相对盐害率。其中,水稻的耐盐性评价标准参照汪宗立等[16]和顾兴友等[17]的分级标准制定,依据相对盐害率分为5个等级:级别1表明供试材料耐盐性极强,其相对盐害率为[0,20%];级别2表明供试材料耐盐性强,其相对盐害率为(20%,40%];级别3表明供试材料耐盐性中等,其相对盐害率为(40%,60%];级别4表明供试材料耐盐性弱,其相对盐害率为(60%,80%];级别5表明供试材料耐盐性极弱,其相对盐害率为(80%,100%]。
$$ \begin{split} 发芽率=&终变期正常发芽种子数/\\ &供试种子总数\times 100{\text{%}}, \end{split} $$ (1) $$ 萌发指数=\Sigma \Bigg(\dfrac{每天发芽种子数}{对应发芽天数}\Bigg), $$ (2) $$ 平均发芽时间=\dfrac{\Sigma (每天发芽种子数\times 发芽天数)}{种子发芽总数}, $$ (3) $$ \begin{split} 相对盐害率=&(对照发芽率-处理发芽率)/\\ &对照发芽率\times 100 {\text{%}} 。 \end{split} $$ (4) 1.3 幼苗生长试验
水稻种子萌发后,从每个培养皿挑选10粒正常发芽且生长的种子,统计和测量NaCl溶液处理8、10、12、14和16 d后的幼苗根长、苗长以及鲜质量,并将幼苗在60 ℃下烘干至恒质量,测定其含水率、计算根冠比。
$$ 含水率=(鲜质量-干质量)/鲜质量\times 100{\text{%}},$$ (5) $$ 根冠比=地下部干质量/地上部干质量。$$ (6) 1.4 根部组织的细胞学观察
在NaCl胁迫处理的8和20 d后,切取不同NaCl浓度处理的水稻根尖组织,放入FAA固定液中固定48 h,利用50%(φ)乙醇溶液冲洗后,将其保存于70%(φ)乙醇溶液中用于后续细胞学观察。利用整体曙红B染色透明激光扫描共聚焦显微镜(WE-CLSM)技术观察根尖组织,采用梯度乙醇复水,用2%(ω)钾矾溶液处理后转入4%(ω)蔗糖曙红溶液中染色,再用2%(ω)钾矾溶液处理后,在梯度乙醇中脱水,随后用不同梯度水杨酸甲脂透明处理,最后取出根尖组织制片后,使用激光共聚焦显微镜LeciaSPE在543 nm激光波长下对根尖不同部位细胞进行分层扫描观察,并拍照记录,方法参考文献[18]。
为明确不同浓度NaCl处理下的水稻根尖伸长区横截面结构,选取固定好的根尖组织样品,采用梯度乙醇脱水,利用Technovit 7100 塑料包埋剂进行渗透、包埋和聚合,获得样品包埋切块。在Leica RM2235切片机上进行切片,利用甲苯胺蓝染色后,在显微镜下观察样品的水稻根尖结构特点。具体参照Wu等[19]的方法进行。
1.5 新型四倍体水稻‘华多1号’基因组水平的变异分析
将‘华多1号’叶片DNA样品送至北京百迈客生物科技有限公司进行基因组重测序分析。对测试合格的DNA样品进行超声波打断,将片段化的DNA进行片段纯化、末端修复、3′端加A和连接测序接头等处理后,利用琼脂糖凝胶电泳选择片段大小,进行PCR扩增,形成测序文库。利用北京百迈客生物科技有限公司的Illumina HiSeqTM2500平台对质检合格的文库进行测序。测序完毕后,将测序得到的原始Reads(双端序列)进行质量评估并过滤得到Clean reads。将‘华多1号’的Clean reads及双亲参考基因组进行序列比对,基于比对结果对SNP和InDel进行检测和注释分析,并实现DNA水平差异基因挖掘和差异功能注释等,挖掘‘华多1号’的基因组变异情况。利用在线分析网agriGO和String等网站进行生物信息学相关分析。
1.6 实时荧光定量PCR检测
采用Trizol法[20]抽提0和150 mmol/L NaCl溶液处理8 d后的‘华多1号’根尖组织RNA样品,通过反转录试验合成cDNA。从‘华多1号’盐胁迫相关基因中筛选出6个代表性基因进行实时荧光定量PCR (Quantitative real-time PCR,qRT-PCR)检测。引物合成由生工生物工程(上海)股份有限公司合成,引物序列见表1。以获得的cDNA为模板,选取Ubiquition为内参基因,采用罗氏Lightcycler480荧光定量PCR仪进行qRT-PCR试验,反应后获得的数据采用2−△△Ct法[21]进行计算。其中,每个基因的qRT-PCR均有3次技术重复和3次生物学重复。
表 1 盐胁迫相关基因的qRT-PCR引物序列Table 1. Primer sequence for qRT-PCR of salt stress related genes基因名称
Gene name引物序列 (5'→3')
Primer sequenceLOC_Os03g16900 F: ATAATGAAGCATCCGATT R: ATATGAGCAACAGAACAC LOC_Os03g20090 F: ACAACGAGATCAAGAACTACTG R: TTGAACTGCTGGCTGTTG LOC_Os11g26790 F: TCCAGCTCAAGCTCGTCT R: AGCTTCTCCTTGATCTTCTCCTT LOC_Os04g32920 F: TCCTCTCCCTCATCCTCT R: CATTGTCGTTGGCGTAGA LOC_Os02g34810 F: GCTTATCCAACCAATCAA R: ACATCAACTCGTCCATAT LOC_Os06g48510 F: ACACCTCGTTGCCTCATA R: ATAGCCACCATCCAGATAGTT Ubiquition F: ACCACTTCGACCGCCACTACT R: ACGCCTAAGCCTGCTGGTT 1.7 数据处理
采用Excel 2016统计软件对不同浓度的NaCl处理下的种子萌发相关数据进行统计和整理;采用IBM SPSS Statistics 24.0进行数据分析,其中显著性检验用单因素方差分析法,多重比较用Least-significant difference(LSD)法。采用GraphPad Prism8.0软件作图。
2. 结果与分析
2.1 NaCl胁迫对‘华多1号’种子发芽时间的影响
由表2可知,‘华多1号’种子在50 mmol/L NaCl处理下的发芽起始及终止时间与对照(0 mmol/L NaCl溶液 )一致,均在胁迫处理的4 d后开始,至5 d后结束。在100 mmol/L的NaCl胁迫处理下,‘华多1号’种子发芽起始时间与对照一致,但其种子在胁迫处理的6 d后终止发芽。当NaCl浓度达150和200 mmol/L时,尽管‘华多1号’种子发芽起始时间与对照一致,均从胁迫处理4 d后开始,但其种子发芽终止时间延迟至7 d后。而当NaCl浓度升至250 mmol/L时,‘华多1号’种子发芽起始及终止时间与对照相比均存在滞后,具体表现为种子发芽起始时间从胁迫处理的5 d后开始,种子发芽终止时间延迟至8 d才结束。
表 2 不同浓度NaCl胁迫对‘华多1号’种子发芽时间的影响1)Table 2. Effects of salt stress with different NaCl concentration on seed germination time of ‘Huaduo1’c(NaCl)/(mmol·L−1) 发芽起始时间/d
Germination initiation time发芽终止时间/d
Germination termination time平均发芽时间/d
Average germination time0 4 5 4.25±0.030a 50 4 5 4.36±0.009a 100 4 6 4.77±0.113b 150 4 7 4.97±0.154b 200 4 7 5.19±0.182c 250 5 8 6.81±0.409d 1)同列数据后不同小写字母表示差异显著(P<0.05,LSD法)
1)Different lowercase letters in the same column indicate significant differences (P<0.05, LSD method )当NaCl为50 mmol/L时,‘华多1号’种子平均发芽时间与对照相比无显著性差异。当NaCl浓度达100 mmol/L及以上时,‘华多1号’种子平均发芽时间逐渐延长,与对照相比存在显著差异,并且其种子发芽受到的抑制程度会逐步加深(图1)。与对照相比,‘华多1号’种子在NaCl胁迫处理下,其平均发芽时间会出现0.52~2.56 d的滞后(表2)。
2.2 NaCl胁迫对新型四倍体水稻种子萌发特性的影响
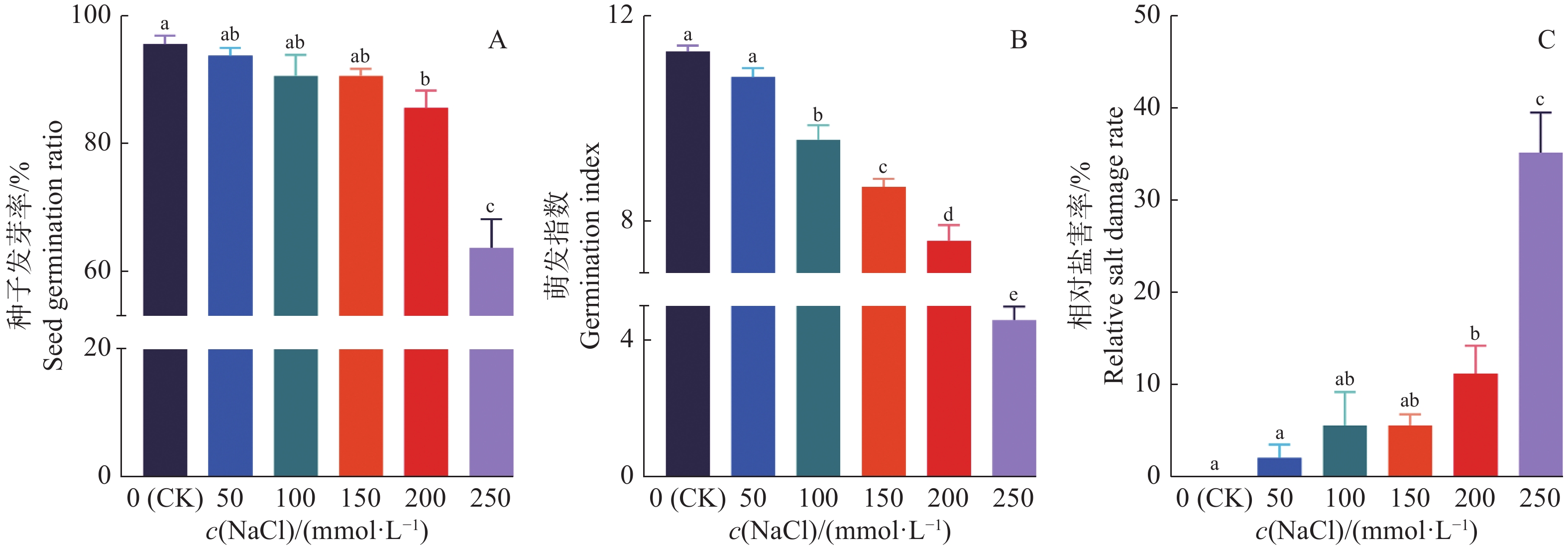
由图2可知,NaCl处理浓度增加时,‘华多1号’的种子发芽率呈下降趋势。与对照相比,‘华多1号’种子在NaCl为150 mmol/L及以下时,其种子发芽率不存在显著差异,种子发芽率达90%以上。当NaCl处理浓度达200和250 mmol/L时,种子能露白发芽,其种子发芽率分别为 84.7%和61.3%。
NaCl为50 mmol/L时,‘华多1号’种子萌发指数与对照相比不存在显著差异,仅比对照减少0.50。但当NaCl浓度升至100~250 mmol/L时,其萌发指数与对照相比存在显著差异,其种子萌发指数下降了1.72~6.72。
当NaCl浓度为50 mmol/L时,‘华多1号’种子受到的盐伤害极轻,其相对盐害率低于2%,相较于对照不存在显著性差异;当NaCl浓度升至250 mmol/L时,‘华多1号’种子的受害程度最严重,其相对盐害率会升至35%。依据水稻萌发相对盐害率分级标准可知,‘华多1号’的耐盐性强,在一定高浓度的NaCl胁迫下胚根仍能突破种皮萌发。
2.3 NaCl胁迫对‘华多1号’幼苗生长的影响
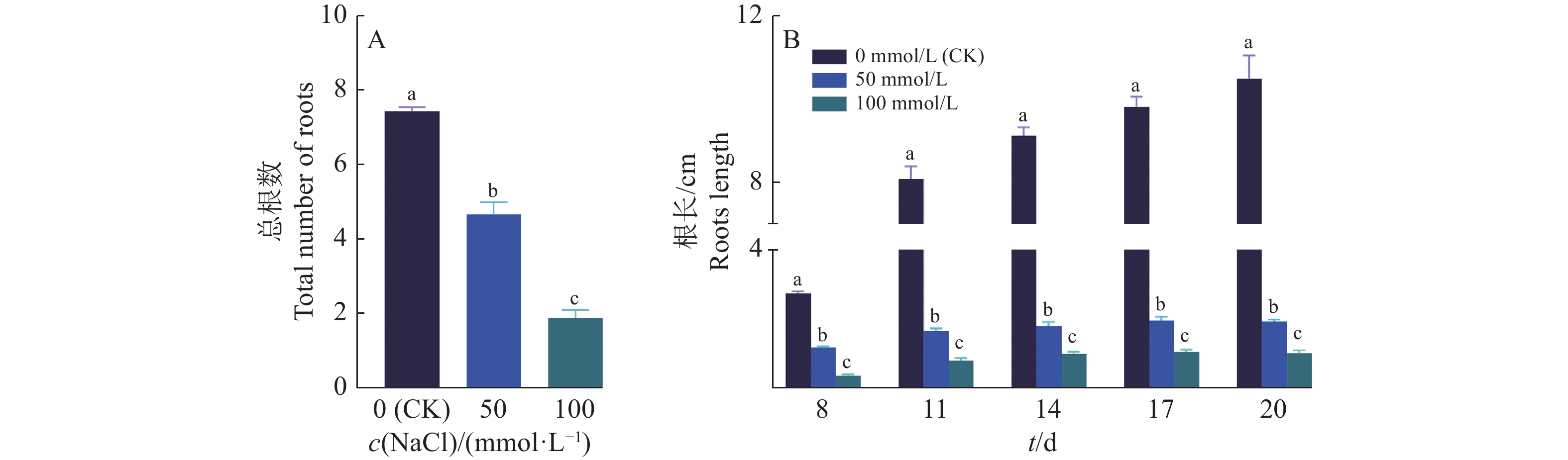
由图3可知,NaCl处理后,‘华多1号’幼苗根部的伸长度及总根数会受到不同程度的抑制。在50和100 mmol/L的NaCl溶液处理下,‘华多1号’幼苗的侧根产生受到显著抑制,与对照相比分别下降了37%和75%(图3A)。同时,在对照中,‘华多1号’幼苗根部长度平均伸长7.7 cm,而在100 mmol/L的NaCl处理下,‘华多1号’的幼苗平均根长从0.35 cm生长到1.01 cm,仅伸长了0.66 cm(图3B)。
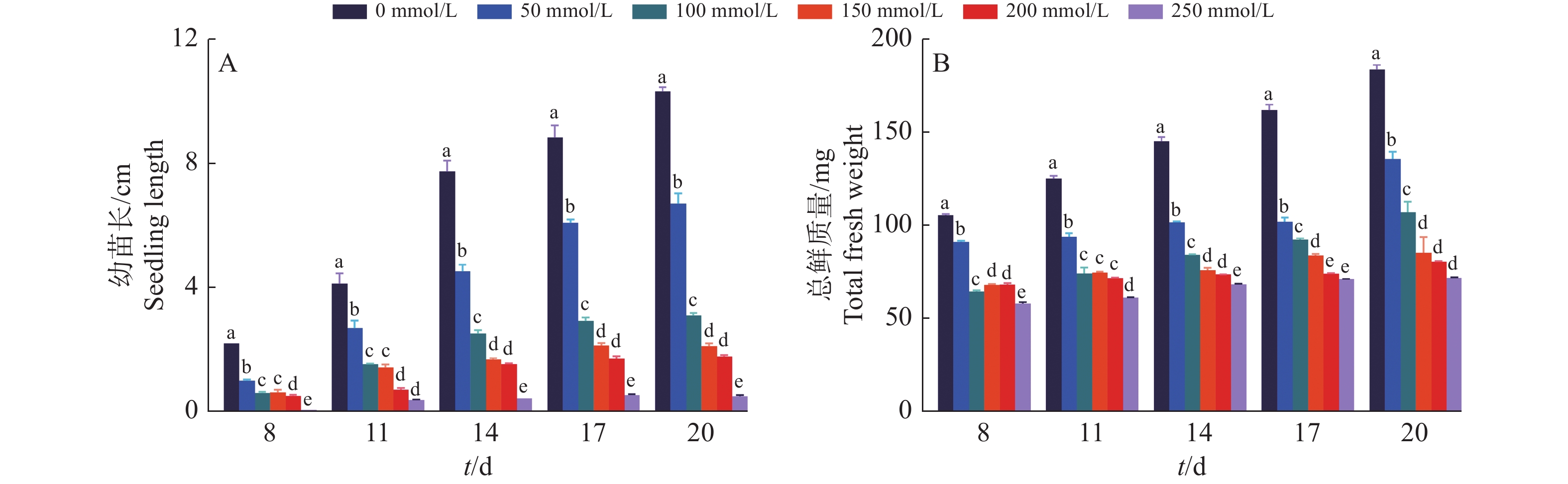
在发芽后的8~20 d,‘华多1号’幼苗在对照中增长了8.09 cm,但在50、100、150、200和250 mmol/L的NaCl胁迫处理下,其幼苗分别增长了5.68、2.45、1.48和1.27 cm (图4)。与对照相比,NaCl胁迫下的幼苗苗长分别下降了29.81%、69.23%、81.73%和84.34%(图4A)。在发芽后的8~20 d,对照材料中的幼苗鲜质量增长了78.1 mg,但在50、100、150、200和250 mmol/L的NaCl胁迫处理下,其幼苗鲜质量分别增长了44.47、42.3、17.17、12.37和13.64 mg。与对照相比,盐胁迫下的幼苗鲜质量分别下降了43.06%、45.83%、78.02%、84.15%和82.53%(图4B)。
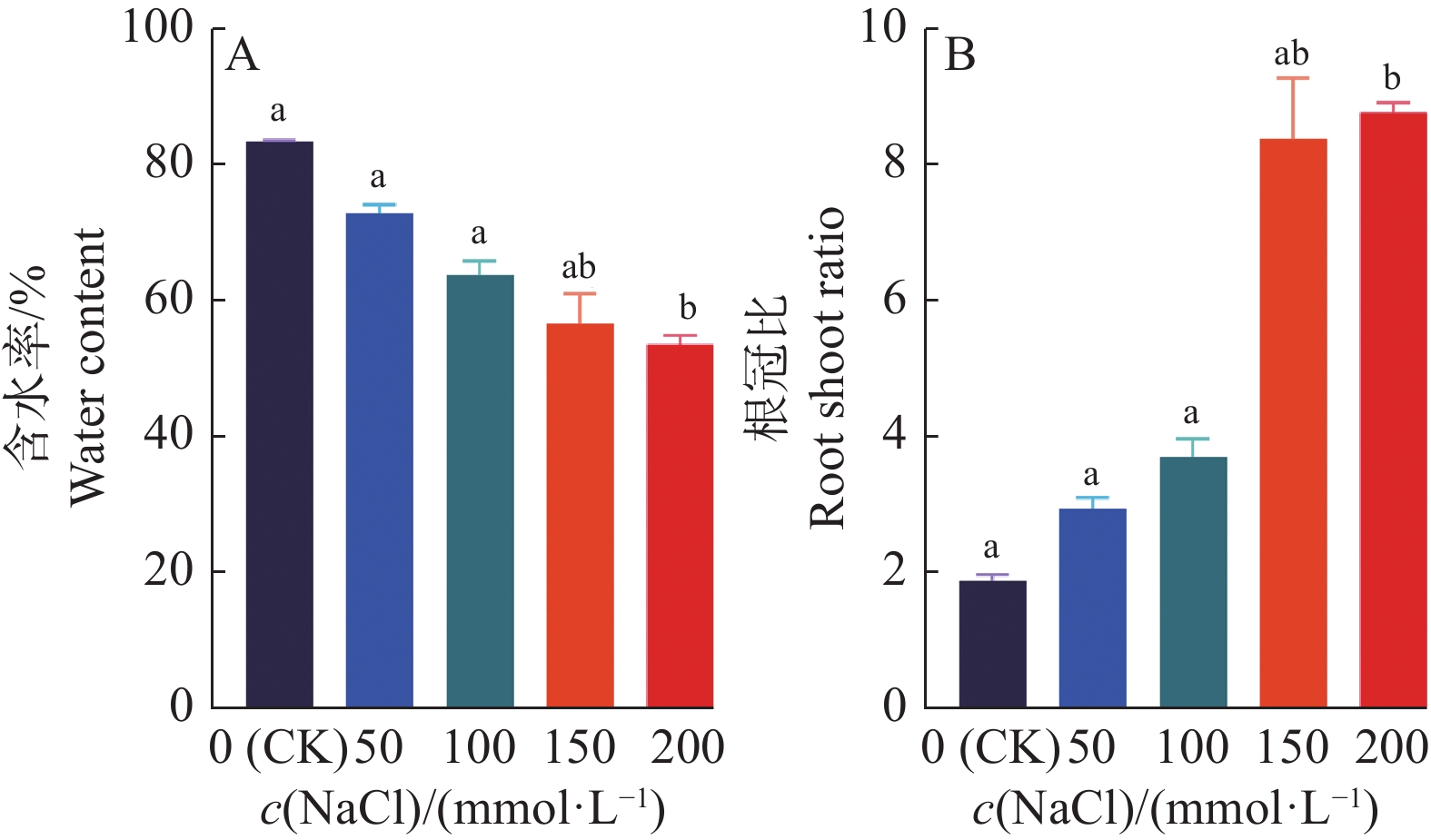
2.4 NaCl胁迫对‘华多1号’幼苗含水率和根冠比的影响
由图5可知,当NaCl胁迫浓度升高时,‘华多1号’幼苗的含水率呈逐渐下降趋势。当NaCl浓度在100 mmol/L以下时,‘华多1号’幼苗含水率与对照相比不存在显著差异。而当NaCl浓度升至200 mmol/L时,‘华多1号’幼苗含水率与对照相比显著降低,其含水率较对照下降35%。
当NaCl胁迫浓度在100 mmol/L及以下时,‘华多1号’幼苗的根冠比呈上升趋势,但与对照相比无显著差异。当NaCl浓度达200 mmol/L时,‘华多1号’幼苗的根冠比与对照相比上升了6.88,差异显著。
2.5 NaCl胁迫对‘华多1号’根部细胞结构的影响
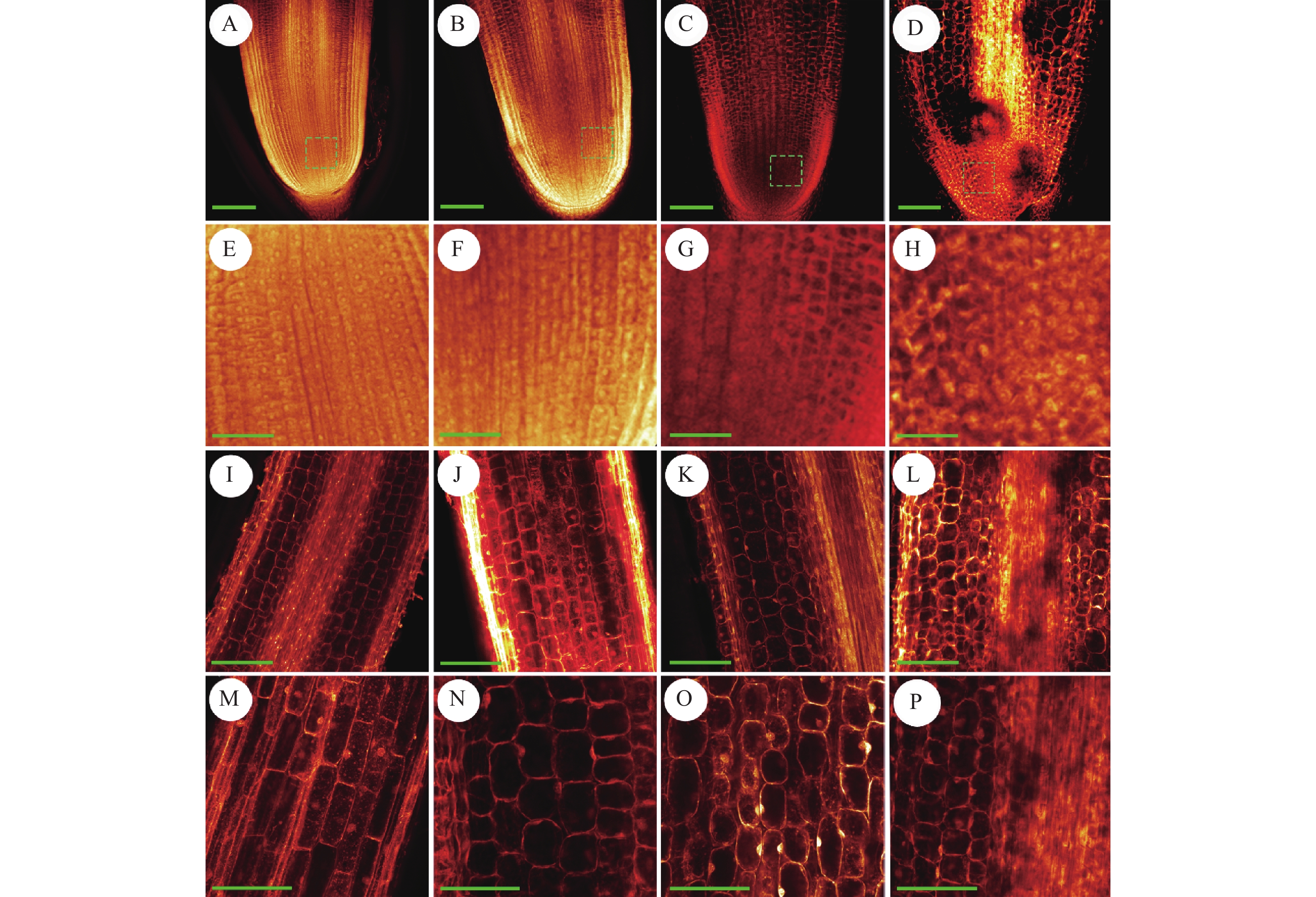
与对照(图6A、6E)相比,‘华多1号’根部细胞形态在NaCl胁迫处理下会出现显著变化,具体表现为根尖分生区变小,根尖细胞体积减小,细胞排列疏松,同时细胞间的间隙变大。在50 mmol/L的NaCl处理下,‘华多1号’根尖的分生区细胞排列紧密,细胞核较大且清晰可见,表明其受到NaCl胁迫的影响微弱(图6B、6F)。当NaCl浓度升至100和150 mmol/L时,‘华多1号’根尖细胞分生区范围开始变小,分生区细胞体积明显缩小,且细胞轮廓不清晰,同时根尖分生区的细胞排列疏松(图6C、6D、6G和6H)。
![]() 图 6 不同浓度NaCl处理下根尖细胞的形态差异A~D分别为0、50、100和150 mmol/L的NaCl溶液处理后的根尖细胞,标尺= 20 µm;E~H分别为A~D对应的分生区细胞,标尺= 40 µm;I~L分别为A~D对应的伸长区细胞,标尺= 40 µm;M~P分别为A~D对应的伸长区细胞,标尺= 100 µmFigure 6. Morphological differences of root tip cells under different NaCl concentrationsA−D: Root tip cells under NaCl concentration of 0, 50, 100, and 150 mmol/L, respectively, bar = 20 μm; E−H: Root tip meristematic zone cells corresponding to A−D respectively, bar = 40 μm; I−L: Root tip elongation zone cells corresponding to A−D respectively, bar =40 μm; M−P: Root tip elongation zone cells corresponding to A−D respectively, bar =100 μm
图 6 不同浓度NaCl处理下根尖细胞的形态差异A~D分别为0、50、100和150 mmol/L的NaCl溶液处理后的根尖细胞,标尺= 20 µm;E~H分别为A~D对应的分生区细胞,标尺= 40 µm;I~L分别为A~D对应的伸长区细胞,标尺= 40 µm;M~P分别为A~D对应的伸长区细胞,标尺= 100 µmFigure 6. Morphological differences of root tip cells under different NaCl concentrationsA−D: Root tip cells under NaCl concentration of 0, 50, 100, and 150 mmol/L, respectively, bar = 20 μm; E−H: Root tip meristematic zone cells corresponding to A−D respectively, bar = 40 μm; I−L: Root tip elongation zone cells corresponding to A−D respectively, bar =40 μm; M−P: Root tip elongation zone cells corresponding to A−D respectively, bar =100 μm在对照中,‘华多1号’的根尖伸长区细胞排列紧密,细胞轮廓清晰,细胞核明显、胞质浓密(图6I、6M)。当NaCl胁迫浓度为50 mmol/L时,‘华多1号’根尖伸长区细胞与对照相比无明显差异(图6J),但根尖伸长区细胞开始缩小,细胞形态发生轻微改变(图6N);当NaCl胁迫浓度升至100和150 mmol/L时,‘华多1号’根尖伸长区细胞的体积变小(图6K、6L),细胞皱缩较为明显,体积明显缩小,细胞排列松散(图6O、6P),细胞形状变为圆形或者椭圆形。
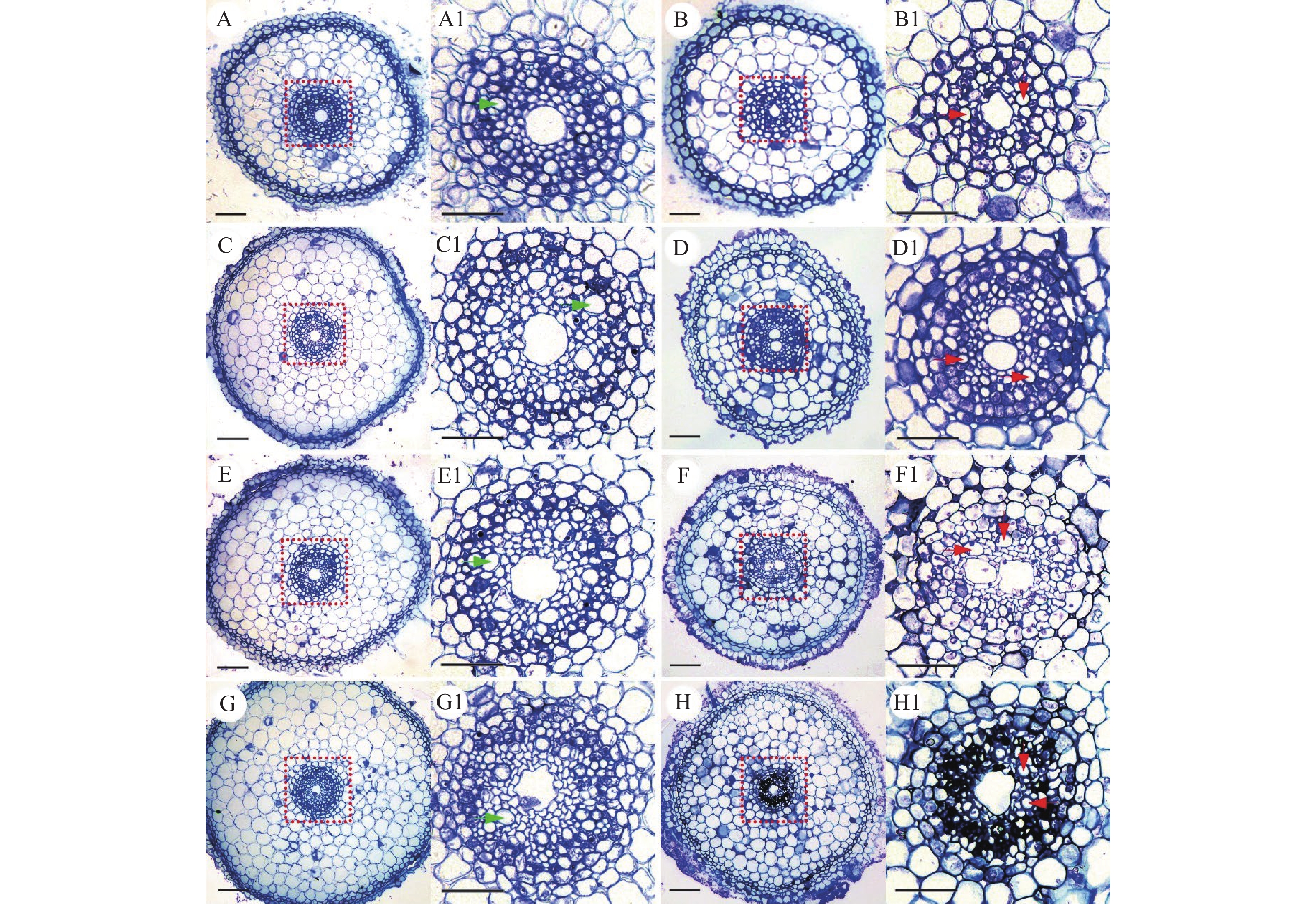
与对照相比(图7A、7B),‘华多1号’在50 mmol/L的NaCl处理下根尖伸长区无明显差异(图7C、7D)。在100和150 mmol/L的NaCl胁迫处理下,根尖伸长区的表皮细胞、皮层层数以及中柱结构形态均存在显著差异(图7E、7F、7G和7H)。其中在NaCl胁迫处理8 d后,‘华多1号’根尖伸长区细胞体积会随着NaCl浓度升高而变小,并且伸长区中的中间皮层细胞层数增加,中柱直径缩小。
![]() 图 7 不同浓度NaCl处理下根尖伸长区横切面差异A、B分别表示0 mmol/L NaCl溶液中处理8和20 d;C、D分别表示在50 mmol/L NaCl溶液中处理8和20 d;E、F分别表示100 mmol/L NaCl溶液中处理8和20 d;G、H分别表示150 mmol/L NaCl溶液中处理8和20 d;A1~H1:分别对应图A~H的根尖伸长区中柱结构细节;绿色和红色箭头分别表示盐胁迫处理下8和20 d后的根尖伸长区木质部;A~H:标尺=100 μm,A1-H1:标尺=20 μmFigure 7. Transection of root tip elongation zone under different NaCl concentrationsA, B: Transection of root tip elongation zone under the 0 mmol/L NaCl treatment after the 8th day and 20th day; C, D: Transection of root tip elongation zone under the 50 mmol/L NaCl treatment afterthe 8th day and 20th day; E, F Transection of root tip elongation zone under the 100 mmol/L NaCl treatment after the 8th day and 20th day; G, H: Transection of root tip elongation zone under the 150 mmol/L NaCl treatment after the 8th day and 20th day; A1−H1: Detailed diagram of the column structure in the root tip elongation zone corresponding to figure A−H; The green arrow indicates the xylem of the root tip elongation zone under salt stress treatment after the 8th day, and the red arrow indicates the xylem of the root tip elongation zone under salt stress treatment after the 20th day; Bar = 100 μm in figure A−H, bar = 20 μm in figure A1−H1
图 7 不同浓度NaCl处理下根尖伸长区横切面差异A、B分别表示0 mmol/L NaCl溶液中处理8和20 d;C、D分别表示在50 mmol/L NaCl溶液中处理8和20 d;E、F分别表示100 mmol/L NaCl溶液中处理8和20 d;G、H分别表示150 mmol/L NaCl溶液中处理8和20 d;A1~H1:分别对应图A~H的根尖伸长区中柱结构细节;绿色和红色箭头分别表示盐胁迫处理下8和20 d后的根尖伸长区木质部;A~H:标尺=100 μm,A1-H1:标尺=20 μmFigure 7. Transection of root tip elongation zone under different NaCl concentrationsA, B: Transection of root tip elongation zone under the 0 mmol/L NaCl treatment after the 8th day and 20th day; C, D: Transection of root tip elongation zone under the 50 mmol/L NaCl treatment afterthe 8th day and 20th day; E, F Transection of root tip elongation zone under the 100 mmol/L NaCl treatment after the 8th day and 20th day; G, H: Transection of root tip elongation zone under the 150 mmol/L NaCl treatment after the 8th day and 20th day; A1−H1: Detailed diagram of the column structure in the root tip elongation zone corresponding to figure A−H; The green arrow indicates the xylem of the root tip elongation zone under salt stress treatment after the 8th day, and the red arrow indicates the xylem of the root tip elongation zone under salt stress treatment after the 20th day; Bar = 100 μm in figure A−H, bar = 20 μm in figure A1−H1在NaCl处理8 d后,对照的根尖伸长区中柱结构细胞大小均匀且排列整齐(图7A1),50 mmol/L的NaCl处理下的中柱结构与对照基本一致(图7C1),100 mmol/L的NaCl处理下的中柱结构细胞有轻微形变(图7E1),但在150 mmol/L的NaCl处理下,其中柱结构细胞形变明显呈不规则状(图7G1)。至NaCl处理20 d后,‘华多1号’根尖伸长区直径较胁迫处理8 d后更小(图7),表皮和外皮层细胞存在增厚现象且细胞排列更为紧密(图7D和图7F),木质部导管分化数目增加(图7D1,7F1,7H1);其中在150 mmol/L的NaCl处理至20 d后,其中柱结构细胞溃烂严重(图7H1)。
2.6 ‘华多1号’基因组变异及差异基因注释
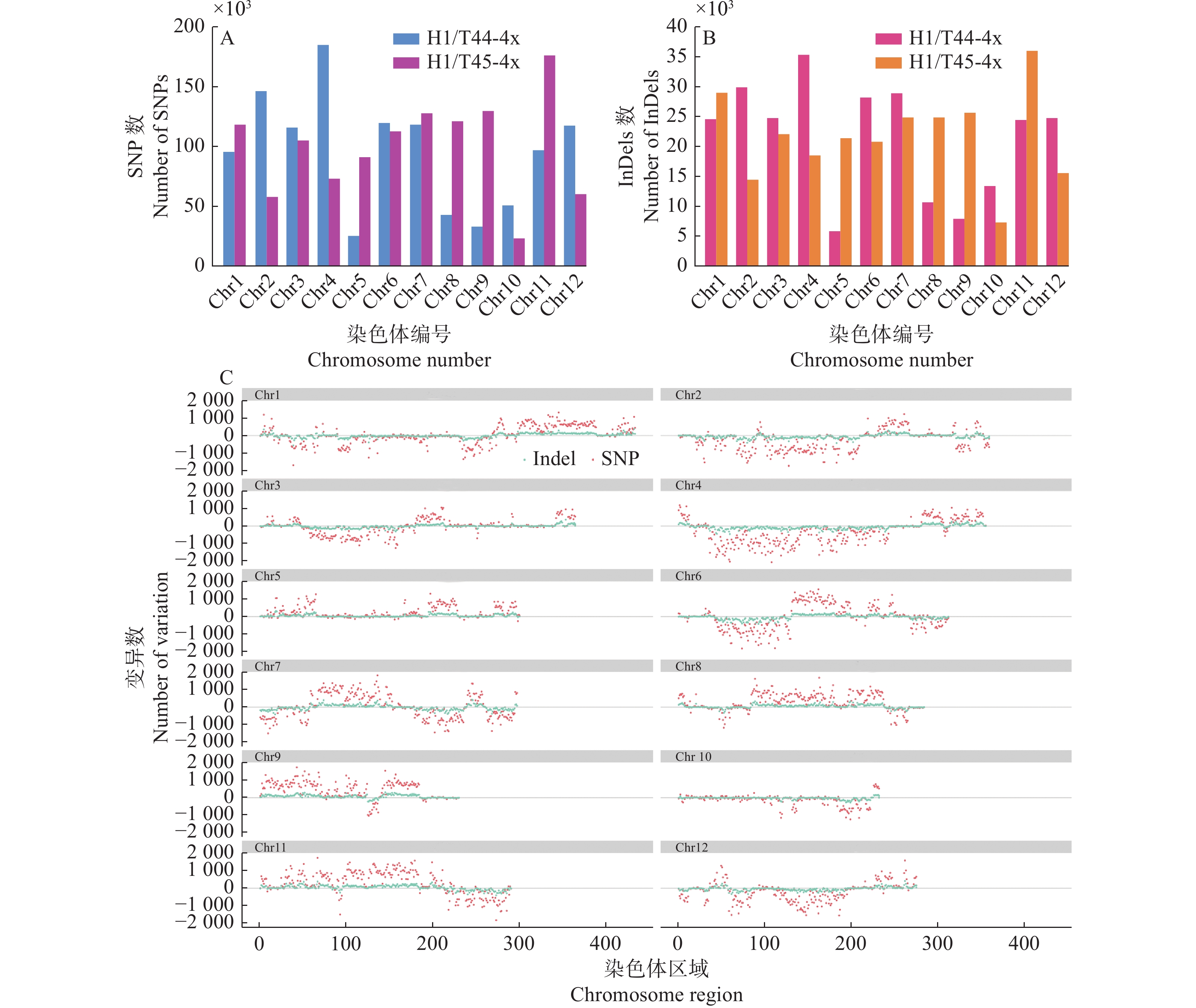
基因组水平比较研究‘华多1号’及双亲(T44-4x和T45-4x)在SNPs及InDels方面的差异(图8)。与亲本T44-4x相比,‘华多1号’在4号染色体上的单核苷酸多态性(SNPs)数量最多,而在5号染色体上检测到的SNPs数量最少;与亲本T45-4x相比,‘华多1号’在11号染色体上检测到的SNPs数量最多,而在10号染色体上检测到的SNPs数量最少(图8A)。在插入/缺失(InDels)方面,‘华多1号’与T44-4x相比,其在4号染色体上检测到的InDels数量最多,而在9号染色体上的InDels数量最少;‘华多1号’与T45-4x相比,其在11号染色体上检测到的InDels最多,而在10号染色体上的InDels数量最少(图8B)。
![]() 图 8 ‘华多1号’及双亲在各染色体的基因组变异情况图C中,‘华多1号’分别与T44-4x和T45-4x的SNPs(粉红色)和InDels(浅绿色)的差值显示在纵轴上,正数表示H1和T44-4x之间的变化,负数表示H1和T45-4x之间的差异Figure 8. Genomic variation of ‘Huaduo1’ and its parents on each chromosomeIn figure C, the difference of SNPs (pink) and InDels (light green) in ‘Huaduo1’ is listed on the vertical axis, compared with T44-4x and T45-4x, respectively, the positive numbers represent the change between ‘Huaduo1’ and T44-4x, and the negative numbers represent the differences between ‘Huaduo1’ and T45-4x
图 8 ‘华多1号’及双亲在各染色体的基因组变异情况图C中,‘华多1号’分别与T44-4x和T45-4x的SNPs(粉红色)和InDels(浅绿色)的差值显示在纵轴上,正数表示H1和T44-4x之间的变化,负数表示H1和T45-4x之间的差异Figure 8. Genomic variation of ‘Huaduo1’ and its parents on each chromosomeIn figure C, the difference of SNPs (pink) and InDels (light green) in ‘Huaduo1’ is listed on the vertical axis, compared with T44-4x and T45-4x, respectively, the positive numbers represent the change between ‘Huaduo1’ and T44-4x, and the negative numbers represent the differences between ‘Huaduo1’ and T45-4x我们重点选取‘华多1号’与亲本在基因CDS区存在变异的位点进行研究,该类变异更易引起基因编码区的变异,进而可能影响基因的表达。与亲本相比,‘华多1号’的基因组中共发现1411个基因与亲本之一存在基因序列的变异。对上述基因进行基因本体(Gene ontology, GO)注释分析,具体从GO的3个部分,即生物过程(Biological process)、细胞组分(Cellular component)和分子功能(Molecular function)进行初步注释,并利用agriGO数据库对‘华多1号’差异基因进行GO富集分析(图9),在生物过程方面,‘华多1号’的差异基因主要表现在RNA依赖的DNA复制过程(RNA-dependent DNA replication)、细胞凋亡(Apoptosis)、染色体组装与拆卸(Chromatin assembly or disassembly)、DNA整合(DNA integration)、核苷酸代谢过程(Nucleotide metabolic process)和防御反应(Defense response)等方面;在分子功能方面,差异基因主要与DNA结合(DNA binding)、RNA导向的DNA聚合酶活性(RNA-directed DNA polymerase activity)、RNA结合(RNA binding)和核糖核酸酶H活性(Ribonuclease H activity)等相关;在细胞组分上,差异基因主要与核染色质(Chromatin)和细胞核(Nucleus)等相关。
将‘华多1号’基因组中存在变异的基因与已知的盐敏感及盐胁迫抗性基因进行整合分析。与亲本之一相比,在‘华多1号’中发现85个盐胁迫基因在CDS区中存在差异,其中,53个是盐敏感相关基因、32个是盐胁迫抗性相关基因。在0和150 mmol/L NaCl处理8 d后的根尖组织中,选取4个盐敏感基因(LOC_Os03g16900、LOC_Os06g48510、LOC_Os02g34810和LOC_Os04g32920)和2个耐盐性基因(LOC_Os03g20090和LOC_Os11g26790)进行实时荧光定量PCR分析,研究结果(图10)表明:与对照根尖组织相比,上述盐胁迫基因在150 mmol/L NaCl处理8 d后的‘华多1号’根尖组织中均存在上调表达,说明‘华多1号’根部组织可能具有较强的盐胁迫适应性。
3. 讨论与结论
多倍体植物除了具有强大的生物学活力和杂种优势外,还存在较强的抗胁迫能力,其能在短时间内适应环境变化[22-23]。前人研究发现,与二倍体水稻相比,四倍体水稻可通过减少钠离子的吸收,在盐胁迫环境中有更强的存活能力[24]。本研究供试的新型四倍体水稻是高育性的多倍体水稻新种质,其携带多种特异和优异基因[7-8, 11]。值得注意的是,新型四倍体水稻与低育性的同源四倍体水稻杂交后,其杂种F1育性表现正常,并可产生强大的产量优势,显示出广阔的应用前景[25]。但新型四倍体水稻耐盐性的研究鲜见报道。因此,挖掘和揭示新型四倍体水稻的品种特性,加快揭示新型四倍体水稻的应用潜力,具有十分重要的现实意义。
本研究选用6个不同浓度梯度的NaCl溶液模拟盐胁迫环境,比较研究‘华多1号’在不同盐胁迫程度下种子萌发及幼苗建成差异。研究结果表明,与对照相比,‘华多1号’随着NaCl浓度升高时,其平均发芽时间、发芽率、萌发指数、幼苗株高、幼苗根长和幼苗鲜质量等指标会呈现下降趋势。上述结果与盐胁迫条件下二倍体水稻的萌发特性基本一致。前人研究结果表明,水稻种子发芽情况受盐浓度影响差异较大,适当的盐胁迫对水稻种子萌发与幼苗建成影响不显著,当盐分浓度高于临界值时种子萌发相关指标会受到抑制[26-27]。二倍体水稻中的耐盐性评价临界NaCl胁迫浓度是150或200 mmol/L。在本研究中,‘华多1号’在150和200 mmol/L的NaCl处理下,其种子发芽率达84.7%以上。至NaCl浓度达250 mmol/L时,‘华多1号’的种子仍能露白发芽,其种子发芽率仍然达到61.3%。这一结果说明‘华多1号’在高浓度的NaCl处理下仍具有较好的发芽率。在水稻耐盐性评价中,水稻萌发相对盐害率是一个耐盐性评价和分级的指标[13-14]。本研究中,‘华多1号’在150和200 mmol/L的NaCl处理下,其相对盐害率不到2%,反应出极强的耐盐抗性。至250 mmol/L的高浓度NaCl胁迫条件下,其相对盐害率为20%~40%,仍然达到强耐盐性标准。综合‘华多1号’在NaCl胁迫处理下的结果,说明‘华多1号’具有较强的盐胁迫耐性。
在幼苗建成阶段,在四周盐浓度较高时,水稻植株侧根数明显降低,同时根部长度也显著缩短[28]。在植物根系结构中,根部皮层细胞层数与根吸收水分的横向运输距离有关,其表皮细胞和中柱结构是根吸水及水分运输的主要构成部分[29]。在本研究中,‘华多1号’在0、50、100和150 mmol/L的NaCl处理20 d后的根部伸长区直径较处理8 d后会变得更小,说明‘华多1号’的根系在NaCl胁迫下仍能伸长,具备一定的盐胁迫适应能力。在NaCl浓度升高及处理时间延长时,‘华多1号’根系皮层中的细胞层数会增加,并且中柱结构细胞出现损坏,这一结果表明NaCl胁迫会导致‘华多1号’的根系吸水受阻。但研究中还发现,‘华多1号’根尖组织中表皮及外皮层细胞增厚,木质部导管数量增加,这一结构的改变在一定程度上说明‘华多1号’能适应NaCl胁迫环境,具备改善根系吸水能力及疏导组织运输能力。在本研究中,我们还利用重测序技术比较分析了‘华多1号’及其双亲在基因组水平的差异,发现‘华多1号’基因组中有1411个基因的序列与其双亲存在差异。已有研究结果表明,新型四倍体水稻基因组中存在非亲变异以及后代分离表现,并且在一些基因中还存在新的等位变异位点,如热激蛋白基因HSP101等,而同源四倍体水稻未出现类似的变异[11-12]。在本研究中,通过4个正调控增加耐盐性的盐敏感基因及2个耐盐性基因进行基因表达研究,研究结果表明:6个盐胁迫相关基因在盐胁迫条件下表达量均上调。其中LOC_Os11g26790基因是一个ABA应答因子,其基因过量表达后能增强植株的耐盐性[30]。LOC_Os03g20090是一个胁迫应答的MYB转录因子,其在水稻盐分、冷害和脱水胁迫下的忍耐性方面具有调控作用[31]。上述结果表明盐胁迫基因在高浓度的NaCl溶液中上调表达,其可能是‘华多1号’具有较强的盐胁迫适应性,表现较强耐盐性的原因,值得下一步深入研究,该结果也为进一步解释和揭示新型四倍体水稻的耐盐性调控机理提供了基础。
综上所述,新型四倍体水稻‘华多1号’具有较强的耐盐性,其在250 mmol/L的NaCl溶液处理下,种子发芽率达到60%以上。同时,NaCl胁迫处理下水稻根尖表皮和外皮层细胞增厚,木质部导管数量增加,在一定程度上为其适应NaCl胁迫并改善根系吸水能力及疏导组织运输能力提供了途径。另外,‘华多1号’中的盐胁迫抗性相关基因在NaCl处理后存在表达差异,这可能是其表现出高抗性的原因。该研究可为后续系统评价四倍体水稻种质资源的耐盐性、揭示四倍体水稻的耐盐性调控机理,以及后续筛选耐盐多倍体水稻品种提供理论依据。
-
图 6 不同浓度NaCl处理下根尖细胞的形态差异
A~D分别为0、50、100和150 mmol/L的NaCl溶液处理后的根尖细胞,标尺= 20 µm;E~H分别为A~D对应的分生区细胞,标尺= 40 µm;I~L分别为A~D对应的伸长区细胞,标尺= 40 µm;M~P分别为A~D对应的伸长区细胞,标尺= 100 µm
Figure 6. Morphological differences of root tip cells under different NaCl concentrations
A−D: Root tip cells under NaCl concentration of 0, 50, 100, and 150 mmol/L, respectively, bar = 20 μm; E−H: Root tip meristematic zone cells corresponding to A−D respectively, bar = 40 μm; I−L: Root tip elongation zone cells corresponding to A−D respectively, bar =40 μm; M−P: Root tip elongation zone cells corresponding to A−D respectively, bar =100 μm
图 7 不同浓度NaCl处理下根尖伸长区横切面差异
A、B分别表示0 mmol/L NaCl溶液中处理8和20 d;C、D分别表示在50 mmol/L NaCl溶液中处理8和20 d;E、F分别表示100 mmol/L NaCl溶液中处理8和20 d;G、H分别表示150 mmol/L NaCl溶液中处理8和20 d;A1~H1:分别对应图A~H的根尖伸长区中柱结构细节;绿色和红色箭头分别表示盐胁迫处理下8和20 d后的根尖伸长区木质部;A~H:标尺=100 μm,A1-H1:标尺=20 μm
Figure 7. Transection of root tip elongation zone under different NaCl concentrations
A, B: Transection of root tip elongation zone under the 0 mmol/L NaCl treatment after the 8th day and 20th day; C, D: Transection of root tip elongation zone under the 50 mmol/L NaCl treatment afterthe 8th day and 20th day; E, F Transection of root tip elongation zone under the 100 mmol/L NaCl treatment after the 8th day and 20th day; G, H: Transection of root tip elongation zone under the 150 mmol/L NaCl treatment after the 8th day and 20th day; A1−H1: Detailed diagram of the column structure in the root tip elongation zone corresponding to figure A−H; The green arrow indicates the xylem of the root tip elongation zone under salt stress treatment after the 8th day, and the red arrow indicates the xylem of the root tip elongation zone under salt stress treatment after the 20th day; Bar = 100 μm in figure A−H, bar = 20 μm in figure A1−H1
图 8 ‘华多1号’及双亲在各染色体的基因组变异情况
图C中,‘华多1号’分别与T44-4x和T45-4x的SNPs(粉红色)和InDels(浅绿色)的差值显示在纵轴上,正数表示H1和T44-4x之间的变化,负数表示H1和T45-4x之间的差异
Figure 8. Genomic variation of ‘Huaduo1’ and its parents on each chromosome
In figure C, the difference of SNPs (pink) and InDels (light green) in ‘Huaduo1’ is listed on the vertical axis, compared with T44-4x and T45-4x, respectively, the positive numbers represent the change between ‘Huaduo1’ and T44-4x, and the negative numbers represent the differences between ‘Huaduo1’ and T45-4x
表 1 盐胁迫相关基因的qRT-PCR引物序列
Table 1 Primer sequence for qRT-PCR of salt stress related genes
基因名称
Gene name引物序列 (5'→3')
Primer sequenceLOC_Os03g16900 F: ATAATGAAGCATCCGATT R: ATATGAGCAACAGAACAC LOC_Os03g20090 F: ACAACGAGATCAAGAACTACTG R: TTGAACTGCTGGCTGTTG LOC_Os11g26790 F: TCCAGCTCAAGCTCGTCT R: AGCTTCTCCTTGATCTTCTCCTT LOC_Os04g32920 F: TCCTCTCCCTCATCCTCT R: CATTGTCGTTGGCGTAGA LOC_Os02g34810 F: GCTTATCCAACCAATCAA R: ACATCAACTCGTCCATAT LOC_Os06g48510 F: ACACCTCGTTGCCTCATA R: ATAGCCACCATCCAGATAGTT Ubiquition F: ACCACTTCGACCGCCACTACT R: ACGCCTAAGCCTGCTGGTT 表 2 不同浓度NaCl胁迫对‘华多1号’种子发芽时间的影响1)
Table 2 Effects of salt stress with different NaCl concentration on seed germination time of ‘Huaduo1’
c(NaCl)/(mmol·L−1) 发芽起始时间/d
Germination initiation time发芽终止时间/d
Germination termination time平均发芽时间/d
Average germination time0 4 5 4.25±0.030a 50 4 5 4.36±0.009a 100 4 6 4.77±0.113b 150 4 7 4.97±0.154b 200 4 7 5.19±0.182c 250 5 8 6.81±0.409d 1)同列数据后不同小写字母表示差异显著(P<0.05,LSD法)
1)Different lowercase letters in the same column indicate significant differences (P<0.05, LSD method ) -
[1] 蔡得田, 袁隆平, 卢兴桂. 二十一世纪水稻育种新战略Ⅱ: 利用远缘杂交和多倍体双重优势进行超级稻育种[J]. 作物学报, 2001, 27(1): 110-116. [2] WU J W, HU C Y, SHAHID M Q, et al. Analysis on genetic diversification and heterosis in autotetraploid rice[J]. SpringerPlus, 2013, 2: 439. doi: 10.1186/2193-1801-2-439
[3] YANG P M, HUANG, Q C, QIN, G Y, et al. Different drought-stress responses in photosynthesis and reactive oxygen metabolism between autotetraploid and diploid rice[J]. Photosynthetica, 2014, 52: 193-202. doi: 10.1007/s11099-014-0020-2
[4] 阮华强, 黄群策, 杨鹏鸣. 同源四倍体水稻光合特性初步研究[J]. 杂交水稻, 2016, 31(2): 76-80. [5] 宋文昌, 张玉华. 水稻四倍化及其对农艺性状和营养成分的影响[J]. 作物学报, 1992, 18(2): 137-144. [6] XIAN L, LONG Y, YANG M, et al. iTRAQ-based quantitative glutelin proteomic analysis reveals differentially expressed proteins in the physiological metabolism process during endosperm development and their impacts on yield and quality in autotetraploid rice[J]. Plant Science, 2021, 306: 110859. doi: 10.1016/j.plantsci.2021.110859
[7] GUO H B, MENDRIKAHY J N, XIE L, et al. Transcriptome analysis of neo-tetraploid rice reveals specific differential gene expressions associated with fertility and heterosis[J]. Scientific Reports, 2017, 7: 40139. doi: 10.1038/srep40139
[8] BEI X, SHAHID M Q, WU J, et al. Re-sequencing and transcriptome analysis reveal rich DNA variations and differential expressions of fertility-related genes in neo-tetraploid rice[J]. PLoS One, 2019, 14(4): e0214953. doi: 10.1371/journal.pone.0214953
[9] GHALEB M A A, LI C, SHAHID M Q, et al. Heterosis analysis and underlying molecular regulatory mechanism in a wide-compatible neo-tetraploid rice line with long panicles[J]. BMC Plant, 2020, 20: 83. doi: 10.1186/s12870-020-2291-z
[10] CHEN L, YUAN Y, WU J, et al. Carbohydrate metabolism and fertility related genes high expression levels promote heterosis in autotetraploid rice harboring double neutral genes[J]. Rice, 2019, 12(1): 34. doi: 10.1186/s12284-019-0294-x
[11] YU H, SHAHID M Q, LI Q, et al. Production assessment and genome comparison revealed high yield potential and novel specific alleles associated with fertility and yield in neo-tetraploid rice[J]. Rice, 2020, 13(1): 32. doi: 10.1186/s12284-020-00387-3
[12] YU H, LI Q, LI Y, et al. Genomics analyses reveal unique classification, population structure and novel allele of neo-tetraploid rice[J]. Rice, 2021, 14(1): 16. doi: 10.1186/s12284-021-00459-y
[13] HUANG Y, HUANG Q, LI J, et al. Photosynthetic physiology and molecular response mechanisms of indica-japonica intersubspecific tetraploid rice seedlings to ion beams[J]. Journal of Plant Growth Regulation, 2021, 40(2): 722-735. doi: 10.1007/s00344-020-10136-x
[14] TU Y, JIANG A, GAN L, et al. Genome duplication improves rice root resistance to salt stress[J]. Rice, 2014, 7(1): 15. doi: 10.1186/s12284-014-0015-4
[15] 刘向东, 吴锦文, 陆紫君, 等. 同源四倍体水稻: 低育性机理、改良与育种展望[J]. 遗传, 2023. doi: 10.16288/j.yczz.23-074. [16] 汪宗立, 李建坤, 王志霞. 水稻耐盐性的生理研究 IV. 盐渍对超氧物歧化酶和过氧化氢酶活性的影响[J]. 江苏农业学报, 1990, 6(2): 1-6. [17] 顾兴友, 郑少玲, 严小龙, 等. 盐浓度对水稻苗期耐盐指标变异度的影响[J]. 华南农业大学学报[J], 1998, 19(1): 33-37. [18] ZENG Y X, HU C Y, LU Y G, et al. Diversity of abnormal embryo sacs in indica/japonica hybrids in rice demonstrated by confocal microscopy of ovaries[J]. Plant Breeding, 2010, 126: 574-580.
[19] WU J W, CHEN Y, LIN H, et al. Comparative cytological and transcriptome analysis revealed the normal pollen development process and up-regulation of fertility-related genes in newly developed tetraploid rice[J]. International of Molecular Science, 2020, 21(19): 7046. doi: 10.3390/ijms21197046
[20] WU J W, SHAHID M Q, GUO H B, et al. Comparative cytological and transcriptomic analysis of pollen development in autotetraploid and diploid rice[J]. Plant Reproduction, 2014, 27(4): 181-196. doi: 10.1007/s00497-014-0250-2
[21] LIVAK K J, SCHMITTGEN T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2−ΔΔCT method[J]. Methods, 2001, 25(4): 402-408.
[22] COMAI L. The advantages and disadvantages of being polyploid[J]. Nature Reviews Genetics, 2005, 6(11): 836-846. doi: 10.1038/nrg1711
[23] VAN DE PEER Y, MIZRACHI E, MARCHAL K. The evolutionary significance of polyploidy[J]. Nature Reviews Genetics, 2017, 18(7): 411-424. doi: 10.1038/nrg.2017.26
[24] WANG L, CAO S, WANG P, et al. DNA hypomethylation in tetraploid rice potentiates stress- responsive gene expression for salt tolerance[J]. Proceedings of the National Academy of Sciences, 2021, 118(13): e2023981118. doi: 10.1073/pnas.2023981118
[25] 刘向东, 吴锦文, SHAHID M Q. 新型四倍体水稻创制及其杂种优势利用研究进展[J]. 生物技术通报, 2021, 38(1): 44-50. [26] 钟静, 陈大鹏. NaCl胁迫对水稻种子萌发和幼苗生长的影响[J]. 黑龙江农业科学, 2016, 5: 18-20. [27] 贺奇, 杨锋, 王昕, 等. NaCl胁迫对水稻宁粳48号种子萌发特性的影响[J]. 宁夏农林科技, 2017, 58(3): 4-6. [28] 信彩云, 马惠, 赵庆雷, 等. 不同浓度NaCl胁迫对水稻种子发芽及幼苗生长的影响[J]. 大麦与谷类科学, 2019, 36(3): 7-10. [29] 刘胜群, 宋凤斌. 不同耐旱性玉米根系解剖结构比较研究[J]. 干旱地区农业研究, 2007, 2: 86-91. [30] GANGULY M, DATTA K, ROYCHOUDHURY A, et al. Overexpression of Rab16A gene in indica rice variety for generating enhanced salt tolerance[J]. Plant Signaling and Behavior, 2012, 7(4): 502-509. doi: 10.4161/psb.19646
[31] YANG A, DAI X Y, ZHANG W H. A R2R3-type MYB gene, OsMYB2, is involved in salt, cold, and dehydration tolerance in rice[J]. Journal of Experimental Botany, 2012, 63(7): 2541-2556. doi: 10.1093/jxb/err431
-
期刊类型引用(1)
1. 王佳琳,王晓琴,魏少奇,张奥,王素巍,薛焱,贾鑫,曹阳. 外源黄腐酸钾对NaCl胁迫下甘草种子萌发及幼苗生理特性的影响. 种子. 2025(02): 162-168 .  百度学术
百度学术
其他类型引用(1)



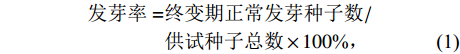


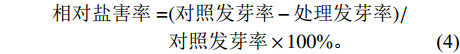
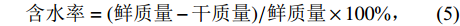
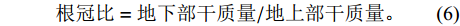
 下载:
下载: