Assessment for soil nutrient content prediction model based on visible-near infrared spectroscopy in the typical regions of Guangdong Province
-
摘要:目的
可见−近红外光谱(Visible-near infrared spectroscopy,VNIRS)可以利用少量土壤样品建立预测模型,从而无损快速地预测土壤养分含量。然而,至今鲜见广东省土壤养分的VNIRS预测模型的报道。本研究旨在通过传统化学分析方法和VNIRS技术对广东典型地区的耕地土壤进行分析,构建土壤全量及速效养分含量的VNIRS预测模型,并评估利用光谱分析土壤全量和速效养分含量的可行性,为广东省土壤养分的快速检测及质量评估提供科学参考。
方法本研究采集了粤东(梅州)、粤西(湛江)、粤北(韶关)、粤西北(肇庆)和珠三角(惠州和珠海) 5个地区共514份耕地土壤样品,测量样品有机质、全氮、可溶性有机碳、碱解氮和速效磷含量,同时利用VNIRS在400~2490 nm波长范围内探明其全光谱特征,筛选定标样品,结合偏最小二乘法和主成分分析,建立预测模型,并在此基础上进行反向验证,评估模型的可行性。
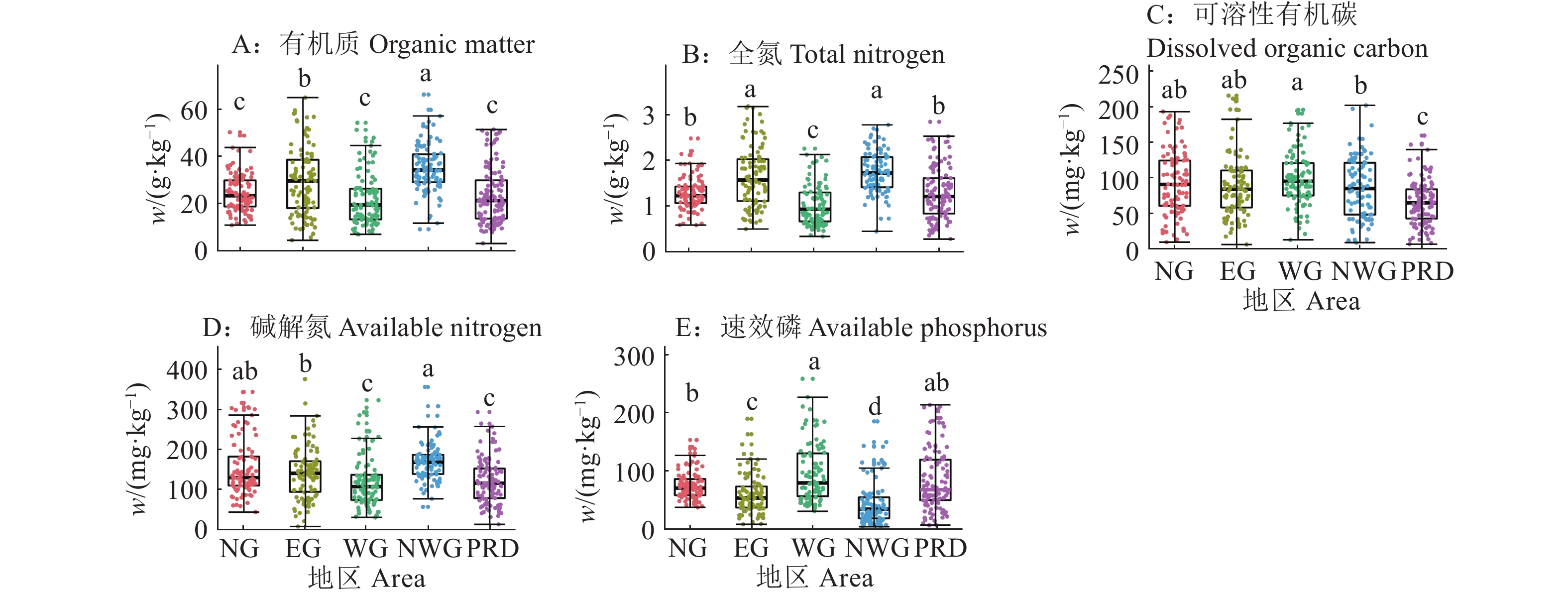
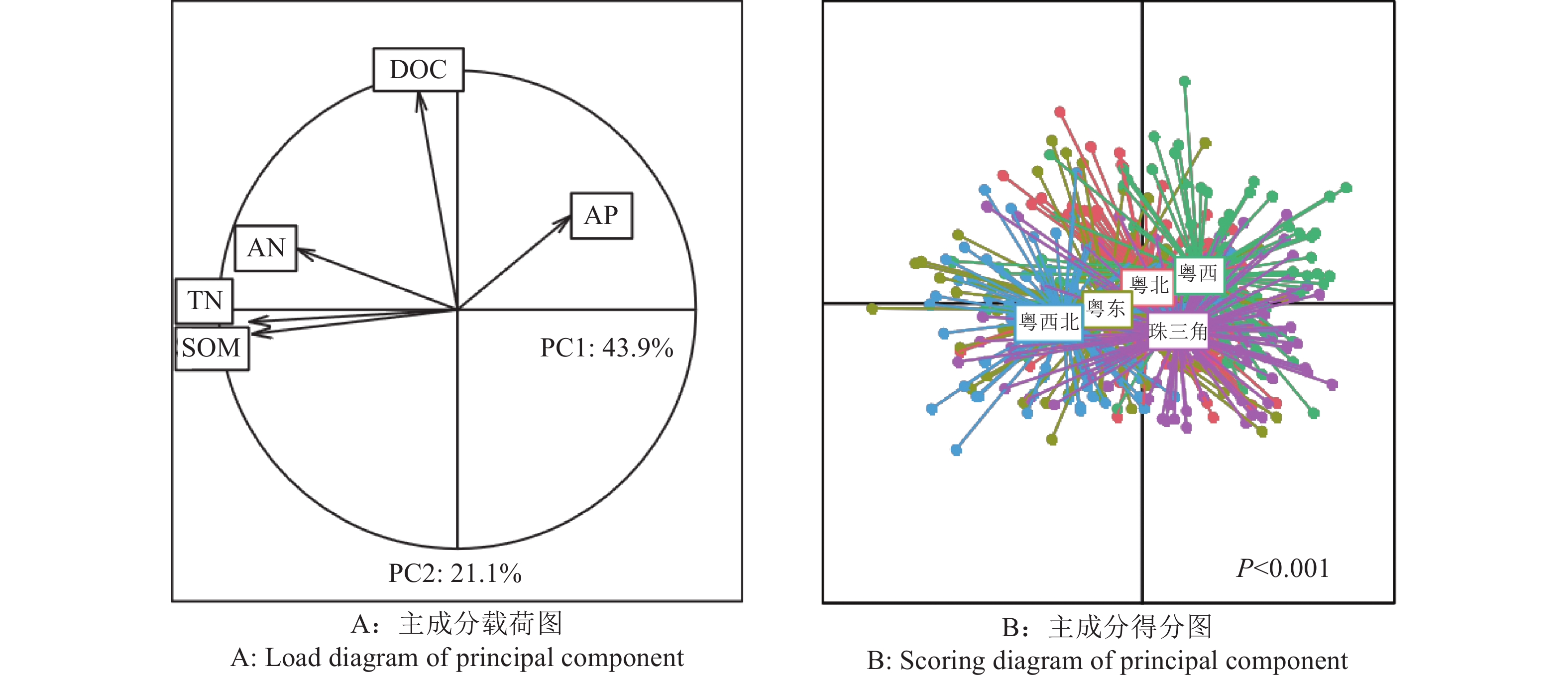
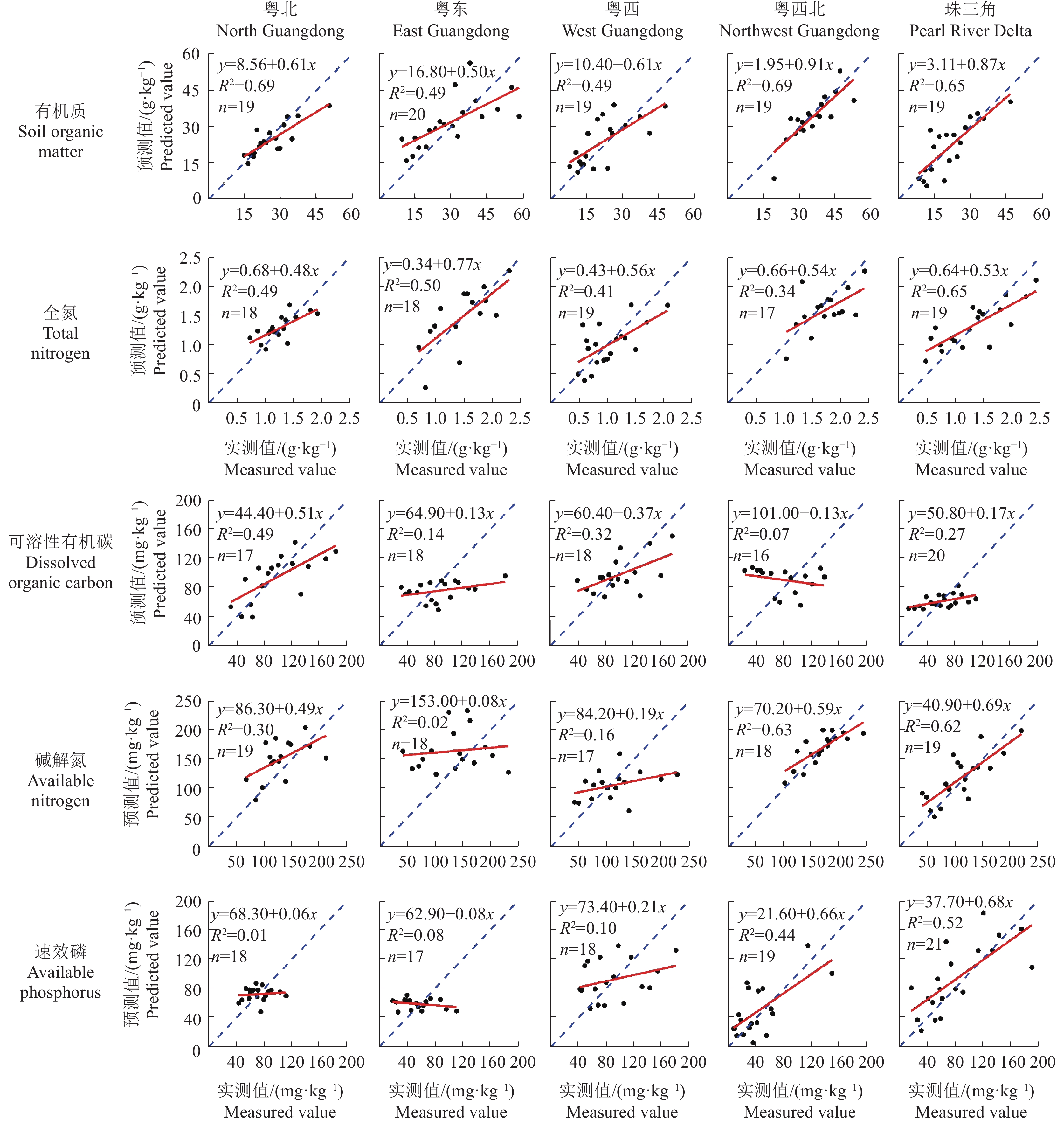
结果各地区土壤有机质、全氮、可溶性有机碳、碱解氮和速效磷含量及光谱特征均存在显著差异。有机质和全氮的定标预测模型效果较好,其中,粤西北地区的有机质定标相关系数达到0.831 1,珠三角地区的全氮定标相关系数达到0.789 8;可溶性有机碳、碱解氮和速效磷的预测模型效果在地区间差异较大,粤西北和珠三角地区碱解氮和速效磷的定标效果远优于其他地区。反向验证结果表明,有机质和全氮的预测值与实测值具有较好的相关性,决定系数(R2)最高分别达到0.69和0.65;粤西北和珠三角地区碱解氮的反向验证结果也较好,R2达到0.63和0.62;而可溶性有机碳和速效磷的反向验证结果总体较差。
结论VNIRS技术能够区分省域内不同地区的土壤来源,可以作为未来土壤分类和土壤质量调查的重要评价指标。VNIRS技术能够较好地直接预测耕地土壤有机质和全氮含量,对可溶性有机碳、碱解氮、速效磷含量的预测存在明显元素差别和地区差异,今后需进一步筛选光谱范围或采用更优方式构建模型。
Abstract:ObjectiveVisible-near-infrared spectroscopy (VNIRS) can non-invasively and rapidly predict soil nutrient contents based on models developed using data of some representative soil samples, but soil nutrient content prediction models for different regions of Guangdong Province are still lacking. In this study, representative agricultural soil samples were collected from Guangdong Province, and models were developed based on the traditional soil chemical analyses and VNIRS spectral signatures. The objective was to assess the predictive ability of the models for soil total and available nutrients so as to provide a scientific basis for rapid soil nutrient content estimation and soil quality evaluation in Guangdong Province.
MethodA total of 514 representative soil samples were collected from the east (Meizhou), west (Zhanjiang), north (Shaoguan), and northwest regions (Zhaoqing) and the Pearl River Delta (Huizhou and Zhuhai) in Guangdong Province, and the contents of soil organic matter, total nitrogen, dissolved organic carbon, available nitrogen, and available phosphorus were analyzed. In addition, the VNIRS spectral signatures of soil samples were obtained between 400 and 2 490 nm. Models were developed and calibrated using partial least squares regression combined with principal component analysis, and the models were reversely validated and assessed for their predictive abilities.
ResultThere were significant differences in the contents of soil organic matter, total nitrogen, dissolved organic carbon, available nitrogen and available phosphorus and VNIRS spectral signatures among the soils from different regions. The models for soil organic matter and total nitrogen showed good prediction performances, with validation determination coefficients of 0.831 1 for soil organic matter in the northwest region and 0.789 8 for total nitrogen in the Pearl River Delta. The models for dissolved organic carbon, available nitrogen, and available phosphorus showed very different prediction performances among regions, with much better performances for available nitrogen and available phosphorus in the northwest region and Pearl River Delta compared with other regions. Model validation showed good correlations between the predicted and measured values of soil organic matter and total nitrogen, with the highest coefficients of determination (R2) being up to 0.69 and 0.65, respectively. The predicted and measured values of available nitrogen in the northwest region and Pearl River Delta also showed good correlations, with R2 of 0.63 and 0.62, respectively. However, model validation showed generally poor correlations between the predicted and measured values of dissolved organic carbon and available phosphorus.
ConclusionVNIRS technology can predict soil organic matter and nutrient contents to differentiate soils from different regions at the provincial scale. Soil VNIRS spectral signature can be used as an important index for soil classification and soil quality evaluation. VNIRS technology shows good performance in the predictions of soil organic matter and total nitrogen contents, but its performance in the predictions of dissolved organic carbon, available nitrogen, and available phosphorus contents is element- and region-dependent. Therefore, future efforts should be focused on spectral range selection and model optimization.
-
大花紫薇Lagerstroemia speciosa为千屈菜科Lythraceae紫薇属Lagerstroemia大乔木,又名为大叶紫薇、大叶百日红、巴拿马等,主要分布于东南亚地区、印度及斯里兰卡,现广泛栽培于我国广东、广西、福建和云南等地[1-2]。大花紫薇树体高大、树形优美、枝叶繁茂、花冠硕大、花色艳丽、花量繁多、花期长久,是重要的夏秋观花景观生态树种[3-5]。
目前,紫薇属中株型矮小的灌木紫薇品种选育获得了巨大成功,但针对高大乔木品种的选育则相对滞后,以大花紫薇为材料的品种选育与改良工作开展较少,且育种手段单一[6]。同时,该树种的应用面临品种花色单调、适生区域窄、结果量大且挂果期长(达8个月)等问题,严重影响开花及花后的景观效果[7-9]。鉴于此,利用多种育种技术进行种质创新成为培育和改良大花紫薇研究的重中之重。
甲基磺酸乙酯(Ethyl methane sulfonate,EMS)是常见的植物育种诱变剂之一,能够诱使材料产生高密度的系列等位基因点突变,已被广泛用于农作物和花卉等草本植物的育种研究上,且取得了不俗的成果[10-13]。相比之下,木本植物因其生长周期较长,运用EMS诱变取得的实质性成果也相对欠缺[14]。本研究以大花紫薇种子为材料,对其采用不同浓度EMS进行不同时间处理,以探究大花紫薇EMS诱变半致死剂量,构建EMS诱变群体,为丰富大花紫薇种质资源提供技术理论支持,同时以期为后续育种提供材料。
1. 材料与方法
1.1 供试材料
大花紫薇果实于2021年12月采自华南农业大学校园内筛选出的单株。果实脱粒后选取饱满种子于−4 ℃冰箱保存。诱变前将大花紫薇种子浸泡在200 mg·L−1赤霉素溶液并置于摇床(30 ℃,150 r·min−1)催芽24 h。
1.2 EMS诱变处理
1.2.1 EMS溶液的配制
称取Na2HPO4·12H2O 35.82 g,用蒸馏水定容至1 L,作为溶液A;称取NaH2PO4·2H2O 15.61 g,用蒸馏水定容至1 L,作为溶液B;磷酸缓冲液按VA∶VB = 63∶39现配现用,使用前用NaOH溶液将pH微调至7.0[15]。
化学诱变剂为EMS(上海麦克林生化科技有限公司),使用磷酸缓冲液进行配制,先配制成0.1 g·mL−1质量浓度溶液,再稀释至所需质量浓度。
1.2.2 处理方法与试验设计
催芽处理后的种子置于100 mL离心管中,加入配制好的不同浓度EMS溶液后于摇床(30 ℃,150 r·min−1)避光进行诱导,在前期预试验0~20 g·L−1质量浓度筛选的基础上,采用随机完全区组设计,EMS溶液设置5个质量浓度梯度(12、14、16、18和20 g·L−1),磷酸缓冲液为空白对照,处理时间设置3个水平(8、10、12 h),共18个处理组合,每个处理50粒种子,重复3次。处理结束后用等体积50 g·L−1 Na2S2O3溶液置于摇床(30 ℃,150 r·min−1)清洗3次,每次10 min,再用流水冲洗2 h,以彻底清除残留药液[16]。最后将清洗的种子置床于铺有3层滤纸和1层纱布的培养皿中,培养条件为16 h·d−1光照、30 ℃的培养箱。
1.3 指标测定
1.3.1 发芽指标测定
每天按时观察种子萌发情况,按需补水,保持滤纸湿润,并及时去除霉变感菌种子。种子萌发以露白作为标准,以连续3 d不再发芽视为发芽终止,每天定时记录各处理发芽数。发芽结束后统计发芽率,计算发芽势和发芽指数。计算公式[17]如下:
$$ \mathrm{发}\mathrm{芽}\mathrm{率}=\dfrac{\mathrm{种}\mathrm{子}\mathrm{发}\mathrm{芽}\mathrm{总}\mathrm{数}}{\mathrm{供}\mathrm{试}\mathrm{种}\mathrm{子}\mathrm{数}}\times \text{100{\text{%}}}, $$ (1) $$ \text{相对发芽率}\text=\dfrac{\text{处理组发芽率}}{\text{对照组发芽率}}\times \text{100{\text{%}}}, $$ (2) $$ \mathrm{发}\mathrm{芽}\mathrm{势}=\dfrac{\mathrm{发}\mathrm{芽}\mathrm{高}\mathrm{峰}\mathrm{期}\mathrm{发}\mathrm{芽}\mathrm{种}\mathrm{子}\mathrm{数}}{\mathrm{供}\mathrm{试}\mathrm{种}\mathrm{子}\mathrm{数}}\times \text{100{\text{%}}}, $$ (3) $$ \mathrm{相}\mathrm{对}\mathrm{发}\mathrm{芽}\mathrm{势}=\dfrac{\mathrm{处}\mathrm{理}\mathrm{组}\mathrm{发}\mathrm{芽}\mathrm{势}}{\mathrm{对}\mathrm{照}\mathrm{组}\mathrm{发}\mathrm{芽}\mathrm{势}}\times \text{100{\text{%}}}, $$ (4) $$ \mathrm{发}\mathrm{芽}\mathrm{指}\mathrm{数}=\displaystyle\sum \dfrac{G_t}{t}, $$ (5) 式中:Gt为第t天发芽数;t为发芽天数。
$$ \mathrm{相}\mathrm{对}\mathrm{发}\mathrm{芽}\mathrm{指}\mathrm{数}=\dfrac{\mathrm{处}\mathrm{理}\mathrm{组}\mathrm{发}\mathrm{芽}\mathrm{指}\mathrm{数}}{\mathrm{对}\mathrm{照}\mathrm{组}\mathrm{发}\mathrm{芽}\mathrm{指}\mathrm{数}}\times \text{100{\text{%}}}。 $$ (6) 半致死剂量(Lethal concentration 50,LC50)以处理大花紫薇种子的相对致死率确定,相对致死率为50%时获得半致死剂量[18]。
$$\mathrm{相}\mathrm{对}\mathrm{致}\mathrm{死}\mathrm{率}=1 - \mathrm{相}\mathrm{对}\mathrm{发}\mathrm{芽}\mathrm{率}。 $$ (7) 1.3.2 胚轴及胚根测定
发芽终止5 d后,每个处理随机抽取10株芽苗,重复3次(数量不足的全组测量),使用游标卡尺(精度为0.1 mm)测量胚轴及胚根长,取平均值。
1.3.3 大花紫薇幼苗形态学指标的观测
经诱变处理的大花紫薇芽苗长出真叶时,移栽至穴盘(基质为V泥炭土∶V珍珠岩=3∶1)培养至5~6 cm时,移栽至花盆中(基质为V泥炭土∶V黄心土=1∶1),于田间进行常规培育120 d后,测定其形态学指标。株高、冠幅和地径分别使用尺子和游标卡尺(精度0.1 mm)测量;叶长、叶宽、叶面积及叶形指数(每株选取第3~5位成熟叶片)使用叶面积仪测量(CL-203,CID,美国)。每个处理组随机选取10株进行测量,3次重复,取平均值。
1.4 数据处理
采用Microsoft Excel 2019对原始数据进行记录,利用SPSS 26.0软件进行方差分析,多重比较采用Duncan’s法,数据采用平均数 ± 标准误表示。绘图采用Origin 2019软件。
2. 结果与分析
2.1 不同处理对大花紫薇种子萌发的影响
表1结果显示,诱变时间相同时,发芽率、发芽势及发芽指数随着EMS浓度的升高呈下降趋势,部分处理种子发芽情况见图1。EMS质量浓度在16 g·L−1及以上时,发芽率迅速降低,12 h 20 g·L−1 EMS处理时降至为0,反映了高浓度EMS对发芽率的作用更加明显。发芽势反映种子生命力的强弱,决定种子出苗的整齐程度,在相同时间处理条件下,随着EMS浓度升高,发芽势递减,反映出EMS处理影响大花紫薇种子出苗的整齐程度。与发芽率相似,EMS质量浓度在16 g·L−1及以上时,发芽势迅速降低,表明高浓度的EMS更易使大花紫薇种子出苗不整齐。发芽指数也是反映种子活力的指标之一,本研究中发现EMS处理对大花紫薇种子毒害作用较强,与对照组相比,不同处理的发芽指数受到显著抑制,当EMS质量浓度高于14 g·L−1,各处理发芽指数均低于10。
表 1 不同EMS处理对大花紫薇种子发芽的影响1)Table 1. Effects of different EMS treatments on germination of Lagerstroemia speciosa seedst/h ρ/(g·L−1) 发芽率/%
Germination rate发芽势/%
Germination vigor发芽指数
Germination index8 0 72.22 ± 2.22a 55.33 ± 0.67a 18.67 ± 0.05a 12 68.89 ± 1.11ab 40.00 ± 0.00b 11.70 ± 0.27b 14 65.56 ± 2.94b 34.67 ± 1.76c 11.69 ± 0.65b 16 54.44 ± 1.11c 30.67 ± 0.67d 8.64 ± 0.37c 18 50.00 ± 1.92c 28.67 ± 1.33d 8.55 ± 0.63c 20 17.78 ± 2.22d 16.67 ± 1.76e 1.88 ± 0.25d 10 0 73.11 ± 1.74a 46.00 ± 1.39a 19.18 ± 0.43a 12 68.22 ± 0.97a 39.33 ± 3.33b 11.99 ± 0.41b 14 58.89 ± 1.60b 37.33 ± 1.76b 10.83 ± 0.47b 16 52.22 ± 1.11c 32.67 ± 1.76b 7.24 ± 0.40c 18 32.89 ± 1.98d 18.67 ± 2.67c 3.24 ± 0.13d 20 5.55 ± 2.22e 4.00 ± 0.00d 0.61 ± 0.16e 12 0 71.78 ± 0.97a 47.78 ± 1.11a 19.92 ± 0.65a 12 65.56 ± 1.82b 46.67 ± 1.76a 10.27 ± 0.28b 14 51.33 ± 1.76c 28.67 ± 1.33b 10.40 ± 0.42b 16 37.33 ± 0.67d 26.67 ± 0.67b 6.73 ± 0.36c 18 14.00 ± 2.31e 11.33 ± 1.33c 1.46 ± 0.29d 20 0.00 ± 0.00f 0.00 ± 0.00d 0.00 ± 0.00e 1) 相同时间同列数据后的不同小写字母表示差异显著(P < 0.05, Duncan’s法)。
1) Different lowercase letters of the same column of the same time indicate significant differences (P < 0.05, Duncan’s method).图2为不同EMS浓度和处理时间下大花紫薇种子相对发芽率、相对发芽势和相对发芽指数情况。与对照组相比,低浓度EMS处理相对发芽率无显著差异,12 g·L−1 EMS处理的相对发芽率均达90%,只有当EMS质量浓度在14 g·L−1以上时,相对发芽率才显著降低。在相同诱变时间条件下,EMS浓度的升高会导致相对发芽势降低。当诱变时间为8 h,相对发芽势变化区间为31.25%~75.00%,当诱变时间为10 h,相对发芽势变化区间为8.70%~85.51%,当诱变时间为12 h,相对发芽势变化区间为0~49.74%。相对发芽指数随着EMS浓度的升高而逐步降低,且当诱变时间为12 h时,降至为0。与对照组相比,当EMS质量浓度高于14 g·L−1时,各处理的相对发芽指数均低于50%。由此可见EMS处理对大花紫薇种子发芽率、相对发芽率、发芽势、相对发芽势、发芽指数和相对发芽指数均有较强的抑制作用,这种抑制作用在高浓度EMS处理下更为明显,并且随着抑制作用的加强,出现不发芽现象。
![]() 图 2 不同EMS处理对大花紫薇种子发芽的影响各图中,相同时间柱子上方的不同小写字母表示不同浓度处理间差异显著(P < 0.05, Duncan’s法)。Figure 2. Effects of different EMS treatments on germination of Lagerstroemia speciosa seedsIn each figure,different lowercase letters on bars of the same time indicate significant differences among treatments with different concentrations (P < 0.05, Duncan’s method).
图 2 不同EMS处理对大花紫薇种子发芽的影响各图中,相同时间柱子上方的不同小写字母表示不同浓度处理间差异显著(P < 0.05, Duncan’s法)。Figure 2. Effects of different EMS treatments on germination of Lagerstroemia speciosa seedsIn each figure,different lowercase letters on bars of the same time indicate significant differences among treatments with different concentrations (P < 0.05, Duncan’s method).2.2 EMS处理对种子发芽进程的影响
由图3可知,EMS处理显著推迟了大花子薇种子的发芽起始时间,在诱变时间相同的情况下,随着EMS浓度的升高,发芽起始时间逐渐推迟。当诱变时间为8 h,发芽起始时间与对照组相比推迟了3.67~7.67 d;当诱变时间为10 h,各处理发芽起始时间与对照相比最少推迟了2.67 d,最长推迟了8.67 d;当诱变时间为12 h,发芽起始时间最早的是12 g·L−1 EMS处理,平均6.33 d开始发芽,比对照组推迟了3.33 d,发芽起始时间最晚的是18 g·L−1 EMS处理,平均10.00 d开始发芽,较对照组推迟了7.00 d。发芽持续时间在诱变时间为8 h时,随着EMS浓度的升高而变长,18 g·L−1 EMS处理发芽持续时间最长,为12.00 d,而20 g·L−1 EMS处理发芽持续时间又降至7.00 d;当诱变时间分别为10和12 h,发芽持续时间随着EMS浓度的升高先延长后缩短,均于14 g·L−1时达到最长,分别为8.67和9.67 d,较对照组延长了2.00和2.67 d。由此可得,在不同浓度和诱变时间作用下,随着EMS浓度的增加会使大花紫薇种子发芽起始时间推迟;高浓度的EMS会导致种子发芽率降低从而缩短发芽持续时间,总体上EMS处理还是会延长发芽的持续时间。
![]() 图 3 不同EMS处理对大花紫薇种子发芽进程的影响各图中,相同时间柱子上方的不同小写字母表示不同浓度处理间差异显著(P < 0.05, Duncan’s法)。Figure 3. Effects of different EMS treatments on germination process of Lagerstroemia speciosa seedsIn each figure,different lowercase letters on bars of the same time indicate significant differences among treatments with different concentrations (P < 0.05, Duncan’s method).
图 3 不同EMS处理对大花紫薇种子发芽进程的影响各图中,相同时间柱子上方的不同小写字母表示不同浓度处理间差异显著(P < 0.05, Duncan’s法)。Figure 3. Effects of different EMS treatments on germination process of Lagerstroemia speciosa seedsIn each figure,different lowercase letters on bars of the same time indicate significant differences among treatments with different concentrations (P < 0.05, Duncan’s method).2.3 EMS处理对胚轴和胚根长度的影响
由图4可知,诱变时间相同时,EMS浓度越高,胚轴长度较对照组变短,整体呈下降趋势,EMS诱变时间与胚轴长度的关系总体也呈现相同的规律。诱变时间为8 h时,12 g·L−1 EMS处理与对照组相比,无显著差异,当EMS浓度逐渐升高,对照组胚轴长度显著长于不同处理,20 g·L−1 EMS处理胚轴长度为8.12 mm,是对照组的49.12%;当诱变时间为10 h,不同处理胚轴长度较对照组缩短5.03~9.55 mm,其中18 g·L−1 EMS处理胚轴长度最短,为6.58 mm,是对照组的41.38%;当诱变时间为12 h,对照组胚轴长度为15.78 mm,而16和18 g·L−1 EMS处理胚轴长度为分别5.64和4.33 mm,仅分别为对照组的35.74%和27.44%。同一诱变时间,EMS浓度越高,胚根长度逐渐变短。在诱变时间为8 h,20 g·L−1 EMS处理胚根长度最短,为8.49 mm,是对照组的23.18%;诱变时间为10 h,18 g·L−1 EMS处理胚根最短,为6.80 mm,是对照组的19.69%,当EMS浓度升至20 g·L−1时,无胚根长出;诱变12 h,16 g·L−1 EMS处理胚根最短,长度仅有4.35 mm,仅为对照组的12.79%,而随着EMS浓度的升高,12 h 18 g·L−1 EMS处理出现无胚根现象。以上结果表明EMS处理能够抑制大花紫薇种子萌发初期胚轴和胚根的生长,且EMS浓度越高、时间越长,种子萌发初期生长受抑制效应越强,胚轴及胚根越短,甚至完全抑制胚根的生长。
![]() 图 4 不同EMS处理对大花紫薇种子胚轴和胚根长度的影响各图中,相同时间柱子上方的不同小写字母表示不同浓度处理间差异显著(P < 0.05, Duncan’s法)。Figure 4. Effects of different EMS treatments on hypocotyls length and radicle length of Lagerstroemia speciosaIn each figure,different lowercase letters on bars of the same time indicate significant differences among treatments with different concentrations (P < 0.05, Duncan’s method).
图 4 不同EMS处理对大花紫薇种子胚轴和胚根长度的影响各图中,相同时间柱子上方的不同小写字母表示不同浓度处理间差异显著(P < 0.05, Duncan’s法)。Figure 4. Effects of different EMS treatments on hypocotyls length and radicle length of Lagerstroemia speciosaIn each figure,different lowercase letters on bars of the same time indicate significant differences among treatments with different concentrations (P < 0.05, Duncan’s method).2.4 EMS诱变半致死剂量
表2结果显示,不同EMS处理抑制了大花紫薇的萌发,EMS浓度越高,处理时间越长,其相对致死率越高。半致死剂量常为EMS诱变最适剂量,本研究中10 h 18 g·L−1 EMS处理相对致死率为55.02%,12 h 16 g·L−1EMS处理相对致死率为47.99%,以上2种处理与半致死剂量最为接近,可作为大花紫薇EMS诱变实际参考剂量。
表 2 不同EMS处理对大花紫薇种子相对致死率的影响Table 2. Effects of different EMS treatments on relative lethality of Lagerstroemia speciosa seedst/h ρ/(g·L−1) 相对致死率1)/%
Relative lethality8 0 0.00 ± 0.00d 12 4.61 ± 1.54cd 14 9.23 ± 4.07c 16 24.61 ± 1.54b 18 30.77 ± 2.66b 20 75.39 ± 3.08a 10 0 0.00 ± 0.00f 12 6.68 ± 1.33e 14 19.45 ± 2.19d 16 28.57 ± 1.52c 18 55.02 ± 2.70b 20 92.40 ± 3.04a 12 0 0.00 ± 0.00f 12 8.67 ± 2.53e 14 28.49 ± 2.46d 16 47.99 ± 0.93c 18 80.50 ± 3.22b 20 100.00 ± 0.00a 1) 相同时间同列数据后的不同小写字母表示差异显著(P < 0.05, Duncan’s法)。
1) Different lowercase letters of the same column of the same time indicate significant differences (P < 0.05, Duncan’s method).2.5 EMS处理对幼苗生长的影响
不同EMS处理的大花紫薇种子萌发后移栽至穴盘,于植物生长室养护管理120 d后对其形态指标进行测定,结果见表3和表4。由表3可知经过EMS处理的大花紫薇幼苗生长受到明显影响,随着EMS浓度升高和处理时间延长,其株高呈逐渐下降趋势,12 h 16 g·L−1 EMS处理株高最小,高度仅为8.28 cm。EMS处理组冠幅与地径也呈现出同样的变化规律,均随着浓度及处理时间的加大而下降,且12 h 16 g·L−1 EMS处理受到抑制也最为明显,此时冠幅和地径分别为9.66 cm和1.70 mm,仅达到对照组的49.90%和52.63%。
表 3 不同EMS处理对大花紫薇幼苗生长的影响1)Table 3. Effects of different EMS treatments on the growth of Lagerstroemia speciosa seedlingst/h ρ/(g·L−1) 株高/cm
Plant
height冠幅/cm
Crown
width地径/mm
Ground
diameter8 0 32.23 ± 0.53a 23.54 ± 1.69a 3.53 ± 0.11a 12 22.61 ± 0.70b 18.22 ± 0.93b 2.87 ± 0.13b 14 19.53 ± 0.66c 16.81 ± 1.06bc 2.51 ± 0.07c 16 18.28 ± 0.64c 16.01 ± 0.61cd 2.09 ± 0.05d 18 14.10 ± 0.30d 14.64 ± 0.34de 1.97 ± 0.12d 20 11.15 ± 0.76e 13.25 ± 0.38e 2.00 ± 0.07d 10 0 32.01 ± 0.24a 20.96 ± 0.58a 3.37 ± 0.05a 12 20.49 ± 0.86b 15.23 ± 0.14b 2.51 ± 0.06b 14 13.77 ± 0.56c 13.82 ± 0.60b 2.15 ± 0.05c 16 10.87 ± 0.48d 10.94 ± 0.56c 1.87 ± 0.08d 18 8.95 ± 0.52e 10.29 ± 0.30c 1.89 ± 0.05d 20 12 0 30.31 ± 0.16a 19.36 ± 0.86a 3.23 ± 0.08a 12 16.29 ± 0.32b 13.73 ± 0.59b 2.29 ± 0.06b 14 11.36 ± 0.48c 10.59 ± 0.22c 2.00 ± 0.06c 16 8.28 ± 0.30d 9.66 ± 0.25c 1.70 ± 0.03d 18 20 1) 相同时间同列数据后的不同小写字母表示差异显著(P < 0.05, Duncan’s法)。
1) Different lowercase letters of the same column of the same time indicate significant differences (P < 0.05, Duncan’s method).表 4 不同EMS处理对大花紫薇幼苗叶片的影响1)Table 4. Effects of different EMS treatments on the leaves of Lagerstroemia speciosa seedlingst/h ρ/(g·L−1) 叶长/cm
Leaf length叶宽/cm
Leaf width叶形指数
Leaf index叶面积/cm2
Leaf area8 0 14.69 ± 0.41a 7.23 ± 0.25a 2.03 ± 0.02b 84.70 ± 3.94a 12 12.89 ± 0.43b 6.16 ± 0.23b 2.10 ± 0.05b 65.05 ± 2.44b 14 12.89 ± 0.26b 6.12 ± 0.04b 2.11 ± 0.04b 62.18 ± 1.14b 16 10.47 ± 0.38c 4.89 ± 0.12c 2.15 ± 0.03b 38.68 ± 3.33c 18 10.10 ± 0.35c 4.81 ± 0.17c 2.12 ± 0.01b 40.07 ± 3.18c 20 8.73 ± 0.65c 3.71 ± 0.33d 2.44 ± 0.04a 28.45 ± 4.62d 10 0 14.70 ± 0.27a 7.25 ± 0.16a 2.03 ± 0.01c 85.90 ± 2.03a 12 12.03 ± 0.30b 5.79 ± 0.16b 2.08 ± 0.02bc 59.68 ± 0.97b 14 9.88 ± 0.29c 4.71 ± 0.16c 2.10 ± 0.03bc 38.69 ± 1.04c 16 8.58 ± 0.31d 4.01 ± 0.11d 2.16 ± 0.02b 30.22 ± 1.38d 18 7.71 ± 0.12d 3.30 ± 0.07e 2.42 ± 0.02a 21.08 ± 1.03e 20 12 0 14.95 ± 0.08a 7.34 ± 0.10a 2.04 ± 0.01b 78.47 ± 0.31a 12 11.81 ± 0.04b 5.65 ± 0.04b 2.09 ± 0.01b 53.41 ± 0.39b 14 9.89 ± 0.46c 4.62 ± 0.26c 2.14 ± 0.02b 36.96 ± 0.92c 16 9.04 ± 0.21c 3.89 ± 0.16d 2.42 ± 0.08a 29.32 ± 1.56d 18 20 1) 相同时间同列数据后的不同小写字母表示差异显著(P < 0.05, Duncan’s法)。
1) Different lowercase letters of the same column of the same time indicate significant differences (P < 0.05, Duncan’s method).表4反映了不同EMS处理对大花紫薇幼苗叶片的影响,结果显示EMS处理组的叶长、叶宽及叶面积均受到抑制,与对照组差异显著,并且随着EMS浓度和处理时间的加大,抑制作用越明显,10 h 18 g·L−1 EMS处理叶片生长受抑制情况最强,其叶长为7.71 cm,叶宽为3.30 cm,叶面积为21.08 cm2,分别是对照组的52.45%、45.52%和24.54%。叶形指数受EMS处理影响不明显,不同处理组随着EMS浓度的升高,叶形指数缓慢递增。当处理时间为8 h时,不同浓度EMS处理组叶形指数为2.10~2.44,当处理时间为10 h时,不同浓度EMS处理组叶形指数为2.08~2.42,当处理时间为12 h时,不同浓度EMS处理组叶形指数为2.09~2.42。此外,由于12 h 18 g·L−1 EMS和12 h 20 g·L−1 EMS处理导致种子萌发无胚根产生,相关处理组移栽后无存活植株。
3. 讨论与结论
3.1 讨论
EMS处理对种子发芽具有抑制作用,且浓度越高抑制作用越明显,这是因为EMS浓度越高越易溶解产生有机酸,毒害作用越强,对种子造成不可逆的严重损伤[19]。王育川等[20]研究发现,随着EMS浓度和处理时间的加大,藜麦Chenopodium quinoa种子发芽势和发芽率呈现下降趋势,表明诱变剂EMS对种子发芽率及发芽势具有抑制作用。本研究通过设置不同浓度EMS和处理时间对大花紫薇进行诱变发现,EMS处理能够显著影响大花紫薇种子的发芽,随着EMS浓度的升高,处理时间的加长,发芽率、发芽势和发芽指数均减小,结果与前人结论一致。EMS处理影响种子发芽进程。本研究中随着EMS浓度及处理时间的加大,发芽起始时间变晚,发芽持续时间变长,但高浓度、长时间的处理组合下,可能由于诱变剂的毒害作用使得发芽种子数变少,发芽持续时间变短。该结论与伊风艳等[21]用EMS处理黄花苜蓿Medicago falcata种子的结论一致,但不同于赵塔等[22]处理党参Codonopsis pilosula种子的结果,不同之处在于党参种子发芽持续时间随着EMS浓度的升高而变短,这种差异可能是植物种类不同造成的,EMS处理降低大花紫薇种子活力,使种子发芽不整齐,造成发芽持续时间延长。胚轴及胚根的生长也受到EMS处理的影响。本研究结果显示,大花紫薇种子胚轴及胚根的长度与EMS浓度和处理时间呈负相关,这与李颜方等[23]对谷子‘晋谷21号’Setaria italica var. germanica进行EMS诱变时所获结果一致。
大量研究表明植株诱变相对致死率达50%时的剂量可作为EMS诱变最佳剂量,不仅可以保证获得更多的突变体植株,又可以增加植物多样性[24-28]。本研究结合大花紫薇种子发芽相对致死率及胚轴、胚根生长情况确定大花紫薇的EMS最适诱变剂量为10 h 18 g·L−1 EMS处理和12 h 16 g·L−1 EMS处理,该结果与伍汉斌等[29]对同属的紫薇进行EMS诱变时获得的半致死剂量相差较大,原因可能是选用的育种方式不同,本研究选用培养皿催芽,而后者选用沙藏法进行紫薇育苗,最终造成结果差异较大。因此,植物EMS诱变育种在剂量选择时需根据物种、条件进行调整,本研究得到的大花紫薇适宜的诱变剂量仅在本文特定的条件下使用,实际生产中可能需在此基础做出微调。
EMS诱变为不定向诱变,但不同处理组合对植物生长会产生一定的效应,且这种效应与EMS浓度及处理时间存在一定的关系[30]。续言等[31]研究发现高浓度的EMS处理促进尾叶紫薇叶片增大,较低浓度EMS处理则促进株高增长,而对幼苗的冠幅和地径等的处理效应不明显。常媚瑕[32]在EMS诱变朝天椒Capsium annuum var. conoides研究中发现,随着EMS浓度的升高、处理时间的延长,大花紫薇幼苗在株高、冠幅、地径、叶长、叶宽、叶面积等方面均受到抑制,而叶形指数较对照处理变大。本研究结果与前者存在差异,和后者相一致,这可能是因为EMS诱变效应存在很大的随机性,处理个体差异较大,在选苗测定时导致差异的产生,为探究具体变化规律需加大测定样本进行进一步分析。
表型性状的突变类型及突变频率对评价诱变群体具有重要意义[33]。张慧等[34]认为EMS诱变后产生的多为隐性突变,突变性状在M1代很少表现,只有经过自交后才能有所表现,因此有关诱变的研究不在M1代对诱变植株进行选择;而Greene等[35]则认为EMS诱发的突变以显性突变为主,诱变性状多为主基因控制的性状,便于突变体的筛选。木本植物生长周期较长,即使是显性突变,也需要在植物成熟后才能确定,本研究EMS诱导获得的大花紫薇植株目前尚不能确定是否发生有益突变,未来将长期对其进行观测,期望能够获得理想的突变单株。
3.2 结论
目前,EMS诱导大花紫薇研究鲜见报道,对其影响大花紫薇种子萌发的情况更是知之甚少。本研究通过设置不同浓度EMS溶液和诱变时间,探究出不同处理对大花紫薇种子萌发、幼苗生长及叶片情况的动态影响,进而确定了大花紫薇种子EMS诱变最佳剂量。利用大花紫薇种子进行EMS诱变时,EMS浓度越高、诱导时间越长,种子发芽率、发芽势及发芽指数受到抑制越明显,萌发初期的生长受抑制效应越强,胚轴及胚根越短,甚至会完全抑制胚根的生长,导致移栽无法存活。最终以半致死剂量作为大花紫薇种子EMS诱变标准,本研究确定了16 g·L−1 EMS处理12 h和18 g·L−1 EMS处理10 h是大花紫薇适宜的诱变剂量,为后续大花紫薇种质资源挖掘、创新利用及优良品系创制提供了材料和理论依据。
-
图 1 广东省不同地区土壤养分含量的差异
NG:粤北,EG:粤东,WG:粵西,NWG:粤西北,PRD:珠三角;各小图中不同小写字母表示不同地区间差异显著(P < 0.05,Duncan’s法)
Figure 1. Differences of soil nutrient contents in different areas of Guangdong Province
NG: North Guangdong, EG: East Guangdong, WG: West Guangdong, NWG: Northwest Guangdong, PRD: Pearl River Delta; Different lowercase letters in each figure indicate significant differences among different areas (P < 0.05, Duncan’s method)
表 1 采样区概况
Table 1 Information about sampling pots
地区
Region行政市
Administrative city样点数量
Sampling point number气候类型
Climate type土壤类型
Soil type粤北
North Guangdong韶关 100 亚热带季风气候 以红壤为主,风化程度深,富铁铝化作用明显,质地较黏重 粤东
East Guangdong梅州 102 亚热带季风气候 以赤红壤、黄壤为主 粤西
West Guangdong湛江 98 热带北缘季风气候 有赤红壤、砖红壤,土层深厚,质地黏重,呈强酸性反应,铁铝富集最为显著 粤西北
Northwest Guangdong肇庆 99 南亚热带季风气候 以赤红壤为主,农田土壤整体偏酸 珠三角
Pearl River Delta惠州 65 亚热带季风气候 有红壤、赤红壤和黄壤,以赤红壤类型分布最广,土壤呈酸性,阳离子交换量较低,矿质养分较贫乏 珠海 50 亚热带季风海洋性
气候有红壤和赤红壤,红壤面积较少,分布不广,300 m以上的丘陵台地多分布有红壤 表 2 广东省各地区的土壤养分模型预测效果1)
Table 2 Prediction performance of soil nutrient models in different areas of Guangdong Province
指标
Index地区
AreaSEC RSQ SECV 1-VR 有机质
Soil organic matter粤北 4.260 2 0.662 2 5.666 3 0.406 5 粤东 10.191 2 0.476 4 11.699 5 0.337 7 粤西 3.803 4 0.837 8 7.071 8 0.595 1 粤西北 3.985 1 0.831 1 5.032 2 0.735 8 珠三角 5.057 6 0.817 2 6.123 1 0.729 5 全氮
Total nitrogen粤北 0.107 4 0.898 6 0.180 9 0.731 9 粤东 0.295 9 0.784 0 0.382 5 0.646 6 粤西 0.219 8 0.660 5 0.347 6 0.336 7 粤西北 0.245 3 0.704 7 0.310 4 0.540 2 珠三角 0.245 4 0.789 8 0.308 9 0.677 0 可溶性有机碳
Dissolved organic carbon粤北 24.437 4 0.694 1 26.896 4 0.641 1 粤东 31.206 8 0.141 4 34.763 2 0.043 9 粤西 25.987 2 0.471 5 30.433 7 0.324 5 粤西北 31.937 4 0.281 6 33.930 4 0.216 6 珠三角 27.896 4 0.132 6 30.310 7 −0.021 7 碱解氮
Available nitrogen粤北 61.912 7 0.108 7 72.340 4 −0.040 3 粤东 50.192 4 0.323 6 57.612 0 0.148 8 粤西 42.216 6 0.380 4 53.081 4 0.130 4 粤西北 19.314 8 0.731 4 25.338 4 0.536 7 珠三角 20.557 2 0.820 0 27.365 0 0.685 0 速效磷
Available phosphorus粤北 15.325 8 0.225 1 18.882 4 0.077 8 粤东 24.353 7 0.070 1 27.115 0 −0.040 5 粤西 31.471 9 0.482 7 34.417 0 0.374 3 粤西北 18.240 2 0.647 6 28.404 3 0.400 4 珠三角 28.844 6 0.694 9 35.797 0 0.546 2 1) SEC:定标标准误差;RSQ:定标相关系数;SECV:交互验证标准误差;1-VR:交叉验证相关系数
1) SEC: Standard error of calibration; RSQ: Coefficient of determination for validation; SECV: Standard error of cross validation; 1-VR: 1 minus the variance ration -
[1] 赵其国, 孙波, 张桃林. 土壤质量与持续环境Ⅰ: 土壤质量的定义及评价方法[J]. 土壤, 1997(3): 113-120. [2] 张甘霖, 朱永官, 傅伯杰. 城市土壤质量演变及其生态环境效应[J]. 生态学报, 2003, 23(3): 539-546. [3] XIAO R, SU S, ZHANG Z, et al. Dynamics of soil sealing and soil landscape patterns under rapid urbanization[J]. Catena, 2013, 109: 1-12. doi: 10.1016/j.catena.2013.05.004
[4] 江恩赐, 陈林, 颜继忠, 等. 智能高光谱成像融合CARS特征波段筛选快速检测硫熏牛膝SO2含量[J]. 中国中药杂志, 2022, 47(7): 1864-1870. [5] 王巧华, 马逸霄, 付丹丹. 基于光谱技术的禽蛋内部品质无损检测研究进展[J]. 华中农业大学学报, 2021, 40(6): 220-230. [6] 宋亮, 刘善军, 虞茉莉, 等. 基于可见−近红外和热红外光谱联合分析的煤和矸石分类方法研究[J]. 光谱学与光谱分析, 2017, 37(2): 416-422. [7] BADARÓ A T, MORIMITSU F L, FERREIRA A R, et al. Identification of fiber added to semolina by near infrared (NIR) spectral techniques[J]. Food Chemistry, 2019, 289: 195-203. doi: 10.1016/j.foodchem.2019.03.057
[8] 孙园园, 蔡怡聪, 谢黎虹, 等. 近红外光谱分析技术在稻米品质测定和遗传分析中应用研究概述[J]. 中国稻米, 2016, 22(6): 1-3. [9] MENDES DE OLIVEIRA D, FONTES L M, PASQUINI C. Comparing laser induced breakdown spectroscopy, near infrared spectroscopy, and their integration for simultaneous multi-elemental determination of micro-and macronutrients in vegetable samples[J]. Analytica Chimica Acta, 2019, 1062: 28-36. doi: 10.1016/j.aca.2019.02.043
[10] ELLE O, RICHTER R, VOHLAND M, et al. Fine root lignin content is well predictable with near-infrared spectroscopy[J]. Scientific Reports, 2019, 9: 6396. doi: 10.1038/s41598-018-37186-2
[11] BELLON-MAUREL V, MCBRATNEY A. Near-infrared (NIR) and mid-infrared (MIR) spectroscopic techniques for assessing the amount of carbon stock in soils: Critical review and research perspectives[J]. Soil Biology and Biochemistry, 2011, 43(7): 1398-1410. doi: 10.1016/j.soilbio.2011.02.019
[12] 刘燕德, 熊松盛, 刘德力. 近红外光谱技术在土壤成分检测中的研究进展[J]. 光谱学与光谱分析, 2014, 34(10): 2639-2644. [13] VELASQUEZ E, LAVELLE P, BARRIOS E, et al. Evaluating soil quality in tropical agroecosystems of Colombia using NIRS[J]. Soil Biology and Biochemistry, 2005, 37(5): 889-898. doi: 10.1016/j.soilbio.2004.09.009
[14] DE SANTANA F B, DE SOUZA A M, POPPI R J. Visible and near infrared spectroscopy coupled to random forest to quantify some soil quality parameters[J]. Spectrochimica Acta Part A: Molecular and Biomolecular Spectroscopy, 2018, 191: 454-462. doi: 10.1016/j.saa.2017.10.052
[15] JOUQUET P, HENRY-DES-TUREAUX T, MATHIEU J, et al. Utilization of near infrared reflectance spectroscopy (NIRS) to quantify the impact of earthworms on soil and carbon erosion in steep slope ecosystem: A study case in Northern Vietnam[J]. Catena, 2010, 81(2): 113-116. doi: 10.1016/j.catena.2010.01.010
[16] 张欣跃, 赵玉国, 刘峰, 等. 基于可见−近红外光谱与化学属性的土壤来源地判别[J]. 土壤学报, 2019, 56(5): 1060-1071. [17] MOUAZEN A M, KUANG B, DE BAERDEMAEKER J, et al. Comparison among principal component, partial least squares and back propagation neural network analyses for accuracy of measurement of selected soil properties with visible and near infrared spectroscopy[J]. Geoderma, 2010, 158(1/2): 23-31. doi: 10.1016/j.geoderma.2010.03.001
[18] 李伟, 张书慧, 张倩, 等. 近红外光谱法快速测定土壤碱解氮、速效磷和速效钾含量[J]. 农业工程学报, 2007, 112(1): 55-59. [19] 赵明松, 谢毅, 陆龙妹, 等. 基于高光谱特征指数的土壤有机质含量建模[J]. 土壤学报, 2021, 58(1): 42-54. [20] 陈秋宇, 杨仁敏, 朱长明. 基于 VIS-NIR 光谱的互花米草入侵湿地土壤有机碳预测研究[J]. 土壤学报, 2021, 58(3): 694-703. [21] QIAO Y, ZHANG S. Near-infrared spectroscopy technology for soil nutrients detection based on LS-SVM[C]//International Conference on Computer and Computing Technologies in Agriculture. Berlin, Heidelberg: Springer, 2012: 325-335.
[22] 陈滢伊, 司友涛, 鲍勇, 等. 隔离降雨对亚热带米槠天然林土壤可溶性有机质数量及光谱学特征的影响[J]. 应用生态学报, 2019, 30(9): 2964-2972. [23] LIU S, ZHU Y, LIU L, et al. Cation-induced coagulation of aquatic plant-derived dissolved organic matter: Investigation by EEM-PARAFAC and FT-IR spectroscopy[J]. Environmental Pollution, 2018, 234: 726-734. doi: 10.1016/j.envpol.2017.11.076
[24] 刘雪梅, 柳建设. 基于MC-UVE的土壤碱解氮和速效钾近红外光谱检测[J]. 农业机械学报, 2013, 44(3): 88-91. [25] 贾生尧, 杨祥龙, 李光, 等. 近红外光谱技术结合递归偏最小二乘算法对土壤速效磷与速效钾含量测定研究[J]. 光谱学与光谱分析, 2015, 35(9): 2516-2520. [26] 方向, 金秀, 朱娟娟, 等. 基于可见−近红外光谱预处理建模的土壤速效氮含量预测[J]. 浙江农业学报, 2019, 31(9): 1523-1530. [27] 汪六三, 鲁翠萍, 王儒敬, 等. 土壤碱解氮含量可见/近红外光谱预测模型优化[J]. 发光学报, 2018, 39(7): 1016-1023. [28] 何电源. 华南热带土壤养分含量状态及肥力评价[J]. 土壤学报, 1983, 20(2): 154-166. [29] 孟鑫鑫, 于雷, 周勇, 等. 基于可见近红外和中红外近地面光谱数据融合的土壤有机碳含量反演[J]. 土壤通报, 2022, 53(2): 301-307. [30] SHI Z, WANG Q L, PENG J, et al. Development of a national VNIR soil-spectral library for soil classification and prediction of organic matter concentrations[J]. Science China Earth Sciences, 2014, 57(7): 1671-1680. doi: 10.1007/s11430-013-4808-x
[31] TZIOLAS N, TSAKIRIDIS N, OGEN Y, et al. An integrated methodology using open soil spectral libraries and Earth Observation data for soil organic carbon estimations in support of soil-related SDGs[J]. Remote Sensing of Environment, 2020, 244: 111793. doi: 10.1016/j.rse.2020.111793
[32] 鲁如坤. 土壤农业化学分析方法[M]. 北京: 中国农业科技出版社, 1999: 146-191. [33] 刘磊, 沈润平, 丁国香. 基于高光谱的土壤有机质含量估算研究[J]. 光谱学与光谱分析, 2011, 31(3): 762-766. [34] 张雪莲, 李晓娜, 武菊英, 等. 不同类型土壤总氮的近红外光谱技术测定研究[J]. 光谱学与光谱分析, 2010, 30(4): 906-910. [35] 王昶. 近红外光谱快速评估土壤和有机肥质量研究[D]. 南京: 南京农业大学, 2014. [36] BEN-DOR E, HELLER D, CHUDNOVSKY A. A novel method of classifying soil profiles in the field using optical means[J]. Soil Science Society of America Journal, 2008, 72(4): 1113-1123. doi: 10.2136/sssaj2006.0059
[37] 曾招兵, 曾思坚, 汤建东, 等. 广东省耕地土壤有效磷时空变化特征及影响因素分析[J]. 生态环境学报, 2014, 23(3): 444-451. [38] 王文俊, 李志伟, 王璨, 等. 高光谱成像的褐土土壤速效钾含量预测[J]. 光谱学与光谱分析, 2019, 39(5): 1579-1585.










 下载:
下载: