Regulation mechanism and breeding application of rice floret-opening-time
-
摘要:
水稻为严格自花授粉作物。花时是水稻的重要农艺性状,受到内部因素(植物激素、遗传因子等)和外部环境因素(温度、光照、湿度、CO2浓度等)的复杂调控。合适的开花时间是水稻成功繁殖的重要保障。颖花过早开放会导致水稻易受低温、露水重引起的病虫害影响;而过晚开放易使水稻遭受高温胁迫,降低产量。此外,在杂交水稻制种过程中,确保父母本的花时一致是提高杂交水稻制种产量的重要条件之一。本文从控制水稻颖花开放的结构基础、生理基础、遗传基础以及分子机理等方面,系统总结了水稻花时调控的研究进展,提出了今后水稻花时研究应重点解决的问题,并讨论了花时性状的改良在水稻生产和籼粳亚种间杂交稻育种上的应用价值。
Abstract:Rice (Oryza sativa L.) is a strictly autogamous crop. Floret-opening-time (FOT) is an important agronomic trait in rice, which is complicatedly regulated by internal factors (plant hormones, genetic factors, etc.) and external environmental factors (temperature, light, humidity, CO2 concentration, etc.). Floret opening at an appropriate time is very critical for the success of rice reproduction. If the floret opens too early in the morning, rice is vulnerable to pathogen infection caused by low temperature and heavy dew. In contrast, if the floret opens too late, the seed setting of rice would be severely affected by high temperature in the afternoon. Moreover, synchronized FOT between the male and female parents is a key requirement for successful production of hybrid seeds. In this review, we summarize the research progresses on the regulation of FOT in rice, mainly focusing on the aspects including the structural basis, physiological basis, genetic basis and molecular mechanism of controlling rice floret opening. We also present some important topics for future in-depth studies of FOT. Finally, we discuss the value of modulating FOT trait for improving rice production and indica-japonica inter-subspecies hybrid rice breeding.
-
Keywords:
- Oryza sativa L. /
- Floret-opening-time /
- Jasmonic acid /
- Lodicule /
- Hybrid seed production
-
动物的采食行为是维持机体能量稳态的基础,畜禽生产中获得充足的食物是其生长发育的前提。动物采食量受中枢调控,其中胃肠道状态是决定畜禽食欲的关键部位。揭示饥饿状态下鸡食欲调控的潜在肠−脑轴机制可为如何提高鸡采食量提供理论依据。下丘脑弓状核作为食欲调控中枢[1-2]存在大量的促采食的刺鼠相关蛋白(Agouti-related protein,AgRP)/神经肽 Y(Neuropeptide Y,NPY)神经元和抑采食的前阿片黑色皮质素(Proopiomelanocortin,POMC)/可卡因−苯丙胺调节转录肽(Cocaine and amphetamine regulated transcript,CART)神经元[3-6]。影响动物食欲的因素有很多,遗传、环境因素、机体健康以及肠道充盈状态等均能影响动物采食量[7]。其中胃肠道作为营养物质暂时储存和消化吸收的关键部位,存在大量食欲调控信号[8]。这些食欲调控信号一方面通过血液循环被中枢所感应[2, 9],另一方面被肠道迷走感觉传入神经元直接感应,经脑干孤束核最终将信号投递至食欲调控中枢,肠道和中枢间的这种信息传递被称为“肠−脑轴” [8, 10]。肠道迷走感觉神经作为假单极双向神经元,位于结状神经节处的胞体分别向中枢孤束核和肠道发出轴突,其中肠道迷走神经末梢存在多种受体感应肠道各种理化信号,例如游离脂肪酸受体2 (FFAR2)、生长激素促分泌素受体(GHSR)、胆囊收缩素受体(CCKR),以及炎症受体TLR4等 [10-12]。
肠道健康对机体维持高食欲具有重要作用,维持肠道平衡可以维持机体正常食欲,反之肠道菌群紊乱等原因导致肠道健康受损则会引起采食量降低[13-14],而肠道屏障是肠道发挥其正常生物学功能的重要前提[15-16],肠道黏膜屏障包括肠上皮细胞及胞间连接,其中,紧密连接是肠上皮细胞间的细胞旁通路的主要屏障,闭合(Occludin)和紧密连接(Claudin)家族成员是影响其功能的主要封闭蛋白,二者与胞浆蛋白相互作用维持紧密蛋白的完整性[17-18]。当肠道出现炎症时,会导致Claudin蛋白结构变化,进而引起肠道屏障功能性障碍,并且受致病菌侵害也会导致肠道屏障通透性增加[19];动物炎症性肠病会导致肠道隐窝改变、小肠绒毛萎缩或变平以及一系列的形态学变化[20]。大量研究发现间歇性饥饿有助于维持肠道及肠道屏障的完整性[21-22]。
此外,胃肠道中上皮基质和微生物群落共调控生成活性氧,导致生成H2O2;而H2O2是维持正常细胞稳态和生理功能所必需的第二信使[23]。Miller等[24]研究发现,结肠内壁中的细胞会释放H2O2(而非氧气)来限制微生物的生长,H2O2可以协同其他物质在肠道黏膜上形成保护,防止菌群紊乱或肠道炎症对机体造成损伤,并且可以治疗肠道炎症,恢复机体正常生理功能。然而,目前并不清楚短期饥饿是否影响肠道炎症水平和屏障功能、是否被迷走感觉神经所感应。本研究旨在揭示禁食后肠道炎症水平和肠道屏障变化,以及提高食欲的潜在机制,并提供理论基础和试验依据。
1. 材料与方法
1.1 试验动物与试验设计
选用20只1日龄初生黄羽肉鸡[25-28](购于广东省清远市凤翔麻鸡发展有限公司生产基地),试验前称体质量并排序,随后按配对随机设计的原则将体质量相近的小鼠分为2组:对照组和禁食组,每组10只黄羽肉鸡,正常饲喂饲料至5日龄并采样。采样前12 h,禁食组禁食,对照组正常采食。禁食12 h后收集小肠肠道内容物检测H2O2水平,采集黄羽肉鸡结状神经节(Nodose ganglia,NG),检测炎症和食欲相关受体的表达;采集十二指肠、空肠和回肠及其肠道黏膜,检测黄羽肉鸡肠道形态、闭锁小带蛋白−1 (Zonula,ZO-1)、闭合蛋白 (Occludens-1,OCC)、紧密连接蛋白(Claudin-1) 以及炎症因子的表达。
1.2 测定指标与方法
1.2.1 小肠肠道内容物
分离小肠,区分十二指肠、空肠和回肠,取部分肠道轻轻挤压,将内容物收集于 2 mL 离心管中,使用过氧化氢测定试剂盒(A064-1-1,南京建成生物工程研究所)检测H2O2水平。
1.2.2 扫描电子显微镜(SEM)
取一段1 cm长的空肠,剪开后平铺,用生理盐水轻轻清洗内容物,而后修剪为5 mm边长的正方形放于保存液中,于4 ℃条件下保存。而后脱水、干燥,进行电镜扫描。
1.2.3 苏木精−伊红(HE) 染色
小肠分离后剪取约 3 cm 空肠中段放于 40 g/L 的多聚甲醛中固定,按照常规方法制作石蜡切片,HE染色,光学显微镜下拍照,然后用Image软件测取肠道绒毛长度(lv)和隐窝深度(dc),每个切片取 3~5 个视野,取其平均值计算绒毛长度与隐窝深度比值(lv/dc)。
1.2.4 小肠黏膜及 NG 的 RNA 提取、逆转录和荧光定量PCR (q-PCR)
小肠黏膜及NG总 RNA 使用 RNA 提取试剂盒(R4130-02,广州美基生物科技有限公司)和 TRIzol 试剂提取。1 g 总 RNA 按试剂盒说明书用 4× Reverse Transcription Master Mix(EZB-RT2GQ,美国 EZBioscience 生物技术有限公司)逆转录成 cDNA。引物序列见表1,按照2× SYBR Green qPCR Master Mix(A0012-R2,美国 EZBioscience 生物技术有限公司)说明书配制反应体系:10 μL 的体系中含有 5 μL 2× Color SYBR Green qPCR Master Mix、3.6 μL dd H2O、1 μL cDNA、0.4 μL 引物工作液;使用 Applied Biosystems QuantStudio 3 实时 PCR 系统并按照以下程序反应:95 ℃预热 5 min;95 ℃ 10 s,60 ℃ 30 s,循环 40 次。根据对照组 β-actin mRNA 表达进行归一化处理[15]。
表 1 实时荧光定量PCR所用引物Table 1. Primers used for quantitative real-time PCR基因
Gene上游引物序列(5′→3′)
Forward primer sequence下游引物序列(5′→3′)
Reverse primer sequence序列号
Accession numberβ-actin CTGTGCCCATCTATGAAGGCTA ATTTCTCTCTCGGCTGTGGTG L08165 AgRP CTCTTCCCAGGCCAGACTTG GCAGAAGGCGTTGAAGAACC XM_046925680.1 CCKAR AGCTCTTCTGCCAACCTGAT GTGTAGGACAGCAGGTGGAT NM_001081501.2 Claudin-1 TGGAGGATGACCAGGTGAAG TGTGAAAGGGTCATAGAAGG NM_001013611.2 CART CGAGAGAAGGAGCTGATCGA AGAAAGGAGTTGCACGAGGT XM_046937244.1 FFAR2 GCACTCTCTTTATGGCTGCC GGATTCCCTGGTCTTGGTCA XM_040693461.2 IL-1 CCTCCTCCAGCCAGAAAGTG CGGTAGAAGATGAAGCGGGT XM_015297469.3 IL-4 CCCCAGGTGTAGGCTCTAGT ACTCTGTCATTGCTGCTCCC XM_040683457.2 IL-6 ACCCGAGCTCTTTGGTGATG CGTGCCCTCTGTTTGTACCT XM_025143427.3 IL-10 GCTGCCAAGCCCTGTT CCTCAAACTTCACCCTCA NM_001004414.4 GHSR ATTAGTGCTGGCCCCATCTT CGGACCGATGTTCTTCCTCT XM_046923539.1 MC4R AGGGGTCATCATCACATGCA GATGGCCCCTTTCATGTTGG NM_001031514.2 NPY GTGCTGACTTTCGCCTTGTC ATCTCTGCCTGGTGATGAGG NM_205473.2 Occludin TGGAGGAGTGGGTGAAGAAC ATCCTTCCCCTTCTCCTCCT XM_046904540.1 POMC AGAGGAAGGCGAGGAGGAAA GTAGGCGCTTTTGACGATGG XM_046914234.1 TLR-4 GGCTCAACCTCACGTTGGTA AGTCCGTTCTGAAATCCCGT NM_001030693.2 TNF-α TTCTATGACCGCCCAGTT CAGAGCATCCAACGCAAAA XM_046920820.1 NPY2R GGCCATCATCTCCTATGCCT GGAAGCCAACTGACAGCAAA NM_001398092.1 ZO-1 TCATCCTTACCGCCGCATAT GTTGACTGCTCGTACTCCCT XM_046925214.1 1.3 数据统计与分析
所有数据均以平均值±标准误差(Mean±SE)表示。用GraphPad Prism 8.0 软件进行统计分析。采用 t 检验对2组均值进行差异显著性分析。
2. 结果与分析
2.1 禁食后下丘脑内食欲肽相关受体表达变化
通过 q-PCR 检测下丘脑内食欲肽相关基因表达,结果发现,与对照组相比,雏鸡禁食12 h后促采食食欲肽基因AgRP (P<0.05)和 NPY (P<0.01)的 mRNA 相对表达量均显著上调(图1),提示雏鸡饥饿模型构建成功。
2.2 禁食对黄羽肉鸡空肠肠道形态的影响
空肠肠绒毛电镜扫描及分析结果如图2A、3A、3B 所示,观察发现雏鸡禁食12 h 后,同对照组相比空肠肠绒毛表面更加完整,单位面积内绒毛总数更多、受损更少并且排列更加整齐。空肠 HE 染色及分析结果如图2B、3C、3D 所示,与正常采食的雏鸡相比,禁食后雏鸡的隐窝深度和lv/dc均无明显变化,但是对照组绒毛有明显损伤,而禁食组绒毛排列整齐、长度更长。
![图 3 黄羽肉鸡禁食12 h后空肠肠道绒毛形态变化的电镜扫描结果(A、B)和HE 染色结果(C、D)统计]() 图 3 黄羽肉鸡禁食12 h后空肠肠道绒毛形态变化的电镜扫描结果(A、B)和HE 染色结果(C、D)统计Ⅰ:对照组,Ⅱ:禁食组;“*”和“**”分别表示差异达到 0.05和0.01的显著水平(t检验)Figure 3. Statistics of the scanning electron microscopy results (A, B) and HE staining results (C, D) for the morphological changes of jejunum intestinal villi of yellow-feathered broilers after fasting for 12 hⅠ: Control, Ⅱ: Fasting group; “*” and “**” indicate that the difference reaches 0.05 and 0.01 significance levels respectively (t test)
图 3 黄羽肉鸡禁食12 h后空肠肠道绒毛形态变化的电镜扫描结果(A、B)和HE 染色结果(C、D)统计Ⅰ:对照组,Ⅱ:禁食组;“*”和“**”分别表示差异达到 0.05和0.01的显著水平(t检验)Figure 3. Statistics of the scanning electron microscopy results (A, B) and HE staining results (C, D) for the morphological changes of jejunum intestinal villi of yellow-feathered broilers after fasting for 12 hⅠ: Control, Ⅱ: Fasting group; “*” and “**” indicate that the difference reaches 0.05 and 0.01 significance levels respectively (t test)2.3 禁食对黄羽肉鸡肠道屏障的影响
由图4 可知,与对照组相比,禁食12 h后雏鸡小肠黏膜中紧密蛋白标志性基因ZO-1和Occludin mRNA的相对表达量均显著上调(P<0.05),在十二指肠中,Claudin-1 的mRNA相对表达量也显著上调(P<0.05)。
![图 4 黄羽肉鸡禁食12 h后小肠肠道黏膜紧密蛋白的mRNA相对表达量变化]() 图 4 黄羽肉鸡禁食12 h后小肠肠道黏膜紧密蛋白的mRNA相对表达量变化“*”和“**”分别表示差异达到 0.05和0.01的显著水平(t检验)Figure 4. mRNA relative expression changes of intestinal mucosal compact protein in small intestine of yellow-feathered broilers after 12 h fasting“*” and “**” indicate that the difference reaches 0.05 and 0.01 significance levels respectively (t test)
图 4 黄羽肉鸡禁食12 h后小肠肠道黏膜紧密蛋白的mRNA相对表达量变化“*”和“**”分别表示差异达到 0.05和0.01的显著水平(t检验)Figure 4. mRNA relative expression changes of intestinal mucosal compact protein in small intestine of yellow-feathered broilers after 12 h fasting“*” and “**” indicate that the difference reaches 0.05 and 0.01 significance levels respectively (t test)2.4 禁食对黄羽肉鸡肠道炎症水平的影响
由图5可知,黄羽肉鸡禁食12 h后,与对照组相比,十二指肠、空肠和回肠黏膜上炎症因子IL-1、IL-6和TNF-α的 mRNA表达量无明显变化,但是空肠黏膜抗炎因子IL-4和IL-10的 mRNA表达量均有显著升高(P<0.01)。并且空肠和回肠内容物中H2O2浓度均有不同程度的增加(图3 D )。
![图 5 黄羽肉鸡禁食12 h后小肠炎症因子mRNA相对表达量及H2O2浓度变化]() 图 5 黄羽肉鸡禁食12 h后小肠炎症因子mRNA相对表达量及H2O2浓度变化图D中,DU:十二指肠,Anterior JE:空肠前段,Middle JE:空肠中段,Posterior JE:空肠后段,Anterior IL:回肠前段,Posterior IL:回肠后段;“*”和“**”分别表示差异达到 0.05和0.01的显著水平(t检验)Figure 5. Changes in mRNA relative expressions of intestinal inflammatory factors and H2O2 concentrations in yellow-feathered broilers after 12 h of fastingIn figure D, DU: Duodenum, Anterior JE: Anterior jejunum, Middle JE: Middle jejunum, Posterior JE: Posterior jejunum, Anterior IL: Anterior ileum , Posterior IL: Posterior ileum; “*” and “**” indicate that the difference reaches 0.05 and 0.01 significance levels respectively (t test)
图 5 黄羽肉鸡禁食12 h后小肠炎症因子mRNA相对表达量及H2O2浓度变化图D中,DU:十二指肠,Anterior JE:空肠前段,Middle JE:空肠中段,Posterior JE:空肠后段,Anterior IL:回肠前段,Posterior IL:回肠后段;“*”和“**”分别表示差异达到 0.05和0.01的显著水平(t检验)Figure 5. Changes in mRNA relative expressions of intestinal inflammatory factors and H2O2 concentrations in yellow-feathered broilers after 12 h of fastingIn figure D, DU: Duodenum, Anterior JE: Anterior jejunum, Middle JE: Middle jejunum, Posterior JE: Posterior jejunum, Anterior IL: Anterior ileum , Posterior IL: Posterior ileum; “*” and “**” indicate that the difference reaches 0.05 and 0.01 significance levels respectively (t test)2.5 禁食后雏鸡NG内受体表达的变化
由图6A 可知,与对照组相比,雏鸡禁食12 h后 NG 内肠道炎症因子IL-4的受体基因IL-4R的mRNA相对表达量显著上调(P<0.01)。由图6B 可知,禁食组雏鸡NG内食欲相关受体基因的mRNA相对表达量有所增加,其中FFAR2和神经肽2受体(NPY2R)表达量增加显著(P<0.01)。
![图 6 黄羽肉鸡禁食12 h后结状神经节内炎症(A)与食欲(B)相关受体mRNA相对表达量]() 图 6 黄羽肉鸡禁食12 h后结状神经节内炎症(A)与食欲(B)相关受体mRNA相对表达量“**”表示差异达到0.01的显著水平(t检验)Figure 6. mRNA relative expression of inflammation-related (A) and orexin-related (B) receptors in nodose ganglia of yellow-feathered broilers after 12 h of fasting“**” indicates that the difference reaches 0.01 significance level (t test)
图 6 黄羽肉鸡禁食12 h后结状神经节内炎症(A)与食欲(B)相关受体mRNA相对表达量“**”表示差异达到0.01的显著水平(t检验)Figure 6. mRNA relative expression of inflammation-related (A) and orexin-related (B) receptors in nodose ganglia of yellow-feathered broilers after 12 h of fasting“**” indicates that the difference reaches 0.01 significance level (t test)3. 讨论与结论
已有研究发现,特异性激活下丘脑弓状核AgRP神经元显著提高动物采食量[29],诱导肥胖发生[30],而消除AgRP神经元则会导致厌食症[31]。因此,本研究首先检测了下丘脑弓状核食欲肽表达变化,结果发现短期禁食后黄羽肉鸡下丘脑 AgRP/NPY表达显著上调(P < 0.05),而POMC有下降趋势(P = 0.07),提示黄羽肉鸡饥饿模型构建成功。
肠道健康对机体维持高食欲具有重要作用,而肠道炎症则会影响肠道代谢水平、破坏微生物平衡[32]以及肠道屏障的完整性[33],甚至会影响中枢神经系统中神经肽的分泌,大量研究发现间歇性饥饿有助于维持肠道及肠道屏障的完整性[21-22]。据报道,胃肠道中上皮基质和微生物群落共调控生成活性氧,导致H2O2形成;而H2O2是维持正常细胞稳态和生理功能所必需的第二信使[23]。本试验通过检测小肠不同肠段内容物的H2O2浓度发现,短期禁食导致禁食组空肠和回肠内容物中H2O2浓度均有不同程度的增加,推测饥饿状态下肠道可能通过生成适量H2O2维持肠道稳定。为进一步验证这一假设,我们通过电镜扫描、HE染色以及q-PCR结果发现,短期禁食并未对肠道形态造成损伤,且由于缺少食物影响,肠道绒毛排列更加紧凑整齐。我们推测,机体短期禁食后尚未引发肠道疾病,并且在肠道饥饿状态下,因肠道营养物质缺乏,机体可能出于自我保护机制防止肠道毒素等有害因子进入机体,从而紧密连接增强,即肠道物理屏障增强,且抗炎因子的表达增加,降低空肠损伤比例,避免肠道受损,以抵抗禁食给机体带来的不良影响,维持肠道正常的生理功能,这对维持较高食欲至关重要。
大量研究报道,肠道食欲调控信号不仅可以通过血液信号被中枢所识别,还可以被肠道迷走感觉传入神经元直接感应,经肠−脑轴最终将信号投递至食欲调控中枢[10-12]。本试验结果发现,与对照组相比,雏鸡禁食12 h后结状神经节内IL-4受体基因的mRNA相对表达量显著上调,和肠道黏膜抗炎因子表达变化相对应;提示机体在饥饿状态下,可能通过提高肠道抗炎能力以及增强物理屏障来抵抗由禁食所导致的轻微炎症,维持肠道健康。
此外,结状神经节内食欲相关受体基因的mRNA相对表达量有所增加,其中FFAR2和NPY2R表达量增加显著(P < 0.01),推测黄羽肉鸡饥饿后由于AgRP和NPY表达量增加[4],并且FFAR2和NPY2R表达增加,二者将肠道饥饿信号传递至中枢神经系统,提高动物食欲进而促进采食量增加。
综上所述,饥饿可引起肠道抗炎因子水平升高,并维持肠道屏障完整性,同时促进迷走感觉神经末梢抗炎因子受体表达,最终引起食欲增强。
-
图 1 水稻颖花结构及籼、粳稻花时对比
a:水稻小穗,Bar = 0.5 cm,b:水稻颖花结构图,Bar = 1.0 mm;c:粳稻‘中花11’与籼稻‘天丰B’在09:30的开花对比图,Bar = 1.0 cm,d:粳稻‘中花11’与籼稻‘天丰B’在11:00的开花对比图,Bar = 1.0 cm
Figure 1. The rice floret structure and the comparison of floret-opening-time between indica and japonica
a: Rice spikelet, bar = 0.5 cm; b: The structure of a rice floret, bar = 1.0 mm; c: Comparison of flowering between japonica ‘Zhonghua 11’ and indica ‘Tianfeng B’ at 09:30, bar = 1.0 cm; d: Comparison of flowering between japonica ‘Zhonghua 11’ and indica ‘Tianfeng B’ at 11:00, bar = 1.0 cm
图 2 水稻开花前后不同时间点浆片吸水膨胀与失水萎缩过程
a:水稻浆片形态,Bar = 1 mm;b:水稻颖花示意图;c:b图红色虚线对应的横切示意图,红色箭头表示浆片膨胀时张力方向
Figure 2. The process of lodicule swelling and shrinking in rice before and after floret-opening
a: Dynamic morphology change of the rice lodicules during anthesis, bar = 1 mm; b: Schematic diagrams of rice florets during anthesis; c: Schematic diagrams of the cross-sections of florets as the red dash lines indicates in Fig. 2b, the red arrow indicates the direction of tension when the lodicule expanding
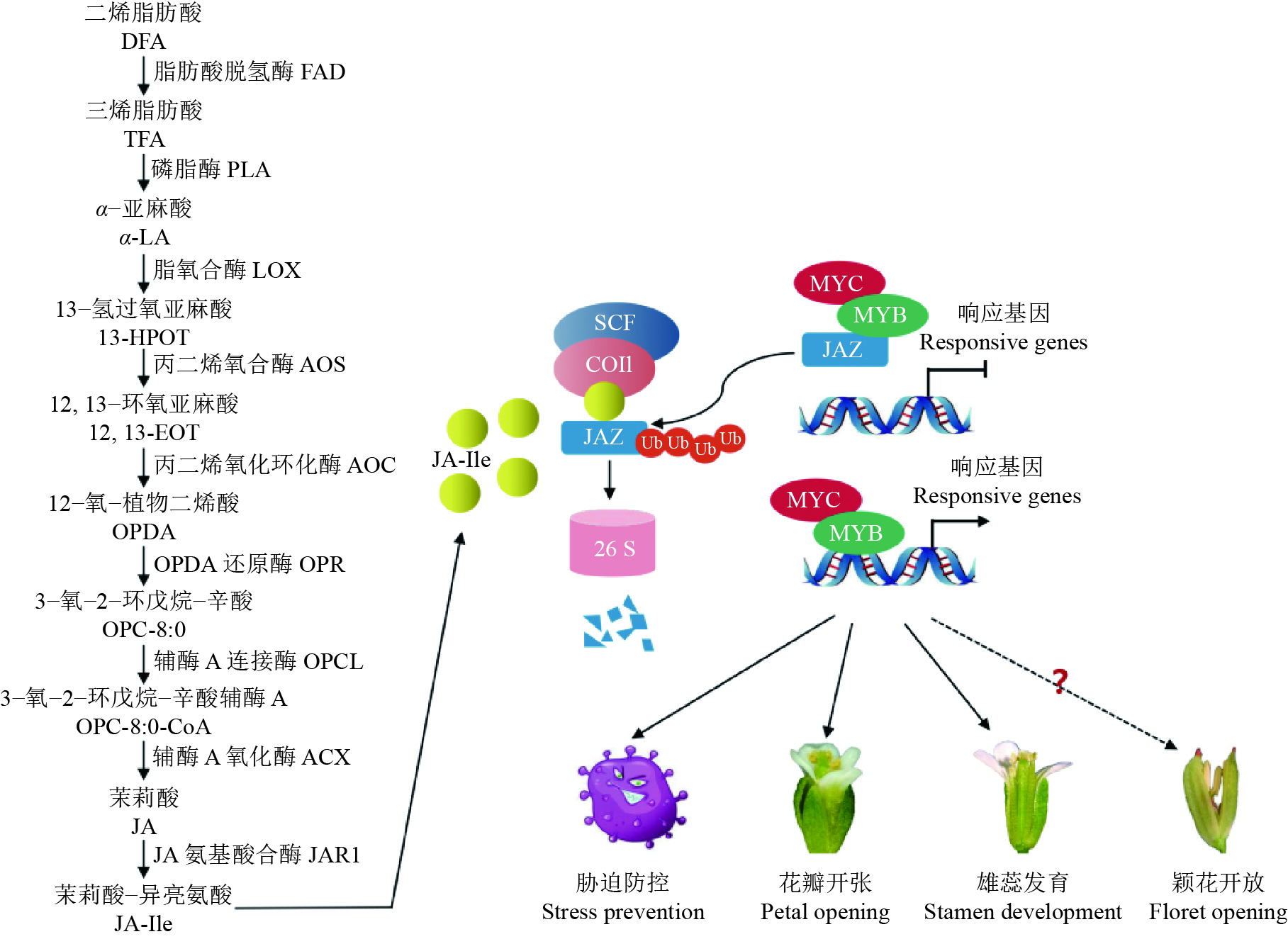
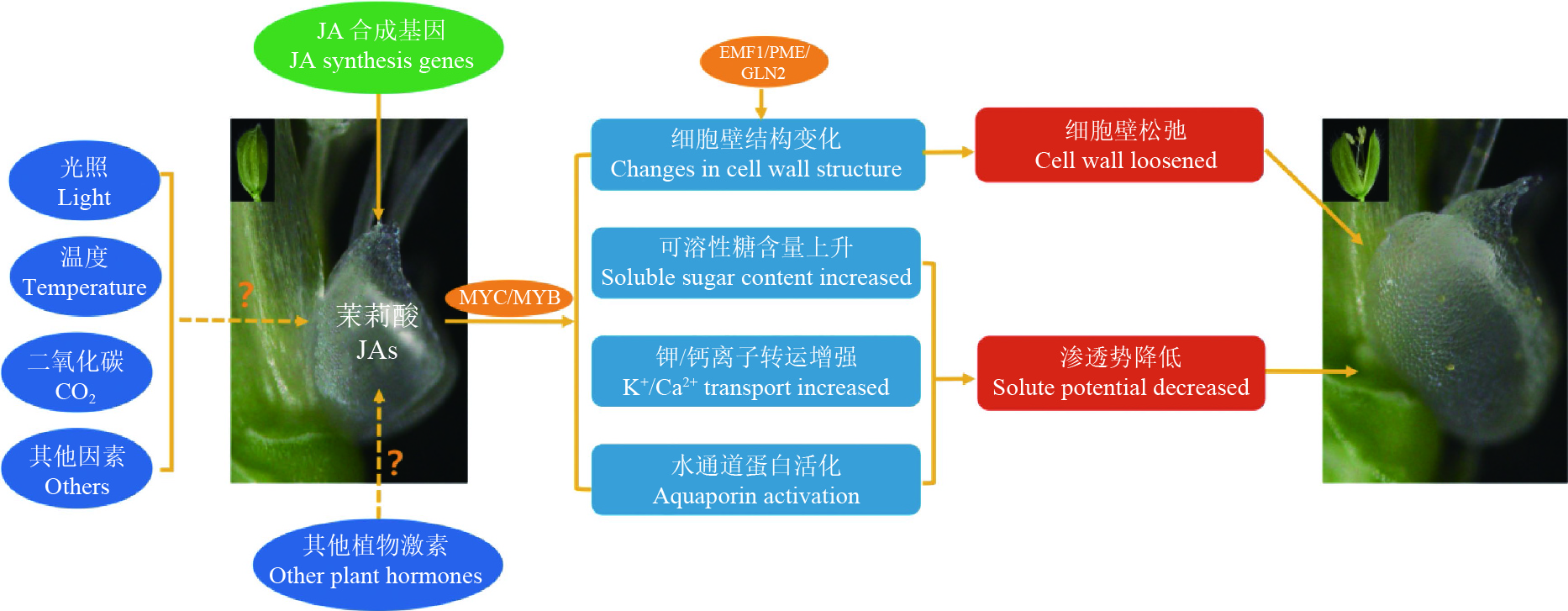
图 3 茉莉酸合成、信号转导及生物学功能[46]
Figure 3. Jasmonic acid synthesis, signal transduction and biological function
表 1 花时QTLs的详细信息
Table 1 The details of floret-opening-time QTLs
数量性状 基因座 QTL 亲本1)Parent 性状 Trait 染色体 Chromosome 定位区间 Mapping location 基因来源 Gene source 贡献率/% Contribution rate 文献 Reference qFBT-12 七山占 × 秋光 始花时 12 PSM420—RM247 秋光 10.33 [7] qVFT-1 七山占 × 秋光 盛花时 1 RM259—RM449 秋光 12.43 [7] qVFT-8 七山占 × 秋光 盛花时 8 RM477—PSM396 秋光 10.57 [7] qVFT-10 七山占 × 秋光 盛花时 10 RM269—RM222 七山占 26.95 [7] qFET-2 七山占 × 秋光 终花时 2 RM240—RM525 秋光 7.08 [7] qFET-10 七山占 × 秋光 终花时 7 RM82—RM420 七山占 10.11 [7] SOTb W630 × 日本晴 始花时 5 RM249—RM440 W630 27.21 [34] SOTb W630 × 日本晴 始花时 10 RM171—RM496 W630 28.55 [34] SOTm W630 × 日本晴 盛花时 4 RM303—RM255 W630 14.66 [34] SOTm W630 × 日本晴 盛花时 5 RM249 W630 20.50 [34] qFT1a WAB368-B-2-H2-HB × 六千辛 盛花时 1 RM580—RM8004 WAB368-B-2-H2-HB 7.50 [35] qFT1b WAB368-B-2-H2-HB × 六千辛 盛花时 1 RM7318—RM5497 WAB368-B-2-H2-HB 5.80 [35] qFT10 WAB368-B-2-H2-HB × 六千辛 盛花时 10 RM184—RM3773 WAB368-B-2-H2-HB 6.20 [35] qFT12 WAB368-B-2-H2-HB × 六千辛 盛花时 12 RM511—RM519 WAB368-B-2-H2-HB 11.30 [35] qEMF3 Oryza officinalis × 南京11 始花时 3 RM14407 O. officinalis 19.70 [36] 1)籼稻:‘七山占’‘南京11’,粳稻:‘秋光’‘日本晴’‘WAB368-B-2-H2-HB’‘六千辛’,野生稻:‘W630’、Oryza officinalis 1) Indica: ‘Qishanzhan’ ‘Nanjing11’; Japonica: ‘Qiuguang’ ‘Ribenqing’ ‘WAB368-B-2-H2-HB’ ‘Liuqianxin’; Wild rice: ‘W630’, Oryza officinalis -
[1] FITZGERALD M A, MCCOUCH S R, HALL R D. Not just a grain of rice: The quest for quality[J]. Trends in Plant Science, 2009, 14(3): 133-139. doi: 10.1016/j.tplants.2008.12.004
[2] PENG S, KHUSH G S, VIRK P, et al. Progress in ideotype breeding to increase rice yield potential[J]. Field Crops Research, 2008, 108(1): 32-38. doi: 10.1016/j.fcr.2008.04.001
[3] CHENG S H, ZHUANG J Y, FAN Y Y, et al. Progress in research and development on hybrid rice: A super-domesticate in China[J]. Annals of Botany, 2007, 100(5): 959-966. doi: 10.1093/aob/mcm121
[4] 孙凌飞, 李绍波, 官杰, 等. 亚洲栽培稻的籼粳分化[J]. 现代农业科技, 2008(22): 157-159. [5] 张桂权. 5G水稻的演变和发展[J]. 华南农业大学学报, 2019, 40(5): 211-216. [6] 张萌, 戴冬青, 李西明, 等. 水稻花时性状研究进展[J]. 核农学报, 2016, 30(2): 267-274. [7] 马作斌, 詹瞻, 徐海, 等. 籼粳稻杂交后代花时性状的QTL分析[J]. 植物生理学报, 2011, 47(8): 799-802. [8] YANG J, FEI K, CHEN J, et al. Jasmonates alleviate spikelet-opening impairment caused by high temperature stress during anthesis of photo-thermo-sensitive genic male sterile rice lines[J]. Food and Energy Security, 2020, 9(4): e233.
[9] 徐乾坤, 任德勇, 李自壮, 等. 水稻小穗颖壳发育的研究进展[J]. 中国水稻科学, 2016, 30(1): 99-105. [10] TANAKA W, TORIBA T, HIRANO H Y. Flower development in rice[J]. Advances in Botanical Research, 2014, 72(8): 221-262.
[11] 黄俊宝, 何永明, 曾晓春, 等. 水稻颖花开放前花器官茉莉酸水平变化及浆片茉莉酸信号基因表达分析[J]. 中国农业科学, 2015, 48(6): 1219-1227. [12] KOBAYASI K, MATSUI T, YOSHIMOTO M, et al. Effects of temperature, solar radiation, and vapor-pressure deficit on flower opening time in rice[J]. Plant Production Science, 2010, 13(1): 21-28. doi: 10.1626/pps.13.21
[13] 田大成. 水稻异交栽培学: 杂交水稻高产制种原理与技术[M]. 成都: 四川科学技术出版社, 1991. [14] 曾晓春. 茉莉酸类对稻、高梁和果园草颖花开放的诱导效应[D]. 南京: 南京农业大学, 2000. [15] 仲维功, 李传国, 苏自强. 不同类型水稻品种花时特性的研究[J]. 江苏农业科学, 1990(1): 16-18. [16] 陆燕雯, 王冬翼, 顾庆华, 等. 粳型光温敏感雄性核不育系开花习性研究[J]. 上海农业学报, 2012, 28(3): 124-126. [17] 曾晓春, 周燮, 吴晓玉. 水稻颖花开放机理研究进展[J]. 中国农业科学, 2004, 37(2): 188-195. [18] 王忠, 顾蕴洁, 高煜珠. 水稻开颖机理的探讨: Ⅲ: 浆片的结构及其在开颖过程中内含物的变化[J]. 作物学报, 1991, 17(2): 96-101. [19] HESLOP-HARRISON Y, HESLOP-HARRISON J S. Lodicule function and filament extension in the grasses: Potassium ion movement and tissue specialization[J]. Annals of Botany, 1996: 573-582.
[20] 王忠, 顾蕴洁. 水稻开闭颖过程及其影响因素[EB/OL]. 中国科技论文在线, [2022-09-03]. http://www.paper.edu.cn. [21] 王忠, 顾蕴洁, 高煜珠. 水稻开颖机理的探讨: Ⅴ: 不育系与可育系浆片和花丝结构的比较[J]. 作物学报, 1994, 20(1): 13-17. [22] 薛欣艳. 关于水稻浆片调节颖花开放机理的分子生物学基础研究[D]. 扬州: 扬州大学, 2010. [23] 刘娟. 一个水稻花时提前突变体的遗传分析与基因定位[D]. 成都: 四川农业大学, 2016. [24] 邹春梅, 何永明, 曾晓春. MeJA诱导水稻颖花开放作用机理的研究[G]. 2007年全国植物生长物质研讨会论文摘要汇编. 南昌: 中国植物生理学会, 2007. [25] QIN Y, YANG J, ZHAO J. Calcium changes and the response to methyl jasmonate in rice lodicules during anthesis[J]. Protoplasma, 2005, 225(1/2): 103-112.
[26] 玉忠, 顾蕴洁, 高煜珠. 水稻开颖机理的探讨: Ⅱ: CO2对水稻开颖的效应[J]. 作物学报, 1989, 15(1): 59-66. [27] FRY S C, SMITH R C, RENWICK K F, et al. Xyloglucan endotransglycosylase, a new wall-loosening enzyme activity from plants[J]. The Biochemical Journal, 1992, 282(Pt 3): 821-828.
[28] CARPITA N C, GIBEAUT D M. Structural models of primary cell walls in flowering plants: Consistency of molecular structure with the physical properties of the walls during growth[J]. The Plant Journal, 1993, 3(1): 1-30. doi: 10.1111/j.1365-313X.1993.tb00007.x
[29] 付永琦, 向妙莲, 蒋海燕, 等. 水稻颖花开放前浆片转录组变化[J]. 中国农业科学, 2016, 49(6): 1017-1033. [30] SAKURAI J, ISHIKAWA F, YAMAGUCHI T, et al. Identification of 33 rice aquaporin genes and analysis of their expression and function[J]. Plant and Cell Physiology, 2005, 46(9): 1568-1577. doi: 10.1093/pcp/pci172
[31] 何永明, 曾晓春, 向妙莲, 等. 水稻花时调控研究进展[J]. 湖北农业科学, 2014, 53(7): 1489-1492. [32] ZENG X C, ZHOU X, ZHANG W, et al. Opening of rice floret in rapid response to methyl jasmonate[J]. Journal of Plant Growth Regulation, 1999, 18(4): 153-158. doi: 10.1007/PL00007063
[33] 李金军, 范国华, 张仁余, 等. 不同水稻品种开花时间的比较试验[J]. 浙江农业科学, 2007(1): 63-66. [34] PHAM T T, PHUONG D T P, ISHIKAWA R, et al. QTL analysis for flowering time using backcross population between Oryza sativa Nipponbare and O. rufipogon[J]. Genes & Genetic Systems, 2010, 85(4): 273-279.
[35] 万国, 冯跃, 张凤娇, 等. 水稻花时性状的QTL定位[J]. 核农学报, 2013, 27(5): 562-567. [36] HIRABAYASHI H, SASAKI K, KAMBE T, et al. qEMF3, a novel QTL for the early-morning flowering trait from wild rice, Oryza officinalis, to mitigate heat stress damage at flowering in rice, O. sativa[J]. Journal of Experimental Botany, 2015, 66(5): 1227-1236. doi: 10.1093/jxb/eru474
[37] SHEEHY J, ELMIDO A, CENTENO G, et al. Searching for new plants for climate change[J]. Journal of Agricultural Meteorology, 2005, 60(5): 463-468. doi: 10.2480/agrmet.463
[38] SHEEHY J E, MABILANGAN A E, DIONORA M J A, et al. Time of day of flowering in wild species of the genus Oryza[J]. International Rice Research Notes, 2007, 32(1): 12-13.
[39] XIAO H, WANG Y, LIU D, et al. Functional analysis of the rice AP3 homologue OsMADS16 by RNA interference[J]. Plant Molecular Biology, 2003, 52(5): 957-966. doi: 10.1023/A:1025401611354
[40] NAGASAWA N, MIYOSHI M, SANO Y, et al. SUPERWOMAN1 and DROOPING LEAF genes control floral organ identity in rice[J]. Development, 2003, 130(4): 705-718. doi: 10.1242/dev.00294
[41] YADAV S R, PRASAD K, VIJAYRAGHAVAN U. Divergent regulatory OsMADS2 functions control size, shape and differentiation of the highly derived rice floret second-whorl organ[J]. Genetics, 2007, 176(1): 283-294. doi: 10.1534/genetics.107.071746
[42] YAO S G, OHMORI S, KIMIZU M, et al. Unequal genetic redundancy of rice PISTILLATA orthologs, OsMADS2 and OsMADS4, in lodicule and stamen development[J]. Plant and Cell Physiology, 2008, 49(5): 853-857. doi: 10.1093/pcp/pcn050
[43] WANG M, ZHU X, PENG G, et al. Methylesterification of cell-wall pectin controls the diurnal flower-opening times in rice[J]. Molecular Plant, 2022, 15(6): 956-972. doi: 10.1016/j.molp.2022.04.004
[44] XU P, WU T, ALI A, et al. EARLY MORNING FLOWERING 1 (EMF1) regulates the floret opening time by mediating lodicule cell wall formation in rice[J]. Plant biotechnology journal, 2022, 20: 1441-1443. doi: 10.1111/pbi.13860
[45] ZHAI Q, ZHANG X, WU F, et al. Transcriptional mechanism of jasmonate receptor COI1-mediated delay of flowering time in Arabidopsis[J]. Plant Cell, 2015, 27(10): 2814-2828.
[46] SONG S, QI T, HUANG H, et al. Regulation of stamen development by coordinated actions of jasmonate, auxin, and gibberellin in Arabidopsis[J]. Molecular Plant, 2013, 6(4): 1065-1073. doi: 10.1093/mp/sst054
[47] WASTERNACK C, STRNAD M. Jasmonates are signals in the biosynthesis of secondary metabolites: Pathways, transcription factors and applied aspects: A brief review[J]. New Biotechnology, 2019, 48: 1-11. doi: 10.1016/j.nbt.2017.09.007
[48] CHINI A, FONSECA S, FERNÁNDEZ G, et al. The JAZ family of repressors is the missing link in jasmonate signaling[J]. Nature, 2007, 448(7154): 666-671. doi: 10.1038/nature06006
[49] THINES B, KATSIR L, MELOTTO M, et al. JAZ repressor proteins are targets of the SCF(COI1) complex during jasmonate signaling[J]. Nature, 2007, 448(7154): 661-665. doi: 10.1038/nature05960
[50] KATSIR L, CHUNG H S, KOO A J, et al. Jasmonate signaling: A conserved mechanism of hormone sensing[J]. Current Opinion in Plant Biology, 2008, 11(4): 428-435. doi: 10.1016/j.pbi.2008.05.004
[51] GEERINCK J, PAUWELS L, DE JAEGER G, et al. Dissection of the one-MegaDalton JAZ1 protein complex[J]. Plant Signaling & Behavior, 2014, 5(8): 1039-1041.
[52] WANG C, LIU Y, LI S S, et al. Insights into the origin and evolution of the plant hormone signaling machinery[J]. Plant Physiology, 2015, 167(3): 872-886. doi: 10.1104/pp.114.247403
[53] 宋平, 夏凯, 吴传万, 等. 雄性不育和可育水稻开颖对茉莉酸甲酯响应的差异[J]. 植物学报, 2001, 43(5): 480-485. [54] 闫芝芬, 周燮, 马春红, 等. 冠毒素和茉莉酸甲酯对诱导小麦、黑麦和高羊茅草颖花开放的效应[J]. 中国农业科学, 2001, 34(3): 334-337. [55] 何永明, 林拥军, 曾晓春. 水稻颖花自然开放过程中茉莉酸(JA)生物合成的变化[J]. 作物学报, 2012, 38(10): 1891-1899. [56] XIAO Y, CHEN Y, CHARNIKHOVA T, et al. OsJAR1 is required for JA-regulated floret opening and anther dehiscence in rice[J]. Plant Molecular Biology, 2014, 86(1/2): 19-33.
[57] LI X, WANG Y, DUAN E, et al. OPEN GLUME1: A key enzyme reducing the precursor of JA, participates in carbohydrate transport of lodicules during anthesis in rice[J]. Plant Cell Reports, 2018, 37(2): 329-346. doi: 10.1007/s00299-017-2232-y
[58] HIBARA K I, ISONO M, MIMURA M, et al. Jasmonate regulates juvenile-adult phase transition in rice[J]. Development, 2016, 143(18): 3407-3416.
[59] 闫志强, 徐海, 马作斌, 等. 籼稻与粳稻花时对茉莉酸甲酯(MeJA)响应的敏感性差异[J]. 中国农业科学, 2014, 47(13): 2529-2540. [60] 黄友明, 曾晓春. 环境因子和颖花构造对水稻颖花关闭的效应[J]. 江苏农业科学, 2021, 49(19): 94-100. [61] LIU L, ZOU Z, QIAN K, et al. Jasmonic acid deficiency leads to scattered floret opening time in cytoplasmic male sterile rice Zhenshan 97A[J]. Journal of Experimental Botany, 2017, 68(16): 4613-4625. doi: 10.1093/jxb/erx251
[62] 杨天玲. 提高杂交水稻繁殖制种异交结实率的途经[J]. 种子科技, 2007(3): 51-53. [63] 夏原野, 杜志敏, 杨宇尘, 等. 喷施表油菜素内酯对籼稻和粳稻花时的影响[J]. 作物杂志, 2019(4): 139-147. [64] 闫志强, 徐海, 宫彦龙, 等. 籼粳稻的花时对乙烯利调控的响应及其敏感性差异[J]. 沈阳农业大学学报, 2015, 46(6): 641-647. [65] 丁超尘, 郑立平. 激素改变杂交水稻制种父本花时的试验初报[J]. 安徽农业科学, 1994, 22(4): 295-299. [66] HUANG Y, ZENG X, CAO H. Hormonal regulation of floret closure of rice (Oryza sativa)[J]. PLoS One, 2018, 13(6): e198828.
[67] ZHAO Z, ZHANG Y, LIU X, et al. A role for a dioxygenase in auxin metabolism and reproductive development in rice[J]. Developmental Cell, 2013, 27(1): 113-122. doi: 10.1016/j.devcel.2013.09.005
[68] ZHAO Z, WANG C, YU X, et al. Auxin regulates source-sink carbohydrate partitioning and reproductive organ development in rice[J]. Proceedings of the National Academy of Sciences of the United States of America, 2022, 119(36): e2121671119. doi: 10.1073/pnas.2121671119
[69] JAGADISH S V K, BAHUGUNA R N, DJANAGUIRAMAN M, et al. Implications of high temperature and elevated CO2 on flowering time in plants[J]. Frontiers in Plant Science, 2016, 7: 913. doi: 10.3389/fpls.2016.00913.
[70] 蒯建敏, 莫惠栋, 惠大丰. 水稻花时与气象因子的关系[J]. 中国水稻科学, 1994, 8(2): 79-84. [71] 王忠, 卢从明, 顾蕴洁, 等. 水稻开颖机理的探讨: Ⅰ: 温度对水稻开颖及花粉生活力的影响[J]. 作物学报, 1988, 14(1): 14-21. [72] JAGADISH S, CRAUFURD P, WHEELER T. High temperature stress and spikelet fertility in rice (Oryza sativa L.)[J]. Journal of Experimental Botany, 2007, 58(7): 1627-1635. doi: 10.1093/jxb/erm003
[73] BISWAS K K O C, NEUMANN R, HAGA K, et al. Photomorphogenesis of rice seedlings: A mutant impaired in phytochrome-mediated inhibition of coleoptile growth[J]. Plant and Cell Physiology, 2003, 44(3): 242-254. doi: 10.1093/pcp/pcg040
[74] NISHIYAMA I, BLANCO L. Artificial control of flower opening time during the day in rice plant: I: Preliminary experiments[J]. Japanese Journal of Crop Science, 1981, 50(1): 59-66. doi: 10.1626/jcs.50.59
[75] 顾蕴洁, 王忠, 高煜珠. 环境因素对水稻颖花开闭影响的机理[J]. 植物生理学报, 1993, 19(4): 345-352. [76] 王忠, 何循宏. CO2促进小麦开花的效应[J]. 江苏农学院学报, 1991, 12(1): 46. [77] 许祥明, 王忠. 某些酸类物质对水稻开颖的效应[J]. 植物生理学报, 1998, 24(2): 124-130. [78] KOBAYASI K, SAKAI H, TOKIDA T, et al. Effects of free-air CO2 enrichment on flower opening time in rice[J]. Plant Production Science, 2019, 22(3): 367-373. doi: 10.1080/1343943X.2019.1569472
[79] 王忠, 顾蕴洁, 高煜珠. CO2诱导水稻开花技术的应用[J]. 植物生理学报, 1993, 29(4): 282-287. [80] ISHIMARU T, HIRABAYASHI H, IDA M, et al. A genetic resource for early-morning flowering trait of wild rice Oryza officinalis to mitigate high temperature-induced spikelet sterility at anthesis[J]. Annals of Botany, 2010, 106(3): 515-520. doi: 10.1093/aob/mcq124
[81] 徐伟东, 蔡金洋, 杨尧城. 水稻籼粳亚种间杂种优势利用研究现状与展望[J]. 中国稻米, 2016, 22(2): 1-7. doi: 10.3969/j.issn.1006-8082.2016.02.001



 下载:
下载: