Research progress and challenge of environment-sensitive genic male sterility in rice
-
摘要:
以环境敏感雄性不育为核心的两系杂交水稻对于保障我国粮食安全具有重要作用。目前,在水稻中发现了几十个环境敏感雄性不育基因,已对其中一部分基因进行克隆,并对其调控机制进行了详细的研究。本文综述了水稻环境敏感雄性不育的应用和发展,以及RNA代谢、信号转导、转录调控、花粉壁合成和氨基酸代谢等过程调节水稻环境敏感雄性不育的分子机理,最后对水稻环境敏感雄性不育研究存在的挑战进行分析,并提出了相应的对策。
Abstract:Two-line hybrid rice based on environment-sensitive genic male sterility plays an important role in ensuring food security in our country. At present, dozens of environment-sensitive male sterility genes have been found in rice, and some of them have been cloned and their regulatory mechanisms have been studied in detail. In this paper, we reviewed the application and molecular mechanisms of RNA metabolism, signal transduction, transcriptional regulation, pollen wall synthesis and amino acid metabolism of environment-sensitive genic male sterility in rice. Finally, challenges and corresponding countermeasures of environment-sensitive genic male sterility research in rice are also analyzed and proposed.
-
禽肉和禽蛋是人类优质蛋白质的重要来源,禽生长迅速、出栏较快,在中国居民膳食的动物性食物中占较大比例。然而,禽养殖过程中会受到多种疾病威胁,肠炎沙门菌Salmonella enteritidis是其中之一。该细菌病虽不如禽流感、新城疫等烈性传染病,会在禽群中致暴发性死亡或对养禽业造成极大经济损失,但带菌肉制品或蛋制品进入市场,可能引起区域性食物中毒,给人类健康带来威胁。人感染肠炎沙门菌病后,表现为嗜睡、厌食等症状。较严重感染时,主要表现为中毒相关症状,如发烧、腹痛、呕吐和腹泻等[1]。儿童、老人和免疫抑制的群体有病原扩散、全身传播的风险,严重者可恶化至败血症[2]。
肠炎沙门菌感染具有隐蔽性。在我国华中地区一项检测中发现,肠炎沙门菌的感染多见于健康鸡,故需要更为严格的防控措施[3]。该病的防治原则是预防致病菌感染,清除带菌鸡群,执行严格的消毒和隔离制度[4]。最简洁的防治方法是保证养殖场环境整洁,并对禽进行疫苗接种。在封闭式饲养条件下,沙门菌流行和卫生情况密切相关,如啮齿类动物控制、养殖设备清洁和工人卫生等[5]。针对肠炎沙门菌的疫苗,如ELANCO肠炎沙门菌弱毒活疫苗等,可尽早预防肠炎沙门菌在体内的黏附和定植[6]。但由于禽副伤寒沙门菌的血清型极多,疫苗预防在实际应用中难尽如人意。为防止肠炎沙门菌病持续对动物和人类健康造成威胁,需加强各层面对该病的检测和预防,一种灵敏、特异、快速的检测方法亟须建立。
肠炎沙门菌侵染给禽养殖业带来经济损失,且污染食品对人类健康造成严重威胁。由于该菌血清型众多,疫苗预防效果较差,且细菌耐药性逐渐增强,疾病防控更依赖于早期诊断[7]。近年来,随着诊断技术的不断创新,针对肠炎沙门菌,目前已有一套包括临床症状、病理变化、细菌学、免疫学和分子检测的诊断手段。然而,这些方法或检测时间较长,或灵敏度较低,或操作复杂,这意味着诊断耗时,诊断效果和人员需求可能难尽如人意[8-9]。
1987年,日本科学家Ishino等[10]在K19大肠埃希菌的碱性磷酸酶基因附近发现了一组特殊序列,并发现其广泛存在于细菌之中,这段序列被命名为“成簇的规律间隔的短回文重复序列”(Clustered regularly inter spaced short palindromic repeat,CRISPR),由CRISPR簇、前导序列L和Cas蛋白组成。Cas12a是一种由crRNA引导的核酸内切酶,具有切割DNA的能力。Cas12a不需要tracrRNA的协助,自身含有RNA内切酶活性;其识别的PAM序列灵敏度更高,是一段富含胸腺嘧啶的序列,故在胸腺嘧啶或腺嘌呤较集中的区域应用广泛[11-12]。此外,Cas12a的切割位点在PAM序列的远端[13],为多轮基因编辑提供了可能。
CRISPR/Cas12a在检测上有严格的操作步骤。临床样本采集后,需要抽提核酸。根据检测场所的设施情况,选择合适的核酸扩增反应,以提高待测样本中核酸含量。随后,将待测样本、Cas12a-crRNA复合体和探针进行孵育。通过荧光检测、侧向层析[14]等方法,判断待测样本中是否存在所检测的病原。
前期研究中,得益于扩增原理简单、所需材料轻便,PCR技术已经较广泛地应用于病原的快速检测,但该方法灵敏度较低,且具有假阴性等风险。CRISPR/Cas12a方法应用于检测亦较为轻便,且准确性较高,对检测资源匮乏的地区同样适用。本研究应用上述2种检测技术,联合PCR扩增技术和CRISPR/Cas12a的切割反应,建立一种操作简单、质检合格且能用于临床检测的肠炎沙门菌检测方法,通过荧光强度判断目标病原肠炎沙门菌的污染情况。并对该方法的灵敏性、特异性进行评估,以期为肠炎沙门菌的早期诊断提供技术手段,具有重要的实践意义。
1. 材料与方法
1.1 菌株来源
肠炎沙门菌Salmonella enteritidis S2e、大肠埃希菌Escherichia coli标准菌株(ATCC
25922 )、金黄色葡萄球菌Staphylococcus aureus标准菌株(ATCC29213 )、多杀性巴氏杆菌Pasteurella multocida标准菌株(CVCC 434)、粪肠球菌Salmonella choleraesuis (GDF22P19-1)、猪霍乱沙门氏菌Enterococcus faecalis标准菌株(ATCC 13312)由华南农业大学兽医学院药理教研室提供。1.2 细菌培养和基因组提取
菌株解冻,接种于5 mL LB肉汤培养基中,在恒温摇床中复苏。S2e株接种于SS琼脂培养基37 ℃恒温培养24 h后,挑取金属黑色单菌落,使用LB营养培养基37 ℃恒温培养24 h增菌。大肠埃希菌、金黄色葡萄球菌、多杀性巴氏杆菌、粪肠球菌和猪霍乱沙门氏菌菌株活化后使用LB营养琼脂培养基37 ℃恒温培养24 h扩繁。使用TIANGEN™细菌基因组DNA提取试剂盒(离心柱型)提取各菌株基因组,并使用NanoDrop2000分光光度计测量DNA质量浓度。
1.3 主要仪器和试剂
SS琼脂培养基、LB营养琼脂培养基和LB肉汤培养基购自青岛海博生物技术有限公司;Cas12a蛋白和对应Buffer购自广州艾迪基因科技有限责任公司;PCR引物、crRNA和ssDNA-reporter在手动设计后交由生工生物工程(上海)股份有限公司合成。PCR仪购自北京东胜创新生物科技有限公司;凝胶成像仪购自伯乐生命医学产品(上海)有限公司;NanoDrop2000分光光度计购自赛默飞世尔科技(中国)有限公司;Revvity EnSight™多功能酶标仪购自珀金埃尔默股份有限公司。
1.4 PCR引物、crRNA的设计与合成
将获取的肠炎沙门菌基因组序列(GenBank数据库登录号为CP011942.1、CP007468.2、CP007378.2、CP007433.2、CP007368.2)进行比对,设计符合sdfI基因区域的多对PCR引物和crRNA引物(表1)。
表 1 PCR和crRNA引物设计Table 1. Design of PCR primers and crRNA primers引物名称
Primer name引物序列(5′→3′)
Primer sequenceSe F1 GCGGTTTGATGTGGTTGG Se F2 GGGGAGGGAGGAGCTTTA Se F3 CCTTGACGCTGATACAGATA Se F4 CGAGCATGTTCTGGAAAG Se R1 TGGCTGGCGAATGGTGAG Se R2 TGGCGCGTTATATTTGTCAT Se R3 AGGTGGTGGCTGGCGAAT Se R4 CAGACAACAGGCTGATTTA Se R5 AACATGCTCGCTGCACAA Se R6 AAGAGTTACGACCGGATTTG crRNA1-262fw UAAUUUCUACUAAGUGUAG
AUGUAAAUCAGCCUGUUGUCUGcrRNA2-207fw UAAUUUCUACUAAGUGUAG
AUCAGAACAUGCUCGCUGCACAAcrRNA3-177rev UAAUUUCUACUAAGUGUAG
AUAGCCGGUCAAUGAGUUUUUCU1.5 PCR引物筛选
S2e细菌全基因组稀释至107 μL−1。设计引物对F1、R1,F2、R1,F1、R3,F2、R3,F4、R1,F4、R4,F2、R5,F3、R2,F1、R6,F2、R6和F4、R6,参与PCR反应。退火温度设置8个梯度,分别为52.0、52.5、53.3、54.7、56.3、57.6、58.5和59.0 ℃。采用20 μL反应体系:10 μL TAKARA Ex Taq™、1 μL DNA模板、上下游引物各0.5 μL、8 μL ddH2O。扩增条件:95 ℃预变性3 min;95 ℃变性30 s,各温度梯度退火30 s,72 ℃延伸30 s,共34个循环;72 ℃再延伸5 min。对扩增产物进行琼脂糖凝胶电泳,排除扩增失败、存在非特异性扩增的组别后,使用ImageJ软件根据灰度值测定最佳反应条件。
1.6 PCR-CRISPR/Cas12a检测方法的建立与评价
50 μL Cas12a反应体系需在暗环境下配制:5 μL NEBuffer3、2 μL PCR扩增产物、1 μL crRNA、0.5 μL ssDNA-reporter (5′-FAM-TTATT-BHQ1-3′)、1 μL LbsCas12a、40.5 μL ddH2O。短暂离心,于37 ℃恒温水浴锅中水浴10 min。水浴完成后,再次短暂离心,将50 μL反应体系避光转移至棕色96孔板中。
灵敏度评价和crRNA筛选:将S2e基因组浓度从108 μL−1逐级稀释至10−2 μL−1。各稀释度核酸以最佳的PCR引物和温度组合,使用3条crRNA完成2组扩增,一组用于PCR灵敏度检测,另一组用于PCR与CRISPR/Cas12a的联合检测。前者根据条带情况判断灵敏度;后者在体系配制完全后,使用Revvity EnSight™多功能酶标仪对荧光强度进行检测。各稀释度测试结果与阴性结果均进行独立样本t检验,以与阴性对照组有显著差异(P<0.05)的最低稀释度为其灵敏度。
特异性评价:使用未经稀释的S2e、ATCC 25922、ATCC 29213、CVCC 434、GDF22P19-1、ATCC 13312细菌全基因组在最佳PCR反应条件下,使用灵敏度最佳的crRNA完成扩增。一组扩增产物直接根据条带判断特异性,另一组配制Cas12a反应体系,使用Revvity EnSight™多功能酶标仪对荧光强度进行检测。各细菌基因组测试结果与阴性结果均进行独立样本t检验,以与阴性对照组有显著差异(P<0.05)的最低稀释度为其特异性。
1.7 样品的采集与PCR-CRISPR/Cas12a检测
从广东省广州市天河区的长湴农贸市场、国六宝肉菜市场、上元岗农贸市场;越秀区的东富肉菜市场、东山肉菜市场、共和西市场;白云区的梅花园农贸市场、云苑农贸市场;荔湾区的西华肉菜市场、龙津肉菜市场,共采集40枚禽小肠样品。40枚禽小肠,编号1~40,剪取约1 cm3可疑组织,浸泡于LB肉汤培养基中,37 ℃摇床孵育24 h。取各组肉汤培养基各1 mL,103 ℃金属浴15 min,以肉汤培养基为模板,完成PCR扩增和CRISPR/Cas12a检测。
2. 结果与分析
2.1 细菌基因组提取
使用TIANGEN™细菌基因组DNA提取试剂盒(离心柱型)提取肠炎沙门菌基因组后,测量得到DNA质量浓度为884.2 ng·μL−1。根据肠炎沙门菌全基因组大小,折算拷贝数为1.72×108 μL−1。大肠埃希菌ATCC 25922、金黄色葡萄球菌ATCC 29213、多杀性巴氏杆菌CVCC 434、粪肠球菌GDF22P19-1、猪霍乱沙门氏菌ATCC 13312的基因组提取后,测量质量浓度分别为283.1、190.9、255.7、291.5 和337.0 ng·μL−1。
2.2 PCR引物筛选
电泳完成后发现,引物组F1、R1,F2、R1,F1、R3,F4、R1,F4、R4,F4、R6有杂带或条带逸散的情况。在ImageJ中框选一定面积矩形范围,测量剩余组别各条带灰度值。引物组F1、R6在退火温度57.6 ℃时灰度值最高,故后续PCR扩增反应沿用此条件。
2.3 crRNA筛选和灵敏度检测
各稀释度的基因组DNA经多次PCR联合CRISPR/Cas12a检测后,荧光值与阴性对照组(CK)分别进行独立样本t检验(图1),结果表明采用crRNA1参与检测时,灵敏度最高:肠炎沙门菌基因组含量为1.72×100 μL−1时,P<0.01;基因组含量为1.72×10−1 μL−1或更低时,P>0.05。联合检测时灵敏度可达1.72×100 μL−1。而采用crRNA2和crRNA3参与联合检测时,灵敏度分别达1.72×102和1.72×103 μL−1,均次于crRNA1,故后续评价和临床样品检测环节,沿用crRNA1来建立检测体系。
![]() 图 1 PCR-CRISPR/Cas12a检测方法的定量评价“*” “**” “***”分别表示处理与阴性对照(CK)在0.05、0.01、0.001水平差异显著(t检验)。Figure 1. Quantitative evaluation of PCR-CRISPR/Cas12a detection method“*” “**” “***” indicate significant differences between treatment and the negative control at the 0.05, 0.01, and 0.001 levels, respectively(t test).
图 1 PCR-CRISPR/Cas12a检测方法的定量评价“*” “**” “***”分别表示处理与阴性对照(CK)在0.05、0.01、0.001水平差异显著(t检验)。Figure 1. Quantitative evaluation of PCR-CRISPR/Cas12a detection method“*” “**” “***” indicate significant differences between treatment and the negative control at the 0.05, 0.01, and 0.001 levels, respectively(t test).PCR灵敏度检测结果(图2)表明,肠炎沙门菌基因组含量为1.72×107 μL−1时条带可见,1.72×106 μL−1或更低时条带不显现,因此PCR灵敏度为1.72×107 μL−1。
![]() 图 2 PCR灵敏度检测M:DL500 DNA Marker,1~11表示肠炎沙门菌基因组含量分别为1.72×108、1.72×107、1.72×106、1.72×105、1.72×104、1.72×103、1.72×102、1.72×101、1.72×100、1.72×10−1和1.72×10−2 μL−1。Figure 2. Sensitivity detection of PCRM:DL500 DNA Marker, 1-11 indicate that the genome content of Salmonella enteritidis is 1.72×108, 1.72×107, 1.72×106, 1.72×105, 1.72×104, 1.72×103, 1.72×102, 1.72×101, 1.72×100, 1.72×10−1 and 1.72×10−2 μL−1.
图 2 PCR灵敏度检测M:DL500 DNA Marker,1~11表示肠炎沙门菌基因组含量分别为1.72×108、1.72×107、1.72×106、1.72×105、1.72×104、1.72×103、1.72×102、1.72×101、1.72×100、1.72×10−1和1.72×10−2 μL−1。Figure 2. Sensitivity detection of PCRM:DL500 DNA Marker, 1-11 indicate that the genome content of Salmonella enteritidis is 1.72×108, 1.72×107, 1.72×106, 1.72×105, 1.72×104, 1.72×103, 1.72×102, 1.72×101, 1.72×100, 1.72×10−1 and 1.72×10−2 μL−1.2.4 PCR-CRISPR/Cas12a特异性检测
PCR扩增后,只有肠炎沙门菌组产生明显条带,且不与其他细菌组别发生交叉反应(图3);CRISPR/Cas12a检测后,仅肠炎沙门菌组的荧光值与阴性对照组有显著差异(P<0.05,图4),说明检测方法特异性良好。
![]() 图 3 PCR特异性检测M:DL500 DNA Marker,1~6分别为肠炎沙门菌、大肠埃希菌、金黄色葡萄球菌、多杀性巴氏杆菌、猪霍乱沙门氏菌和粪肠球菌,CK为阴性对照。Figure 3. Specificity detection of PCRM:DL500 DNA Marker, 1: Salmonella enteritidis, 2: Escherichia coli, 3: Staphylococcus aureus, 4: Pasteurella multocida, 5: Enterococcus faecalis, 6: Salmonella choleraesuis, CK: Negative control.
图 3 PCR特异性检测M:DL500 DNA Marker,1~6分别为肠炎沙门菌、大肠埃希菌、金黄色葡萄球菌、多杀性巴氏杆菌、猪霍乱沙门氏菌和粪肠球菌,CK为阴性对照。Figure 3. Specificity detection of PCRM:DL500 DNA Marker, 1: Salmonella enteritidis, 2: Escherichia coli, 3: Staphylococcus aureus, 4: Pasteurella multocida, 5: Enterococcus faecalis, 6: Salmonella choleraesuis, CK: Negative control.![]() 图 4 CRISPR/Cas12a特异性检测1~6分别为肠炎沙门菌、大肠埃希菌、金黄色葡萄球菌、多杀性巴氏杆菌、猪霍乱沙门氏菌和粪肠球菌,CK为阴性对照;“***”表示菌株与阴性对照(CK)在0.001水平差异显著(t检验)。Figure 4. Specificity detection of CRISPR/Cas12a1: Salmonella enteritidis, 2: Escherichia coli, 3: Staphylococcus aureus, 4: Pasteurella multocida, 5: Enterococcus faecalis, 6: Salmonella choleraesuis, CK: Negative control; “***” indicate significant difference between treatment and the negative control at 0.001 level (t test).
图 4 CRISPR/Cas12a特异性检测1~6分别为肠炎沙门菌、大肠埃希菌、金黄色葡萄球菌、多杀性巴氏杆菌、猪霍乱沙门氏菌和粪肠球菌,CK为阴性对照;“***”表示菌株与阴性对照(CK)在0.001水平差异显著(t检验)。Figure 4. Specificity detection of CRISPR/Cas12a1: Salmonella enteritidis, 2: Escherichia coli, 3: Staphylococcus aureus, 4: Pasteurella multocida, 5: Enterococcus faecalis, 6: Salmonella choleraesuis, CK: Negative control; “***” indicate significant difference between treatment and the negative control at 0.001 level (t test).2.5 PCR-CRISPR/Cas12a对临床样品检测效果的评价
从市场上采回禽小肠后,剪取可疑病灶或污染部位,在LB肉汤中培养,培养完成后,金属浴裂解细胞,直接将处理后的培养液扩增并进行检测。结果(图5)显示,40个样品中,有6个样品有一定程度肠炎沙门菌污染现象(P<0.05),使用PCR方法对其进行检验,结果(图6)与图5结果保持一致。
![]() 图 5 PCR-CRISPR/Cas12a联合检测方法的应用“*”表示编号4、13、20、21、37、38的样品与阴性对照(CK)差异显著(P<0.05,t检验),表明有肠炎沙门菌污染现象。Figure 5. Application of the PCR-CRISPR/Cas12a combined assay method“*” indicates that the samples with code 4, 13, 20, 21, 37 and 38 were significantly different from the negative control, indicating that these samples were infected with Salmonella enteritidis.
图 5 PCR-CRISPR/Cas12a联合检测方法的应用“*”表示编号4、13、20、21、37、38的样品与阴性对照(CK)差异显著(P<0.05,t检验),表明有肠炎沙门菌污染现象。Figure 5. Application of the PCR-CRISPR/Cas12a combined assay method“*” indicates that the samples with code 4, 13, 20, 21, 37 and 38 were significantly different from the negative control, indicating that these samples were infected with Salmonella enteritidis.![]() 图 6 PCR检测禽小肠样本肠炎沙门菌的污染情况M:DL500 DNA Marker; “+”“−”分别表示阳性和阴性对照;样品4、13、20、21、37、38检出肠炎沙门菌污染。Figure 6. Detection of Salmonella enteritidis in small intestine samples by PCRM:DL500 DNA Marker; “+” “−” indicate positive control and negative control; The samples with code 4, 13, 20, 21, 37 and 38 were infected with Salmonella enteritidis.
图 6 PCR检测禽小肠样本肠炎沙门菌的污染情况M:DL500 DNA Marker; “+”“−”分别表示阳性和阴性对照;样品4、13、20、21、37、38检出肠炎沙门菌污染。Figure 6. Detection of Salmonella enteritidis in small intestine samples by PCRM:DL500 DNA Marker; “+” “−” indicate positive control and negative control; The samples with code 4, 13, 20, 21, 37 and 38 were infected with Salmonella enteritidis.3. 讨论与结论
肠炎沙门菌是当前最重要的食源性病原体之一,同时也是导致传染性胃肠炎的重要病原。有学者对国内部分地区沙门菌进行血清型分析,发现鸡源沙门菌血清型中肠炎约占60%,猪源沙门菌血清型中肠炎约占12%[15]。从世界范围来看,肠炎沙门菌感染泛滥。欧盟地区,原鸡繁殖群、蛋鸡、肉鸡沙门菌感染率分别为0.36%、0.95%、3.63%,其中分别有54.70%、80.96%和73.40%是由肠炎沙门菌感染引起[16];东亚地区,如韩国,禽肉沙门菌感染率为2.2%,每年有约
25000 人因此中毒,其中约500人因此死亡[17];在美国,据报道,因鸡蛋引起的肠炎沙门菌中毒占食源性疾病的24%[18];非洲地区常年受非伤寒性沙门菌影响,一大部分源于肠炎沙门菌的致病变异,成人相关继发性疾病的死亡率达37%以上[19]。由此可见,该细菌对禽养殖业和人类健康危害严重。目前检测肠炎沙门菌的方法主要有生化试验、PCR后测序比对等。以上常规检测方法特异性均可得到保障,但在细菌培养后,生化试验需要使用多种生化反应管进行检测;PCR测序比对在GC含量较高的区域容易产生偏差。本研究结合PCR和CRISPR/Cas12a技术,开发了1种可快速、灵敏地检测肠炎沙门菌的方法。
利用PCR扩增与CRISPR/Cas12a检测技术相结合建立的快速检测方法,可完善肠炎沙门菌监测体系,并可作为技术储备,在养殖场预防疾病、兽医治疗疾病及检疫等环节发挥重要作用。本研究所建立的方法是通过荧光强度判断病原是否存在。PCR扩增和CRISPR/Cas12a技术联合后,荧光检测的灵敏度可达100 μL−1,而单纯的PCR检测方法仅可达107 μL−1。检测时长上,CRISPR/Cas12a仅多1轮体系配制和孵育时间(约15 min),而灵敏度有较大改善,可以满足对隐性、弱阳性感染的检测需求。特异性检测方面,sdfI基因专一性强,PCR检测和2种方法联合检测结果均显示,有且仅有肠炎沙门菌在扩增后表现为阳性。总而言之,方法的建立较为成功,可用于后续的临床检测。
试验建立的诊断方法由2个步骤组成。首先,通过PCR扩增,实现目标病原基因组的放大。对实验室菌株和临床样品进行检测的过程中均可发现,所选用的F1、R6引物对,无论对纯净的基因组还是组织中较为杂乱的基因组进行扩增,均可完成检测。如禽小肠临床样品的检测中,细菌培养时未进行纯化,对组织和肉汤采用金属浴,不妨碍PCR扩增和CRISPR/Cas12a技术检测。其次,利用CRISPR/Cas12a的切割原理,对目的样本进行检测。Cas12a正确识别crRNA和PAM位点,核酸酶区域得到激活,开始对DNA进行切割。其中,ssDNA-reporter同时含有荧光基团FAM和淬灭基团BHQ1,在Cas12a蛋白切割活性被激活时,该DNA片段也会被切割,荧光基团与淬灭基团分离,从而通过酶标仪检测到荧光[20]。
组内荧光检测结果有一定差异。由于受检测当天气温等因素影响,切割活力有一定变化。重复检测结果发现,使用相同的孵育和检测手段,组内荧光值变异系数最高可达15%,属中等变异水平;但在各项检测过程中,该差异不影响结果判断,故检测方法的建立较为成功。
本研究在方法建立后,通过多次荧光值检测,将各组结果与阴性对照组进行独立样本t检验后得出结论。在临床检测中,若需要对样品进行简单的定性检测,可采用侧向层析试纸条判读。使用生物素探针biotin-DNA-FAM配制体系,通过吸附垫,C线上抗体可与生物素发生特异性结合;而仅当Cas12a被激活、探针被切割时,T线上抗体才可与FAM发生特异性结合,从而显现条带[21]。此外,扩增与CRISPR/Cas12a检测的孵育过程需要多次溶液转移,而“一锅法”检测一次性配制体系,减少了中途配置体系等人为干扰,结果判读更精准。值得注意的是,由于CRISPR/Cas12a反应混合物始终在反应管中,故“一锅法”检测适用于RPA、RAA等恒温扩增,PCR因其扩增过程中温度较高而不适用[22-24]。
本研究成功建立了1种针对肠炎沙门菌的快速检测方法,具有良好的灵敏度和特异性,可对临床样品进行针对性的检测,为禽肠炎沙门菌感染的早期预防提供了新的技术手段。
-
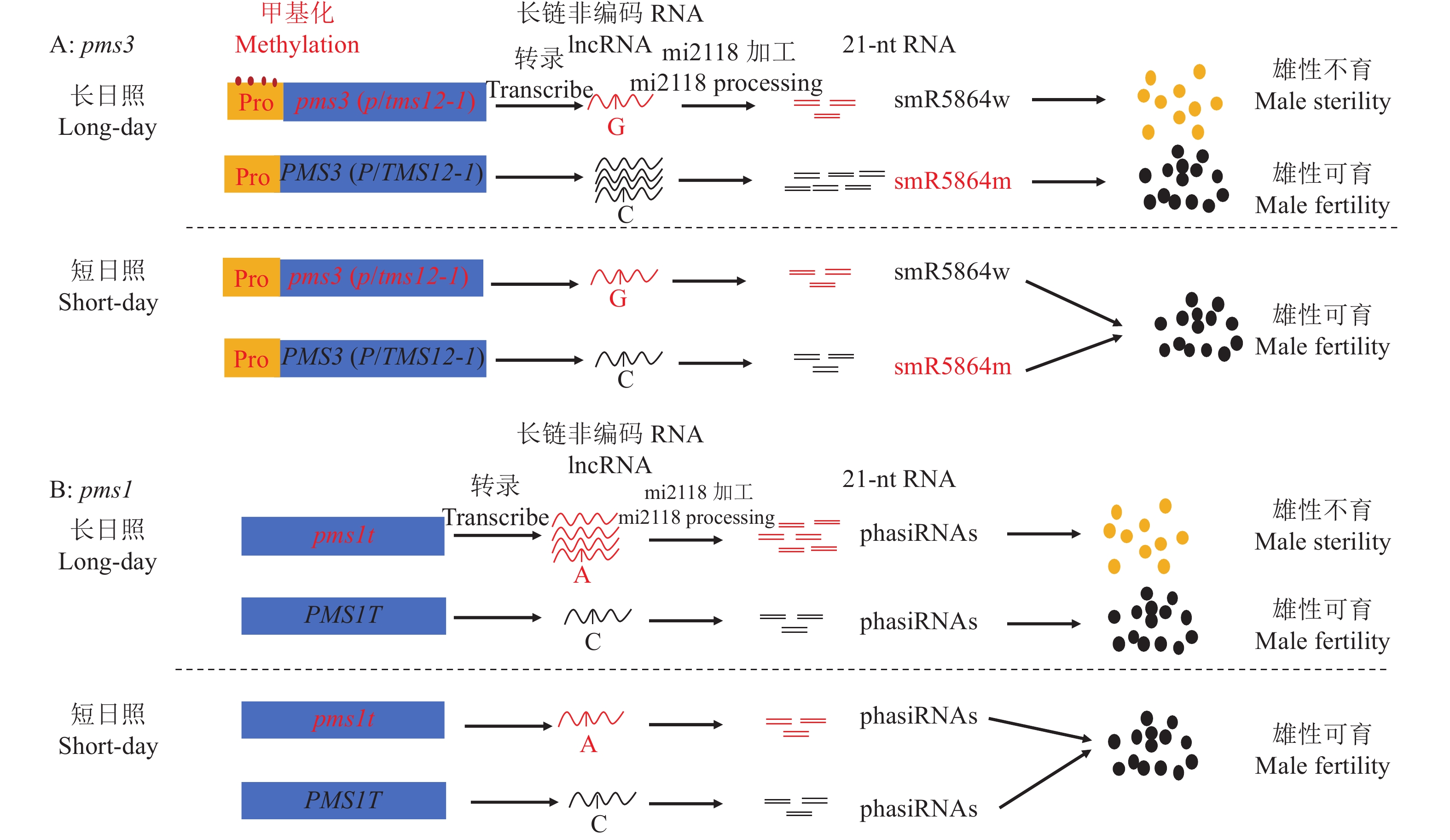
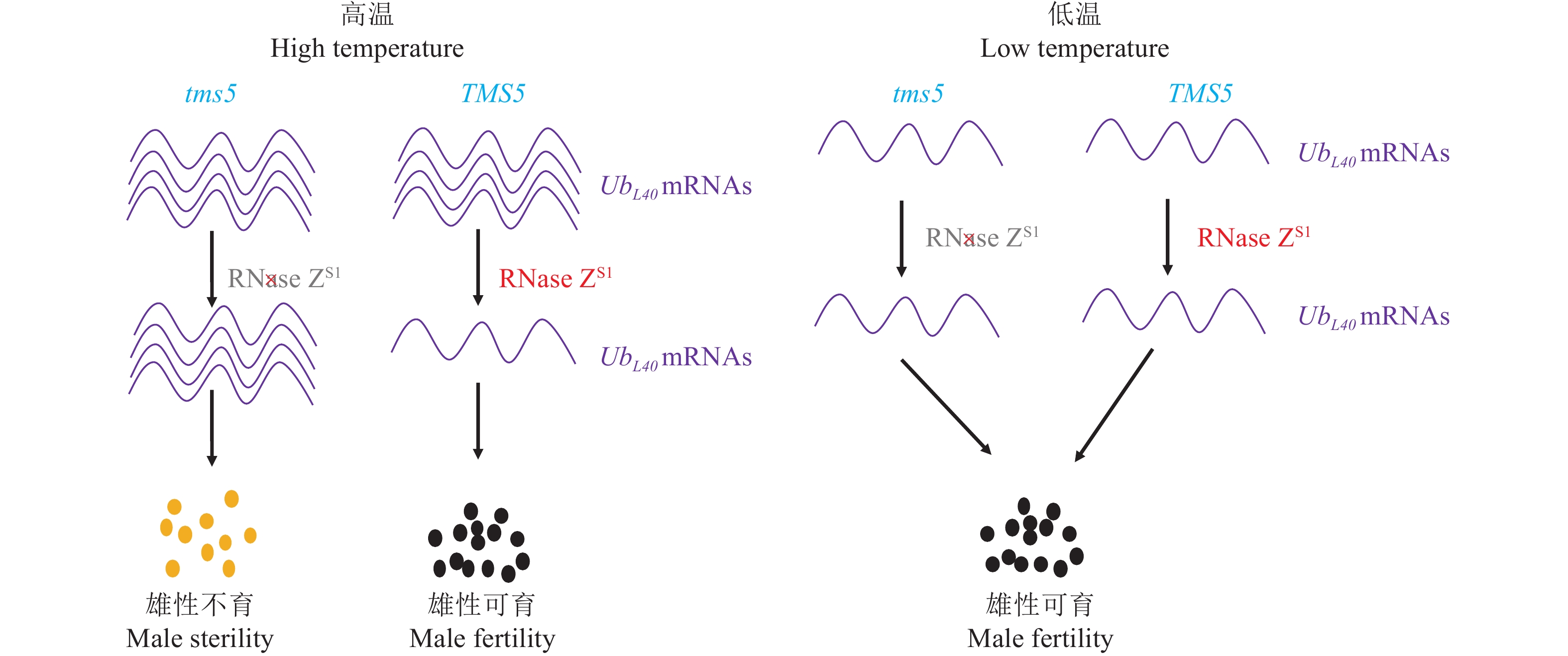
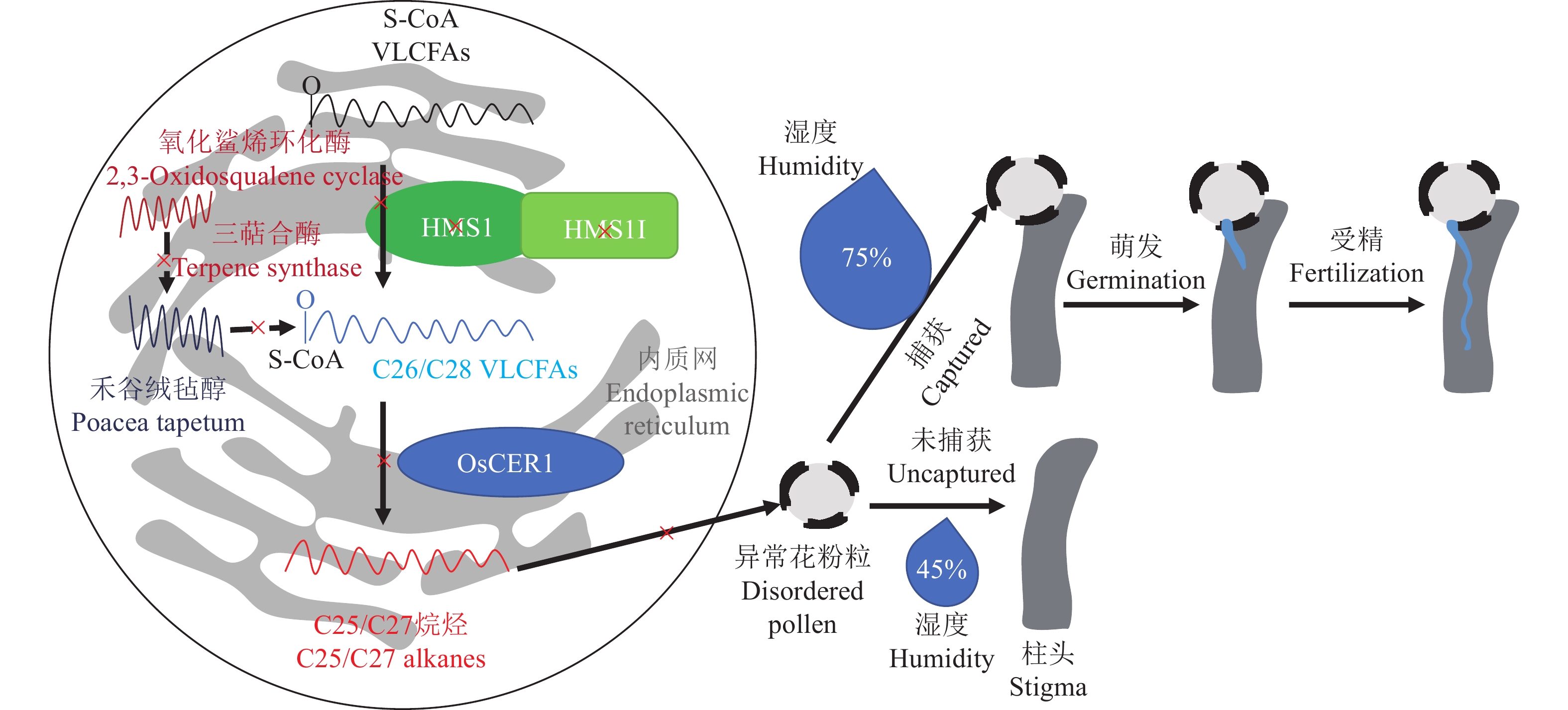
表 1 已经克隆的水稻环境敏感型雄性不育基因
Table 1 The cloned environment-sensitive genic male sterility genes in rice
基因名称 Gene name 基因号 Gene ID 编码产物 Transcript product 生物学过程 Biological process 类型 Type 文献 Reference ugp1 Os09g0553200 UDP葡萄糖焦磷酸化酶 RNA代谢 温敏雄性不育 [15] tms5 Os02g0214300 核糖核酸酶ZS1 RNA代谢 温敏雄性不育 [16] tms10 Os02g0283800 LRR–RLK 信号转导 温敏雄性不育 [17] tms9-1 Os09g0449000 PHD转录因子 转录调节 温敏雄性不育 [18] csa Os01g0274800 MYB转录因子 转录调节 反光敏雄性不育 [19] csa2 Os05g0490600 MYB转录因子 转录调节 反光敏雄性不育 [20] pms1 AK242308 长链非编码RNA RNA代谢 光敏雄性不育 [21] p/tms12-1(pms3) Os12g0545900 长链非编码RNA RNA代谢 光敏雄性不育 [22-23] ostms18 Os10g0524500 葡萄糖−甲醇−胆碱 (GMC) 氧化还原酶 花粉壁合成 温敏雄性不育 [24] hms1 Os03g0220100 3−酮脂酰辅酶A合酶6 花粉壁合成 湿敏雄性不育 [11] hmsi Os01g0150000 3−酮脂酰辅酶A合酶6互作蛋白 花粉壁合成 湿敏雄性不育 [11] ososc12/ospts1 Os08g0223900 双环三萜合酶 花粉壁合成 湿敏雄性不育 [25] oscer1/osgl1-4 Os02g0621300 酰基辅酶A合成酶 花粉壁合成 湿敏雄性不育 [26] etfβ Os04g0182800 电子传输黄素蛋白β亚基 氨基酸代谢 氮敏雄性不育 [27] 表 2 水稻中未克隆的环境敏感型雄性不育基因
Table 2 The un-cloned environment-sensitive genic male sterility genes in rice
基因名称 Gene name 定位的染色体 Located chromosome 类型 Type 来源 Source 文献 Reference PMS2 Chr. 3 光敏雄性不育 农垦58S [13] PMS4 Chr. 4 光敏雄性不育 绵9S [28] RPMS1 Chr. 10 反光敏雄性不育 Yi DS [29] RPMS2 Chr. 9 反光敏雄性不育 Yi DS [30] RTMS1 Chr. 10 反光敏雄性不育 J207S [31] RTMS10 Chr. 10 反光敏雄性不育 烟农S [32] S32 未知 反光敏雄性不育 华粳籼74 [33] TGMS Chr. 9 温敏雄性不育 SA2 [34] TMS1 Chr. 8 温敏雄性不育 5460S [35] TMS2 Chr. 7 温敏雄性不育 Norin PL12 [36] TMS3(t) Chr. 6 温敏雄性不育 IR32364TGMS [37] TMS4(t) Chr. 2 温敏雄性不育 TGMS-VN1 [38] TMS6 Chr. 5、9 温敏雄性不育 Sokcho-MS [39] TMS6(t) Chr. 10 反温敏雄性不育 G20S [40] TMS7 Chr. 9 温敏雄性不育 Tb2s [41] TMS8 Chr. 11 温敏雄性不育 F61 [42] TMS9-1 Chr. 9 温敏雄性不育 衡农S-1 [18] -
[1] 袁隆平. 发展超级杂交水稻保障国家粮食安全[J]. 杂交水稻, 2015, 30(3): 1-2. [2] 刘杰, 黄学辉. 作物杂种优势研究现状与展望[J]. 中国科学: 生命科学, 2021, 51(10): 1396-1404. [3] 商连光, 高振宇, 钱前. 作物杂种优势遗传基础的研究进展[J]. 植物学报, 2017, 52(1): 10-18. doi: 10.11983/CBB16187 [4] 韩亚丽, 林春晶, 赵丽梅, 等. 作物杂种优势预测研究进展[J]. 东北农业科学, 2020, 45(3): 30-34. [5] LONGIN C F H, MÜHLEISEN J, MAURER H P, et al. Hybrid breeding in autogamous cereals[J]. Theoretical and Applied Genetics, 2012, 125(6): 1087-1096. doi: 10.1007/s00122-012-1967-7
[6] 袁隆平. 杂交水稻发展的战略[J]. 杂交水稻, 2018, 33(3): 1-2. doi: 10.16267/j.cnki.1005-3956.20180920.246 [7] 石明松. 晚粳自然两用系选育及应用初报[J]. 湖北农业科学, 1981, 7: 1-3. [8] 牟同敏. 中国两系法杂交水稻研究进展和展望[J]. 科学通报, 2016, 61(35): 3761-3769. [9] 张志刚, 颜育民, 王桂元, 等. 水稻光温敏核不育系双8S的选育与应用[J]. 杂交水稻, 2013, 28(3): 6-9. doi: 10.16267/j.cnki.1005-3956.2013.03.005 [10] 刘金波, 徐大勇, 潘启民, 等. 水稻光温敏核质互作型不育系的选育[J]. 中国稻米, 2011, 17(1): 13-16. doi: 10.3969/j.issn.1006-8082.2011.01.004 [11] CHEN H, ZHANG Z, NI E, et al. HMS1 interacts with HMS1I to regulate very-long-chain fatty acid biosynthesis and the humidity-sensitive genic male sterility in rice (Oryza sativa)[J]. New Phytologist, 2020, 225(5): 2077-2093. doi: 10.1111/nph.16288
[12] DING J, LU Q, OUYANG Y, et al. A long noncoding RNA regulates photoperiod-sensitive male sterility, an essential component of hybrid rice[J]. Proceedings of the National Academy of Sciences of the United States of America, 2012, 109(7): 2654-2659. doi: 10.1073/pnas.1121374109
[13] 石明松. 对光照长度敏感的隐性雄性不育水稻的发现与初步研究[J]. 中国农业科学, 1995, 2: 44-48. [14] 邓华凤, 舒福北, 袁定阳. 安农S-1的研究及其利用概况[J]. 杂交水稻, 1999, 14(3): 1-3. [15] CHEN R, ZHAO X, SHAO Z, et al. Rice UDP-glucose pyrophosphorylase1 is essential for pollen callose deposition and its cosuppression results in a new type of thermosensitive genic male sterility[J]. Plant Cell, 2007, 19(3): 847-861. doi: 10.1105/tpc.106.044123
[16] ZHOU H, ZHOU M, YANG Y, et al. RNase ZS1 processes UbL40 mRNAs and controls thermosensitive genic male sterility in rice[J]. Nature Communications, 2014, 5: 4884. doi: 10.1038/ncomms5884.
[17] YU J, HAN J, KIM Y J, et al. Two rice receptor-like kinases maintain male fertility under changing temperatures[J]. Proceedings of the National Academy of Sciences of the United States of America, 2017, 114(46): 12327-12332. doi: 10.1073/pnas.1705189114
[18] QI Y B, LIU Q L, ZHANG L, et al. Fine mapping and candidate gene analysis of the novel thermo-sensitive genic male sterility tms9-1 gene in rice[J]. Theoretical and Applied Genetics, 2014, 127(5): 1173-1182. doi: 10.1007/s00122-014-2289-8
[19] ZHANG H, XU C, HE Y, et al. Mutation in CSA creates a new photoperiod-sensitive genic male sterile line applicable for hybrid rice seed production[J]. Proceedings of the National Academy of Sciences of the United States of America, 2013, 110(1): 76-81. doi: 10.1073/pnas.1213041110
[20] WANG D, LI J, SUN L, et al. Two rice MYB transcription factors maintain male fertility in response to photoperiod by modulating sugar partitioning[J]. New Phytologist, 2021, 231(4): 1612-1629. doi: 10.1111/nph.17512
[21] FAN Y, YANG J, MATHIONI S M, et al. PMS1T, producing phased small-interfering RNAs, regulates photoperiod-sensitive male sterility in rice[J]. Proceedings of the National Academy of Sciences of the United States of America, 2016, 113(52): 15144-15149. doi: 10.1073/pnas.1619159114
[22] DING J, SHEN J, MAO H, et al. RNA-directed DNA methylation is involved in regulating photoperiod-sensitive male sterility in rice[J]. Molecular Plant, 2012, 5(6): 1210-1216. doi: 10.1093/mp/sss095
[23] ZHOU H, LIU Q, LI J, et al. Photoperiod- and thermo-sensitive genic male sterility in rice are caused by a point mutation in a novel noncoding RNA that produces a small RNA[J]. Cell Research, 2012, 22(4): 649-660. doi: 10.1038/cr.2012.28
[24] ZHANG Y F, LI Y L, ZHONG X, et al. Mutation of GMC oxidoreductase leads to thermosensitive genic male sterility in rice and Arabidopsis[J/OL]. Plant Biotechnology Journal, 2022. [2022-07-11]. doi: 10.1111/pbi.13886.
[25] XUE Z, XU X, ZHOU Y, et al. Deficiency of a triterpene pathway results in humidity-sensitive genic male sterility in rice[J]. Nature Communications, 2018, 9: 604. doi: 10.1038/s41467-018-03048-8.
[26] NI E, DENG L, CHEN H, et al. OsCER1 regulates humidity-sensitive genic male sterility through very-long-chain (VLC) alkane metabolism of tryphine in rice[J]. Functional Plant Biology, 2021, 48(5): 461-468. doi: 10.1071/FP20168
[27] YANG H, LI Y, CAO Y, et al. Nitrogen nutrition contributes to plant fertility by affecting meiosis initiation[J]. Nature Communications, 2022, 13(1): 485. doi: 10.1038/s41467-022-28173-3.
[28] 王志, 吴凡, 唐益文, 等. 水稻新资源籼型两用核不育系绵9S的选育[J]. 西南农业学报, 1999, 12(4): 11-14. doi: 10.3969/j.issn.1001-4829.1999.04.003 [29] 黎世龄, 熊国新, 高一枝. 水稻短光敏雄性核不育性的发现与利用[J]. 杂交水稻, 2006, 21(1): 10-13. doi: 10.3969/j.issn.1005-3956.2006.01.003 [30] PENG H, ZHANG Z, WU B, et al. Molecular mapping of two reverse photoperiod-sensitive genic male sterility genes (rpms1 and rpms2) in rice (Oryza sativa L. )[J]. Theoretical and Applied Genetics, 2008, 118(1): 77-83. doi: 10.1007/s00122-008-0877-1
[31] JIA J, ZHANG D, LI C, et al. Molecular mapping of the reverse thermo-sensitive genic male-sterile gene (rtms1) in rice[J]. Theoretical and Applied Genetics, 2001, 103(4): 607-612. doi: 10.1007/PL00002916
[32] NI J, WANG D, NI D, et al. Characterization and fine mapping of RTMS10, a semi-dominant reverse thermo-sensitive genic male sterile locus in rice[J]. Journal of Integrative Agriculture, 2022, 21(2): 316-325. doi: 10.1016/S2095-3119(20)63563-8
[33] FANG C, LI L, HE R, et al. Identification of S23 causing both interspecific hybrid male sterility and environment-conditioned male sterility in rice[J]. Rice, 2019, 12: 10. doi: 10.1186/s12284-019-0271-4.
[34] REDDY O, SIDDIQ E, SARMA N, et al. Genetic analysis of temperature-sensitive male sterilty in rice[J]. Theoretical and Applied Genetics, 2000, 100(5): 794-801. doi: 10.1007/s001220051354
[35] 孙宗修, 熊振民, 闵绍楷, 等. 温度敏感型雄性不育水稻的鉴定[J]. 中国水稻科学, 1989, 3(2): 49-55. doi: 10.3321/j.issn:1001-7216.1989.02.001 [36] YAMAGUCHI Y, HIRASAWA H, MINAMI M, et al. Linkage analysis of thermosensitive genic male sterility gene, tms-2 in rice (Oryza sativa L. )[J]. Japanese Journal of Breeding, 1997, 47(4): 371-373.
[37] SUBUDHI P, BORKAKATI R, VIRMANI S, et al. Molecular mapping of a thermosensitive genetic male sterility gene in rice using bulked segregant analysis[J]. Genome, 1997, 40(2): 188-194. doi: 10.1139/g97-027
[38] DONG N, SUBUDHI P, LUONG P, et al. Molecular mapping of a rice gene conditioning thermosensitive genic male sterility using AFLP, RFLP and SSR techniques[J]. Theoretical and Applied Genetics, 2000, 100(5): 727-734. doi: 10.1007/s001220051345
[39] LEE D S, CHEN L J, SUH H S. Genetic characterization and fine mapping of a novel thermo-sensitive genic male-sterile gene tms6 in rice (Oryza sativa L. )[J]. Theoretical and Applied Genetics, 2005, 111(7): 1271-1277. doi: 10.1007/s00122-005-0044-x
[40] LIU X, LI X, ZHANG X, et al. Genetic analysis and mapping of a thermosensitive genic male sterility gene, tms6(t), in rice (Oryza sativa L.)[J]. Genome, 2010, 53(2): 119-124. doi: 10.1139/G09-092
[41] 邹丹妮. 水稻野栽远源杂交来源的温敏核雄性不育基因tms7的精细定位[J]. 海口: 海南大学, 2011. [42] HUSSAIN A J, ALI J, SIDDIQ E A, et al. Mapping of tms8 gene for temperature-sensitive genic male sterility (TGMS) in rice (Oryza sativa L. )[J]. Plant Breeding, 2012, 131(1): 42-47. doi: 10.1111/j.1439-0523.2011.01897.x
[43] ZHANG H, LIANG W, YANG X, et al. Carbon starved anther encodes a MYB domain protein that regulates sugar partitioning required for rice pollen development[J]. Plant Cell, 2010, 22(3): 672-689. doi: 10.1105/tpc.109.073668
[44] WU L, JING X, ZHANG B, et al. A natural allele of OsMS1 responds to temperature changes and confers thermosensitive genic male sterility[J]. Nature Communications, 2022, 13(1): 2055. doi: 10.1038/s41467-022-29648-z.
[45] FAN Y, ZHANG Q. Genetic and molecular characterization of photoperiod and thermo-sensitive male sterility in rice[J]. Plant Reproduction, 2018, 31(1): 3-14.
[46] ZHANG Q, SHEN B, DAI X, et al. Using bulked extremes and recessive class to map genes for photoperiod-sensitive genic male sterility in rice[J]. Proceedings of the National Academy of Sciences of the United States of America, 1994, 91(18): 8675-8679. doi: 10.1073/pnas.91.18.8675
[47] KUNZMANN A, BRENNICKE A, MARCHFELDER A. 5' end maturation and RNA editing have to precede tRNA 3' processing in plant mitochondria[J]. Proceedings of the National Academy of Sciences of the United States of America, 1998, 95(1): 108-113. doi: 10.1073/pnas.95.1.108
[48] PENG G, HE Y, WANG M, et al. The structural characteristics and the substrate recognition properties of RNase ZS1[J]. Plant Physiology and Biochemistry, 2021, 158: 83-90. doi: 10.1016/j.plaphy.2020.12.001
[49] ZHU L, CHENG H, PENG G, et al. Ubiquitinome profiling reveals the landscape of ubiquitination regulation in rice young panicles[J]. Genomics Proteomics & Bioinformatics, 2020, 18(3): 305-320.
[50] LIU W, SUN J, LI J, et al. Reproductive tissue-specific translatome of a rice thermo-sensitive genic male sterile line[J]. Journal of Genetics and Genomics, 2022, 49(7): 624-635.
[51] LI J, ZHANG H, SI X, et al. Generation of thermosensitive male-sterile maize by targeted knockout of the ZmTMS5 gene[J]. Journal of Genetics and Genomics, 2017, 44(9): 465-468. doi: 10.1016/j.jgg.2017.02.002
[52] ZHOU H, HE M, LI J, et al. Development of commercial thermo-sensitive genic male sterile rice accelerates hybrid rice breeding using the CRISPR/Cas9-mediated TMS5 editing system[J]. Scientific Reports, 2016, 6: 37395. doi: 10.1038/srep37395.
[53] NI E, ZHOU L, LI J, et al. OsCER1 plays a pivotal role in very-long-chain alkane biosynthesis and affects plastid development and programmed cell death of tapetum in rice (Oryza sativa L. )[J]. Frontiers in Plant Science, 2018, 9: 1217. doi: 10.3389/fpls.2018.01217.
[54] 黄蓉芬. 水稻光温敏核不育系利用中存在的问题与对策[J]. 江西农业, 2018(10): 35. doi: 10.3969/j.issn.1674-1479.2018.10.028 [55] LI Q L, ZHANG D B, CHEN M J, et al. Development of japonica photo-sensitive genic male sterile rice lines by editing Carbon Starved Anther using CRISPR/Cas9[J]. Journal of Genetics and Genomics, 2016, 43(6): 415-419. doi: 10.1016/j.jgg.2016.04.011
[56] LEI D, TANG W, XIE Z, et al. Solutions to insecurity problems in seed production of two-line hybrid rice[J]. Agricultural Science & Technology, 2013, 15(7): 1160-1166.
[57] 雷东阳, 唐文帮, 解志坚, 等. 两系法杂交水稻制种不安全问题的解决途径[J]. 作物学报, 2013, 39(9): 1569-1575. [58] 柏斌, 吴俊, 庄文, 等. 育性敏感期低温对水稻光温敏不育系生理指标的影响[J]. 华北农学报, 2015, 30(3): 98-104. doi: 10.7668/hbnxb.2015.03.018 [59] 蔡星星, 张盛, 曾亚军, 等. 水稻两系不育系广占63-4S育性转换温度的提纯[J]. 湖北农业科学, 2015, 54(21): 5216-5217. doi: 10.14088/j.cnki.issn0439-8114.2015.21.004 [60] 陈立云, 肖应辉. 水稻光温敏核不育机理设想及光温敏核不育系选育策略[J]. 中国水稻科学, 2010, 24(2): 103-107. doi: 10.3969/j.issn.1001-7216.2010.02.01 [61] 何强, 庞震宇, 孙平勇, 等. 低温处理水稻光温敏核不育系筛选核心单株的效果研究[J]. 杂交水稻, 2016, 31(1): 18-20. doi: 10.16267/j.cnki.1005-3956.201601006



 下载:
下载: