Existing position and extraction of antifungal substance produced by Chaetomium subaffine LB-1
-
摘要:目的
对近缘毛壳Chaetomium subaffine菌株LB-1产生抑菌物质的部位及提取方法进行研究,为开发生防菌株LB-1防治植物病害奠定基础。
方法以番茄灰霉病菌Botrytis cinerea和玉米大斑病菌Exserohilum turcicum为指示菌,采用平板密封培养法检测菌株LB-1是否产生挥发性抑菌物质;采用菌体超声破碎和液态培养的方式检测菌株LB-1产生的非挥发性抑菌物质存在的部位;采用含毒培养基法和滤纸片法检测菌株LB-1培养液的硫酸铵沉淀、盐酸沉淀和有机溶剂萃取物的抑菌效果,以确定菌株LB-1培养液中抑菌物质的提取方法。
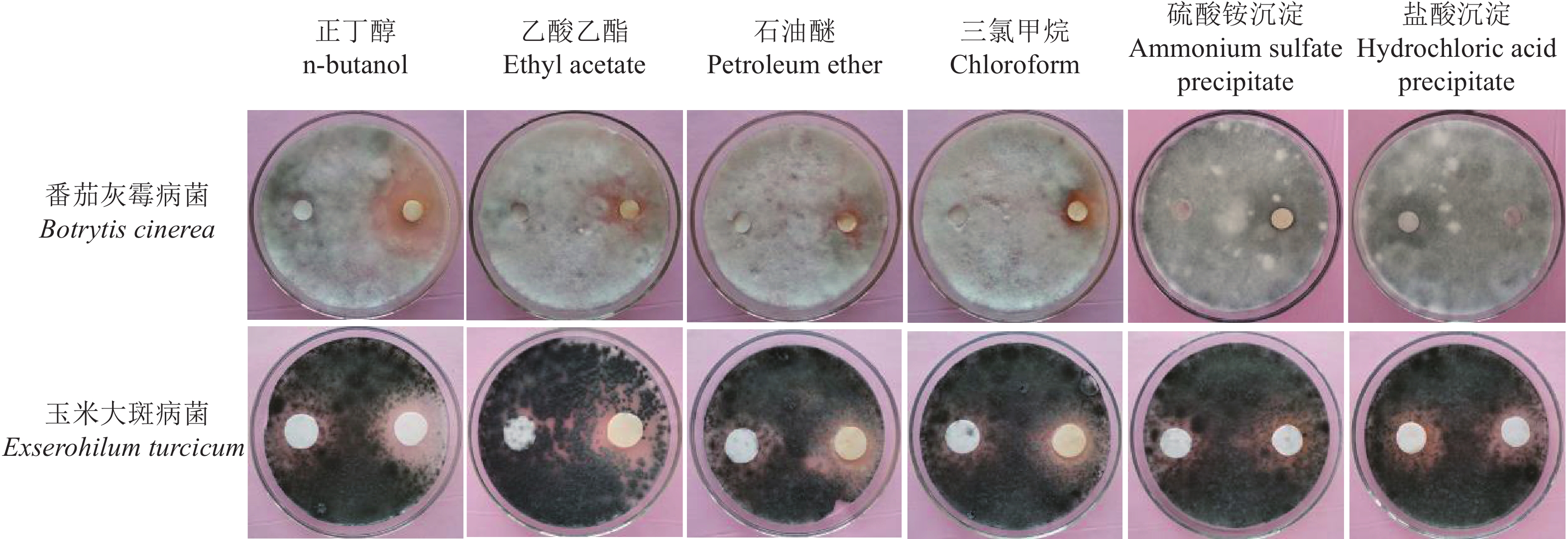
结果菌株LB-1与2种供试病原菌密封共培养时,对病原菌的生长没有明显影响,表明菌株LB-1不能产生挥发性抑菌物质。菌株LB-1菌体胞内提取物的抑菌活性与对照无差异,但其培养液对B. cinerea和E. turcicum的生长有较强的抑制作用,表明菌株LB-1产生的抑菌物质存在于菌体细胞外。菌株LB-1培养液的硫酸铵沉淀和盐酸沉淀对2种供试植物病原真菌的生长均无抑制效果,但有机溶剂萃取可获得菌株LB-1培养液中的抑菌物质,其中正丁醇萃取物抑菌效果最好,当其质量浓度为0.1 mg/mL时,对B. cinerea和E. turcicum的生长抑制率分别高达59.80%和58.37%。
结论菌株LB-1通过产生胞外非挥发性物质抑制植物病原真菌的生长,培养液中的抑菌物质可通过正丁醇萃取获得。
Abstract:ObjectiveThe existing position and extraction method of antifungal substance produced by Chaetomium subaffine strain LB-1 were studied in order to lay a foundation for the development of the strain LB-1 to control plant diseases.
MethodWith Botrytis cinerea and Exserohilum turcicum as test plant pathogens, the sealed plate assay was used to detect whether the strain LB-1 could produce volatile antifungal substance. The hyphae ultrasonic breaking and liquid culture methods were used to detect the existing position of nonvolatile antifungal substance produced by the strain LB-1. The extraction method of antifungal substance was determined by detecting the inhibitory effects of ammonium sulfate precipitation, hydrochloric acid precipitation and organic solvents extracts of strain LB-1 culture broth via poison plate assay and filter paper disc assay.
ResultThe strain LB-1 did not have obvious inhibitory effect on the growth of the two test plant pathogens when being co-cultured in a sealed plate with each plant pathogen, indicating that strain LB-1 could not produce volatile antifungal substance. The antifungal activity of the intracellular extract of the strain LB-1 was not different from that of the control, but its culture broth had a strong inhibitory effect on B. cinerea and E. turcicum, indicating that the antifungal substances produced by the strain LB-1 existed outside the mycelium. Neither ammonium sulfate precipitate nor hydrochloric acid precipitate of strain LB-1 culture broth showed inhibitory effect on B. cinerea and E. turcicum, but the organic solvent extract of strain LB-1 culture broth showed antifungal effect, and the inhibition rate of n-butanol extract was the highest. When the concentration was 0.1 mg/mL, the inhibition rates against B. cinerea and E. turcicum growth were 59.80% and 58.37% respectively.
ConclusionThe strain LB-1 inhibited the growth of plant pathogenic fungi by producing extracellular nonvolatile antifungal substances, and the antifungal substance in the culture broth can be extracted by n-butanol.
-
氯虫苯甲酰胺属于新型邻氨基苯甲酰胺类杀虫剂,其选择性地与鳞翅目昆虫受体鱼尼丁结合,并打开钙离子通道,使贮存在胞内的钙离子持续释放到肌浆中,导致肌肉细胞丧失收缩功能[1-4],从而使昆虫表现为取食停止、乏力、反胃和肌肉瘫痪,直至死亡[5-7]。氯虫苯甲酰胺不仅可经茎、叶表面渗透到植物体内,还可通过根部吸收并在木质部移动[8],具有良好的植物传导特性、耐雨水冲刷能力和抗光解性能及持效性[9],因其杀虫谱广、对哺乳动物毒性低、对非靶标生物(如鸟、鱼、蚯蚓以及微生物等)影响较小等优点[9-11],成为近年防治我国水稻害虫的主力品种之一。
2007年氯虫苯甲酰胺在菲律宾获准登记并销售,后在美国、澳大利亚、印度尼西亚、中国、韩国、巴西等50多个国家获准登记。氯虫苯甲酰胺200SC于2007年在中国获临时登记,用于防治稻纵卷叶螟Cnaphalocrocis medinalis Guenée[12]。田间应用表明,氯虫苯甲酰胺不仅对稻纵卷叶螟具有优异的防治效果,还对部分水稻品种具有促生长和增产作用。研究报道氯虫苯甲酰胺对水稻品种冈优881和高粱品种泸糯8号具有一定的增产作用[13-14],而对武运粳23号增产不明显[15]。
笔者在湖北水稻主要种植区黄冈和仙桃2地4点,进行了大田示范试验,旨在验证氯虫苯甲酰胺200SC对湖北主要水稻种植品种鄂中5号稻纵卷叶螟的防效以及对水稻植株生长和产量的影响,为其大面积示范和推广应用提供科学依据。
1. 材料与方法
1.1 材料
供试水稻Oryza sativa L.品种为鄂中5号,插秧种植。氯虫苯甲酰胺200SC,上海杜邦农化有限公司生产,用药量为30 g·hm-2;阿维菌素18EC,河北威远生物化工股份有限公司生产,用药量为27 g·hm-2。
1.2 方法
1.2.1 试验设计
田间试验在湖北省仙桃市和黄冈市试验点进行,试验点1:仙桃谢场镇新洲村;试验点2:仙桃海口镇陈家村;试验点3:黄冈麻城杨家冲村;试验点4:黄冈麻城刘角林村。各试验点选取一块100~150 m2的水稻田作为大区,大区周围设保护行,每大区分成3个处理区,各处理区之间设保护行并筑20~30 cm宽的田埂。试验区地势平整,水稻长势均匀,肥水管理一致。各试验点基本情况如表 1所示。
表 1 试验点基本情况Table 1. Background of the test sites
1.2.2 施药方法
各处理将氯虫苯甲酰胺200SC和阿维菌素18EC(阳性对照)按药剂试验设计用量兑水配成药液,以水稻常规防治稻纵卷叶螟方法对水稻植株进行茎叶喷雾处理。每平方米喷药液0.045 L,并按每平方米0.045 L用水量计算各处理区的用水量,空白对照区喷等量清水。
1.2.3 试验处理及调查
喷药前进行虫口基数调查,第1次药后14 d,第2次药后14 d进行药效调查,试验期间共调查3次。将各处理区分为2个部分:一部分用于对害虫的药效调查,每试验点各处理调查100蔸水稻,记录稻纵卷叶螟为害卷叶株数;另一部分用于产量的测定。
在施药前,调查卷叶株数、水稻叶色、分蘖数和长势。第1次药后14 d,调查卷叶数和水稻长势。第2次药后14 d,调查卷叶数、水稻叶色、分蘖数和长势。到收获期时,调查水稻无效穗数、每穗粒数、每穗的有效结实粒、千粒质量以及产量。
叶色:用国际水稻研究所LCC比色板为标准,评估每蔸水稻的颜色分级,每种处理随机抽取40蔸水稻,计算4个试验点平均叶色级别和平均长势。
分蘖数:每种处理随机抽取40蔸水稻,分别于药前调查并记录每蔸水稻株数和第2次药后14 d调查并记录每蔸水稻分蘖数,计算4个试验点平均分蘖数和增加率。在同一处理前期没调查过的另一半区域,随机抽取40蔸水稻,调查并记录有效分蘖数、无效分蘖数,计算4个试验点有效分蘖数的增加率和无效分蘖数的减少率。
每穗粒数及结实率:从调查有效穗数项目中的40蔸水稻里,随机抽取10个稻穗进行考种,调查并记录每穗粒数及有效粒数,计算4个试验点每穗粒数和每穗结实粒增加率。
千粒质量:从调查有效穗数项目中的40蔸水稻谷粒里,随机抽点1 000粒稻谷,抽取3次,干燥,直至谷粒含水量(w)为13%时称质量。
测产:用农业部规定的方法进行产量测定,每大区随机验收收割测规(20 m2)水稻,对其进行测产,并把亩产量转化成每公顷的产量,单位为t·hm-2,计算4个试验点增产率。
1.2.4 药效计算

2. 结果与分析
2.1 氯虫苯甲酰胺200SC的保叶效果
在本试验实施期间,氯虫苯甲酰胺200SC对稻纵卷叶螟药效试验调查结果见表 2。由表 2可知:第1次施药后14 d和第2次施药后14 d氯虫苯甲酰胺200SC的保叶效果分别为85.71%和69.69%,明显优于对照药剂阿维菌素18EC的67.21%和48.20%。
表 2 氯虫苯甲酰胺200SC对稻纵卷叶螟的药效1)Table 2. Effects of chlorantraniliprole 200SC on rice leaf roller
2.2 氯虫苯甲酰胺200SC对水稻生长及产量的影响
2.2.1 对水稻叶色及长势的影响
氯虫苯甲酰胺200SC对水稻叶色及长势的影响调查结果见表 3。从表 3可以看出:4个试验点2个处理,药前4个试验点长势一致;第2次药后14 d,氯虫苯甲酰胺200SC处理叶色优于空白对照,与阳性对照阿维菌素18EC差异不显著;氯虫苯甲酰胺200SC处理作物长势优于阳性对照阿维菌素18EC和空白对照。
表 3 氯虫苯甲酰胺200SC对水稻叶色及作物长势的影响1)Table 3. Influence of chlorantraniliprole 200SC on rice leaf color and crop vigor
2.2.2 对水稻分蘖的影响
氯虫苯甲酰胺200SC对水稻分蘖的影响调查结果显示第2次药后14 d,氯虫苯甲酰胺200SC处理4个试验点水稻分蘖数为10.49苗·蔸-1,阿维菌素18EC处理为9.40苗·蔸-1,与空白对照8.45苗·蔸-1相比,分别增加24.14%和11.24%。氯虫苯甲酰胺200SC对水稻分蘖有较明显的促进作用,并明显优于阳性对照药剂阿维菌素18EC。
氯虫苯甲酰胺200SC和阿维菌素18EC处理,4个试验点平均水稻有效分蘖分别为19.79和20.50株·蔸-1,比对照(19.40株·蔸-1)分别增加2.01%和3.35%,对照药剂阿维菌素18EC优于处理药剂氯虫苯甲酰胺200SC;无效分蘖分别为0.83和0.80株·蔸-1,分别比对照(1.34株·蔸-1)减少38.06%和40.30%,2种药剂间差异不显著。试验结果表明氯虫苯甲酰胺200SC可提高水稻有效分蘖和减少无效分蘖数。
2.2.3 对水稻每穗粒数及结实率的影响
4个试验点平均水稻每穗粒数和每穗结实粒数,氯虫苯甲酰胺200SC处理分别为177.00和133.10粒·穗-1,比对照(160.58和126.78粒·穗-1)分别增加10.23%和4.99%;对照药剂阿维菌素18EC分别为167.65和133.10粒·穗-1,比对照分别增加4.49%和4.99%。氯虫苯甲酰胺200SC处理每穗粒数增加效果优于对照药剂阿维菌素18EC;而每穗结实粒数与对照药剂阿维菌素18EC相当。但各药剂处理的4个试验点的每穗粒数和结实粒数差异显著,这可能与不同试验点药剂对稻纵卷叶螟防治效果相关。
2.2.4 对水稻千粒质量及产量的影响
氯虫苯甲酰胺200SC对水稻千粒质量及产量的影响调查结果见表 4。从表 4可以看出:氯虫苯甲酰胺200SC和阿维菌素18EC处理千粒质量分别为17.63和17.49 g,对照为17.17 g,氯虫苯甲酰胺200SC处理千粒质量增加效果优于对照药剂阿维菌素18EC;20 m2水稻产量分别为8.85和8.48 kg,对照为7.85 kg,与对照相比,氯虫苯甲酰胺200SC处理增产率为12.72%优于对照药剂阿维菌素18EC处理的7.89%。试验结果表明2种药剂处理均可增加水稻产量和千粒质量,且处理药剂氯虫苯甲酰胺200SC优于对照药剂阿维菌素18EC。
表 4 氯虫苯甲酰胺200SC对水稻千粒质量及产量的影响1)Table 4. Influence of chlorantraniliprole 200SC on thousand-grain weight and rice yield
3. 结论
4个试验点第1次施药后14 d和第2次施药后14 d氯虫苯甲酰胺200SC对稻纵卷叶螟防效分别为85.71%和69.69%,明显优于对照药剂阿维菌素18EC的67.21%和48.20%。与董波等[15]和赵阳等[16]研究结果基本一致,而保叶率效果低于束兆林等[17]和张志东等[13]报道的防效,这可能与稻纵卷叶螟产生抗药性有关。
氯虫苯甲酰胺200SC对水稻叶色和长势与对照药剂差异不显著。但第2次施药后14天,水稻分蘖数比空白对照平均增加2.04苗·蔸-1,每蔸水稻分蘖数平均增加了24.14%,而对照药阿维菌素18EC分蘖数增加0.95苗·蔸-1,每蔸水稻分蘖数平均增加了11.24%。因此,氯虫苯甲酰胺200SC对水稻分蘖有较明显的促进作用,并优于对照药剂。
氯虫苯甲酰胺200SC和阿维菌素18EC处理水稻有效分蘖数分别增加2.01%和3.35%,对照药剂阿维菌素18EC处理优于处理药剂氯虫苯甲酰胺200SC处理;无效分蘖数分别减少38.06%和40.30%,处理药剂之间差异不显著;而每穗粒数分别增加10.23%和4.40%,氯虫苯甲酰胺200SC处理优于对照药剂阿维菌素18EC处理;结实率分别增加4.49%和4.49%,处理药剂之间差异不显著;千粒质量分别增加2.68%和1.86%,每667 m2产量分别增加12.72%和7.89%,处理药剂氯虫苯甲酰胺200SC优于对照药剂阿维菌素18EC,与张志东等[13]报道一致,这可能与氯虫苯甲酰胺200SC诱导水稻每蔸分蘖数增加2.04棵苗,每穗粒数增加16.42粒和千粒质量增加0.46 g相关,因此,氯虫苯甲酰胺可诱导水稻分蘖数,每穗粒数和千粒质量增加,从而提高水稻的亩产量,其增产机理有待进一步的研究。
-
图 1 滤纸片法检测的菌株 LB-1 培养液不同提取物对病原菌生长的抑制效果
每一培养皿中,左侧滤纸片为 DMSO 或缓冲液处理(CK),右侧为有机溶剂萃取物或沉淀物处理
Figure 1. Antifungal effects of different extracts from culture broth of strain LB-1 on the growth of plant pathogens by filter paper disc assay
In each petri dish, the filter paper on the left side was treated with DMSO or buffer solution (CK), the right side was treated with organic extract or precipitation
表 1 菌株LB-1菌体胞内提取物质对病原菌生长的抑制效果
Table 1 Inhibitory effects of intracellular extract of strain LB-1 on the growth of plant pathogens
处理 Treatment 番茄灰霉病菌 Botrytis cinerea 玉米大斑病菌 Exserohilum turcicum 菌落直径/mm Diameter of colony 抑制率1)/% Inhibition rate 菌落直径/mm Diameter of colony 抑制率1)/% Inhibition rate 菌体胞内液 Intracellular extract 59.17±1.44 2.25a 61.17±1.89 1.47a 8.5 g/L NaCl 59.33±1.26 2.00a 60.83±1.26 1.96a 空白对照 Blank control 60.67±1.53 62.17±1.26 1) 同列数据后的不同小写字母表示差异显著(P < 0.05,LSD法) 1) Different lowercase letters in the same column indicate significant difference (P < 0.05,LSD method) 表 2 菌株LB-1不同培养天数的培养液对病原菌生长的抑制效果
Table 2 Inhibitory effects of culture broth of strain LB-1 on the growth of plant pathogens
培养时间/d Incubation time 番茄灰霉病菌 Botrytis cinerea 玉米大斑病菌 Exserohilum turcicum 菌落直径/mm Diameter of colony 抑制率1)/% Inhibition rate 菌落直径/mm Diameter of colony 抑制率1)/% Inhibition rate 3 54.00±0.10 10.00c 46.92±0.04 22.37c 7 48.17±0.06 18.75b 46.33±0.20 23.23c 10 45.37±0.16 22.95b 42.50±0.36 28.85b 15 35.33±0.15 38.00a 35.67±0.03 38.88a 20 34.67±0.08 39.00a 35.17±0.10 39.61a 空白对照 Blank control 60.67±1.53 62.17±0.13 1) 同列数据中的不同小写字母表示差异显著(P<0.05,LSD法) 1) Different lowercase letters in the same column indicate significant difference (P<0.05,LSD method) 表 3 菌株LB-1培养液的硫酸铵沉淀物和盐酸沉淀物对病原菌生长的抑制效果
Table 3 Inhibitory effects of ammonium sulfate precipitation and hydrochloric acid precipitation of culture broth of strain LB-1 on the growth of plant pathogens
处理 Treatment 番茄灰霉病菌 Botrytis cinerea 玉米大斑病菌 Exserohilum turcicum 菌落直径/mm Diameter of colony 抑制率1)/% Inhibition rate 菌落直径/mm Diameter of colony 抑制率1)/% Inhibition rate 硫酸铵沉淀 Ammonium sulfate precipitate 60.33±1.53 1.24a 62.17±2.02 2.15a PBS缓冲液 PBS buffer solution 59.67±1.61 2.23a 62.83±1.15 1.20a 盐酸沉淀 Hydrochloric acid precipitate 60.50±1.50 0.99a 63.17±1.04 0.72a 磷酸缓冲液 Phosphate buffer solution 60.67±1.61 0.74a 62.83±1.15 1.20a 空白对照 Blank control 61.17±1.26 63.67±1.53 1)同列数据后的不同小写字母表示差异显著(P < 0.05,LSD法) 1)Different lowercase letters in the same column indicate significant difference (P < 0.05,LSD method) 表 4 菌株LB-1培养液的有机溶剂萃取物及水相对病原菌生长的抑制效果
Table 4 Inhibitory effects of organic extracts and its aqueous phase of culture broth of strain LB-1 on the growth of plant pathogens
处理 Treatment 番茄灰霉病菌 Botrytis cinerea 玉米大斑病菌 Exserohilum turcicum 菌落直径/mm Diameter of colony 抑制率1)/% Inhibition rate 菌落直径/mm Diameter of colony 抑制率1)/% Inhibition rate 正丁醇粗提物 Crude extract of n-butanol 21.00±1.32 59.80a 23.00±1.80 58.37a 乙酸乙酯粗提物 Crude extract of ethyl acetate 47.67±1.26 20.10b 50.00±1.32 19.62b 石油醚粗提物 Crude extract of petroleum ether 51.17±1.89 14.89c 54.67±0.38 12.92c 三氯甲烷粗提物 Crude extract of chloroform 49.17±2.02 17.87bc 52.67±1.26 15.79c 正丁醇水相 Aqueous phase of n-butanol 60.00±1.00 1.74d 63.17±1.76 0.72d 乙酸乙酯水相 Aqueous phase of ethyl acetate 60.33±1.89 1.24d 63.00±1.80 0.96d 石油醚水相 Aqueous phase of petroleum ether 59.67±0.76 2.23d 62.83±2.02 1.20d 三氯甲烷水相 Aqueous phase of chloroform 59.17±2.25 2.98d 62.36±1.30a 1.88d 二甲基亚枫 Dimethylsulfoxide 59.83±1.44 1.99d 62.41±1.36 1.81d 空白对照 Blank control 61.17±1.26 63.67±1.53 1)同列数据后的不同小写字母表示差异显著(P < 0.05,LSD法) 1) Different lowercase letters in the same column indicate significant difference (P < 0.05,LSD method) -
[1] HUANG P M, WATTANACHAI P, KASEM S, et al. Efficacy of Chaetomium species as biological control agents against Phytophthora nicotianae root rot in citrus[J]. Mycobiology, 2015, 43(3): 288-296. doi: 10.5941/MYCO.2015.43.3.288
[2] 万 慧, 刘晓光, 曹荣花, 等. 螺旋毛壳ND35抗生素的产生及其在病害生物防治中的作用[J]. 植物保护学报, 2007, 34(1): 51-56. doi: 10.3321/j.issn:0577-7518.2007.01.010 [3] 刘永亮, 尹成林, 田叶韩, 等. 拮抗真菌HTC的鉴定及其对辣椒疫病的生物防治潜力[J]. 植物保护学报, 2013, 40(5): 437-444. doi: 10.13802/j.cnki.zwbhxb.2013.05.008 [4] SOYTONG K, KANOKMEDHAKUL S, KUKONGVIRIYAPA V, et al. Application of Chaetomium species (Ketomium®) as a new broad spectrum biological fungicide for plant disease control: A review article[J]. Fungal Diversity, 2001, 7: 1-15.
[5] 张 蕊, 田叶韩, 李 超, 等. 球毛壳菌ND35对黄瓜种子萌发和胚根生长的影响[J]. 北方园艺, 2020(23): 1-9. [6] FATIMA N, MUHAMMAD S A, KHAN I, et al. Chaetomium endophytes: A repository of pharmacologically active metabolites[J]. Acta Physiologiae Plantarum, 2016, 38(6): 1-18.
[7] 梁海林, 童志武, 朱 笃. 球毛壳菌次级代谢产物及其生物活性研究进展[J]. 天然产物研究与开发, 2018, 30: 702-707. doi: 10.16333/j.1001-6880.2018.4.027 [8] 印容, 高慧娟, 赵秀云. 球毛壳菌及其产生的鞘氨醇对油菜根肿病的室内生防作用[J]. 华中农业大学学报, 2016, 35(5): 58-62. doi: 10.13300/j.cnki.hnlkxb.2016.05.029 [9] SHYLAJA G, SASIKUMAR K, SATHIAVELU A. Antimycobacterial potential of resorcinol type lipid isolated from Chaetomium cupreum, an endophytic fungus from Mussaenda luteola[J]. Bangladesh Journal of Pharmacology, 2018, 13: 114-119. doi: 10.3329/bjp.v13i2.34860
[10] GUO Q F, YIN Z H, ZHANG J J, et al. Chaetomadrasins A and B, two new cytotoxic cytochalasans from desert soil-derived fungus Chaetomium madrasense 375[J]. Molecules, 2019, 24(18): 3240-3249. doi: 10.3390/molecules24183240
[11] 赵德立, 曾林子, 李 晖, 等. 多粘芽孢杆菌JW-725抗菌活性物质及其发酵条件的初步研究[J]. 植物保护, 2006, 32(1): 47-50. doi: 10.3969/j.issn.0529-1542.2006.01.012 [12] 梁建根, 吴吉安, 竺利红, 等. 生防菌BH-2发酵液中抑菌成分的定位及提取研究[J]. 中国农学通报, 2007, 23(11): 324-327. doi: 10.3969/j.issn.1000-6850.2007.11.070 [13] LANDUM M C, DO ROSÁRIO FÉLIX M, ALHO J, et al. Antagonistic activity of fungi of Olea europaea L. against Colletotrichum acutatum[J]. Microbiological Research, 2016, 183: 100-108. doi: 10.1016/j.micres.2015.12.001
[14] SILVA M, PEREIRA A, TEIXEIRA D, et al. Combined use of NMR, LC-ESI-MS and antifungal tests for rapid detection of bioactive lipopeptides produced by Bacillus[J]. Advances in Microbiology, 2016, 6: 788-796. doi: 10.4236/aim.2016.610077
[15] 许乐, 王子强, 张 爽, 等. 丹参根腐病拮抗细菌筛选、鉴定及生防机理研究[J]. 中国生物防治学报, 2021, 37(4): 846-854. doi: 10.16409/j.cnki.2095-039x.2021.04.011 [16] 杨廷雅, 孙 亮, 周婷婷, 等. 短短芽孢杆菌Brevibacillus brevs HAB-5主要抑菌活性成分的分析及其特性研究[J]. 中国生物防治学报, 2021, 30(2): 222-231. [17] PHONG N H, PONGNAK W, SOYTONG K. Antifungal activities of Chaetomium spp. against Fusarium wilt of tea[J]. Plant Protection Science, 2016, 52(1): 10-17. doi: 10.17221/34/2015-PPS
[18] YAN W, CAO L L, ZHANG Y Y, et al. New metabolites from endophytic fungus Chaetomium globosum CDW7[J]. Molecules, 2018, 23(11): 1-7.
[19] 刘彩云, 季洪亮, 王 瑞, 等. 生防菌株LB-1对几种常见植物病原真菌的拮抗作用及其生长适应性分析[J]. 植物保护学报, 2018, 45(2): 332-339. [20] 罗 琳, 周泠璇, 刘 娅. 毕赤酵母G5拮抗葡萄灰霉病机理初探[J]. 生物技术通报, 2017, 33(9): 210-215. [21] 周 瑚, 邹秋霞, 胡 玲, 等. 特基拉芽孢杆菌JN-369的分离鉴定及其抑菌物质分析[J]. 农药学学报, 2019, 21(1): 52-58. [22] 马桂珍, 吴少杰, 付泓润, 等. 海洋放线菌BM-2菌株抗真菌活性物质的分离纯化与结构鉴定[J]. 中国生物防治学报, 2014, 30(3): 393-401. [23] JUNIOR W J F L, BOVO B, NADAI C, et al. Biocontrol ability and action mechanism of Starmerella bacillaris (Synonym Candida zemplinina) isolated from wine musts against gray mold disease agent Botrytis cinerea on grape and their effects on alcoholic fermentation[J]. Frontiers in Microbiology, 2016, 7: 1-12.
[24] TOGHUEO R M K, EKE P, ZABALGOGEAZCOA I, et al. Biocontrol and growth enhancement potential of two endophytic Trichoderma spp. from Terminalia catappa against the causative agent of common bean root rot (Fusarium solani)[J]. Biological Control, 2016, 96: 8-20. doi: 10.1016/j.biocontrol.2016.01.008
[25] MUNJAL V, NADAKKAKATH A V, SHEORAN N, et al. Genotyping and identification of broad spectrum antimicrobial volatiles in black pepper root endophytic biocontrol agent, Bacillus megaterium BP17[J]. Biological Control, 2016, 92: 66-76. doi: 10.1016/j.biocontrol.2015.09.005
[26] MCMULLIN D R, SUMARAH M W, BLACKWELL B A, et al. New azaphilones from Chaetomium globosum isolated from the built environment[J]. Tetrahedron Letters, 2013, 54: 568-572. doi: 10.1016/j.tetlet.2012.11.084
[27] PARK J H, CHOI G J, JANG K S, et al. Antifungal activity against plant pathogenic fungi of chaetoviridins isolated from Chaetomium globosum[J]. FEMS Microbiology Letters, 2005, 252(2): 309-313. doi: 10.1016/j.femsle.2005.09.013
[28] YAMADA T, MUROGA Y, JINNO M, et al. New class azaphilone produced by a marine fish-derived Chaetomium globosum: The stereochemistry and biological activities[J]. Bioorganic and Medicinal Chemistry, 2011, 19(13): 4106-4113. doi: 10.1016/j.bmc.2011.05.008
[29] JIAO W X, FENG Y J, BLUNT J W, et al. Chaetoglobosins Q, R and T, three further new metabolites form Chaetomium globosum[J]. Journal of Natural Products, 2004, 67(10): 1722-1725. doi: 10.1021/np030460g
[30] ZHENG Q C, KONG M Z, ZHAO Q, et al. Chaetoglobosin Y, a new cytochalasan from Chaetomium globosum[J]. Fitoterapia, 2014, 93: 126-131. doi: 10.1016/j.fitote.2013.12.022
[31] 何海清, 钟 娟, 周金燕, 等. 角毛壳菌CH-1产生的抗真菌活性化合物的纯化和鉴定[J]. 中国生物防治学报, 2015, 31(4): 592-597.



 下载:
下载: