Rhizosphere colonization of Bacillus subtilis biocontrol strain SEM-9 and the effect on microbial diversity in rhizosphere soil
-
摘要:目的
研究枯草芽孢杆菌生防菌株SEM-9在作物根际的定植规律及对根际土壤微生物多样性的影响。
方法通过自然转化法对SEM-9菌株进行绿色荧光蛋白标记,利用倒置荧光显微镜观察该菌株在作物根际土壤、根表面及根系内组织的定植情况;并以土传病害土壤为试验对象,通过高通量测序初步分析SEM-9菌株处理后根际土壤中微生物多样性的变化。
结果构建了稳定表达绿色荧光蛋白的重组菌株SEM-9-pGFP22。荧光显微镜观察结果表明,SEM-9-pGFP22重组菌株可以在根际土壤和根表面定植,但是无法在根内组织或细胞内定植。SEM-9菌液处理显著降低了黄瓜土传病害的发病率,提高了根际土壤真菌微生物的多样性。
结论成功建立了SEM-9菌株的GFP标记方法,明确了该菌株的根际定植规律及对黄瓜土传病害的防治效果,为后期开发替代型微生物肥料奠定了基础。
Abstract:ObjectiveIn order to study the colonization rule of Bacillus subtilis biocontrol strain SEM-9 in the rhizosphere of crops and its influence on the microbial diversity of rhizosphere soil.
MethodThe strain SEM-9 was labeled with green fluorescent protein by natural transformation method, and the colonization in rhizosphere soil, on root surface and in root tissue were observed by inverted fluorescence microscope. The changes of microbial diversity in rhizosphere soil treated with the strain SEM-9 were analyzed by high-throughput sequencing using soil with soilborne diseases as test material.
ResultThe recombinant strain SEM-9-pGFP22 stably expressing green fluorescent protein was constructed. The observations of fluorescence microscopy showed that SEM-9-pGFP22 could colonize on the rhizosphere soil and root surface, but not in root tissue or cell. After treated with the SEM-9 suspension, the incidence rate of cucumber soilborne disease significantly reduced, and the fungal diversity in rhizosphere soil increased.
ConclusionThe GFP labeling method of SEM-9 strain was successfully established, and the rhizosphere colonization rule of the strain and the control effect on cucumber soilborne diseases were clarified, which lays a foundation for the later development of alternative microbial fertilizer.
-
在现代农业中,可持续和环境友好的作物种植策略越来越依赖于生物肥料及生物农药的使用。我国研究、生产和应用微生物肥料已有50多年的历史,但其一直未得到很好的发展。其中一个重要的原因是在实验室筛选研究过程中微生物菌株肥效很好,但在温室和田间试验中则出现肥效不稳定或达不到预期效果的情况。这可能是由于土壤环境条件复杂以及大量竞争性微生物的存在影响目标菌株生物活性因子的表达,以及菌株根际定植能力不良等原因造成[1-3]。因此,探讨微生物在复杂土壤环境中的活性和定植情况对更好地评价微生物菌株在肥料、生防等方面的应用潜力具有重要的意义。
自然界中,细菌主要靠生物膜黏附于生物或非生物体表面,生物膜对细菌自身适应环境及遗传进化起着重要的作用[4]。研究发现,形成生物膜是细菌稳定定植在宿主植物根系的重要机制之一,细菌通过形成致密的生物膜,在根系周围稳定定植,提高定植量,发挥促生防病等作用[5-6]。枯草芽孢杆菌生物膜的主要骨架成分包括胞外多糖、蛋白质、胞外核酸及其他多聚体分子等。胞外多糖的表达、修饰及分泌主要由含有16个基因的 epsA-O 操纵子调控[7-8],而胞外蛋白的编码调控基因主要由 yqx-M (tapA)-sipW-tasA操纵子调控[9-10]。此外,生物膜的形成主要有3条调控途径:Spo0A下游的 SinR/SinI、AbbA/AbrB、SlrR/SlrA 和独立于 Spo0A的 YwcC和DegU/DegS 等途径[8,10-11]。
SEM-9菌株是广东省农业科学院蚕业与农产品加工研究所蚕桑与南药资源综合利用团队从蚕沙堆肥发酵的高温期分离得到的1株枯草芽孢杆菌,具有明显的解磷、解钾及拮抗镰刀菌的功能,具有很好的生防和微生物肥料应用开发的潜力[12]。在前期试验中发现其基因组序列中含有枯草芽孢杆菌生物膜形成的主要调控基因,包括epsA-O 操纵子基因、yqx-M (tapA)-sipW-tasA 及生物膜形成的主要调控网络Spo0A及 DegU/S途径的基因[12]。为更好地探讨该菌株在作物根际和根际土壤的定植能力及其对根际土壤微生物群落的影响,本文通过对SEM-9菌株进行绿色荧光蛋白标记,然后利用盆栽试验分析该菌株在作物根际土壤、根表面及根系内组织的定植情况,并以土传病害土壤为试验对象,初步分析SEM-9菌株处理后根际土壤中微生物多样性的变化情况,以期通过本文的研究,探明该菌株在作物根际的定植规律,深入挖掘该菌株的应用潜力,为该菌株的产品开发利用奠定基础。
1. 材料与方法
1.1 材料
番茄Lycopersicon esculentum种子购买自广东省农业科学院蔬菜研究所;枯草芽孢杆菌SEM-9由广东省农业科学院蚕业与农产品加工研究所蚕桑与南药资源综合利用研究室从蚕沙中分离、鉴定并保存;含有绿色荧光蛋白(Green fluorescent protein, GFP)基因和氯霉素抗性基因的重组质粒pGFP 22载体(质粒大小为8200 bp)的枯草芽孢杆菌购买自BioVector质粒载体菌种细胞基因保藏中心。
HS液体培养基:蒸馏水 66.5 mL,10 ×最低盐溶液 10.0 mL,200 g/L 葡萄糖 2.5 mL,1g/L,L− 色氨酸5.0 mL,20 g/L 酪蛋白 1.0 mL,100 g/L 酵母提取物 5.0 mL,80 g/L 精氨酸 10.0 mL,4g/L组氨酸 10.0 mL,121 ℃,灭菌20 min。其中,10×最低盐溶液(100 mL):2 g (NH4)2SO4、14 g K2HPO4、6 g KH2PO4、1 g柠檬酸钠,加100 mL蒸馏水和高压灭菌后添加0.1 mL 1 mol/L MgSO4。
LS培养基:蒸馏水 80.0 mL,10 × 最低盐溶液 10.0 mL,200 g/L 葡萄糖 2.5 mL,1 g/L L−色氨酸 0.5 mL,20 g/L 酪蛋白 0.5 mL,20 g/L酵母提取物 5.0 mL,1 mol/L MgCl2 0.25 mL,1 mol/L CaCl2 0.05 mL,121 ℃条件下灭菌20 min。
1.2 pGFP22质粒DNA提取
挑取含pGFP22载体的单菌落接种于含5 μg/mL氯霉素的液体LB培养基,于37 ℃条件下,220 r/min振荡培养过夜。
按照质粒提取试剂盒(TaKaRa MiniBEST Plasmid Purification Kit Ver. 4.0)提取pGFP22质粒。由于革兰阳性菌细胞壁较厚,在加入Solution 1时需要添加终浓度50 g/L的溶菌酶,37 ℃条件下,摇床放置1 h,其他步骤不变;提取后制备8 g/L的琼脂糖凝胶,电泳后进行凝胶成像分析。
1.3 pGFP22质粒转化
挑取SEM-9单菌落接种于20 mL HS液体培养基,180 r/min 37 ℃摇床过夜培养后接种500 μL菌液于50 mL LB培养基中, 180 r/min 37 ℃摇床培养,每隔1 h取5 mL菌液,分光光度计测定D600 nm。
菌株繁殖到达平台期时,间隔15 min取样品,用φ为20%的甘油,分装为每管1 mL, −80 ℃条件下保存。将制备的感受态样品1 mL,加入20 mL LS培养基, 37 ℃条件下,100 r/min培养2 h后取1 mL培养液,加入10 mmol/L的EGTA 10 μL ,37 ℃、100 r/min摇床培养5 min后分装为每管0.5 mL,加入20 μL 质粒DNA,37 ℃、250 r/min培养90 min,取100 μL涂布于含有氯霉素的LA培养基平板,37 ℃培养箱倒置培养过夜。
1.4 阳性转化子筛选与遗传稳定性检测
利用相差荧光倒置显微镜观察在氯霉素平板上生长的单菌落,挑取绿色荧光的单菌落,加入到添加了氯霉素的LB培养基中,37 ℃条件下,摇床12 h,按“1.2”的方法提取质粒并进行电泳检测。将有绿色荧光蛋白表达并且质粒检测阳性的菌液用φ为20%的甘油在−80℃条件下保存。
取200 μL菌液加入到20 mL含有氯霉素的LB培养基中,37 ℃、250 r/min摇床培养72~96 h,按“1.2”的方法提取质粒并进行电泳检测。取少量菌液稀释后涂布于含5 mg/L氯霉素的LA培养基平板,37 ℃条件下培养1 d后,荧光显微镜观察绿色荧光蛋白的表达情况。
1.5 SEM-9-pGFP22阳性转化子根际定植
将消毒过的番茄种子置于培养皿中浸种。育苗盆装好无菌营养土待用。将阳性转化子SEM-9-pGFP22菌液稀释至106 CFU/mL。每个育苗盆中加入菌液5 mL,点入1~2粒番茄种子,进行盆栽试验。无菌水作为对照。20 d后观察菌株在土壤以及根系的定植。
根际土壤定植分析:将幼苗根系的土壤轻轻抖落,梯度稀释、涂板,荧光显微镜下观察菌落荧光情况。
根表定植分析:幼苗根系用流水轻轻冲洗后,按比例加入无菌水和冲洗过的根,放入事先装有玻璃珠的试管中,涡旋、悬浮液梯度稀释、平板培养,荧光显微镜观察菌落荧光情况。
根内定植分析:将根部土壤全部洗净并消毒,在无菌条件下,将消毒过的根系压片,荧光显微镜观察是否有绿色荧光表达;将消毒过的根系用研钵磨碎后,梯度稀释涂板,荧光显微镜观察。
1.6 SEM-9菌株对根际土壤微生物多样性的影响
试验土壤为广东中山某地,该地连续种植黄瓜6年,土传病害频繁发生。瓜苗生长约30 d时(观察到叶面开始发黄),每株瓜苗灌根处理100 mL (106 CFU/L)SEM-9发酵液,分别以空白培养基(CK)和市售菌剂SJ(SJ)为空白对照和阳性对照,每组处理3垄,每垄为1个重复。处理14 d后,观察瓜苗生长情况,统计每组的黄叶株数;并对每个处理根际土壤按S形取样,送深圳华大基因股份有限公司进行16 S/ITS测序及微生物多样性分析。组间多样性指数的差异分析使用SPSS statistics 11.0。
2. 结果与分析
2.1 SEM-9生长曲线的测定
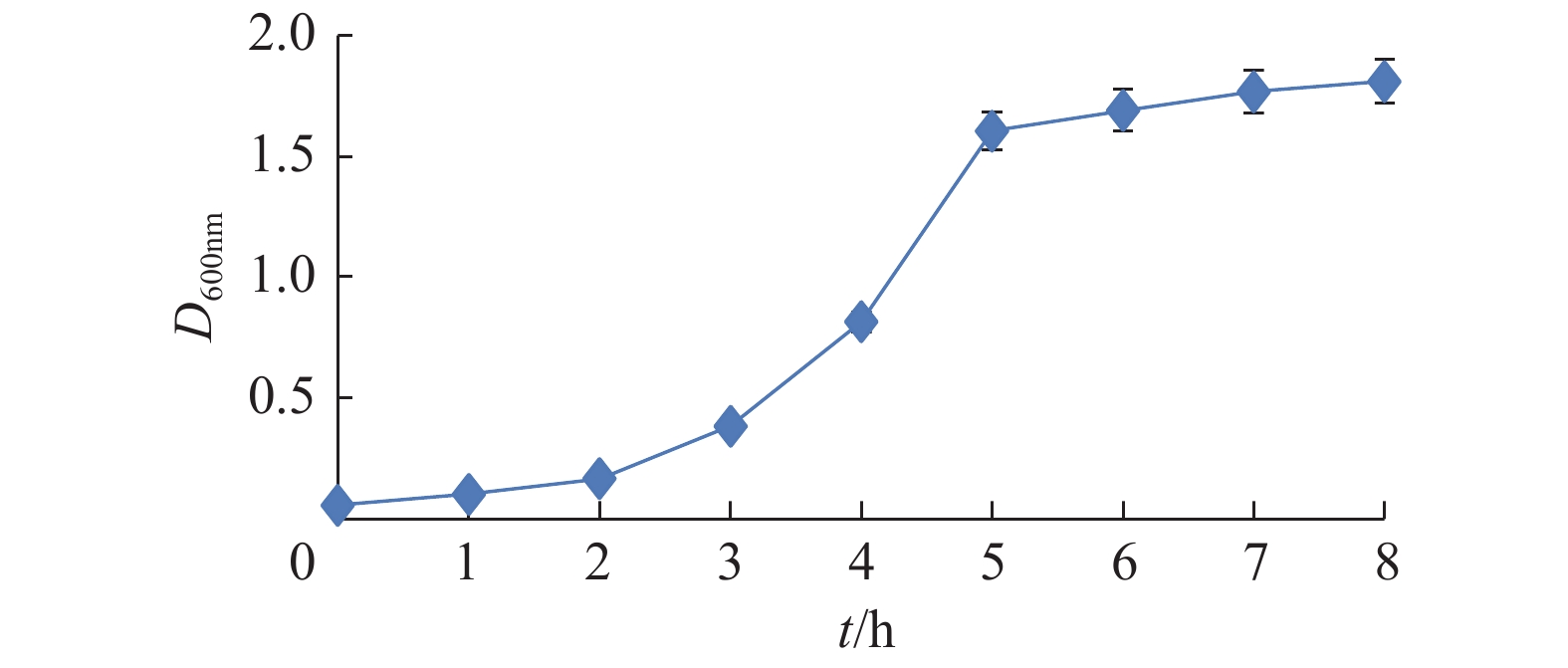
按照“1.3”的方法对野生型菌株SEM-9进行生长曲线的测定,每小时取3 mL培养基,使用分光光度计测量D600 nm。得到如图1所示的生长曲线,曲线符合细菌生长S型曲线。菌株在接种后生长至2 h处于延滞期,2 h后开始进入对数期,对数期为2~5 h;5 h时处于对数末期。因此,从5 h开始间隔15 min取样,甘油保存,准备pGFP22质粒的转化。
2.2 pGFP22质粒提取及转化
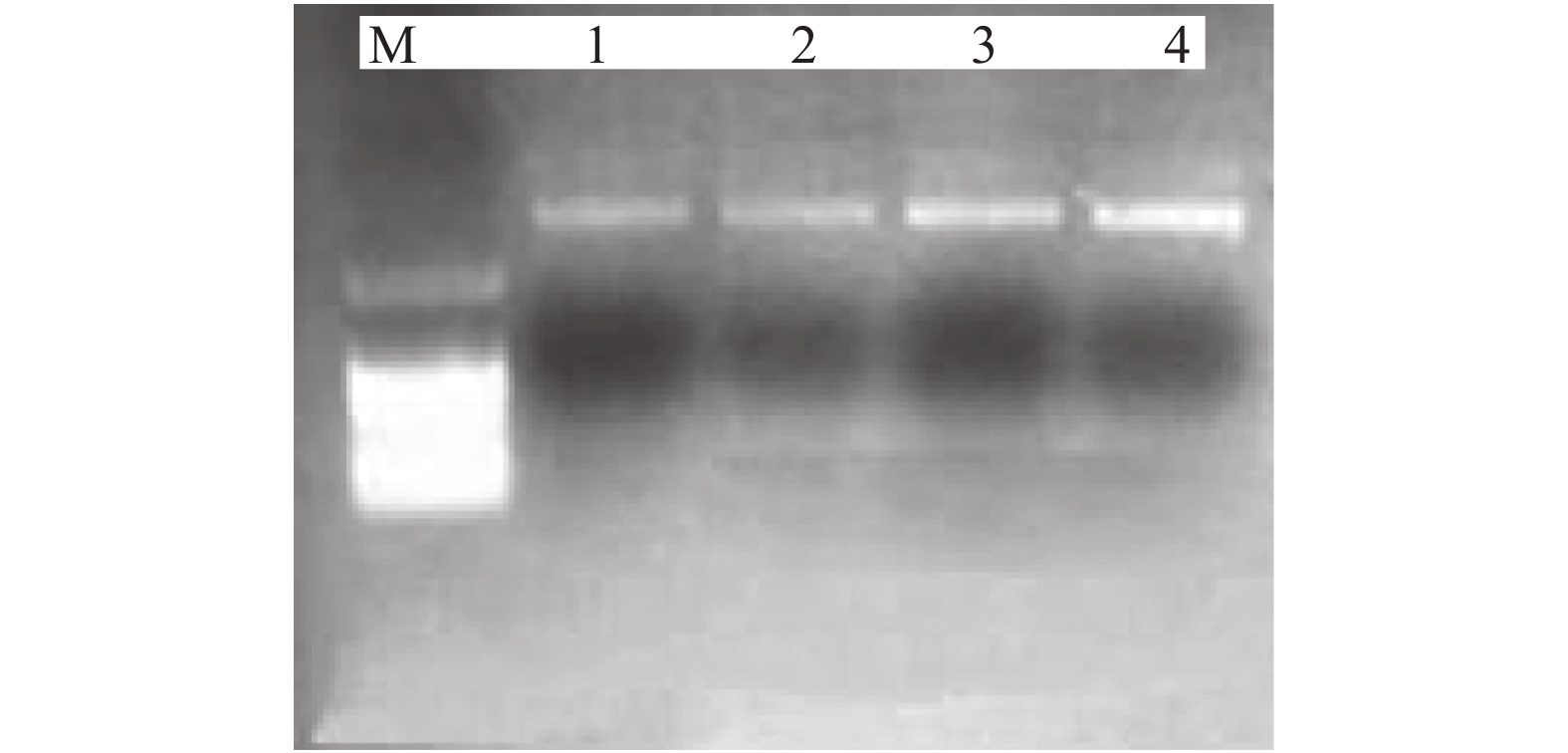
用接种环挑取阳性单菌落接种至氯霉素质量浓度为10 μg/mL的LB培养基,37 ℃条件下180 r/min培养过夜,然后进行质粒提取,提取质粒后进行琼脂糖凝胶电泳,结果如图2所示。
![]() 图 2 SEM-9菌株质粒提取结果M为DNA marker DL2000,1为菌株中提取的pGFP22质粒,2为阳性转化子提取的pGFP22质粒,3、4为阳性转化子繁殖3(约200代)和4 d(约280代)提取的质粒Figure 2. Plasmid extraction results of SEM-9 strainM is DNA marker DL2000, Lane 1 is the pGFP22 plasmid extracted from the preserved strain, lane 2 is the pGFP22 plasmid extracted from the positive transformant with green fluorescence, and lanes 3 and 4 are the plasmids extracted from the positive transformant breeding for three (about 200 generations) and four days (about 280 generations)
图 2 SEM-9菌株质粒提取结果M为DNA marker DL2000,1为菌株中提取的pGFP22质粒,2为阳性转化子提取的pGFP22质粒,3、4为阳性转化子繁殖3(约200代)和4 d(约280代)提取的质粒Figure 2. Plasmid extraction results of SEM-9 strainM is DNA marker DL2000, Lane 1 is the pGFP22 plasmid extracted from the preserved strain, lane 2 is the pGFP22 plasmid extracted from the positive transformant with green fluorescence, and lanes 3 and 4 are the plasmids extracted from the positive transformant breeding for three (about 200 generations) and four days (about 280 generations)结果(图2)说明转化子中成功导入了质粒pGFP22;连续培养3~4 d后,仍然能够检测到阳性转化子中具有质粒pGFP22。将20 μL提取质粒与含500 μL感受态的SEM-9菌株细胞混合,进行自然转化,涂板到氯霉素质量浓度为10 mg/L的LA培养基,倒置培养过夜后,用荧光显微镜观察激发光为绿色的菌落确定为阳性转化子(图3A)。且平板菌落4 d后仍能观测到绿色荧光(图3B),说明质粒在菌体内能够稳定遗传。
2.3 定植检测
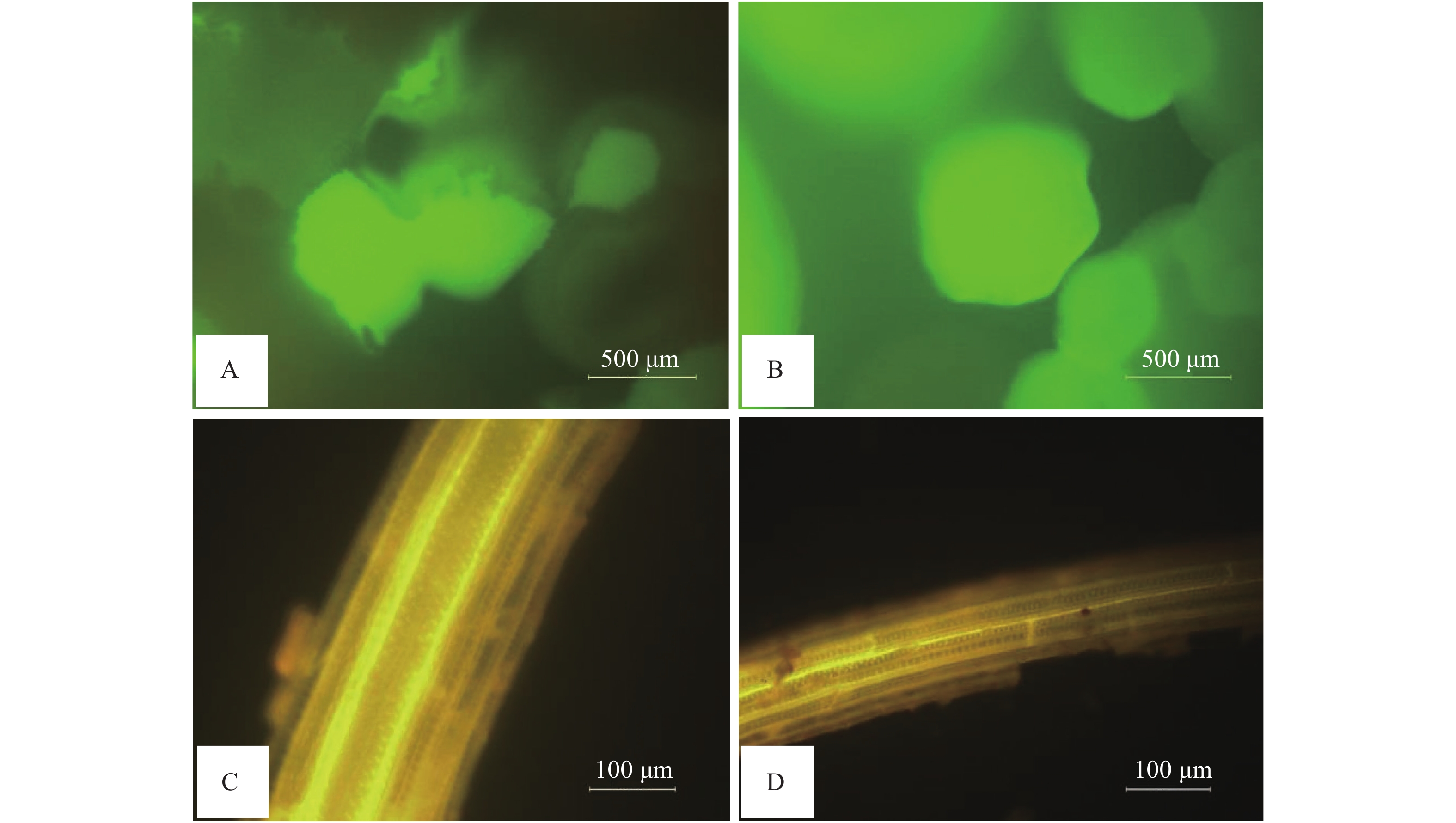
在菌液处理后的20 d内按“1.5”的方法检测SEM-9-pGFP22在番茄根际土壤、根表和根内的定植情况,结果如图4所示。根际土壤内细菌区植检测发现,有绿色荧光菌株存在,说明SEM-9-pGFP22菌株可以在根际土壤内定植(图4A);根表面经无菌水冲洗后,冲洗液无菌培养,同样观察到大量的绿色荧光菌株的存在,表明SEM-9-pGFP22菌株也可以在幼苗根表面生长繁殖(图4B);但是在对根表面进行消毒处理、研磨培养后未发现绿色荧光菌株的存在,且消毒处理后的根系荧光显微镜观察也没有发现绿色荧光,表明SEM-9-pGFP22菌株不会定植在番茄苗的根内部(图4D)。
![]() 图 4 SEM-9-pGFP22菌株的根际定植分析图中绿色荧光为SEM-9-pGFP22菌落,其中A、B分别为SEM-9-pGFP22菌株在根际土壤和根表面的定植;C、D分别为空白对照和SEM-9-pGFP22菌株在根内的定植Figure 4. Analysis of rhizosphere colonization of the recombinant strain SEM-9-pGFP22The green fluorescence in the figure shows the colony of the recombinant strain SEM-9-pGFP22. A and B are the recombinant strains SEM-9-pGFP22 colonizing in rhizosphere soil and on the root surface, respectively; C and D are blank control and the recombinant strain SEM-9-pGFP22 colonizing in roots, respectively
图 4 SEM-9-pGFP22菌株的根际定植分析图中绿色荧光为SEM-9-pGFP22菌落,其中A、B分别为SEM-9-pGFP22菌株在根际土壤和根表面的定植;C、D分别为空白对照和SEM-9-pGFP22菌株在根内的定植Figure 4. Analysis of rhizosphere colonization of the recombinant strain SEM-9-pGFP22The green fluorescence in the figure shows the colony of the recombinant strain SEM-9-pGFP22. A and B are the recombinant strains SEM-9-pGFP22 colonizing in rhizosphere soil and on the root surface, respectively; C and D are blank control and the recombinant strain SEM-9-pGFP22 colonizing in roots, respectively2.4 SEM-9灌根处理对黄瓜叶片黄化率及土壤微生物多样性的影响
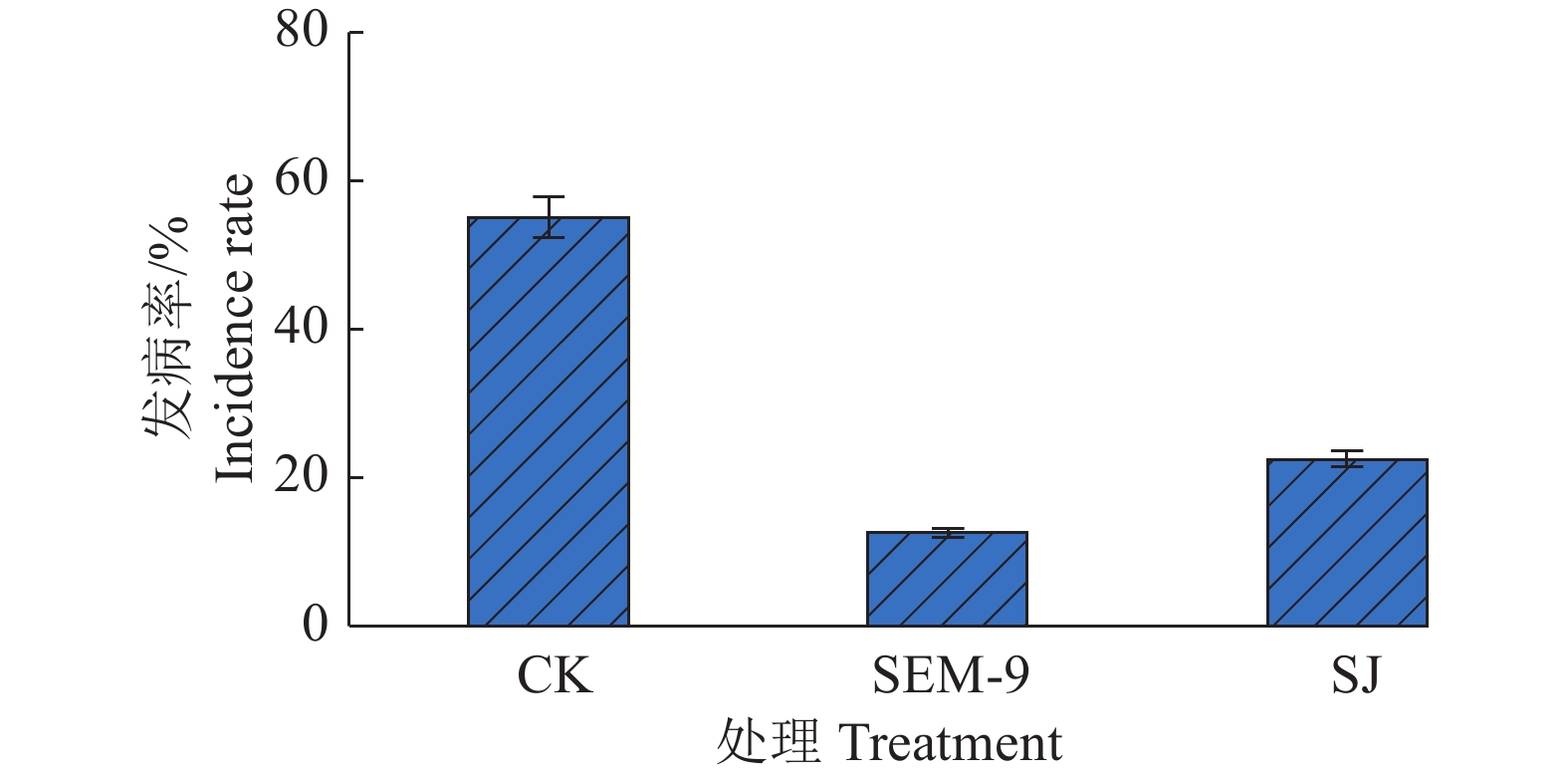
在连作种植黄瓜的病害发作地,灌根法施加SEM-9菌悬液(菌液浓度106 CFU/mL),分别以施加等量市售菌肥和空白培养基为阳性对照和空白对照,生长2周后观察黄瓜的生长情况及枯萎病发生情况。发现施加SEM-9菌悬液后,瓜苗生长良好,苗壮叶绿,很少有株苗叶片黄化、枯萎现象发生(发病率12.5%),显著好于市售对照菌肥SJ(发病率22.5%)及空白对照组(发病率55.0%)(图5)。
对空白培养对照区、SEM-9处理区及菌肥SJ处理区的根际土壤按S形取样法取样,进行16 S和ITS的测序,分析不同处理组根际土壤中细菌及真菌的微生物多样性的变化,以Chao、Ace指数评价每个处理组的菌群丰度,以Shannon和Simpson指数评价处理组的菌群多样性。处理区域的细菌微生物菌群丰度及多样性分析结果见表1。显著性分析发现,与空白对照组相比,SEM-9菌液处理和SJ对照菌肥处理后,细菌各评价指数没有显著性变化,因此处理对根际土壤的细菌微生物菌群丰度及多样性没有显著影响。通过ITS测序分析每个处理区域的真菌微生物菌群丰度及多样性(表1),结果发现,与空白对照组相比,SEM-9菌液处理后,Chao、Ace和Shannon指数显著增加(P<0.05),而Simpson指数显著降低(P<0.05),这说明SEM-9菌液处理显著增加了根际土壤真菌微生物的菌群丰度及多样性。
表 1 SEM-9处理后根际土壤微生物多样性分析1)Table 1. Analysis of microbial diversity in rhizosphere soil after treated with the strain SEM-9病原菌 Pathogen 处理 Treatment Chao Ace Shannon Simpson 细菌
BacteriaCK 1973±207.4a 1940±218.3a 5.84±0.389a 0.0091±0.006a SEM-9 2112±37.2a 2114±68.2a 6.08±0.196a 0.0068±0.003a SJ 2064±121.4a 2035±121.8a 6.06±0.266a 0.0059±0.003a 真菌
FungiCK 176±15.9a 182±2.8a 2.57±0.321a 0.24±0.08a SEM-9 206±7.2b 206±6.2b 2.93±0.158b 0.11±0.02b SJ 196±23.1ab 197±25.3ab 2.65±0.363a 0.19±0.05a 1) 同种病原菌同列数据后的不同小写字母表示不同处理差异显著(P<0.05, LSD 法)
1) Different lowercase letters after the data of the same pathogen of the same column indicate significant differences among different groups (P<0.05, LSD method)黄瓜枯萎病的病原菌为尖孢镰刀菌黄瓜专化型[13],为明确SEM-9处理后,根际土壤中尖孢镰刀菌相对丰度的变化,对根际土壤中镰刀菌和尖孢镰刀菌的相对丰度进行了对比分析(表2)。由表2可知,在种和属的水平上,SEM-9处理后镰刀菌属和尖孢镰刀菌的相对丰度都较对照显著降低(P<0.05),而对照菌肥SJ处理后,在属的水平上镰刀菌属相对丰度较对照显著降低(P<0.05),在种的水平上尖孢镰刀菌的相对丰度略高于对照但无显著差异。结果表明,SEM-9菌株处理后,抑制了黄瓜枯萎病原菌尖孢镰刀菌的生长繁殖,降低了其在根际土壤的相对丰度。
表 2 SEM-9处理后根际土壤中镰刀菌在种属水平上的相对丰度变化1)Table 2. Analysis of relative abundance of Fusarium in rhizosphere soil at species and genus level after treated by the suspension of the strain SEM-9属 Species CK SEM-9 SJ 镰刀菌属
Fusarium0.73±0.131a 0.52±0.049b 0.51±0.104b 尖孢镰刀菌
F.oxysporum0.14±0.025a −0.25±0.282b 0.26±0.182a 1) 表中数据为相对丰度的对数值,同行数据后的不同小写字母表示不同处理差异显著(P<0.05, LSD 法)
1) The data in the table are the logarithm values of relative abundances, and different lowercase letters after the data of the same row indicate significant differences among different groups (P<0.05, LSD method)3. 讨论与结论
3.1 枯草芽孢杆菌SEM-9菌株的GFP标记
绿色荧光蛋白被广泛用于研究菌株在根和根际的定植[14-15]。但是芽孢杆菌易生成芽孢,质粒转化难度较大。在前期质粒转化试验中我们采取了多种感受态制备方法,包括适用于自然转化的Spizizen法及适用于电击转化的EM(Electroporation medium)法。电击转化技术难度大,尤其是枯草芽孢杆菌感受态及电击参数的选择影响较大,SEM-9菌株的质粒转化未能成功,因此最终选择了适应于该菌株的化学感受态制备法。Wang等[16]研究发现,枯草芽孢杆菌自然转化时,感受态高峰出现在对数生长期,且一定浓度的镁离子和钙离子可以提高自然转化效率。本研究结果可以看出,枯草芽孢杆菌SEM-9在营养丰富的HS液体培养基中培养后,5 h迅速达到对数生长期,将此时培养液接种到营养贫瘠的LS培养基后,由于营养限制,可能导致枯草芽孢杆菌细胞内发生一系列生理变化,细胞通透性增加,利于外源DNA的进入[17]。
3.2 枯草芽孢杆菌SEM-9菌株的根际定植定性分析
微生物菌剂及肥料在耕地中的应用,非常重要的一环在于菌株能否在根际土壤中定植。外源菌株施用到田间,与土著根际微生物和寄主植物根系组成了一个复杂的生态系统。菌株在根际土壤中成功定植并建立种群,必然与其他根际微生物之间产生了空间、能源的竞争,这是一个非常复杂的过程,受到多种因素的调控与制约[18]。在前期的研究中我们发现SEM-9菌株的基因组内含有枯草芽孢杆菌生物膜合成的主要调控基因,包括epsA-O 操纵子基因、yqx-M (tapA)-sipW-tasA 及生物膜形成的主要调控网络Spo0A及 DegU/S途径的基因[12]。为更好地明确该菌株在根际的定植情况,本研究选择适用于枯草芽孢杆菌的pGFP22质粒,通过自然转化法获得可以稳定表达GFP的SEM-9- pGFP22重组菌株。利用荧光显微镜观察了根际土壤、根表面及根系内部结构的菌株定植情况,发现在根际土壤及根表面存在大量表达绿色荧光蛋白的菌株,而在消毒后的根系上未能观察到绿色荧光信号,说明SEM-9菌株可以成功地在根际土壤和根表面生长繁殖,但是不会定植到根系内细胞和组织中。
3.3 枯草芽孢杆菌SEM-9菌株对根际土壤微生物多样性的影响
土传病害是指生活在土壤中的病原体,如真菌、细菌、线虫和病毒,从作物根部或茎部侵害作物而引起的病害。在耕作过程中,轮作、施肥、管理等措施不合理,会降低土壤微生物多样性,破坏土壤微生物群落结构和功能,导致土传病害爆发。本文以广东中山地区一处黄瓜连作导致土传病害频繁的土地为试验区,在瓜苗成长期施加SEM-9菌液,处理区瓜苗生长良好,苗壮叶绿,株苗叶片黄化、枯萎发生率显著低于对照组;且通过微生物多样性分析发现SEM-9菌株处理后,根际土壤的细菌微生物多样性均值虽略有增加但无显著变化,而真菌类微生物多样性显著增加。土壤中的细菌、真菌是土壤的重要组成部分,对土壤物质代谢及循环具有重要作用,对维持土壤系统稳定性和受损土壤系统的恢复有重要作用,与土壤系统健康紧密相关[19-21]。提高土壤微生物群落多样性和功能,是控制土传病害发生的一条有效途径。
在本研究中SEM-9菌液处理后14 d的根际土壤细菌多样性指数较对照组平均值略有增加,但并没有显著性改变,推测原因可能在于细菌种类繁多,多样性指数改变不明显,也可能由于试验仅仅分析了SEM-9处理后14 d的样品,而对更短时间或者更长时间的样品没有进行检测,具体原因还有待于后期进一步的研究。根际土壤细菌微生物多样性因生防菌株处理时间而不同也有相关文献报道,例如郑婷婷[22]研究了生防菌株GHt-q6对黄瓜根系土壤微生态的影响,发现生防菌株GHt-q6处理后,在黄瓜生长前期群落多样性变化不明显,生长后期细菌群落的多样性增加。黄瓜枯萎病是一种重要的土传病害,主要病原菌为尖孢镰刀菌。SEM-9菌株对多种镰刀菌都有显著的拮抗效果,包括尖孢镰刀菌。因此,我们对根际土中尖孢镰刀菌和镰刀菌属的相对丰度进行了分析,发现SEM-9菌液处理后根际土壤中的尖孢镰刀菌和镰刀菌属的相对丰度较对照显著降低,因此,我们推测经SEM-9处理后,根际土壤中土传病菌尖孢镰刀菌的生长繁殖被显著抑制,从而促进了其他土著微生物的生长,提高了真菌类微生物的种群多样性,改良了土壤的真菌微生物群落结构,因此降低了黄瓜土传病害的发生。
3.4 结论
本研究成功建立了枯草芽孢杆菌SEM-9菌株的GFP标记方法,明确了该菌株的根际定植规律及其对黄瓜土传病害的防治效果,为后期开发替代型微生物肥料奠定了基础。
-
图 2 SEM-9菌株质粒提取结果
M为DNA marker DL2000,1为菌株中提取的pGFP22质粒,2为阳性转化子提取的pGFP22质粒,3、4为阳性转化子繁殖3(约200代)和4 d(约280代)提取的质粒
Figure 2. Plasmid extraction results of SEM-9 strain
M is DNA marker DL2000, Lane 1 is the pGFP22 plasmid extracted from the preserved strain, lane 2 is the pGFP22 plasmid extracted from the positive transformant with green fluorescence, and lanes 3 and 4 are the plasmids extracted from the positive transformant breeding for three (about 200 generations) and four days (about 280 generations)
图 4 SEM-9-pGFP22菌株的根际定植分析
图中绿色荧光为SEM-9-pGFP22菌落,其中A、B分别为SEM-9-pGFP22菌株在根际土壤和根表面的定植;C、D分别为空白对照和SEM-9-pGFP22菌株在根内的定植
Figure 4. Analysis of rhizosphere colonization of the recombinant strain SEM-9-pGFP22
The green fluorescence in the figure shows the colony of the recombinant strain SEM-9-pGFP22. A and B are the recombinant strains SEM-9-pGFP22 colonizing in rhizosphere soil and on the root surface, respectively; C and D are blank control and the recombinant strain SEM-9-pGFP22 colonizing in roots, respectively
表 1 SEM-9处理后根际土壤微生物多样性分析1)
Table 1 Analysis of microbial diversity in rhizosphere soil after treated with the strain SEM-9
病原菌 Pathogen 处理 Treatment Chao Ace Shannon Simpson 细菌
BacteriaCK 1973±207.4a 1940±218.3a 5.84±0.389a 0.0091±0.006a SEM-9 2112±37.2a 2114±68.2a 6.08±0.196a 0.0068±0.003a SJ 2064±121.4a 2035±121.8a 6.06±0.266a 0.0059±0.003a 真菌
FungiCK 176±15.9a 182±2.8a 2.57±0.321a 0.24±0.08a SEM-9 206±7.2b 206±6.2b 2.93±0.158b 0.11±0.02b SJ 196±23.1ab 197±25.3ab 2.65±0.363a 0.19±0.05a 1) 同种病原菌同列数据后的不同小写字母表示不同处理差异显著(P<0.05, LSD 法)
1) Different lowercase letters after the data of the same pathogen of the same column indicate significant differences among different groups (P<0.05, LSD method)表 2 SEM-9处理后根际土壤中镰刀菌在种属水平上的相对丰度变化1)
Table 2 Analysis of relative abundance of Fusarium in rhizosphere soil at species and genus level after treated by the suspension of the strain SEM-9
属 Species CK SEM-9 SJ 镰刀菌属
Fusarium0.73±0.131a 0.52±0.049b 0.51±0.104b 尖孢镰刀菌
F.oxysporum0.14±0.025a −0.25±0.282b 0.26±0.182a 1) 表中数据为相对丰度的对数值,同行数据后的不同小写字母表示不同处理差异显著(P<0.05, LSD 法)
1) The data in the table are the logarithm values of relative abundances, and different lowercase letters after the data of the same row indicate significant differences among different groups (P<0.05, LSD method) -
[1] LUGTENBERG B J J, DEKKERS L, BLOEMBERG G V. Molecular determinants of rhizosphere colonization by Pseudomonas[J]. Annual Review of Phytopathology, 2001, 39(0): 461-490. doi: 10.1146/annurev.phyto.39.1.461
[2] COMPANT S, CLÉMENT C, SESSITSCH A. Plant growth-promoting bacteria in the rhizo and endosphere of plants: Their role, colonization, mechanisms involved, and prospects for utilization[J]. Soil Biology and Biochemistry, 2010, 42(5): 669-678. doi: 10.1016/j.soilbio.2009.11.024
[3] GHIRARDI S, DESSAINT F, MAZURIER S, et al. Identification of traits shared by rhizosphere competent strains of fluorescent pseudomonads[J]. Microbial Ecology, 2012, 64(3): 725-737. doi: 10.1007/s00248-012-0065-3
[4] HALL-STOODLEY L, COSTERTON J W, STOODLEY P. Bacterial biofilms: From the natural environment to infectious diseases[J]. Nature Reviews Microbiology, 2004, 2(2): 95-108. doi: 10.1038/nrmicro821
[5] BAIS H P, FALL R, VIVANCO J M. Biocontrol of Bacillus subtilis against infection of Arabidopsis roots by Pseudomonas syringae is facilitated by biofilm formation and surfactin production[J]. Plant Physiology, 2004, 134(1): 307-319. doi: 10.1104/pp.103.028712
[6] CHEN Y, CAO S G, CHAI Y R, et al. A Bacillus subtilis sensor kinase involved in triggering biofilm formation on the roots of tomato plants[J]. Molecular Microbiology, 2012, 85(3): 418-430. doi: 10.1111/j.1365-2958.2012.08109.x
[7] CHU F, KEARNS D B, BRANDA S S, et al. Targets of the master regulator of biofilm formation in Bacillus subtilis[J]. Molecular Microbiology, 2006, 59(4): 1216-1228. doi: 10.1111/j.1365-2958.2005.05019.x
[8] KEARNS D B, CHU F, BRANDA S S, et al. A master regulator for biofilm formation by Bacillus subtilis[J]. Molecular Microbiology, 2005, 55(3): 739-749.
[9] TASAKI S, NAKAYAMA M, SHOJI W. Morphologies of Bacillus subtilis communities responding to environmental variation[J]. Development, Growth & Differentiation, 2017, 59(5): 369-378. doi: 10.1111/dgd.12383
[10] HAMON M A, LAZAZZERA B A. The sporulation transcription factor Spo0A is required for biofilm development in Bacillus subtilis[J]. Molecular Microbiology, 2001, 42(5): 1199-1209.
[11] VLAMAKIS H, CHAI Y, BEAUREGARD P, et al. Sticking together: Building a biofilm the Bacillus subtilis way[J]. Nature Reviews Microbiology, 2013, 11(3): 157-168. doi: 10.1038/nrmicro2960
[12] LI Q R, LIAO S T, ZHI H Y, et al. Characterization and sequence analysis of potential biofertilizer and biocontrol agent Bacillus subtilis strain SEM-9 from silkworm excrement[J]. Canadian Journal of Microbiology, 2019, 65(1): 45-58. doi: 10.1139/cjm-2018-0350
[13] 梁肇均, 林毓娥, 何晓明, 等. 黄瓜土传性病害的发生与防治技术[J]. 长江蔬菜, 2019(7): 52-54. [14] COOMBS J T, FRANCO C M M. Visualization of an endophytic Streptomyces species in wheat seed[J]. Applied and Environmental Microbiology, 2003, 69(7): 4260-4262. doi: 10.1128/AEM.69.7.4260-4262.2003
[15] WEYENS N, BOULET J, ADRIAENSEN D, et al. Contrasting colonization and plant growth promoting capacity between wild type and a GFP-derative of the endophyte Pseudomona sputida W619 in hybrid poplar[J]. Plant and Soil, 2012, 356(1/2): 217-230. doi: 10.1007/s11104-011-0831-x
[16] WANG X J, LI M J, YAN Q, et al. Across genus plasmid transformation between Bacillus subtilis and Escherichia coli and the effect of Escherichia coli on the transforming ability of free plasmid DNA[J]. Current Microbiology, 2007, 54(6): 450-456. doi: 10.1007/s00284-006-0617-1
[17] 李瑞芳, 薛雯雯, 黄亮, 等. 枯草芽孢杆菌感受态细胞的制备及质粒转化方法研究[J]. 生物技术通报, 2011(5): 227-230. [18] ZBORALSKI A, FILION M. Genetic factors involved in rhizosphere colonization by phytobeneficial Pseudomonas spp.[J]. Computational and Structural Biotechnology Journal, 2020, 18: 3539-3554. doi: 10.1016/j.csbj.2020.11.025
[19] 崔晓辰. 根际微生物与土壤植物关系的研究进展[J]. 现代农业研究, 2021, 27(5): 34-35. doi: 10.3969/j.issn.1674-0653.2021.05.015 [20] 刘京伟, 李香真, 姚敏杰. 植物根际微生物群落构建的研究进展[J]. 微生物学报, 2021, 61(2): 231-248. [21] 刘王锁, 李海泉, 何毅, 等. 根际微生物对植物与土壤交互调控的研究进展[J]. 中国土壤与肥料, 2021(5): 318-327. doi: 10.11838/sfsc.1673-6257.20292 [22] 郑婷婷. 生防菌GHt_q6对黄瓜根系土壤微生态及根结线虫的影响[D]. 晋中: 山西农业大学, 2019. -
期刊类型引用(4)
1. 宋鹏,李理想,江厚龙,王茹,李慧,赵鹏宇,张均,秦平伟,任江波,陈庆明. 施用侧孢短芽孢杆菌对烤后烟叶钾含量及烟株生理特征的影响. 浙江农业学报. 2024(03): 494-502 .  百度学术
百度学术
2. 杜蓉惠,何涛,杜鸿燕,邓维萍,朱书生,杜飞. 枯草芽孢杆菌对‘红地球’葡萄白粉病防效及叶际细菌群落的影响. 中外葡萄与葡萄酒. 2024(03): 38-46 .  百度学术
百度学术
3. 李妍,胡斯乐,白晓雄,刘朝斌,张敏,王迎,余旋. 核桃根际耐旱促生菌的分离筛选及其促生作用研究. 西北林学院学报. 2024(03): 84-92 .  百度学术
百度学术
4. 吕嘉妍,毛健辉,霍春宇,黄永芳,罗连荷,梁家俊,陈祖静. 广东省本地油茶和引种油茶根际土壤微生物群落特征. 微生物学通报. 2023(11): 4938-4953 .  百度学术
百度学术
其他类型引用(8)



 下载:
下载: