Alternations of mammary gland morphology, and marker protein expression, related hormones and signaling pathways of mammary gland development during gestation in Tibetan pigs
-
摘要:目的
研究藏猪妊娠期乳腺形态和乳腺发育标志蛋白、相关激素及信号通路的变化。
方法选取妊娠33、50、75和90 d的藏猪,屠宰后采集血清和第3、4对乳腺。利用HE染色观察乳腺形态变化;使用ELISA试剂盒检测血清中雌二醇(E2)、孕酮(P)和催乳素(PRL)等乳腺发育相关激素的水平;利用Western blot方法检测乳腺发育标志蛋白[包括ETS相关的转录因子5 (Elf-5)和脂滴包被蛋白2 (PLIN2)],以及激素受体[包括雌激素受体(ERα)、催乳素受体(PRLR)和孕酮受体(PR)]的表达,并检测乳腺发育相关信号通路PI3K/AKT和Jak2/STAT5的激活情况。
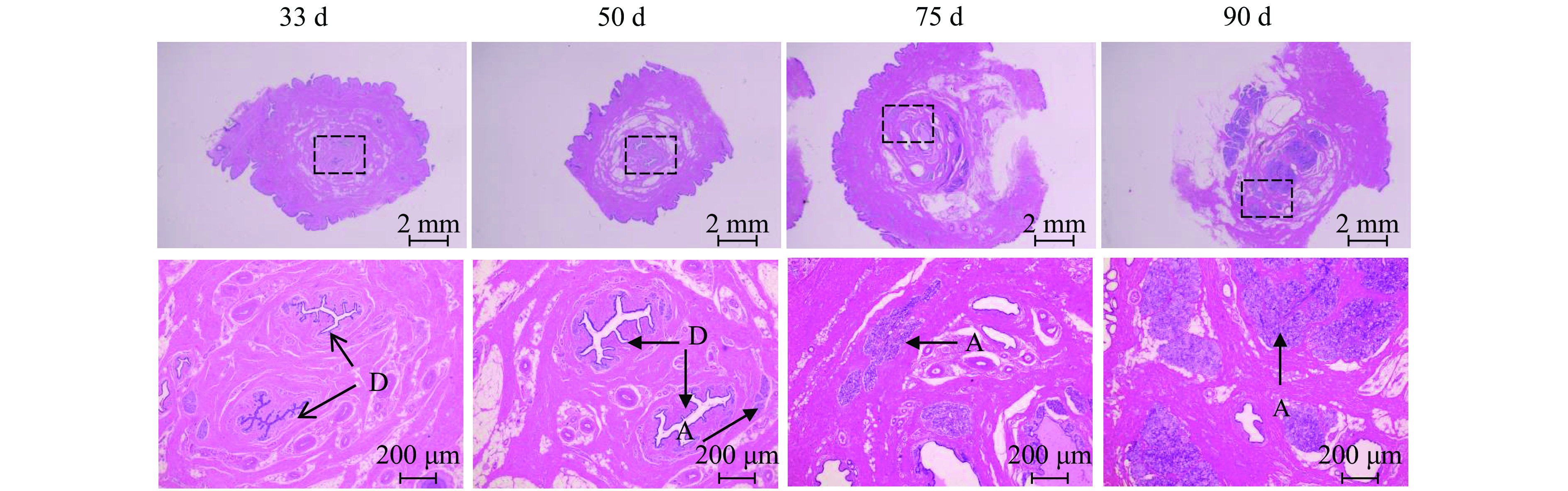
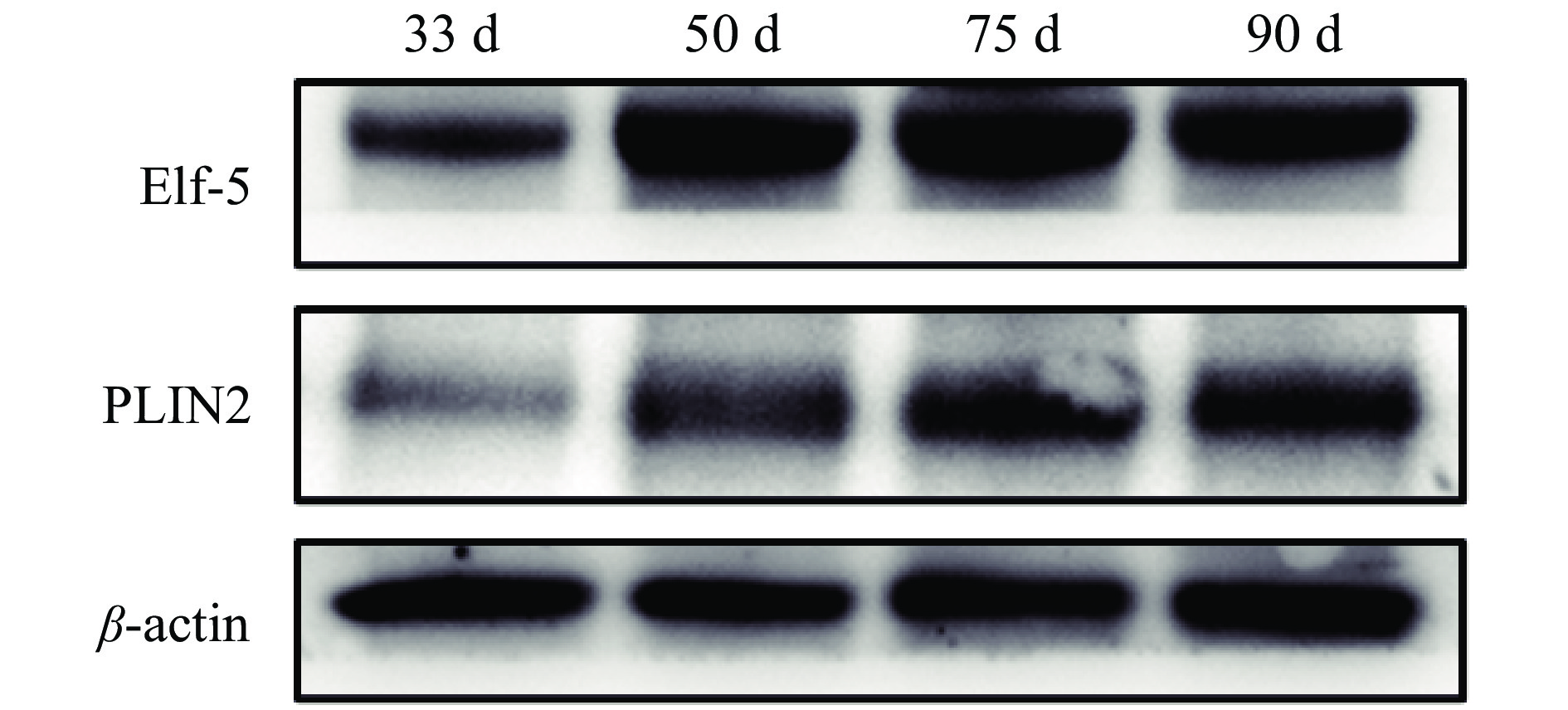
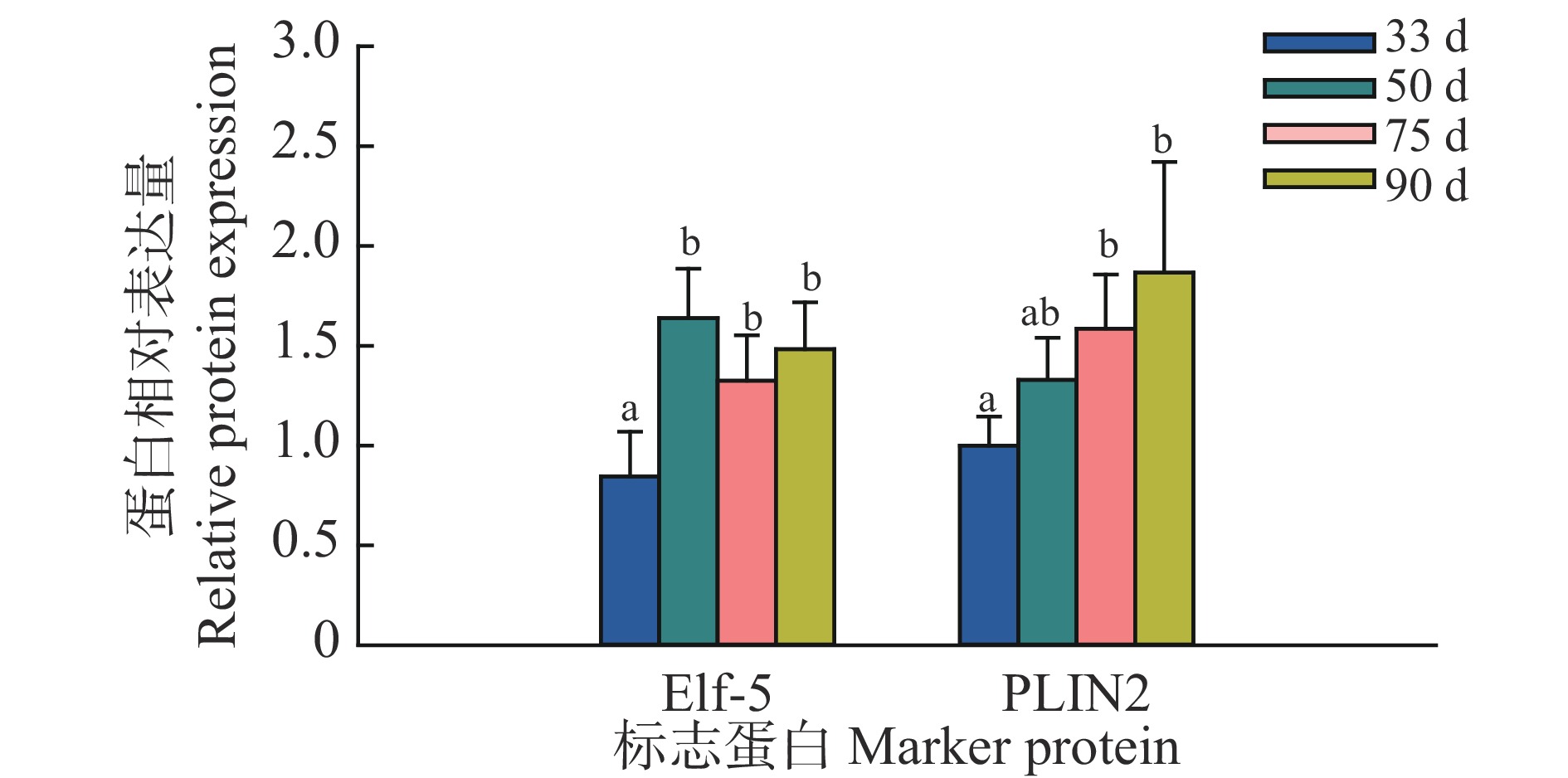
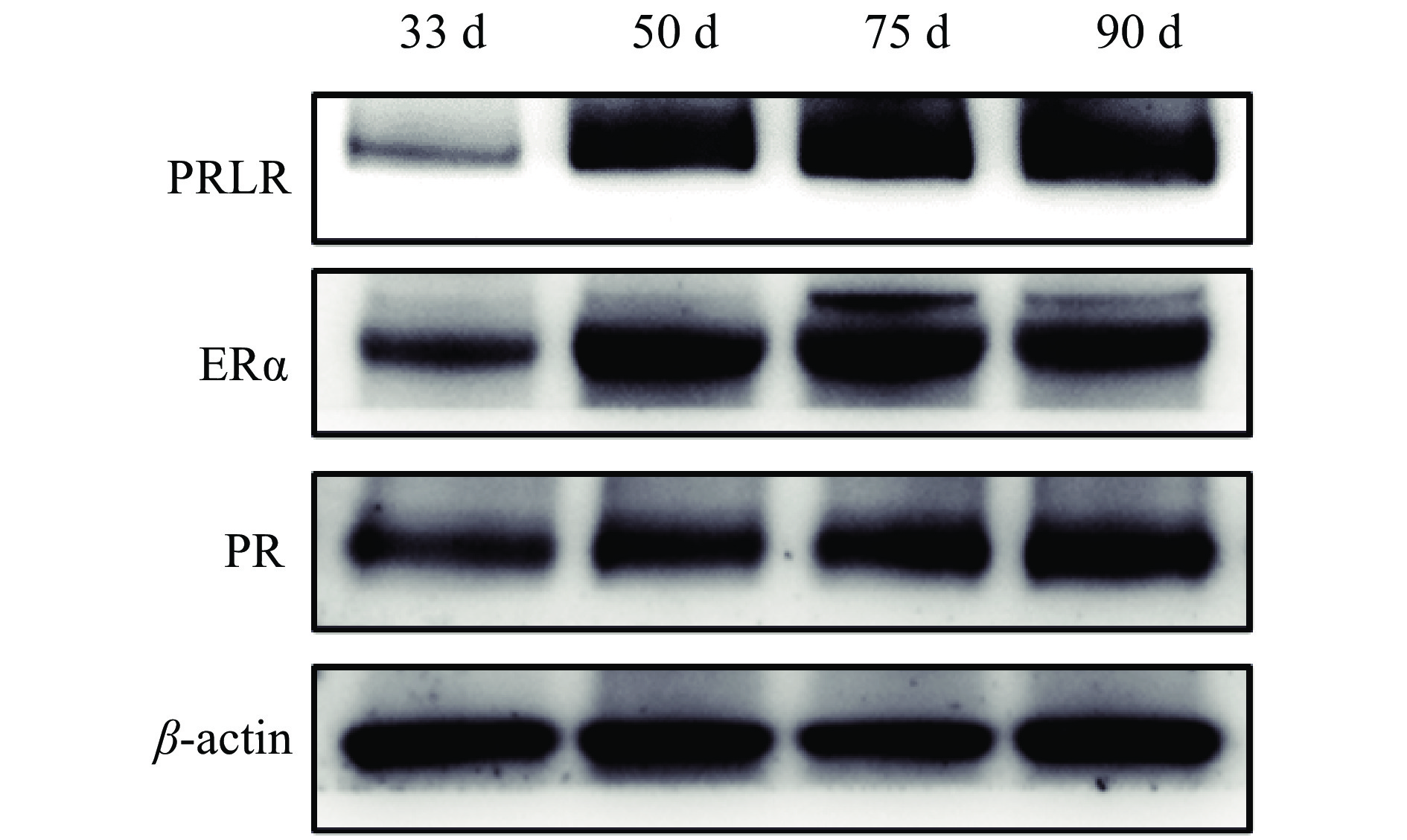
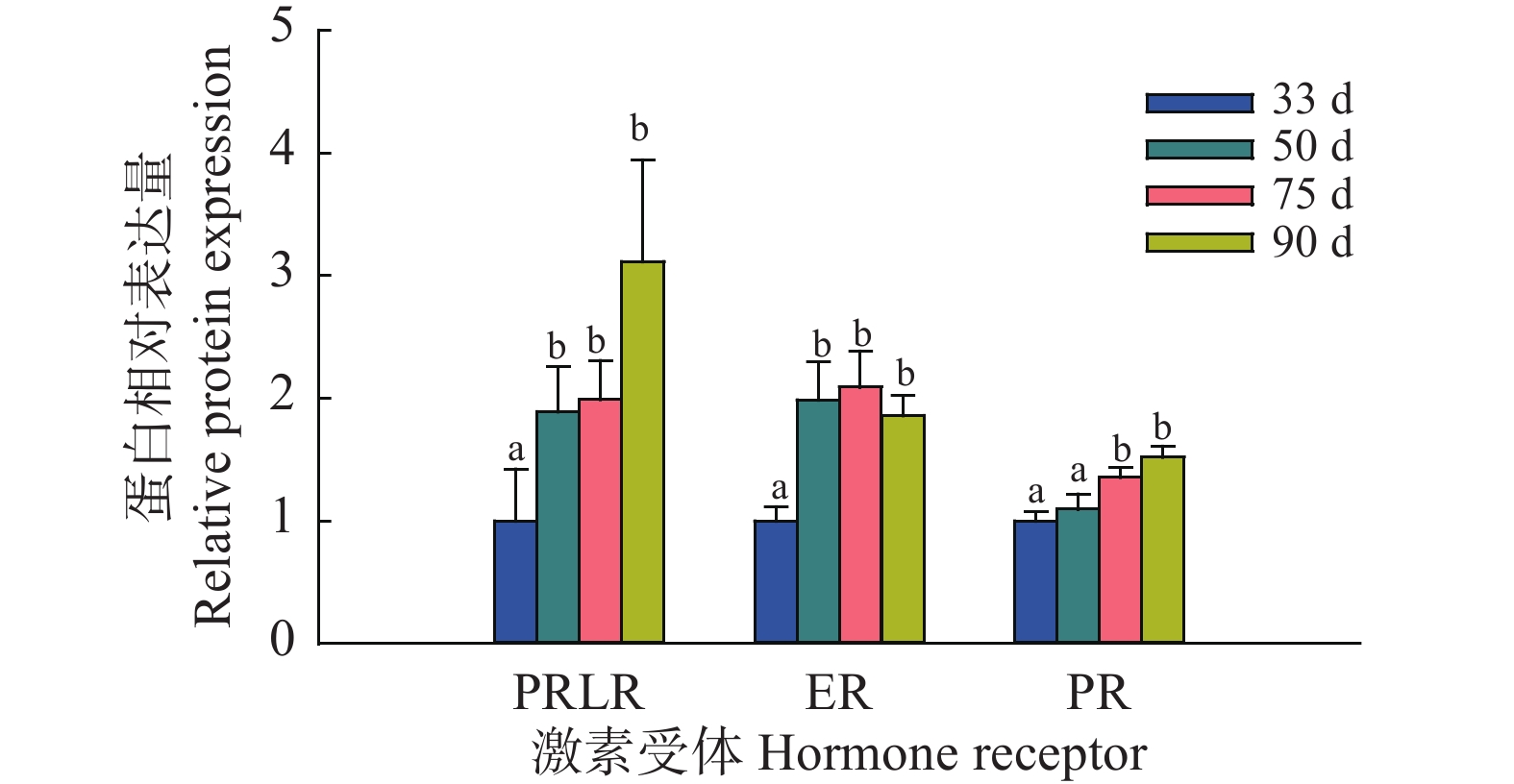
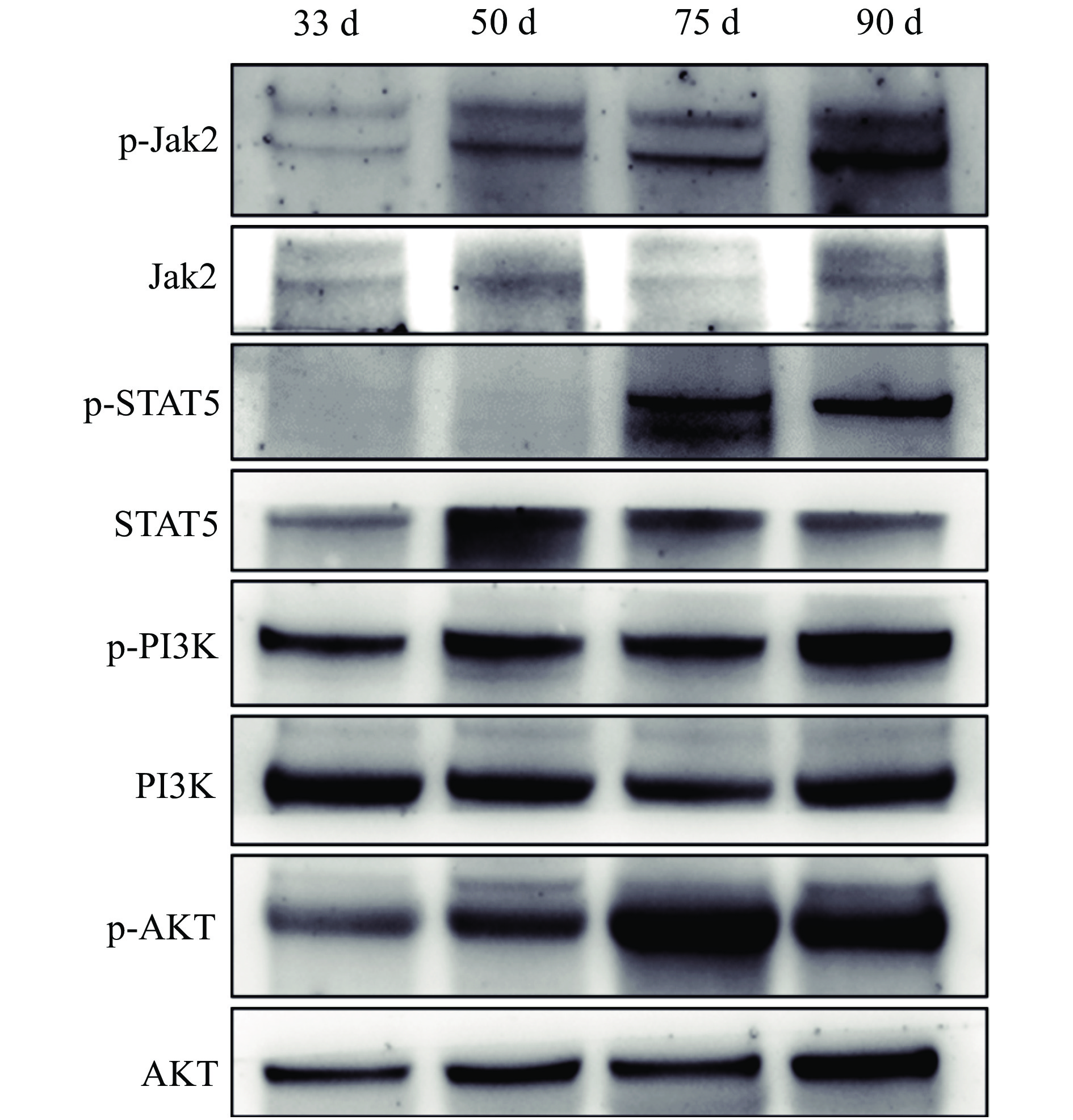
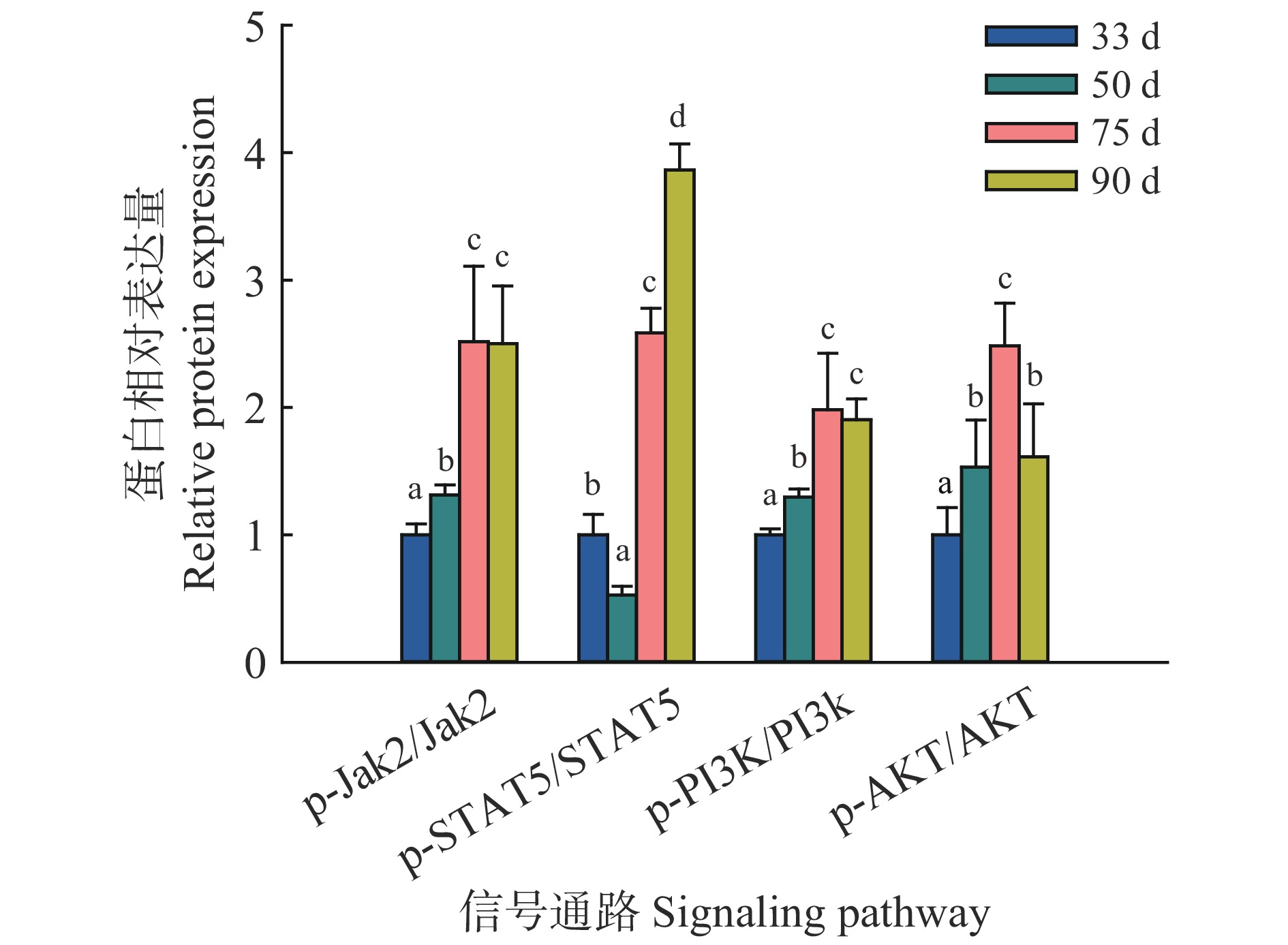
结果从乳腺形态观察可知,妊娠33 d时乳腺中主要是导管结构,50 d时出现少量腺泡结构,75 d时腺泡快速发育、腺泡增多,90 d时乳腺中主要是腺泡结构;乳腺发育标志蛋白Elf-5和PLIN2在妊娠50 d蛋白表达开始升高,75和90 d时均具有很高的表达量;血清中E2、P和PRL质量浓度随着妊娠的进行而升高,90 d时E2达到42.82 ng/L,P达到36.76 μg/L,PRL达到66.53 μg/L;ERα和PRLR在妊娠50 d时表达量升高,PR在75 d时表达量升高。此外,Jak2/STAT5和PI3K/AKT信号通路在妊娠75和90 d时被显著激活。
结论藏猪妊娠过程中,乳腺在50 d时开始腺泡发育、75 d时乳腺进入腺泡快速发育期、90 d时发育程度更高,同时,伴随着血清中乳腺发育相关激素和乳腺中激素受体表达的显著升高,以及乳腺发育相关通路PI3K/AKT和Jak2/STAT5的激活。
Abstract:ObjectiveTo investigate the alternations of the mammary gland morphology and of the marker protein expression, related hormones and signaling pathways of mammary gland development during gestation in Tibetan pigs.
MethodThe pigs were slaughtered, and serum and the mammary glands of the third and fourth pairs were collected at 33, 50, 75 and 90 days of gestation. HE staining was used to observe the changes in mammary gland morphology. The ELISA kit was used to detect the serum levels of hormones related to mammary gland development such as estradiol (E2), progesterone (P) and prolactin (PRL). Western blot method was used to examine the expressions of marker proteins such as E74-like factor 5 (Elf- 5) and perilipin 2(PLIN2) in mammary gland development, and of hormone receptors such as estrogen receptor (ERα), prolactin receptor (PRLR) and progesterone receptor (PR), as well as the activations of PI3K/AKT and Jak2/STAT5 signal pathways which were related to mammary gland development.
ResultMorphologically, the mammary glands at 33 days of gestation were mainly composed of ductal structures, and a small amount of alveolar structures appeared at 50 days. At 75 days, the alveoli developed rapidly in the mammary glands. Notably, the mammary glands were mainly composed of alveolar structures at 90 days. Correspondingly, the expression levels of the marker proteins Elf-5 and PLIN2 in mammary gland development began to increase at 50 days of gestation, with high expression levels at 75 and 90 days. Meanwhile, serum levels of E2, P and PRL all increased with the progress of gestation. The contents of E2, P and PRL reached 42.82 ng/L, 36.76 and 66.53 μg/L respectively at 90 days. In addition, the expression levels of ERα and PRLR increased at 50 days and the PR expression increased at 75 days. Furthermore, the Jak2/STAT5 and PI3K/AKT signaling pathways were significantly activated at 75 and 90 days of gestation.
ConclusionDuring gestation in Tibetan pigs, the mammary glands begin to develop alveolar at 50 days, enter the rapid alveolar development stage at 75 days, with higher developmental degree at 90 days. The alternations of mammary gland morphology are accompanied with the significant increase of hormones related to mammary gland development in serum and of hormone receptor expression in mammary glands, and with the activations of the PI3K/AKT and Jak2/STAT5 pathways which are closely related to mammary gland development.
-
Keywords:
- Tibetan pig /
- mammary gland development /
- hormone /
- gestation /
- signaling pathway
-
防风Saposhnikovia divaricata (Turcz.) Schischk.为伞形科多年生草本植物,主要分布在中国、韩国和日本[1],以未抽薹的干燥根入药[2]。防风药用历史悠久,在中医临床实践中已有
2000 多年的历史,是我国传统中药材的重要组成部分,具有解表祛风、胜湿、止痛解痉的功效[3]。现代研究表明防风中含有挥发油、色原酮、有机酸、香豆素以及多糖等多种类别的化学成分,其中,香豆素类是防风的主要药效成分之一,具有抗炎、抗病毒、抗菌、保护心脏、诱导癌细胞凋亡等药理作用[4]。香豆素类化合物通过苯丙烷途径产生,根据母核上的取代基及其位置的不同,可分为简单香豆素、呋喃香豆素和吡喃香豆素,具有多种生物活性;在香豆素合成通路中多数基因均是以基因家族的形式存在于植物中,对香豆酰辅酶A 2'−羟化酶(p-Coumaroyl CoA 2'-hydroxylase, C2'H)参与香豆素合成,属于2−氧代戊二酸依赖性双加氧酶(2-Oxoglutarate-dependent dioxygenase,2OGD)超家族[5]。邻羟基化反应是香豆素生物合成的关键步骤,C2'H通过催化对香豆酰辅酶A和阿魏酰辅酶A的邻位羟基化,生成伞形酮前体与东莨菪碱前体,最后通过自发或酶促环化形成香豆素核心骨架。目前,在拟南芥[6]、甘薯[7]、芸香[8]、白花前胡[9]等物种中发现C2'H对对香豆酰辅酶A和阿魏酰辅酶A这2种底物均具有高度特异性;然而,在防风中尚未克隆到C2'H基因。因此,本研究拟克隆防风SdC2'H基因,解析其对香豆素生物合成的调控作用。
毛状根是发根农杆菌Agrobacterium rhizogenes侵染植物受伤部位使植物表面产生的一种病理表现[10],具有遗传稳定、繁殖速度快、容易进行基因操作等优点。毛状根不仅是研究植物基因功能的良好遗传体系[11],还可以合成具植物特征的次生代谢产物,因此在药用植物研究方面,毛状根的培养技术受到诸多关注,在丹参[12]、人参[13]、长春花[14]等药用植物中取得显著进展。近年来,很多学者利用毛状根培养体系在不同植物中进行基因功能研究。例如,在丹参毛状根中过表达SmSCR1基因显著提高毛状根中丹参酮的含量[15];在黄芩毛状根中过表达肉桂酸4−羟化酶(Cinnamate 4-hydroxylase,C4H)和4−香豆酰辅酶A连接酶(4-Coumaroyl coenzyme A ligase,4CL)基因显著增加毛状根中黄酮的含量[16];在何首乌毛状根中过表达2种尿苷二磷酸依赖性糖基转移酶(Uridine-diphosphate-dependent glycosyltransferases,UGTs)基因使毛状根中2, 3, 5, 4'−四羟基二苯乙烯−2−O−β−D−葡萄糖苷(2, 3, 5, 4'- Tetrahydroxy stilbene-2-O-β-D-glucoside,THSG)含量显著提高[17]。而在防风毛状根中进行基因过表达功能验证的研究报道较少。本研究前期利用茉莉酸甲酯(Methyl jasmonate,MeJA)诱导的防风毛状根转录组测序数据[18]筛选出香豆素生物合成途径的关键基因C2'H,利用无缝克隆技术,构建含有SdC2'H基因的过表达载体,利用毛状根遗传转化体系开展SdC2'H基因功能研究,解析该基因在防风香豆素生物合成中的作用,为阐明香豆素生物合成的分子调控网络提供基础。
1. 材料与方法
1.1 试剂与仪器
植物RNA提取试剂盒(货号:ZP405)、cDNA合成试剂盒(货号:AT311)、快速高保真DNA聚合酶(货号:AS131)、同源重组无缝克隆试剂盒(货号:CU201)购于北京全式金生物科技有限公司;SanPrep柱式DNA胶回收试剂盒(货号:B518131)、限制性内切酶Bg1 II和BstE II、SanPrep柱式质粒DNA小量抽提试剂盒(货号:B518191)、植物DNA提取试剂盒(货号:B518262)以及大肠埃希菌DH5α感受态细胞购于上海生工生物工程股份有限公司;pMD-19T载体以及DNA marker(BM2000、BM15000)购于TaKaRa公司;K599发根农杆菌感受态细胞采购自华越洋生物科技(北京)有限公司。
仪器包含PCR仪ProFlex™(美国ThermoFish)、恒温振荡培养箱YAMATOIC412C(美国Yamato)、离心机(美国ThermoFish)、琼脂糖凝胶电泳仪DYY-8C(北京六一)、凝胶成像系统GIS-2010(上海Tanon)。
1.2 PCR引物及程序
由上海生工生物工程股份有限公司完成所有PCR引物合成及测序工作,试验所用引物信息及PCR反应程序参见表1、2。
表 1 引物信息Table 1. Primer information编号
Code项目
Item名称
Name正向序列(5′→3′)
Forward sequence反向序列(5′→3′)
Reverse sequenceS1 SdC2'H基因克隆 SdC2'H-1 ATGCATATTGTTAATCATGG TCATATCTTTGCAAACTCGA S2 SdC2'H基因过表达载体构建 SdC2'H-2 TGACCATGGTAGATCTATGCATA
TTGTTAATCATGGAGTCCCCAATTCGAGCTGGTCACCTCATATC
TTTGCAAACTCGAGAGTGTCCS3 植物双元表达载体构建 1304 GCAACAGGATTCAATCTTAAGA ATTGTGAAGATAGTGGAAAAGG S4 毛状根中rolB验证 rolB GCCAGCATTTTTGGTGAACT GGCACTGAACTTGCCGTTAT S5 转基因毛状根外源SdC2'H鉴定 hrHyg ATCATCGAAATTGCCGTCAA ATGGCGTGATTTCATATGCG S6 利用RT-qPCR检测EF1-α表达 EF1-α AGGCTCTTCAGGAGGCTCTTC CAATGTGACAGGTGTGGCAATC S7 利用RT-qPCR检测SdC2'H表达 q-C2'H ATGCATATTGTTAATCATGGAGTCC GCAACGCAAAGAATCTACGA 1.3 防风SdC2'H基因克隆及生物信息学分析
采用植物RNA提取试剂盒提取新鲜防风叶片总RNA,采用cDNA合成试剂盒逆转录获得cDNA。使用Vector N TI设计引物S1(表1)对SdC2'H基因进行PCR扩增,采用反应程序1(表2);反应体系(20 μL)为cDNA 1.0 μL、2× TransTag HiFi PCR SuperMixⅡ 10.0 μL、上游引物(10 μmol·L−1)1.0 μL、下游引物(10 μmol·L−1)1.0 μL、ddH2O 7.0 μL。利用琼脂糖凝胶电泳纯化PCR扩增产物,在16 ℃恒温条件下与pMD-19T载体过夜连接。将连接产物转入大肠埃希菌DH5α感受态细胞,在含50 mg·L−1 Amp的LB平板上筛选阳性克隆,随机选取若干阳性克隆进行PCR鉴定,对确认符合要求的阳性菌液样本进行测序。
表 2 PCR 程序Table 2. PCR programs编号
Code项目
Item程序
Program1 SdC2'H基因克隆 94 ℃ 5 min;94 ℃ 30 s, 45 ℃ 30 s,72 ℃ 1 min,35次循环;72 ℃ 10 min 2 SdC2'H基因过表达载体构建 94 ℃ 3 min;94 ℃ 30 s,68 ℃ 30 s,72 ℃ 1 min,35次循环;72 ℃ 10 min 3 植物双元表达载体构建 95 ℃ 5 min;95 ℃ 30 s,55 ℃ 30 s,72 ℃ 1.5 min,35次循环;72 ℃ 10 min 4 毛状根中rolB验证 94 ℃ 5 min;94 ℃ 30 s,55 ℃ 30 s, 72 ℃ 1 min,35次循环;72 ℃ 10 min 5 转基因毛状根外源SdC2'H鉴定 94 ℃ 5 min;94 ℃ 30 s,55 ℃ 55 s,72 ℃ 1 min,35次循环;72 ℃ 10 min 6 利用RT-qPCR检测EF1-α表达 95 ℃ 30 s;95 ℃ 5 s,58 ℃ 30 s,72 ℃ 10 s,40次循环 7 利用RT-qPCR检测SdC2'H表达 95 ℃ 30 s;95 ℃ 5 s,58 ℃ 30 s,72 ℃ 10 s,40次循环 基于Expasy-ProtParam在线平台解析SdC2'H蛋白的理化参数;通过SOPMA在线工具预测其二级结构组成;利用Swiss-Model进行三级结构建模;通过SiqnalP6.0 Server在线平台进行信号肽特征预测;借助NCBI的CD-search工具进行保守结构域鉴定;从GenBank选取16个跨物种同源序列,将其与本研究获得的防风SdC2'H序列共同导入MEGA 11软件进行多序列比对,基于近邻聚类算法构建系统进化树。
1.4 构建过表达SdC2'H基因的植物双元表达载体
选取pCAMBIA1304载体Bg1 II与BstE II酶切位点作为SdC2'H基因插入位点,按照同源重组无缝克隆试剂盒的要求设计同源臂引物S2(表1),并进行PCR扩增,采用反应程序2(表2);对质粒pCAMBIA1304进行Bg1 II和BstE II双酶切处理(37 ℃、1 h);按照Basic Assembly反应体系对琼脂糖凝胶电泳纯化扩增产物的目标基因及线性化载体(物质的量比2∶3)进行重组连接,在PCR仪中于50 ℃温育15 min;将重组连接产物转化至大肠埃希菌Trans1-T1感受态细胞,在含50 mg·L−1 Kan的LB固体培养基上随机挑选阳性单菌落;对扩大培养的阳性菌液进行PCR分子鉴定与测序验证,将确认无误的重组质粒命名为pCA-SdC2'H。
1.5 构建重组发根农杆菌K599
利用冻融法将重组pCA-SdC2'H质粒导入发根农杆菌K599感受态细胞,在含50 mg·L−1 Kan、50 mg·L−1 Str的YEB固体培养基上随机选取阳性克隆;选取引物S3(表1)配合PCR程序3(表2)对阳性克隆进行PCR检测与测序;将经测序确认的重组农杆菌接种至含有相应抗生素的YEB液体培养基中,于28 ℃摇床以180 r·min−1振荡培养至对数期,测定菌液D600 nm为0.6~1.0时离心,收集菌体,以等体积1/2MS液体培养基进行重悬[18]。
1.6 过表达SdC2'H基因防风毛状根的诱导、验证及培养
在超净工作台中将防风无菌苗的叶片剪出伤口,并放置在重悬于等体积1/2MS液体培养基的菌液中,于28 ℃摇床中震荡侵染;10 min后取出外植体在滤纸上擦干,接种于MS固体培养基,放置于25 ℃恒温培养箱共培养3 d;3 d后将外植体在无菌水中冲洗掉多余农杆菌,吸干水分并转接到含有50 mg·L−1 Cef的固体MS培养基中除菌培养[18]。以发根农杆菌K599诱导防风毛状根建立空白对照组(CK),同时分别利用携带pCAMBIA1304空载体的工程菌诱导防风毛状根构建阴性对照组(NC),以及携带SdC2'H过表达载体的工程菌诱导防风毛状根构建过表达组(SdC2'H+);每周继代培养并梯度降低Cef质量浓度,直至诱导获得防风毛状根;随后通过植物DNA提取试剂盒获取各处理组毛状根系基因组DNA,分别选取引物S4、S5(表1)配合程序4、5(表2)进行rolB基因及hrHyg外源基因的PCR鉴定。参照西芸霏[18]的方法对上述鉴定正确的防风毛状根进行液体扩大培养,操作如下:无菌条件下称取1.5 g长势一致的防风毛状根系样本,接种于含1/2MS液体培养基的锥形瓶中,置于25 ℃恒温摇床以130 r·min−1进行振荡培养,每7 d更换1次新鲜培养基;持续培养21 d后收获毛状根样本,经蒸馏水冲洗后用于后续SdC2'H基因表达量检测与香豆素含量测定。每个处理设3次生物学重复。
1.7 防风毛状根中SdC2'H基因表达水平检测
通过植物RNA提取试剂盒提取各处理组毛状根系总RNA,并选用cDNA合成试剂盒进行cDNA合成,反应体系为防风毛状根RNA 4 μL、Anchored Oligo (dT)18 1 μL、2× TS Reaction Mix 10 μL、TransScript RT/RI Enzyme Mix 1 μL、gDNA Remover 1 μL、RNase-free Water 1 μL,反应条件为42 ℃孵育15 min,85 ℃加热5 s失活TransScript RT/RI与gDNA Remover。以防风EF1-α基因作为内参基因,利用RT-qPCR检测防风毛状根样品中SdC2'H基因的表达水平;以引物S6(表1)对EF1-α进行扩增,采用PCR反应程序6(表2),以引物S7(表1)对SdC2'H进行扩增,采用PCR程序7(表2),反应体系均为基因1.0 μL、上游引物(10 μmol·L−1)1.0 μL、下游引物(10 μmol·L−1)1.0 μL、SYBR Green Master Mix 10.0 μL、ddH2O 7.0 μL;采用2−△△CT法计算SdC2'H基因的相对表达水平[19]。
1.8 防风毛状根中香豆素含量的测定
用蒸馏水将毛状根冲洗干净,并用滤纸吸干水分后置于60 ℃烘箱,干燥后的毛状根用研钵磨成细粉,过0.6 mm孔径筛,称取0.2 g样品,加入6 mL甲醇,于60 ℃超声提取1 h,冷却,滤纸过滤,过0.22 μm滤膜。采用HPLC测定香豆素含量[20]。
2. 结果与分析
2.1 SdC2'H基因克隆与生物信息学分析
如图1所示,PCR扩增产物呈现813 bp的特异性条带,经测序证实其实际长度与预期完全一致,包含完整的813 bp开放阅读框。
BLAST比对结果显示,该序列与Kitagawia praeruptora的C2'H cDNA序列相似性为93.33%,氨基酸序列相似性为94.44%,确证其为防风SdC2'H基因序列,并成功提交至GenBank数据库(登录号:PV169361)。生物信息学分析显示,防风SdC2'H蛋白分子式为C
1386 H2 191N357O401S9,理论相对分子质量为305603330 ,等电点为6.61,不稳定指数为37.50(<40),是一个不稳定蛋白;亲水性为−0.184(<0),为亲水性蛋白。SdC2'H蛋白质的二级结构以α−螺旋和卷曲结构为主,分别占比34.81%和47.41%,另外延伸链占据17.78%。由三级结构模型预测可知,该蛋白主要由α−螺旋和无规则卷曲组成。SdC2'H蛋白位于跨膜区和膜内部的概率很低,主要定位于膜外。信号肽预测值均为0,说明不含典型信号肽序列。保守结构域分析结果进一步显示,防风SdC2'H属于PLN03178超家族,聚类分析结果如图2所示。防风SdC2'H的氨基酸序列与伞形科植物紫花前胡Angelica decursiva和K. praeruptora的序列聚在一起,亲缘关系较近,说明防风SdC2'H和其他伞形科植物C2'H具有相似的功能。2.2 过表达SdC2'H基因防风毛状根的验证
基于图3所示方法构建防风pCA-SdC2'H双元表达载体,经PCR验证(图4)显示,特异性扩增条带长度为813 bp,与SdC2'H基因预期长度一致,测序比对证实其与GenBank注册序列(PV169361)相似性为100%,确证成功构建了防风pCA-SdC2'H双元表达载体。侵染7、30 d后的毛状根样本如图5所示,空白对照(CK)、空载体阴性对照(NC)及过表达SdC2'H(SdC2'H+)3个处理组均长势良好。
图6a为各处理防风毛状根系中rolB基因的PCR验证结果,扩增获得长度为703 bp的条带,经测序比对,与K599发根农杆菌中rolB基因序列完全匹配(相似性100%)。如图6b所示,SdC2'H+组特异性扩增出418 bp条带,经测序比对,与hrHyg基因序列完全匹配(相似性100%),确证SdC2'H基因成功外源整合至毛状根基因组,并排除内源性基因干扰。上述结果证实,本研究成功诱导了过表达SdC2'H基因的防风毛状根。
![图 6 基于rolB (a)和hrHyg (b)扩增的防风毛状根鉴定]() 图 6 基于rolB (a)和hrHyg (b)扩增的防风毛状根鉴定SdC2'H+:过表达SdC2'H,NC:空载体阴性对照,CK:空白对照,M:DNA marker。Figure 6. Identification of Saposhnikovia divaricata hairy roots based on rolB (a) and hyHyg (b) amplificationSdC2'H+: Overexpressing SdC2'H, NC: Negative control containing empty vector, CK: Blank control, M: DNA marker.
图 6 基于rolB (a)和hrHyg (b)扩增的防风毛状根鉴定SdC2'H+:过表达SdC2'H,NC:空载体阴性对照,CK:空白对照,M:DNA marker。Figure 6. Identification of Saposhnikovia divaricata hairy roots based on rolB (a) and hyHyg (b) amplificationSdC2'H+: Overexpressing SdC2'H, NC: Negative control containing empty vector, CK: Blank control, M: DNA marker.2.3 防风毛状根中SdC2'H基因的表达水平
通过RT-qPCR定量检测防风毛状根中SdC2'H基因表达水平,应用GraphPad Prism 9.5软件进行t检验。如图7所示,SdC2'H+处理组基因表达水平显著高于空白对照组(CK) (P<
0.0001 )。![图 7 SdC2'H在不同处理防风毛状根系中的相对表达水平]() 图 7 SdC2'H在不同处理防风毛状根系中的相对表达水平CK:空白对照,NC:空载体阴性对照,SdC2'H+:过表达SdC2'H;****表示在P<0.000 1水平差异显著(t检验)。Figure 7. Relative expression levels of SdC2'H in Saposhnikovia divaricata hairy roots of different treatmentsCK: Blank control, NC: Negative control containing empty vector, SdC2'H+: Overexpressing SdC2'H; **** indicates significant difference at P<0.000 1 level (t test).
图 7 SdC2'H在不同处理防风毛状根系中的相对表达水平CK:空白对照,NC:空载体阴性对照,SdC2'H+:过表达SdC2'H;****表示在P<0.000 1水平差异显著(t检验)。Figure 7. Relative expression levels of SdC2'H in Saposhnikovia divaricata hairy roots of different treatmentsCK: Blank control, NC: Negative control containing empty vector, SdC2'H+: Overexpressing SdC2'H; **** indicates significant difference at P<0.000 1 level (t test).2.4 防风毛状根中香豆素含量
如图8所示,经1/2MS液体培养基培养21 d后,各处理防风毛状根均长势良好。采用HPLC检测各处理组防风毛状根系中香豆素含量(图9),经采用GraphPad Prism 9.5软件进行t检验,SdC2'H+组香豆素含量均显著高于空白对照组(CK) (P<0.001)与空载体阴性对照组(NC) (P<0.01)。
![图 9 不同处理防风毛状根系中的香豆素含量]() 图 9 不同处理防风毛状根系中的香豆素含量CK:空白对照,NC:空载体阴性对照,SdC2'H+:过表达SdC2'H;**和***分别表示在P<0.01和P<0.001水平差异显著(t检验)。Figure 9. Coumarin contents in Saposhnikovia divaricata hairy roots of different treatmentsCK: Blank control, NC: Negative control containing empty vector, SdC2'H+: Overexpressing SdC2'H; ** and *** indicate significant differences at P<0.01 and P<0.001 levels respectively (t test).
图 9 不同处理防风毛状根系中的香豆素含量CK:空白对照,NC:空载体阴性对照,SdC2'H+:过表达SdC2'H;**和***分别表示在P<0.01和P<0.001水平差异显著(t检验)。Figure 9. Coumarin contents in Saposhnikovia divaricata hairy roots of different treatmentsCK: Blank control, NC: Negative control containing empty vector, SdC2'H+: Overexpressing SdC2'H; ** and *** indicate significant differences at P<0.01 and P<0.001 levels respectively (t test).3. 讨论与结论
香豆素作为苯骈−α−吡喃酮类的芳香族天然产物,在药用植物中广泛存在,具有抗肿瘤、抗凝血及抗氧化等重要的药理活性[21]。本研究从防风中成功克隆SdC2'H基因,其开放阅读框为813 bp,编码蛋白含270个氨基酸。SdC2'H蛋白一级结构分析显示其具有亲水性及结构不稳定特征,且缺乏典型信号肽序列。二级结构以α−螺旋和无规则卷曲为主,初步解析了该蛋白的折叠构象特征。由C2'H蛋白构建的系统进化树可见,防风SdC2'H蛋白与伞形科植物紫花前胡亲缘关系最近,推测防风SdC2'H可能与紫花前胡C2'H具有相似功能,为后续解析防风香豆素生物合成的分子机制提供了依据。
近年来,有关功能基因对药用成分生物合成调控的研究日益深入。Hwang等[22]利用根瘤菌注射法,在黄芪茎外植体中诱导过表达AmUGT15基因的毛状根,其黄芪甲苷总量是野生型对照组的4.2倍。侯嘉铭等[23]利用发根农杆菌转化法将CHI基因在甘草毛状根中过表达,其黄酮类有效成分的含量显著增加。本研究在防风中构建过表达载体pCA-SdC2'H,利用发根农杆菌诱导防风子叶外植体,获得过表达SdC2'H基因的防风毛状根系,其SdC2'H基因的表达水平显著高于空白对照,且香豆素含量显著高于空白对照和空载体阴性对照,证实该基因通过增强对对香豆酰辅酶A的催化效率正向调控香豆素合成通路。前人通过系统进化树分析发现,白花前胡PpC2'H与欧防风PsC2'H具有较高的序列相似性[24]。已有研究表明,C2'H及F6'H介导的邻位羟基化反应是香豆素生物合成的关键步骤,其中游离肉桂酸衍生物作为非活性底物参与催化过程[8, 25],例如,拟南芥AtF6'H1和甘薯IbF6'H1对阿魏酰辅酶A表现出严格的底物特异性。本研究中SdC2'H基因对香豆素合成具有正向调控作用,这一结果也与在拟南芥中过表达F6'H1促进东莨菪碱生成的研究结果[26]相似,说明防风中SdC2'H基因和AtF6'H1基因可能具有高度相似的功能。
本研究成功构建了过表达SdC2'H基因的防风毛状根培养体系,明确了SdC2'H基因在香豆素生物合成中的促进作用。今后,将继续以防风毛状根为研究对象,对影响香豆素生物合成的其他关键基因进行研究,进一步解析香豆素生物合成的分子调控机制。
-
图 3 藏猪妊娠期不同时间点乳腺发育标志蛋白相对表达量
相同标志蛋白柱子上方的不同小写字母表示差异显著(P<0.05,Duncan’s法)
Figure 3. Relative expressions of marker proteins for mammary gland development at different time points during gestation in Tibetan pigs
Different lowercase letters on bars of the same marker protein indicate significant differences (P<0.05,Duncan’s method)
图 5 藏猪妊娠期不同时间点乳腺中激素受体蛋白相对表达量
相同激素受体柱子上方的不同小写字母表示差异显著(P<0.05,Duncan’s法)
Figure 5. Relative expressions of the hormone receptors at different time points during gestation in mammary glands of Tibetan pigs
Different lowercase letters on bars of the same hormone receptor indicate significant differences (P<0.05,Duncan’s method)
图 7 藏猪妊娠期不同时间点乳腺中Jak2/STAT5和PI3K/AKT信号通路的蛋白相对表达量
相同信号通路柱子上方的不同小写字母表示差异显著(P<0.05,Duncan’s法)
Figure 7. Relative expressions of proteins from Jak2/STAT5 and PI3K/AKT signaling pathways at different time points during gestation in mammary glands of Tibetan pigs
Different lowercase letters on bars of the same signaling pathway indicate significant differences (P<0.05,Duncan’s method)
表 1 藏猪妊娠期不同时间点的血清激素水平1)
Table 1 Serum hormone levels at different time points during gestation in Tibetan pigs
t妊娠/d
Days of gestationρ(E2)/
(ng·L−1)ρ(P)/
(μg·L−1)ρ(PRL)/
(μg·L−1)33 14.56±0.82a 31.55±1.15a 44.86±1.36a 50 22.30±0.71b 32.36±0.62a 54.12±2.73b 75 27.56±0.91c 35.19±0.90b 52.91±1.31b 90 42.82±2.25d 36.76±0.94b 66.53±2.87c 1)同列数据后的不同小写字母表示差异显著(P<0.05,Duncan’s 法)
1) Different lowercase letters in the same column indicate significant differences (P<0.05,Duncan’s method) -
[1] 唐建华, 冯静, 陈晓英, 等. 藏猪种质资源保护与利用研究[J]. 养猪, 2016(1): 68-70. [2] 张浩, 吴常信, 强巴央宗, 等. 藏猪3个繁殖性状主效基因多态性研究[J]. 遗传, 2007(8): 939-944. [3] JI F, HURLEY W L, KIM S W. Characterization of mammary gland development in pregnant gilts[J]. Journal of Animal Science, 2006, 84(3): 579-587. doi: 10.2527/2006.843579x
[4] MACIAS H, HINCK L. Mammary gland development[J]. Wiley Interdisciplinary Reviews Developmental Biology, 2012, 1(4): 533-557. doi: 10.1002/wdev.35
[5] HILTON H N, CLARKE C L, GRAHAM J D. Estrogen and progesterone signalling in the normal breast and its implications for cancer development[J]. Molecular and Cellular Endocrinology, 2018, 466: 2-14. doi: 10.1016/j.mce.2017.08.011
[6] ZIELNIOK K, SOBOLEWSKA A, GAJEWSKA M. Mechanisms of autophagy induction by sex steroids in bovine mammary epithelial cells[J]. Journal of Molecular Endocrinology, 2017, 59(1): 29. doi: 10.1530/JME-16-0247
[7] TIAN L, ZHANG L, CUI Y, et al. miR-142-3p regulates milk synthesis and structure of murine mammary glands via PRLR-mediated multiple signaling pathways[J]. Journal of Agricultural and Food Chemistry, 2019, 67(34): 9532-9542. doi: 10.1021/acs.jafc.9b03734
[8] O’LEARY K A, SHEA M P, SALITURO S, et al. Prolactin alters the mammary epithelial hierarchy, increasing progenitors and facilitating ovarian steroid action[J]. Stem Cell Reports, 2017, 9(4): 1167-1179. doi: 10.1016/j.stemcr.2017.08.011
[9] RÄDLER P D, WEHDE B L, WAGNER K U. Crosstalk between STAT5 activation and PI3K/AKT functions in normal and transformed mammary epithelial cells[J]. Molecular and Cellular Endocrinology, 2017, 451: 31-39. doi: 10.1016/j.mce.2017.04.025
[10] MENG Y, YUAN C, ZHANG J, et al. Stearic acid suppresses mammary gland development by inhibiting PI3K/Akt signaling pathway through GPR120 in pubertal mice[J]. Biochemical And Biophysical Research Communications, 2017, 491(1): 192-197. doi: 10.1016/j.bbrc.2017.07.075
[11] MENG Y, ZHANG J, ZHANG F, et al. Lauric acid stimulates mammary gland development of pubertal mice through activation of GPR84 and PI3K/Akt signaling pathway[J]. Journal of Agricultural and Food Chemistry, 2017, 65(1): 95-103. doi: 10.1021/acs.jafc.6b04878
[12] VOLKER S E, HEDRICK S E, FEENEY Y B, et al. Cyclophilin a function in mammary epithelium impacts Jak2/Stat5 signaling, morphogenesis, differentiation, and tumorigenesis in the mammary gland[J]. Cancer Research, 2018, 78(14): 3877-3887. doi: 10.1158/0008-5472.CAN-17-2892
[13] ZHANG M C, ZHAO S G, WANG S S, et al. d-Glucose and amino acid deficiency inhibits casein synthesis through JAK2/STAT5 and AMPK/mTOR signaling pathways in mammary epithelial cells of dairy cows[J]. Journal of Dairy Science, 2018, 101(2): 1737-1746. doi: 10.3168/jds.2017-12926
[14] JI F, WU G, BLANTON J R, et al. Changes in weight and composition in various tissues of pregnant gilts and their nutritional implications1[J]. Journal of Animal Science, 2005, 83(2): 366-375. doi: 10.2527/2005.832366x
[15] KENSINGER R S, COLLIER R J, BAZER F W, et al. Nucleic acid, metabolic and histological changes in gilt mammary tissue during pregnancy and lactogenesis[J]. Journal of Animal Science, 1982, 54(6): 1297-1308. doi: 10.2527/jas1982.5461297x
[16] 高慧杰, 郑惠玲. WGCNA鉴定奶山羊妊娠至泌乳期乳腺发育关键基因[J]. 畜牧兽医学报, 2020, 51(11): 2679-2688. [17] 苏启明, 曲鑫建, 伍会健. ELF5在正常乳腺发育和乳腺肿瘤发生中的作用[J]. 生命科学研究, 2017, 21(3): 262-267. [18] OAKES S R, NAYLOR M J, ASSELIN-LABAT M-L, et al. The Ets transcription factor Elf5 specifies mammary alveolar cell fate[J]. Genes & Development, 2008, 22(5): 581-586.
[19] SHI H B, YU K, LUO J, et al. Adipocyte differentiation-related protein promotes lipid accumulation in goat mammary epithelial cells[J]. Journal of Dairy Science, 2015, 98(10): 6954-6964. doi: 10.3168/jds.2015-9452
[20] KELLY P A, BACHELOT A, KEDZIA C, et al. The role of prolactin and growth hormone in mammary gland development[J]. Molecular and Cellular Endocrinology, 2002, 197(1): 127-131.
[21] 方莉莉, 安玲, 荆海霞, 等. 孕激素受体在不同发育期牦牛乳腺组织内的分布及表达[J]. 黑龙江畜牧兽医, 2019(11): 141-146. [22] HORIGAN K C, TROTT J F, BARNDOLLAR A S, et al. Hormone interactions confer specific proliferative and histomorphogenic responses in the porcine mammary gland[J]. Domestic Animal Endocrinology, 2009, 37(2): 124-138. doi: 10.1016/j.domaniend.2009.04.002
[23] CHAI X, SUN D, HAN Q, et al. Hypoxia induces pulmonary arterial fibroblast proliferation, migration, differentiation and vascular remodeling via the PI3K/Akt/p70S6K signaling pathway[J]. International Journal of Molecular Medicine, 2018, 41(5): 2461-2472.
[24] PALIN M F, BEAUDRY D, ROBERGE C, et al. Expression levels of STAT5A and STAT5B in mammary parenchymal tissue from Upton-Meishan and Large White gilts[J]. Canadian Journal of Animal Science, 2002, 82(4): 507-518. doi: 10.4141/A01-091



 下载:
下载: