Effects of chemical substances on melanin formation of Rhizoctonia solani AG-1 IA
-
摘要:目的
水稻纹枯病是由立枯丝核菌Rhizoctonia solaniAG-1 IA融合群引起的真菌病害,本研究旨在明确外界培养条件与水稻纹枯病菌黑色素形成的关系。
方法采用菌丝生长速率法和紫外分光光度法,测定化学肥料[500 μg/mL K2SO4、NaH2PO4、CO(NH2)2]、金属离子(5 μg/mL CuSO 4、FeSO4、ZnSO4)、抗氧化剂(5 μg/mL槲皮素、桑色素、抗坏血酸)和对照(300 μg/mL莨菪碱、50 μg/mL儿茶酚、水)对水稻纹枯病菌菌丝生长速率、菌核数量、菌核鲜质量和干质量以及黑色素含量的影响。
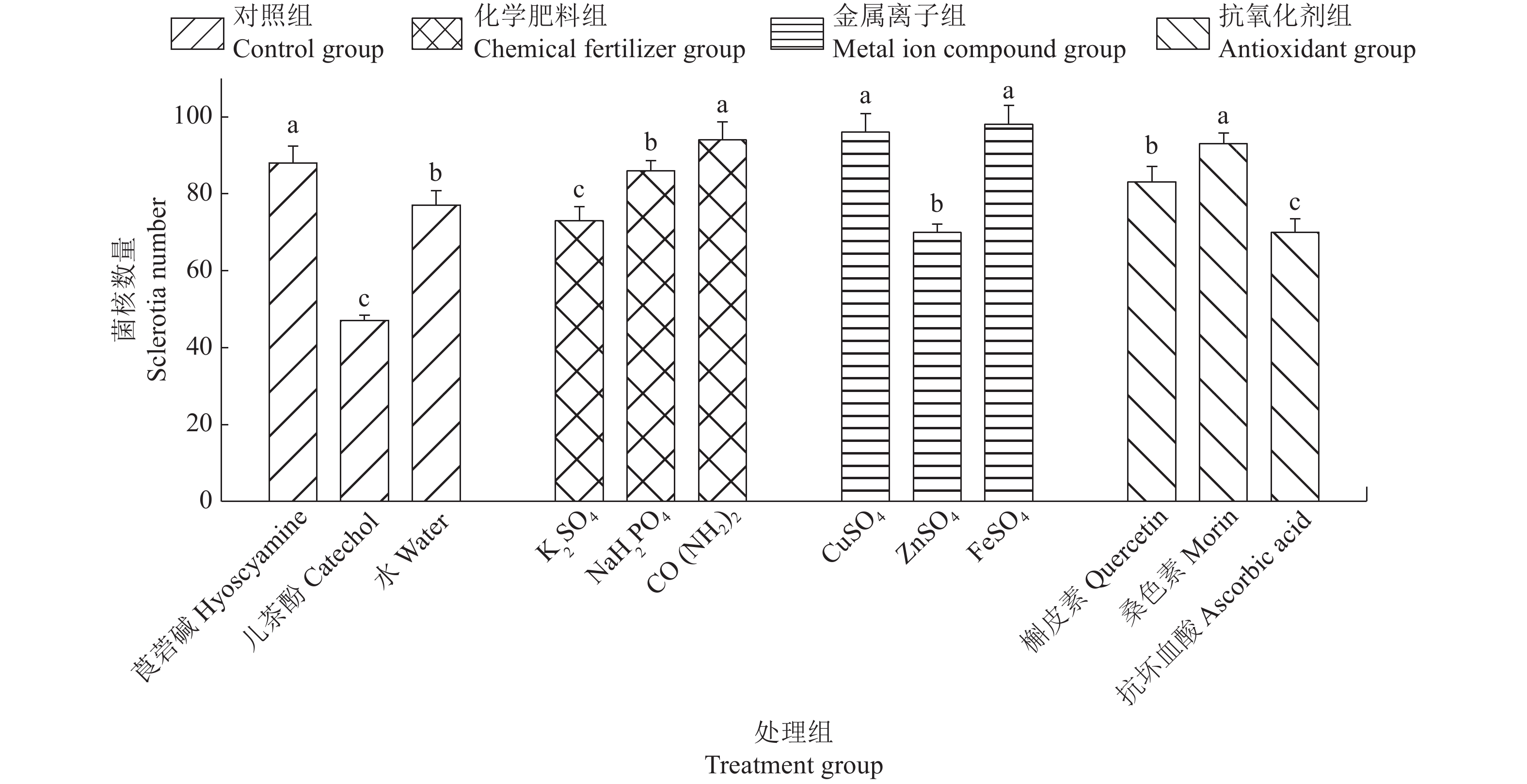
结果500 μg/mL K2SO4、NaH2PO4和CO(NH2)2,5 μg/mL CuSO4和ZnSO4,5 μg/mL槲皮素、桑色素和抗坏血酸以及50 μg/mL儿茶酚溶液对水稻纹枯病菌黑色素的形成均有促进作用。其中,500 μg/mL的CO(NH2)2处理下,水稻纹枯病菌产生黑色素最多,为113.2 mg;而300 μg/mL的莨菪碱处理下,水稻纹枯病菌产生黑色素最少,为37.4 mg。
结论水稻纹枯病菌黑色素的产生与菌丝生长速率和菌核发育没有必然的联系,即抑制菌丝生长和菌核发育的化学物质,不一定能够抑制黑色素的形成。本研究结果可为水稻纹枯病防控机理的研究提供依据。
Abstract:ObjectiveRice sheath blight, caused by Rhizoctonia solaniAG-1 IA, is an important fungal disease. The purpose of this study was to determine the relationship between external culture conditions and melanin formation of R. solani AG-1 IA.
MethodThe effects of four different treatment groups, i. e. chemical fertilizer group [500 μg/mL K2SO4, NaH2PO4, CO(NH2)2], metal ion compound group(5 μg/mL CuSO4, FeSO4, ZnSO4), antioxidant group (5 μg/mL quercetin, morin, vitamin C) and control group (300 μg/mL hyoscyamine, 50 μg/mL catechol, water), on the mycelial growth rate, sclerotia number, sclerotial fresh weight and dry weight as well as melanin content of R. solani AG-1 IA were determined by measuring mycelial growth rate and ultraviolet spectrophotometry.
ResultChemical fertilizer [500 μg/mL K2SO4, NaH2PO4, CO(NH2)2], metal ion compound (5 μg/mL CuSO4, ZnSO4), antioxidant(5 μg/mL quercetin, morin, vitamin C) and catechol(50 μg/mL) could promote the formation of melanin. Under the treatment of 500 μg/mL CO(NH2)2, the melanin content of R. solani AG-1 IA was the highest (113.2 mg), while under the treatment of 300 μg/mL hyoscyamine, the melanin content of R. solani AG-1 IA was the lowest (37.4 mg).
ConclusionMelanin formation is not necessarily related to mycelial growth and sclerotial development, i.e. the chemical substances, which have inhibitory effect on mycelial growth and sclerotial development, might have no inhibition on melanin formation. The results of this study provide a basis for understanding the mechanism for prevention and control of rice sheath blight.
-
Keywords:
- Rhizoctonia solani AG-1 IA /
- mycelium /
- sclerotium /
- melanin /
- chemical substance
-
香蕉枯萎病是由尖镰孢古巴专化型Fusarium oxysporum f. sp. cubense引起的香蕉毁灭性病害[1],在亚洲、非洲和澳洲等香蕉产区均有分布,给全球的香蕉产业造成严重的经济损失。据报道,香蕉枯萎病菌有4个生理小种,不同的生理小种侵染的香蕉品种及所造成的病害程度不同,分布区域也不同[2]。我国目前存在的1号和4号生理小种危害性最大。1号生理小种最易侵染大蜜啥(Gros Michel)、Apple和Silk等香蕉品系,而4号生理小种毁灭性最大,能侵染大蜜啥、矮香蕉和Cavendish等香蕉品系[3]。2号和3号生理小种在我国尚未发现,2号生理小种在中美洲侵染三倍体杂种煮食蕉和某些Jamaica四倍体等,3号生理小种被报道只危害芭蕉科的野生羯尾蕉Heliconia spp.[4]。
目前对香蕉枯萎病菌4个生理小种分子鉴定的报道较少。应用核糖体DNA(Ribosomal DNA, rDNA)ITS序列的保守性鉴定菌种是植物病原菌分子鉴定中较常用的方法[5-8]。基于DNA限制性片段长度多态性(Restriction fragment length polymorphism,RFLP)的遗传标记技术目前已成为对生物物种及种以下单元分类的常用方法[5, 9-12]。
本研究利用真菌通用引物ITS4/ITS5对香蕉枯萎病菌不同生理小种的ITS序列进行扩增,并进行RFLP分析,旨在寻找香蕉枯萎病菌不同生理小种ITS序列的差异,阐明该方法是否可用于区分香蕉枯萎病菌的不同生理小种。
1. 材料与方法
1.1 材料
1号生理小种WG02菌株、2号生理小种WG03菌株、3号生理小种WG04菌株、4号生理小种WG05菌株由澳大利亚Bentley博士惠赠。4号生理小种Z13和Z16菌株,1号生理小种Z14和Z15菌株,由华南农业大学植物病理系研究室姜子德教授提供。
限制性内切酶Alu Ⅰ、Hpa Ⅱ和Taq Ⅰ购于宝生物工程(大连)有限公司。
1.2 方法
1.2.1 真菌总DNA的提取及ITS序列的扩增
提取以上4个生理小种8个菌株的基因组DNA,具体方法参照OMEGA公司的真菌DNA提取试剂盒说明书。以香蕉枯萎病菌4个生理小种8个菌株的基因组DNA为模板,采用ITS4(5′-TCCTCCGCTTATTGATATGC-3′)和ITS5(5′-GGAAGTAAAAGTCGTAACAAGG-3′)引物PCR,扩增体系如下:10×缓冲液2.5 μL,2.5 mmol·L-1 dNTP 2 μL,5 μmol·L-1引物各1 μL,5 U·μL -1Taq酶0.2 μL,模板DNA约30 ng,ddH2O 17.5 μL。PCR扩增程序为: 95 ℃预变性3 min,94 ℃变性45 s,56 ℃复性45 s,72 ℃延伸1.5 min,30个循环;72 ℃延伸10 min。反应结束后取5 μL PCR产物电泳。将阳性PCR产物纯化、连接和克隆,挑选出阳性转化子,送北京奥科基因公司测序,每个菌株重复测序3次。PCR产物的测序结果用DNAMAN软件和BLAST进行序列比对和同源性分析。
1.2.2 ITS-RFLP分析
将15 μL ITS-PCR产物,0.5 μL内切酶(5 U),2 μL酶切缓冲液和2.5 μL ddH2O依次加入0.2 mL PCR管内,短暂离心混匀后,放入所需温度的水浴锅中反应4 h,其中Alu Ⅰ、Hpa Ⅱ限制性内切酶反应温度为37 ℃,Taq Ⅰ限制性内切酶反应温度为65 ℃,酶切产物通过电泳检测。
2. 结果与分析
2.1 不同生理小种ITS-PCR扩增
利用ITS4/ITS5和优化的扩增条件,对香蕉枯萎病菌4个生理小种共8个菌株的rDNA-ITS区进行了扩增。PCR扩增结果表明,8个菌株扩增出的特异性条带大小一致,位于500~700 bp,经测序确定其大小为568 bp(图 1)。
2.2 不同生理小种ITS的序列分析
对4个生理小种8个菌株的ITS区段进行克隆并测序,结果均得到568 bp的片段。用DNAMAN对8个菌株的ITS全长序列进行比对,结果(图 2)发现,8个菌株只在第344、390和409个碱基处存在差异:在344 bp处,除3号生理小种(WG04) 的碱基为C外,其他的均为T;在390 bp处,除4号生理小种(Z13、Z16) 的碱基为C外,其余的均为T;在409 bp处,1号和2号生理小种的为T,3号和4号生理小种的为C。用DNAMAN对4个生理小种8个菌株进行序列比对,相似性高达99.85%。国内、外的1号生理小种ITS序列基本相同;除WG05外,国内、外的4号生理小种的ITS序列基本相同。WG02和WG03 ITS序列完全相同。与GenBank中的已知序列进行相似性比对,发现其与GenBank中的尖镰孢F. oxysporum的序列相似性高达100%,表明ITS序列可以作为鉴定尖镰孢F. oxysporum的依据。
2.3 不同生理小种ITS-RFLP分析
3种限制性内切酶(Alu Ⅰ、Hpa Ⅱ、Taq Ⅰ)对ITS扩增产物的酶切图谱见图 3。由图 3A可看出,Alu Ⅰ对供试的4个生理小种8个菌株均有2个共同的酶切位点,供试菌株只有1种酶切图谱,每个菌株的ITS片段被酶切为大约380、130和50 bp的3个片段,50 bp左右的片段很模糊甚至不容易观察到。由图 3B可看出,Hpa Ⅱ对供试菌株的酶切位点较少,且比较保守;4个生理小种8个菌株均有1个共同的酶切位点,每个菌株的ITS片段被酶切为大约430和130 bp的2个片段;供试菌株只有1种酶切图谱。由图 3C可以看出,Taq Ⅰ对供试的8个菌株的酶切位点较多,均有3个共同的酶切位点,每个菌株的ITS片段被酶切为大约240、140、90和60 bp的4个片段;供试菌株只有1种酶切图谱。
从上述ITS酶切图谱的分析中可知,3种内切酶对香蕉枯萎病菌4个生理小种8个菌株所产生的酶切带型一致,并不能将香蕉枯萎病菌的不同生理小种区分开来,表明该病菌的种内rDNA ITS区段比较保守,遗传多样性有限。
3. 讨论与结论
rDNA已被广泛应用于植物病原菌亲缘关系以及致病性相关的研究。ITS区段在核基因组中是高度保守的,可用与它们序列互补的通用引物对ITS区进行PCR扩增、序列对比[8, 13]以及RFLP分析[11, 14-15]。Mills等[16]用RFLP区分不同地理来源和不同果树寄主的胶孢炭疽病菌Colletotrichum gloeosporioides,但不能区分不同地理来源芒果上的胶孢炭疽病菌的菌株。张瑞萍等[17]通过rDNA-ITS序列分析法成功鉴定出大豆根腐病菌F. oxysporum的菌株。李志芳等[6]用ITS-RFLP快速鉴定了棉花上的6种主要病原真菌,其ITS-RFLP产物大小各异、具有多态性,参考标准电子图谱可准确鉴定其种类。ITS-RFLP技术在担子菌的鉴定方面也有很多成功的例子[18-20],表明该技术适用性强。
本研究利用真菌通用引物ITS4/ITS5对香蕉枯萎病菌4个生理小种8个菌株的ITS进行了克隆和序列分析以及ITS-RFLP比较研究。结果表明,4个生理小种菌株的ITS序列只有3个碱基的差异,序列相似性高达99.85%,与GenBank中尖镰孢菊花专化型F. oxysporum f. sp. chrysanthemi(编号DQ452449.1)、尖镰孢黄瓜专化型F. oxysporum f. sp. cucumerinum(编号DQ452450.1) 和一品冠(仙客来)枯萎病菌F. oxysporum f. sp. cyclaminis strain ATCC 16061(编号DQ452451.1) 的序列相似性为99%以上,表明尖镰孢不同专化型在rDNA-ITS序列上差异性较小,因而rDNA-ITS区段序列在一定程度上不适合于种内专化型及生理小种的鉴定。
通过序列比对,发现香蕉枯萎病菌1号生理小种的3个菌株(WG02,Z14和Z15) 的rDNA-ITS区段序列完全一致,而4号生理小种的3个菌株(WG05,Z13和Z16) 的rDNA-ITS区段序列存在着一定程度的差异,可以推断现阶段香蕉枯萎病菌4号生理小种的变异频率比1号生理小种快,这与王文华[7]的研究结果一致,其原因可能是地域差异导致的生理分化。
通过比对香蕉枯萎病菌4个生理小种8个供试菌株的序列,还发现4号生理小种(Z13、Z16) 在390 bp与409 bp位点的碱基为C,而1号生理小种在此位点的碱基为T。笔者推测,4号生理小种在rDNA-ITS区段序列这2个位点上存在着专一性,为通过rDNA-ITS序列比对鉴定4号和1号生理小种提供了一定的理论依据。
本研究采用3种不同的限制性内切酶进行了ITS-RFLP分析,均未能将4个生理小种的8个菌株区分开,再次证实了其ITS序列的保守性。曾莉莎等[21]通过ITS遗传进化树将18个香蕉枯萎病菌分为4个分支,其中1号生理小种、2号生理小种及非致病性香蕉枯萎病菌共享1个分支,3号生理小种和4号生理小种也共享1个分支,提出了ITS不能代表香蕉枯萎病菌的种间亲缘关系,不适合做系统发育分析。本研究对ITS片段进行RFLP分析,结果获得的酶切谱带很单一,在一定程度上可能是因为内切酶种类太少,或者是因为单酶切的局限性等。尽管单个内切酶在一定程度上可以区分一些种和小种,如Alu Ⅰ能够将大豆灰斑病菌Cercospora sojina Hara[22]与其他种分开,但是仅有的单个酶对菌株进行鉴定是不可靠的,因为种内该位点可能存在多态性,酶切位点的突变也可能带来错误的结果。因此,为了更好地鉴定和监测香蕉枯萎病菌的生理小种,应结合4个生理小种的致病性试验[7],同时选择TEF-1α、IGS、histone H3等基因[21]以及复合限制性内切酶进行RFLP分析,以获得更为有力的证据和更为准确的鉴定结果。
-
表 1 本研究使用的化学物质及浓度
Table 1 Chemicals and concentrations used in this study
组别
Group化学物质 Chemical 母液 Stock solution 组分 Component ρ/(μg·mL−1) 溶剂 Solvent ρ/(mg·mL−1) 金属离子
Metal ion compoundCuSO4 5 ddH2O 50 ZnSO4 5 ddH2O 50 FeSO4 5 ddH2O 50 抗氧化剂
Antioxidant槲皮素 Quercetin 5 无水乙醇 Absolute ethanol 5 桑色素 Morin 5 无水乙醇 Absolute ethanol 5 抗坏血酸 Ascorbic acid 5 无水乙醇 Absolute ethanol 5 化学肥料
Chemical fertilizerCO(NH2)2 500 ddH2O 50 NaH2PO4 500 ddH2O 50 K2SO4 500 ddH2O 50 对照
Control莨菪碱 Hyoscyamine 300 无水乙醇 Absolute ethanol 150 儿茶酚 Catechol 50 无水乙醇 Absolute ethanol 100 水 Water 表 2 化学物质对水稻纹枯病菌菌丝生长速率和菌核质量 (m) 的影响1)
Table 2 Effects of chemicals on mycelial growth rate and sclerotial weight (m) of Rhizoctonia solani AG-1 IA
组别
Group化学物质
Chemicalρ(化学物质)/(μg·mL−1)
Chemical contentd(菌落)/mm
Colony diameterm鲜/g
Fresh weightm干/g
Dry weight化学肥料
Chemical fertilizerK2SO4 500 45.66±1.26b 0.487±0.041a 0.154±0.008a NaH2PO4 500 40.89±0.87c 0.473±0.008a 0.139±0.004a CO(NH2)2 500 53.83±1.20a 0.499±0.027a 0.128±0.015a 金属离子
Metal ion compoundCuSO4 5 50.11±1.57b 0.175±0.003b 0.068±0.002b ZnSO4 5 47.52±1.13c 0.152±0.009b 0.057±0.004b FeSO4 5 58.13±0.82a 0.212±0.006a 0.081±0.004a 抗氧化剂
Antioxidant槲皮素 Quercetin 5 43.55±1.19b 0.347±0.021b 0.117±0.006b 桑色素 Morin 5 37.71±1.28c 0.509±0.021a 0.149±0.003a 抗坏血酸 Ascorbic acid 5 50.04±0.79a 0.414±0.009b 0.133±0.007b 对照
Control莨菪碱 Hyoscyamine 300 52.75±0.47a 0.434±0.009a 0.138±0.004a 儿茶酚 Catechol 50 23.40±0.72c 0.401±0.023a 0.132±0.007a 水 Water 49.23±0.62b 0.500±0.047a 0.148±0.011a 1)相同组别、同列数据后的不同小写字母表示差异显著(P<0.05,Duncan’s法)
1)Different lowercase letters in the same column of the same group indicate significant differences (P<0.05,Duncan’s test)表 3 化学物质对水稻纹枯病菌黑色素产生的影响
Table 3 Effects of chemicals on the melanin formation of Rhizoctonia solani AG-1 IA
组别
Group化学物质
Chemicalρ/(μg·mL−1) m(黑色素)/mg
Melanin mass化学肥料
Chemical fertilizerK2SO4 500 65.1 NaH2PO4 500 85.5 CO(NH2)2 500 113.2 金属离子
Metal ion compoundCuSO4 5 65.7 ZnSO4 5 59.5 FeSO4 5 44.3 抗氧化剂
Antioxidant槲皮素 Quercetin 5 75.7 桑色素 Morin 5 91.1 抗坏血酸 Ascorbic acid 5 69.5 对照
Control莨菪碱 Hyoscyamine 300 37.4 儿茶酚 Catechol 50 55.7 水 Water 0 46.2 -
[1] ELAD Y. The use of antioxidants (free radical scavengers) to control grey mould (Botrytis cinerea) and white mould (Sclerotinia sclerotiomm) in various crops[J]. Plant Pathol, 1992, 41(4): 417-426. doi: 10.1111/j.1365-3059.1992.tb02436.x
[2] TOWNSEND B B. Nutritional factors influencing the production of sclerotia by certain fungi[J]. Ann Bot, 1957, 21(81): 153-166.
[3] 曹志艳, 杨胜勇, 董金皋. 植物病原真菌黑色素与致病性关系的研究进展[J]. 微生物学通报, 2006, 33(1): 154-158. doi: 10.3969/j.issn.0253-2654.2006.01.031 [4] REVANKAR S G, SUTTON D A. Melanized fungi in human disease[J]. Clin Microbiol Rev, 2010, 23(4): 884. doi: 10.1128/CMR.00019-10
[5] 江绍锋, 王陈骄子, 舒灿伟, 等. 水稻纹枯病菌RsCat基因的克隆及其表达分析[J]. 华中农业大学学报, 2018, 37(3): 25-31. [6] BELOZERSKAYA T A, GESSLER N N, AVER YANOV A A. Melanin pigments of fungi[M]. Berlin: Springer International Publishing, 2015.
[7] MISHRA S, SINGH H B. Silver nanoparticles mediated altered gene expression of melanin biosynthesis genes in Bipolaris sorokiniana[J]. Microbiol Res, 2015, 172(64): 16-18.
[8] JIANG S, WANG C, SHU C, et al. Effects of catechol on growth, antioxidant enzyme activities and melanin biosynthesis gene expression of Rhizoctonia solani AG-1 IA[J]. Can J Plant Pathol, 2018, 40(2): 220-228. doi: 10.1080/07060661.2018.1437775
[9] FENG B, WANG X, HAUSER M, et al. Molecular cloning and characterization of WdPKS1, a gene involved in dihydroxynaphthalene melanin biosynthesis and virulence in Wangiella(Exophiala) dermatitidis[J]. Infect Immun, 2001, 69(3): 1781. doi: 10.1128/IAI.69.3.1781-1794.2001
[10] 江绍锋, 王陈骄子, 舒灿伟, 等. 水稻纹枯病菌RsPhm基因的克隆及其表达分析[J]. 中国水稻科学, 2018, 32(2): 111-118. [11] YANG Y Q, YANG M, LI M H, et al. Cloning and functional analysis of an endo-PG-encoding gene Rrspg1 of Rhizoctonia solani, the causal agent of rice sheath blight[J]. Can J Plant Pathol, 2012, 34(3): 436-447. doi: 10.1080/07060661.2012.709884
[12] 方中达. 植病研究方法[M]. 3版. 北京: 中国农业出版社, 1998: 46. [13] CHEN J, WANG C, SHU C, et al. Isolation and characterization of a melanin from Rhizoctonia solani, the causal agent of rice sheath blight[J]. Eur J Plant Pathol, 2015, 142(2): 281-290. doi: 10.1007/s10658-015-0612-0
[14] MOROMIZATO Z, MATSUYAMA N, WAKIMOTO S. The effect of amino acids on sclerotium formation of Rhizoctonia solani Kühn (AG-1) I: Inhibition of sclerotial formation by various amino acids[J]. Jap J Plant Pathol, 1980, 46(1): 15-20.
[15] 沈会芳, 周而勋, 戚佩坤. 化学肥料对水稻纹枯病菌菌丝生长和菌核形成的影响[J]. 华南农业大学学报, 2002, 23(2): 94. doi: 10.3969/j.issn.1001-411X.2002.02.029 [16] 刘力, 葛起新. 立枯丝核菌融合群对四种微量元素敏感性的研究[J]. 植物病理学报, 1988, 18(3): 175-178. [17] ENGLANDER C M, CORDEN M E. Stimulation of mycelial growth of Endothia parasitica by heavy metals[J]. Appl Microbiol, 1971, 22(6): 1012-1016. doi: 10.1128/AEM.22.6.1012-1016.1971
[18] 刘杏忠, 沈崇尧, 裘维蕃. 重金属离子对一些水霉的毒性[J]. 植物病理学报, 1989, 19(3): 173-177. doi: 10.3321/j.issn:0412-0914.1989.03.002 [19] 沈会芳, 周而勋, 戚佩坤. 金属离子对水稻纹枯病菌菌丝生长和菌核形成的影响[J]. 华南农业大学学报, 2002, 23(1): 38-40. doi: 10.3969/j.issn.1001-411X.2002.01.011 [20] WANG C, PI L, JIANG S, et al. ROS and trehalose regulate sclerotial development in Rhizoctonia solani AG-1 IA[J]. Fungal Biol, 2018, 122(5): 322-332. doi: 10.1016/j.funbio.2018.02.003
[21] GEORGIOU C D, ZEES A. Lipofuscins and sclerotial differentiation in phytopathogenic fungi[J]. Mycopathologia, 2002, 153(4): 203-208. doi: 10.1023/A:1014988419357
[22] GEORGIOU C D. Lipid peroxidation in Sclerotium rolfsii: A new look into the mechanism of sclerotial biogenesis in fungi[J]. Mycol Res, 1997, 101(4): 460-464. doi: 10.1017/S0953756296002882
[23] LU L, SHU C, LIU C, et al. The impacts of natural antioxidants on sclerotial differentiation and development in Rhizoctonia solani AG-1 IA[J]. Eur J Plant Pathol, 2016, 146(4): 729-740. doi: 10.1007/s10658-016-0953-3
[24] 张传玉, 张执金, 黄荣峰, 等. 水稻品种中VC含量及抗氧化性的比较分析[J]. 中国农业科技导报, 2011, 13(6): 6-11. doi: 10.3969/j.issn.1008-0864.2011.06.02 [25] GEORGIOU C D, ZERVOUDAKIS G, PETROPOULOU K P. Ascorbic acid might play a role in the sclerotial differentiation of Sclerotium rolfsii[J]. Mycologia, 2003, 95(2): 308-316. doi: 10.1080/15572536.2004.11833115
[26] ABDEL-MOTAAL F F, EL-ZAYAT S A, KOSAKA Y, et al. Antifungal activities of hyoscyamine and scopolamine against two major rice pathogens: Magnaporthe oryzae and Rhizoctonia solani[J]. J Gen Plant Pathol, 2010, 76(2): 102-111. doi: 10.1007/s10327-010-0225-6




 下载:
下载: