Research on the index system of cultivated land quality grading based on random forest algorithm
-
摘要:目的
分析研究区域内的耕地质量差异,优化耕地利用与布局,为耕地保护提供参考依据。
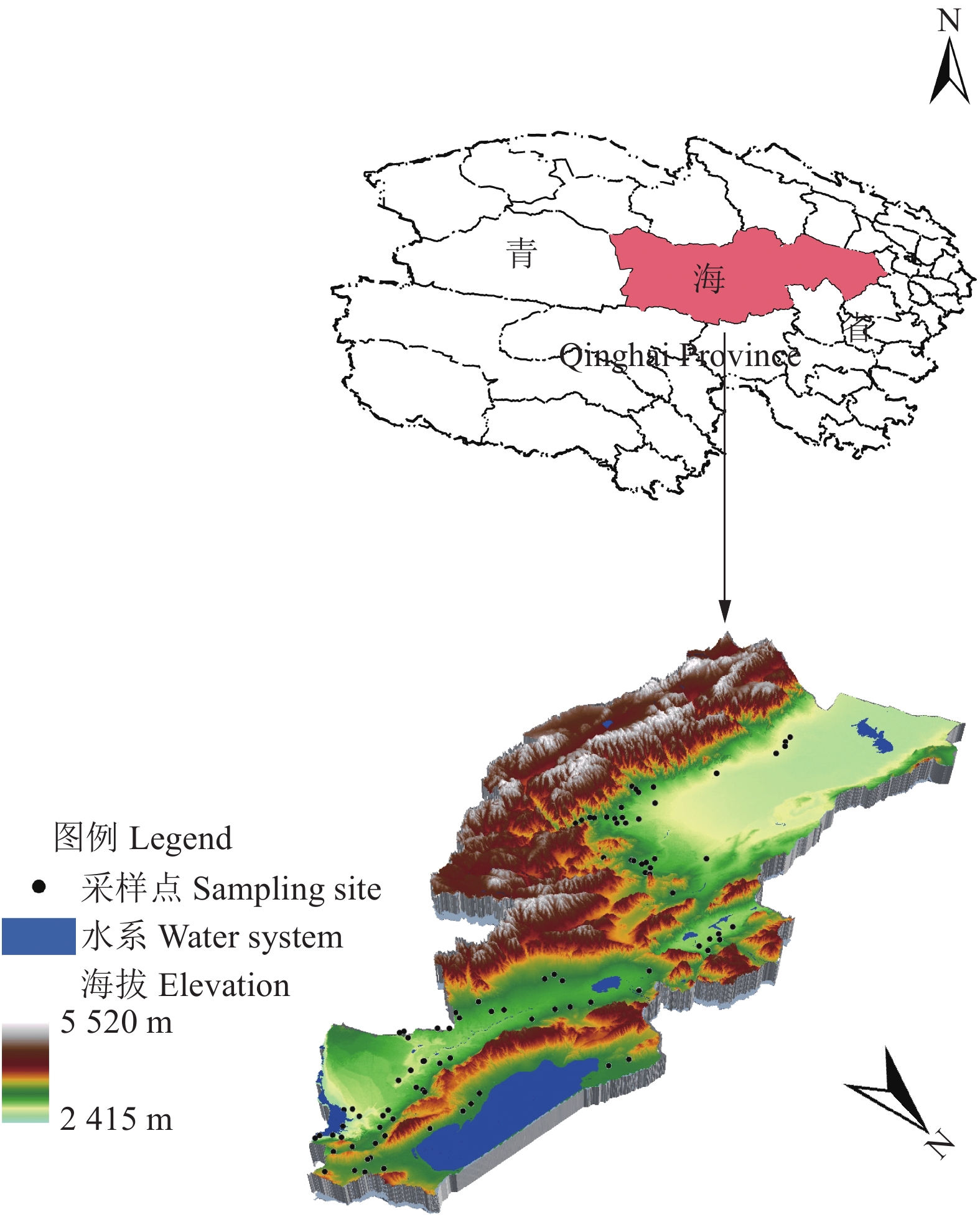
方法以青海省共和县、都兰县和乌兰县的耕地为研究对象,根据历史及现有文献收集耕地质量的影响因素,采用随机森林算法和相关性分析筛选定级指标并确认权重,通过加权求和法计算定级指数并划分级别,得到定级结果。与常用的特尔菲法定级成果进行比较分析。
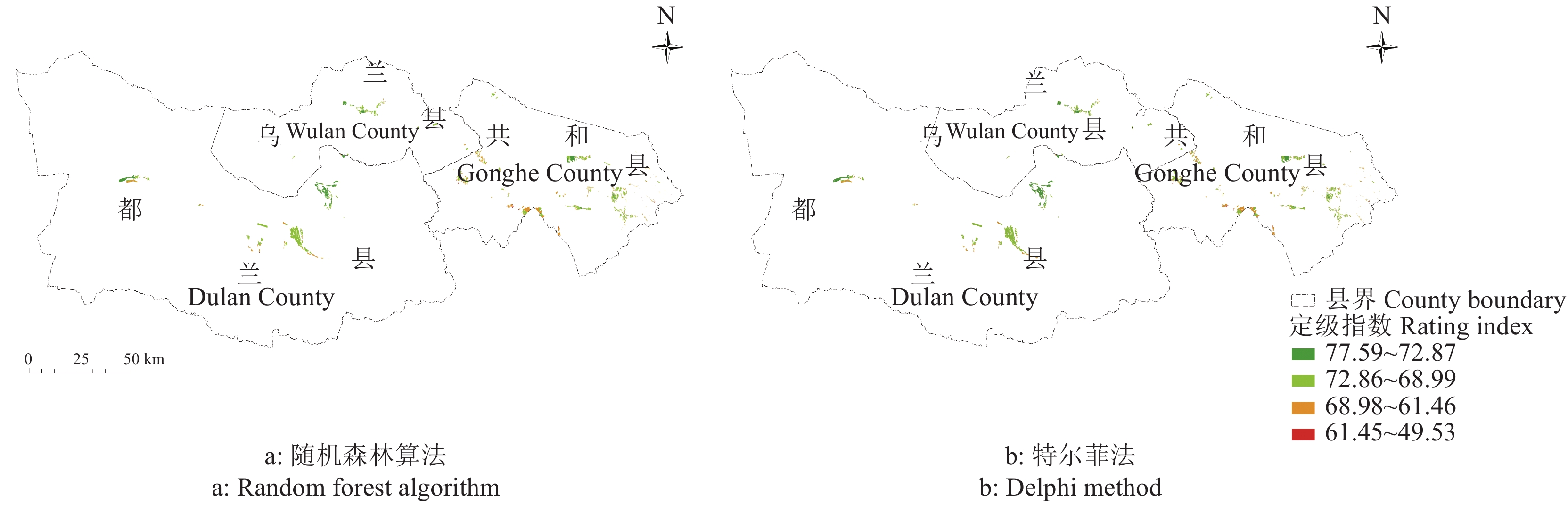
结果随机森林算法得到的变量重要性(I)范围在0.03~11.94,相关性分析结果显示,大部分影响因素间相关性不显著,有8个为显著相关,综合I值和相关性分析结果将30个影响因素收敛为4个纬度下的14个定级指标,其中影响研究区域耕地质量的主要因素为生态系统脆弱性、生长季平均降水和年总太阳辐射量,权重分别为0.11、0.10和0.09,随机森林算法评价结果与实际情况相符。
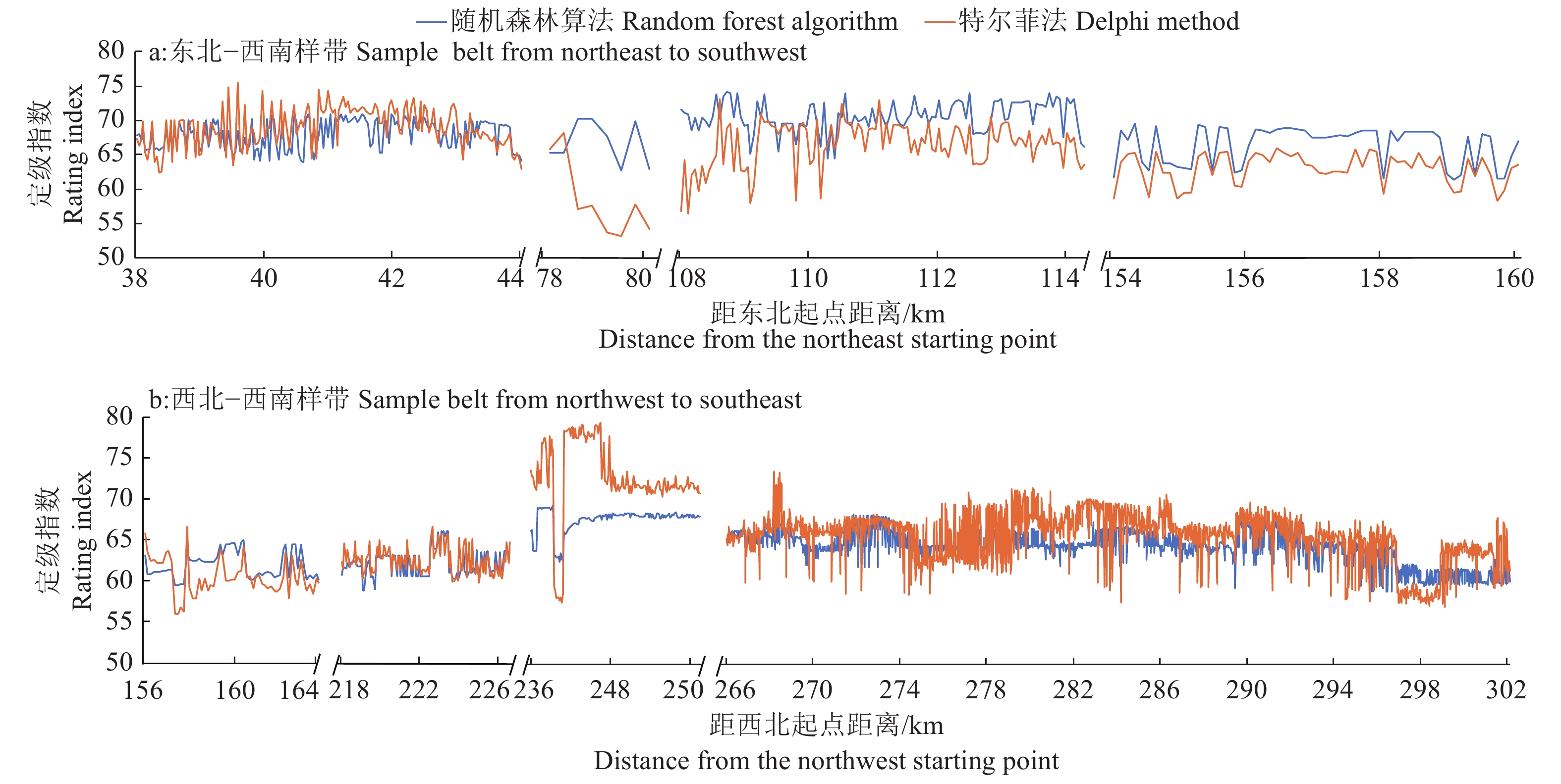
结论与常用的特尔菲法比较,随机森林算法稳定性更好,级别指数变幅区间更小,更有利于构建省级空间尺度的耕地级别可比序列。
Abstract:ObjectiveTo analyze the difference of cultivated land quality in the study region, optimize the use and layout of cultivated land, and provide a reference for cultivated land protection.
MethodTaking the cultivated land in Gonghe County, Dulan County and Wulan County in Qinghai Province as the research object, the influencing factors of cultivated land quality were collected based on the history and existing literature, and the random forest algorithm and correlation analysis were used to screen the grading indicators and confirm the weight. We calculated the grading index and divided the levels by weighted sum method to get the grading result. We compared the results with the grading results of commonly used Delphi method.
ResultThe value of variable importance I obtained by random forest algorithm ranged from 0.03 to 11.94. Correlation analysis showed that the correlation between most influencing factors was not significant, eight of which were significant correlation. The 14 rating indicators under four dimensions were astringed from 30 influencing factors. The main factors influencing the quality of cultivated land in the study area were ecosystem vulnerability, mean precipitation of growing season and annual solar radiation amount, with the weights of 0.11, 0.10 and 0.09, respectively.
ConclusionCompared with Delphi method, the random forest algorithm has better stability and smaller level of index variation interval, which is more conducive to construct a comparable sequence of cultivated land levels at provincial spatial scale.
-
植物固着生长在不断变化的环境中,不能通过移动来规避周围不良环境,需要根据环境灵活地调整自身生长状况进行应对。植物通过多种复杂的机制感知各种环境因素,并做出相应的反应,已经确定多种转录因子、转运蛋白等分子成分参与植物的胁迫响应[1-2]。在响应环境变化时,植物可以通过染色质结构的变化(包括DNA甲基化、组蛋白修饰、组蛋白变体、染色质重塑、非编码RNA等)来调控不同的生物学进程,从而适应外界环境的变化[3-4]。
H3K27me3是一种重要的组蛋白修饰,是一种抑制性的表观遗传标记,由Polycomb repressive complex 2(PRC2)复合物催化建立[5]。PRC2属于多梳家族蛋白(Polycomb group, PcG),PcG在表观遗传的调控方面起重要的作用,其最先在果蝇中被发现,参与许多重要的细胞活动和发育过程,具体包括干细胞多能性和可塑性、基因组印迹、X染色体失活等多种表观遗传过程[6-8]。在果蝇中PRC2的核心组分是一个含有SET结构域的甲基转移酶E[z](Enhancer of zeste),具有催化H3K27me3建立的活性[5]。
PRC2在果蝇、哺乳动物和植物中高度保守[9],拟南芥中存在和果蝇PRC2复合物核心亚基高度相似的蛋白,其中CURLY LEAF(CLF)、MEDEA (MEA)、SWINGER(SWN)是E[z]的同源蛋白[10-12]。在拟南芥生长发育过程中PRC2对调控基因的表达至关重要,涉及从种子萌发到胚形成的整个生命周期[13]。CLF和SWN主要在营养期起作用,而MEA主要在生殖期起作用[9, 13]。
拟南芥中CLF蛋白是PRC2蛋白复合物的重要组分,是H3K27me3甲基转移酶,CLF的突变会使H3K27me3的水平降低[14]。CLF影响植物叶片、花序、种子和根的发育,具体表现为:clf突变体叶片窄小而卷曲,叶片的细胞伸长长度和细胞数量显著减少[10, 15];萼片弯曲不足,不能包裹花蕾,导致早花表型,在短日照条件下开花时间比野生型早约3周,在长日照条件下开花时间比野生型早约2 d[10];种子更大,含油量更高[16-17];主根长度伸长,侧根的数目增加[18]。CLF影响拟南芥生长发育过程的多个方面,调控植物的多种性状。
温度是控制植物生长发育、分布和季节行为的关键因素,植物的整个生命周期都受到环境温度的影响,植物通过优化生长发育,不断适应自然季节温度的变化[19]。植物对温度非常敏感,甚至能感知到1 ℃的温差[20]。极端高温和低温都会对拟南芥的生长造成胁迫,导致生长缓慢、形态异常、种子产量降低[21]。在温和高温条件下,拟南芥表现出早花、下胚轴伸长、叶柄伸长、叶片变薄等性状[22];而在温和低温条件下,拟南芥表现出晚花、下胚轴变短等表型[20, 23]。本研究通过在不同温度条件(16、22 ℃)下,对野生型与clf-29突变体进行表型分析和差异表达基因分析,探索拟南芥表观遗传调控因子CLF在响应环境温度和温度形态建成中的作用。
1. 材料与方法
1.1 供试材料与引物设计
本研究使用的拟南芥植株为哥伦比亚(Col-0)生态型,其中clf-29(SALK_021003)为T-DNA插入突变体,鉴定突变体和RT-qPCR验证所需的引物见表1。
表 1 本研究用到的引物Table 1. Primers used in this study用途
Usage名称
Name序列
Sequence基因分型
Genotypingclf-29-BP 5′-ATTTTGCCGATTTCGGAAC-3′ clf-29-LP 5′-AAGAAACTTGCTAGTTCCGCC-3′ clf-29-RP 5′-GAGGCATTGACTTTGATTTGC-3′ RT-qPCR SUS1-F 5′-GGCTAGGCTTGATCGTGTCA-3′ SUS1-R 5′-GATCCACCTGAACTGACCGT-3′ LHCA1-F 5′-CAGTCCCGTGGGGTACTTTG-3′ LHCA1-R 5′-GCCGCCCGTTCTTGATCTC-3′ B1L-F 5′-AATCTCCGATGGACCGTTTGA-3′ B1L-R 5′-AGAGCTTTCTTAGCTCGCCG-3′ DIN10-F 5′-CGCTTTCTGATCTTGGAAATCGC-3′ DIN10-R 5′-ACACCGGTTAGAATCGTCCG-3′ ACTIN 2-F 5′-AGTGTTAGCTGCTGCCGCTGT-3′ ACTIN 2-R 5′-ACCAGCAAAACCAGCCTTCACCA-3′ 1.2 拟南芥生长条件和表型观察
拟南芥种子先用75%(φ)乙醇溶液消毒12 min,再用95%(φ)乙醇溶液继续消毒10 min后,在4 ℃冰箱避光放置2 d,然后在22或16 ℃长日照(16 h光∶8 h暗)条件下生长。22 ℃条件下,取用生长18 d的植株拍摄表型;16 ℃条件下,取用生长36 d的植株拍摄表型。
1.3 RNA-seq文库构建
取0.1~0.2 g植物材料迅速用液氮预冷,于研钵中研磨成粉末后使用植物总RNA提取试剂盒(Tiangen Biotech,Beijing,China)进行RNA提取,每个样品3次重复。链特异性RNA-seq文库的构建参照KAPA stranded mRNA-seq kit(Illumina® Platforms,KR0960-v5.17)进行。构建好的文库进行琼脂糖凝胶电泳,选取250~500 bp的片段进行回收纯化。文库送到上海逆耳生物科技有限公司用Illumina Hiseq 6000测序仪测序,测序模式为双端150 bp。
1.4 RNA-seq数据分析
使用cutadapt(v3.5)去除接头和测序质量低于Q20的碱基[24],再用HISAT2(v2.1.0)将筛选后的reads比对到拟南芥基因组(tair10)[25],通过SAMtools(v1.9)筛选出高比对质量的reads进行后续分析[26]。每个基因的reads数目通过featureCounts(v1.6.2)进行计算[27],并使用R包DESeq2(v1.34.0)以|log2(Fold change,FC)|≥log21.5和P<0.05的条件鉴定差异基因[28]。此外使用deeptools(v3.5.1)的bamCoverage工具将reads进行标准化处理生成bigwig文件[29],并使用IGV(v2.11.2)进行可视化[30]。分析基因的GO功能注释时使用了R包clusterProfiler(v4.2.2)[31]。
1.5 RT-qPCR
取0.1~0.2 g植物材料迅速用液氮预冷,于研钵中研磨成粉末后使用TRIzol(Invitrogen,15596026)进行RNA提取,每个样品3次重复。利用反转录试剂盒(TaKaRa,RR047A)将提取的RNA反转录成cDNA,之后利用设计好的引物(表1)进行RT-qPCR,以ACTIN 2作为内参基因,根据3次生物学重复计算平均值和标准差。
2. 结果与分析
2.1 clf-29突变体在不同温度条件下的表型分析
我们分别在22和16 ℃条件下种植拟南芥Col-0和clf-29突变体,使用三引物法对T-DNA插入材料进行鉴定,PCR结果显示,clf-29仅在T-DNA边界引物+右侧基因组引物(BP+RP)组合中才出现特异性条带,并且未出现Col-0中左侧基因组引物+右侧基因组引物(LP+RP)组合的特异性条带(图1),说明所用植物材料为纯合突变体。
16 ℃条件下,clf-29突变体植株比Col-0稍小,但整体差异不大,叶片正常伸展,略小;而在22 ℃条件下,clf-29突变体与Col-0差异明显,植株更小,叶片卷曲而且显著减小(图2、3a)。无论在22 ℃还是16 ℃,相比Col-0,clf-29突变体都表现为抽苔时间提前和莲座叶数目减少,在16和22 ℃条件下,抽苔时间分别提前6和3 d,叶片数目分别减少4和1片(图3b、3c)。clf-29突变体在不同温度条件下的形态差异,说明CLF参与叶片形态、植株大小等发育进程,暗示CLF参与调控了拟南芥的温度形态建成。
![]() 图 3 Col-0和clf-29在不同温度条件的表型统计图a统计的叶片数量为3片,图b、c统计的植株数量为25株;“*”和“***”分别表示Col-0和clf-29在P < 0.05和P < 0.001水平差异显著(t检验)Figure 3. Phenotypic statistics of Col-0 and clf-29 at different temperaturesThe number of leaves counted in figure a is 3, the number of plants counted in figure b, c is 25; “*” and “***” indicate significant differences at P < 0.05 and P < 0.001 levels between Col-0 and clf-29 respectively (t test)
图 3 Col-0和clf-29在不同温度条件的表型统计图a统计的叶片数量为3片,图b、c统计的植株数量为25株;“*”和“***”分别表示Col-0和clf-29在P < 0.05和P < 0.001水平差异显著(t检验)Figure 3. Phenotypic statistics of Col-0 and clf-29 at different temperaturesThe number of leaves counted in figure a is 3, the number of plants counted in figure b, c is 25; “*” and “***” indicate significant differences at P < 0.05 and P < 0.001 levels between Col-0 and clf-29 respectively (t test)2.2 RNA-seq数据的获取和处理
为了更深刻及全面地了解温度对clf-29突变体形态建成的调控机制,我们进行了高通量RNA-seq测序分析。使用在22 ℃培养箱生长18 d和在16 ℃培养箱生长36 d的整株植物材料进行取样、建库、测序,每个样品各有3次重复。筛选出碱基质量高的reads比对到拟南芥基因组,保留仅比对到染色质且比对质量较高的reads进行后续分析。结果显示,所有样品的原始Reads都在2 000万条以上,比对率都在97%以上,表明所建的RNA-seq文库的数据质量较高(表2)。为确定样品材料无误,查看了CLF基因的转录水平,在clf-29突变体中,CLF的表达量显著下降,而其邻近基因AT2G23370的表达量未受影响,说明试验材料是正确无误的(图4a)。此外转录组数据之间的相关性显示,每个样品的3次重复各自聚在一起,数据有良好的重复性(图4b)。
表 2 RNA-seq数据统计1)Table 2. Statistical analyses of RNA-seq dataθ/ ℃ 样品
SampleNraw Ntrim ηtrim/% Nmap ηmap/% Nfilter ηfilter/% 22 Col-0-1 37 244 778 37 224 204 99.94 36 546 723 98.18 32 101 104 87.84 Col-0-2 22 235 624 22 206 546 99.87 21 582 542 97.19 19 117 943 88.58 Col-0-3 33 187 892 33 167 450 99.94 32 477 567 97.92 22 820 849 70.27 clf-29-1 34956528 34 928 744 99.92 34 052 033 97.49 30 609 312 89.89 clf-29-2 32 170 570 32 138 512 99.90 31 122 935 96.84 27 113 262 87.12 clf-29-3 33 342 874 33 311 222 99.91 32 488 435 97.53 29 058 947 89.44 16 Col-0-1 22 773 106 22 750 524 99.90 22 163 560 97.42 20 064 343 90.53 Col-0-2 28 556 576 28 521 012 99.88 27 642 565 96.92 24 617 366 89.06 Col-0-3 29 554 426 29 506 424 99.84 28 694 997 97.25 26 892 274 93.72 clf-29-1 31 924 456 31 886 896 99.88 30 662 439 96.16 28 160 281 91.84 clf-29-2 34 539 696 34 510 886 99.92 33 692 978 97.63 29 642 353 87.98 clf-29-3 30 517 278 30 473 504 99.86 29 717 761 97.52 25 571 998 86.05 1) Nraw:原始测序的reads数目;Ntrim、ηtrim:除去低质量碱基后的reads数目和对应的比例;Nmap、ηmap:比对到拟南芥基因组的reads数目和对应的比例;Nfilter、ηfilter:比对到拟南芥染色质上且高比对质量的reads数目和对应的比例
1) Nraw: The number of raw reads; Ntrim, ηtrim: The number and corresponding proportion of reads after removing the low quality bases; Nmap, ηmap: The number and corresponding proportion of reads that aligned on Arabidopsi genome; Nfilter, ηfilter: The number and corresponding proportion of reads that aligned on Arabidopsi with high quality2.3 差异表达基因的筛选
为了探究温度对CLF的影响,以|log2FC|≥log21.5和P<0.05为筛选条件,对转录组数据进行差异基因分析。我们鉴定到了Col-0、clf-29各自在16 ℃相较于22 ℃的差异基因,其中Col-0表达上调和下调的基因分别有2 284和1 628个,clf-29突变体分别是2 345和2 077个(图5a、5b),Col-0和clf-29在响应温度变化时改变的基因数目相近。我们还鉴定到了相比于Col-0,clf-29突变体分别在22和16 ℃的差异基因,22 ℃条件下clf-29突变体相比野生型上调801个基因、下调688个基因,而在16 ℃条件下clf-29突变体相比野生型上调574个基因、下调1 012个基因(图5c、5d),说明CLF的缺失会导致大量基因异常表达。
将Col-0在16、22 ℃的差异基因和clf-29在16、22 ℃的差异基因做交集。结果发现,对于上调基因,两者的交集是1 326个基因,仅在Col-0的是958个基因,仅在clf-29的是1 019个基因;对于下调基因,两者的交集是919个基因,仅在Col-0的是709个基因,仅在clf-29的是1 158个基因(图6a、6b)。在不同温度条件下,Col-0和clf-29有很多基因是共同改变的(图7),而那些仅在Col-0或者仅在clf-29变化的基因更为重要。我们对这些基因进行GO富集分析,发现仅在Col-0上调的基因更多地富集在环境响应、物质转运等途径(图8a);仅在clf-29上调的基因主要富集在响应刺激、激素运输、细胞壁生长等途径(图8b);仅在Col-0下调的基因富集在物质合成、物质代谢等途径(图8c);仅在clf-29下调的基因富集在刺激响应、合成代谢调控等途径(图8d)。
2.4 温度响应基因的改变
温度的变化造成了clf-29突变体的不同表型,因此我们找到了上述4类差异表达基因(图6),相比于22 ℃,在16 ℃条件下在Col-0显著上调而在clf-29中未显著上调的,称之为Col-0上调,同样得到了clf-29上调、Col-0下调、clf-29下调,通过GO注释在这4类基因中寻找与温度响应相关的基因进行分析。有19个基因仅在Col-0上调表达,有14个基因仅在clf-29上调表达(图9a);仅在Col-0下调的是26个基因,仅在clf-29下调的是37个基因(图9b)。在这4类基因中各选取特定基因SUCROSE SYNTHASE 1(SUS1)、PHOTOSYSTEM Ⅰ LIGHT HARVESTING COMPLEX GENE 1(LHCA1)、BYPASS1-LIKE(B1L)、DARK INDUCIBLE 10 (DIN10)进行RT-qPCR验证(材料情况与构建RNA-seq文库一致),相比于clf-29,SUS1在Col-0上调更加显著,与之类似,LHCA1在clf-29上调更加显著,B1L在Col-0、DIN10在clf-29的下调程度更高(图10),这与热图结果基本一致。Col-0材料在12 ℃处理1、3、5、10 h后LHCA1表达量上升,处理24 h后表达量下降[32],我们的结果与短时间处理一致;Col-0材料在4 ℃处理1、3、6、12 h后B1L表达量上升[33],处理24 h后表达量下降,我们的结果与处理24 h一致。我们的结果与其他已发表文章结果的差异,可能是处理温度与处理时间都存在差别而共同导致的。综上,CLF的缺失造成了大量温度响应基因表达改变,造成一系列的表型差异,证明了CLF在不同温度条件下调控生长发育的重要作用。
3. 讨论与结论
拟南芥中的CLF是PRC2复合物的重要亚基,是H3K27me3甲基转移酶,CLF蛋白结构保守,在多种植物如水稻、番茄中都报道过CLF的同源蛋白[34-35]。CLF调控植物生长发育的多个阶段,在拟南芥中鉴定到6 854个H3K27me3富集的基因,这些基因都是潜在的CLF可以调控的靶基因,涉及多种生长发育、响应刺激相关的通路,暗示CLF对植物的正常生长起至关重要的作用[14]。本研究发现不同温度条件下clf-29突变体的形态建成存在差异,并且找到了多类可能导致表型差异的重要基因,其中仅在Col-0响应而在clf-29突变体未响应的基因说明CLF的缺失使突变体无法正常发挥功能,仅在clf-29响应的差异基因说明缺失CLF使其产生了更多的变化,并找到了多个和温度相关的基因,其发生明显的表达变化,这些结果说明CLF是参与拟南芥温度形态建成的重要表观调控因子。
不同温度条件下clf-29突变体的形态差异,极有可能是因为在不同温度下CLF介导的H3K27甲基化在基因组上的不同丰度造成的。温度是一种重要的环境影响因子,低温会影响拟南芥H3K27me3的富集。在低温条件(4 ℃)下,低温响应基因COR15A和ATGOLS3的H3K27me3水平会降低从而导致基因表达的变化[36-37]。温度变化也可以通过改变开花抑制基因FLOWERING LOCUS C(FLC)的H3K27me3水平来调控FLC的活性,从而调控植物开花时间[38-39]。然而温度如何影响甲基转移酶CLF介导的H3K27甲基化的分布,是需要进一步探索的问题。
除了H3K27甲基化以外,其他的表观遗传标记也参与植物对环境温度的适应性调控,当植物生长环境的温度较低时,组蛋白变体H2A.Z会富集在DNA上,抑制基因的表达,当温度升高时,H2A.Z富集程度降低,使基因正常表达[20]。因此,在不同温度条件下,H3K27me3与其他的表观遗传标记会产生怎样的偶联反应也是值得深思和深入探究的问题。
-
表 1 研究区域调查样点产量数据
Table 1 Yield information of investigation plot in research area
耕地类型
Type of cultivated land耕地数量/块
Amount of cultivated land耕地密度/(块·hm−2)
Density of cultivated land产量/(kg·hm−2)
Yield最大值 Max. 最小值 Min. 平均值 Mean 旱地 Rainfed cropland 20 306.26 3 840 1 980 2 671.50 水浇地 Irrigable cropland 77 556.42 9 375 2 100 5 296.35 总计 Total 97 512.78 9 375 1 980 4 755.15 表 2 影响耕地质量的因素
Table 2 Factors impacting the quality of cultivated land
类别
Classification影响因素
Impact factor类别
Classification影响因素
Impact factor自然因素
Natural factor生长季均温
Mean temperature of growing season社会经济因素
Socioeconomic factor林网化程度
Degree of forestation生长季降水量
Mean precipitation of growing season耕作距离
Cultivation distance年总太阳辐射量
Annual solar radiation amount农田路网密度
Farmland road network density海拔高度
Elevation田块形状
Field shape地形坡度
Topographic slope田块大小
Field size有效土层厚度
Effective soil thickness农田破碎度
Farmland fragmentation degree表层土壤质地
Surface soil texture利用现状
Utilization status砾石含量
Gravel content区位因素
Location factor城镇影响度
Urban influence degree土壤有机质含量
Soil organic matter content农贸市场影响度
Agricultural market influence degree土壤酸碱度
Soil pH道路通达度
Road accessibility degree灌溉保证率
Irrigation guarantee rate对外交通便利度
External traffic convenience degree灌溉水质量
Irrigation water quality工程因素
Engineering factor灌溉排水工程
Irrigation drainage project生态因素
Ecological factor自然灾害危险性
Natural disaster risk道路工程
Road construction project生态系统脆弱性
Ecosystem vulnerability农田防护林工程
Farmland protective forest project水土流失状况
Soil erosion condition土地平整工程
Land leveling project表 3 采用特尔菲法的定级指标体系
Table 3 Grading indicators system using Delphi method
一级 Primary level 二级 Secondary level 定级 Grading level 一级指标
Primary indicator权重
Weight二级指标
Secondary indicator权重
Weight定级指标
Grading indicator权重
Weight生态因素
Ecological factor0.19 生态状况
Ecological condition0.19 生态系统脆弱性
Ecosystem vulnerability0.02 自然灾害危险性 Natural disaster risk 0.08 水土流失状况 Soil erosion condition 0.09 自然因素
Natural factor0.48 气候状况
Climate condition0.16 生长季平均温度
Mean temperature of growing season0.06 生长季平均降水
Mean precipitation of growing season0.08 年总太阳辐射量
Annual solar radiation amount0.02 地形状况
Terrain condition0.08 海拔高度 Elevation 0.03 地形坡度 Topographic slope 0.04 砾石含量 Gravel content 0.01 土壤条件
Soil condition0.22 有效土层厚度 Effective soil thickness 0.06 表层土壤质地 Surface soil texture 0.06 土壤酸碱度 Soil pH 0.03 土壤有机质含量
Soil organic matter content0.07 水资源状况
Water resources condition0.02 灌溉水质量
Irrigation water quality0.02 社会经济因素
Socioeconomic factor0.09 基础设施条件
Infrastructure condition0.04 农田路网密度
Farmland road network density0.01 林网化程度 Degree of forestation 0.01 农田破碎度
Farmland fragmentation degree0.01 灌溉保证率 Irrigation guarantee rate 0.01 续表 3 Continued table 3 一级 Primary level 二级 Secondary level 定级 Grading level 一级指标
Primary indicator权重
Weight二级指标
Secondary indicator权重
Weight定级指标
Grading indicator权重
Weight耕作条件
Cultivating condition0.03 耕作距离 Cultivation distance 0.01 田块形状 Field shape 0.01 田块大小 Field size 0.01 土地利用状况
Land use status0.02 利用现状
Utilization status0.02 区位因素
Location factor0.20 区位条件
Locational condition0.11 城镇影响度 Urban influence degree 0.06 农贸市场影响度
Agricultural market influence degree0.05 交通条件
Traffic condition0.09 道路通达度 Road accessibility degree 0.05 对外交通便利度
External traffic convenience degree0.04 工程因素
Engineering factor0.04 工程建设状况
Construction condition0.04 灌溉排水工程
Irrigation drainage project0.01 农田防护林工程
Farmland protective forest project0.01 道路工程 Road construction project 0.01 土地平整工程 Land leveling project 0.01 表 4 随机森林算法对影响因素的变量重要性(I)排序
Table 4 Variable importance (I) ranking of impact factors by random forest algorithm
影响因素 Impact factor I 影响因素 Impact factor I 生态系统脆弱性 Ecosystem vulnerability 11.94 灌溉保证率 Irrigation guarantee rate 4.74 生长季降水量 Mean precipitation of growing season 10.63 有效土层厚度 Effective soil thickness 4.65 自然灾害危险性 Natural disaster risk 10.01 灌溉排水工程 Irrigation drainage project 4.58 年总太阳辐射 Annual solar radiation 9.08 表层土壤质地 Surface soil texture 4.50 土壤酸碱度 pH 8.54 海拔高度 Elevation 3.85 灌溉水质量 Irrigation water quality 7.94 农田路网密度 Farmland road network density 3.85 对外交通便利度 External traffic convenience 7.60 道路工程 Road construction project 3.63 地形坡度 Slope 7.47 利用现状 Utilization status 3.61 生长季均温 Mean temperature of growing season 6.82 砾石含量 Gravel content 3.38 农田破碎度 Farmland fragmentation 6.75 农田防护林工程 Protective forest project 2.85 城镇影响度 Urban influence 6.14 林网化程度 Degree of forestation 2.62 农贸市场影响度 Agricultural market influence 6.10 道路通达度 Road accessibility 2.57 土壤有机质含量 Soil organic matter 5.79 土地平整工程 Land leveling project 2.01 水土流失状况 Soil erosion condition 5.73 田块大小 Field size 1.02 耕作距离 Cultivation distance 5.70 田块形状 Field shape 0.03 表 5 显著相关影响因素的相关系数1)
Table 5 Correlation coefficients matrix of significantly related impact factors
影响因素 Impact factor Y1 Y2 Y3 Y4 Y5 Y6 Y7 Y8 Y1 1 Y2 0.790** 1 Y3 0.254* 0.310** 1 Y4 −0.278* −0.150* 0.957** 1 Y5 0.132* 0.119* 0.243* −0.251* 1 Y6 0.142* 0.156* 0.222* −0.258* 0.856** 1 Y7 0.140* 0.177* 0.278* −0.262* 0.905** 0.986** 1 Y8 0.190* 0.104* 0.189* −0.247* 0.851** 0.969** 0.982** 1 1)Y1:表层土壤质地;Y2:砾石含量;Y3:自然灾害危险性;Y4:生态系统脆弱性;Y5:灌溉排水工程;Y6:道路工程;Y7:农田防护林工程;Y8:土地平整工程;“*”和“**”分别表示在0.05和0.01水平显著相关(Pearson法)
1)Y1: Surface soil texture; Y2: Gravel content; Y3: Natural disaster risk; Y4: Ecosystem vulnerability; Y5: Irrigation drainage project; Y6: Road construction project; Y7: Farmland protective forest project; Y8: Land leveling project; “*” and “**” indicate significant correlation at 0.05 and 0.01 levels, respectively(Pearson method)表 6 耕地质量定级指标体系
Table 6 The index system of cultivated land quality grading
一级 Primary level 二级 Secondary level 定级 Grading level 一级指标
Primary indicator权重
Weight二级指标
Secondary indicator权重
Weight定级指标
Grading indicatorI 权重
Weight生态因素
Ecological factor0.16 生态状况
Ecological condition0.16 生态系统脆弱性
Ecosystem vulnerability11.94 0.11 水土流失状况
Soil erosion condition5.73 0.05 自然因素
Natural factor0.53 气候状况
Climate condition0.25 生长季平均温度
Mean temperature of growing season6.82 0.06 生长季平均降水
Mean precipitation of growing season10.63 0.10 年总太阳辐射量
Annual solar radiation amount9.08 0.09 地形状况
Terrain condition0.07 地形坡度 Topographic slope 7.47 0.07 土壤条件
Soil condition0.14 土壤有机质含量
Soil organic matter content5.79 0.08 土壤酸碱度 pH 8.54 0.06 水资源状况
Water resources condition0.07 灌溉水质量 Irrigation water quality 7.94 0.07 社会经济因素
Socioeconomic factor0.12 基础设施条件
Infrastructure condition0.06 农田破碎度
Farmland fragmentation degree6.75 0.06 耕作便利条件
Cultivating condition0.06 耕作距离 Cultivation distance 5.70 0.06 区位因素
Location factor0.19 区位条件
Locational condition0.12 城镇影响度 Urban influence degree 6.14 0.06 农贸市场影响度
Agricultural market influence degree6.10 0.06 交通条件
Traffic condition0.07 对外交通便利度
External traffic convenience degree7.60 0.07 -
[1] 吴大放, 刘艳艳, 董玉祥, 等. 我国耕地数量、质量与空间变化研究综述[J]. 热带地理, 2010, 30(2): 108-113. doi: 10.3969/j.issn.1001-5221.2010.02.002 [2] 温良友, 孔祥斌, 辛芸娜, 等. 对耕地质量内涵的再认识[J]. 中国农业大学学报, 2019, 24(3): 156-164. [3] 张超, 乔敏, 郧文聚, 等. 耕地数量、质量、生态三位一体综合监管体系研究[J]. 农业机械学报, 2017, 48(1): 1-6. doi: 10.6041/j.issn.1000-1298.2017.01.001 [4] 刘兴华, 孙鹏举, 刘学录. 甘肃省临夏县耕地资源社会保障价值测算[J]. 干旱区资源与环境, 2013, 27(1): 53-57. [5] 中华人民共和国国土资源部. 农用地定级规程: GB/T 28405—2012 [S]. 北京: 中国标准出版社, 2012. [6] 高中贵, 彭补拙. 我国农用地分等定级研究综述[J]. 经济地理, 2004, 24(4): 514-519. doi: 10.3969/j.issn.1000-8462.2004.04.020 [7] 金东海, 许皞, 秦文利. 基于分等成果的农用地定级新方法:两层七参数法[J]. 中国土地科学, 2004, 18(6): 34-39. doi: 10.3969/j.issn.1001-8158.2004.06.007 [8] 鲁明星, 贺立源, 吴礼树. 我国耕地地力评价研究进展[J]. 生态环境, 2006, 8(4): 866-871. [9] 冯超. 中国谷物产出的"面积− 质量"导向因素分析[J]. 干旱区资源与环境, 2015, 29(8): 7-13. [10] 沈仁芳, 陈美军, 孔祥斌, 等. 耕地质量的概念和评价与管理对策[J]. 土壤学报, 2012, 49(6): 1210-1217. doi: 10.11766/trxb201208130319 [11] 张凤荣, 安萍莉, 王军艳, 等. 耕地分等中的土壤质量指标体系与分等方法[J]. 资源科学, 2002, 24(2): 71-75. doi: 10.3321/j.issn:1007-7588.2002.02.014 [12] 付国珍, 摆万奇. 耕地质量评价研究进展及发展趋势[J]. 资源科学, 2015, 35(2): 226-236. [13] 盛艳, 姚云峰, 秦富仓, 等. 基于GIS的耕地地力等级划分研究[J]. 干旱区资源与环境, 2014, 28(6): 27-32. [14] 马瑞明, 马仁会, 韩冬梅, 等. 基于多层级指标的省域耕地质量评价体系构建[J]. 农业工程学报, 2018, 34(16): 249-257. doi: 10.11975/j.issn.1002-6819.2018.16.032 [15] 杜国明, 刘彦随, 于凤荣, 等. 耕地质量观的演变与再认识[J]. 农业工程学报, 2016, 32(14): 243-249. [16] 马昊翔, 陈长成, 宋英强, 等. 青海省近10年草地植被覆盖动态变化及其驱动因素分析[J]. 水土保持研究, 2018, 25(6): 137-145. [17] 保广裕, 张静, 周丹, 等. 青海省太阳辐射强度时空变化特征分析[J]. 冰川冻土, 2017, 39(3): 563-571. [18] 樊杰. 中国主体功能区划方案[J]. 地理学报, 2015, 70(2): 186-201. doi: 10.11821/dlxb201502002 [19] BREIMAN L. Random forests[J]. Machine Learning, 2001, 45(1): 5-32. doi: 10.1023/A:1010933404324
[20] CHEN X W, LIU M. Prediction of protein-protein interactions using random decision forest framework[J]. Bioinformatics, 2005, 21(24): 4394-4400. doi: 10.1093/bioinformatics/bti721
[21] WARD M M, PAJEVIC S, DREYFUSS J, et al. Short-term prediction of mortality in patients with systemic lupus erythematosus: Classification of outcomes using random forests[J]. Arthrit Rheumat, 2006, 55(1): 74-80. doi: 10.1002/art.21695
[22] OPARIN I, GLEMBEK O, BURGET L, et al. Morphological random forests for language modeling of inflectional languages[C/OL]//IEEE. 2008 IEEE Spoken Language Technology Workshop. Goa: IEEE, 2008: 189-192. [2019-08-25]. https://www.infona.pl/resource/bwmeta1.element.ieee-art-000004777872/tab/summary. doi: 10.1109/SLT.2008.4777872.
[23] ZHANG M, ZHANG H, WU P, et al. Prediction of soil organic carbon in an intensively managed reclamation zone of eastern China: A comparison of multiple linear regressions and the random forest model[J]. Sci Total Environ, 2017, 592: 704-713. doi: 10.1016/j.scitotenv.2017.02.146
[24] 方匡南, 朱建平, 谢邦昌. 基于随机森林方法的基金收益率方向预测与交易策略研究[J]. 经济经纬, 2010, 27(2): 61-65. doi: 10.3969/j.issn.1006-1096.2010.02.015 [25] 董师师, 黄哲学. 随机森林理论浅析[J]. 集成技术, 2013, 2(1): 1-7. [26] 张雷, 王琳琳, 张旭东, 等. 随机森林算法基本思想及其在生态学中的应用:以云南松分布模拟为例[J]. 生态学报, 2014, 24(3): 650-659. [27] 刘斌, 郭星, 朱宇恩. 基于随机森林模型的土壤重金属源解析:以晋中盆地为例[J]. 干旱区资源与环境, 2019, 33(1): 106-111. [28] 马玥, 姜琦刚, 孟治国, 等. 基于随机森林算法的农耕区土地利用分类研究[J]. 农业机械学报, 2016, 47(1): 297-303. doi: 10.6041/j.issn.1000-1298.2016.01.040 [29] ZHU Z, WOODCOCK C E, ROGAN J, et al. Assessment of spectral, polarimetric, temporal, and spatial dimensions for urban and peri-urban land cover classification using Landsat and SAR data[J]. Rem Sens Environ, 2012, 117: 72-82. doi: 10.1016/j.rse.2011.07.020
[30] VAN BEIJMA S, COMBER A, LAMB A. Random forest classification of salt marsh vegetation habitats using quad-polarimetric airborne SAR, elevation and optical RS data[J]. Rem Sens Environ, 2014, 149: 118-129. doi: 10.1016/j.rse.2014.04.010
[31] LIAW A, WIENER M. Classification and regression by random forest[J]. R News, 2002, 2(3): 18-22.
[32] 刘欢, 吴克宁, 宋文, 等. 耕地质量定级方法改进研究:以农安县为例[J]. 北京师范大学学报(自然科学版), 2018, 54(3): 315-320. [33] 赵璐, 郑新奇, 闫弘文, 等. 基于地统计学的县域农用地定级方法[J]. 农业工程学报, 2008, 24(S1): 99-103. [34] 黄居茂. 青海省农作物生产发展的科学技术探讨[J]. 青海农林科技, 1984, 14(4): 18-26. [35] 朱文江, 康素珍. 柴达木盆地春小麦高产的气候因素[J]. 中国农业科学, 1978, 19(2): 51-56. [36] 张玮, 李江. 青海省菜田盐渍化形成及治理[J]. 青海农技推广, 2015, 20(2): 32-33. doi: 10.3969/j.issn.1008-7117.2015.02.012



 下载:
下载: