Effect of dietary supplementation of fish oil on intestinal barrier function in mouse fed with high-fat diet
-
摘要:目的
研究日粮添加鱼油对高脂日粮饲喂小鼠肠道屏障功能的影响。
方法选用36只4周龄C57BL/6J雌性小鼠,随机分为对照组、高脂组、高脂+鱼油组,每组12只小鼠,分别饲喂基础日粮、高脂日粮、高脂日粮添加质量分数为5%的鱼油(等能替换高脂日粮中脂肪)。试验持续21周,每周测定小鼠采食量和体质量,期间测定小鼠肠道通透性以及粪便粗脂肪含量和能值;试验结束后,检测小鼠血清内毒素水平,检测小鼠肠道形态、杯状细胞的数量、肠道紧密连接蛋白和炎症因子的表达。
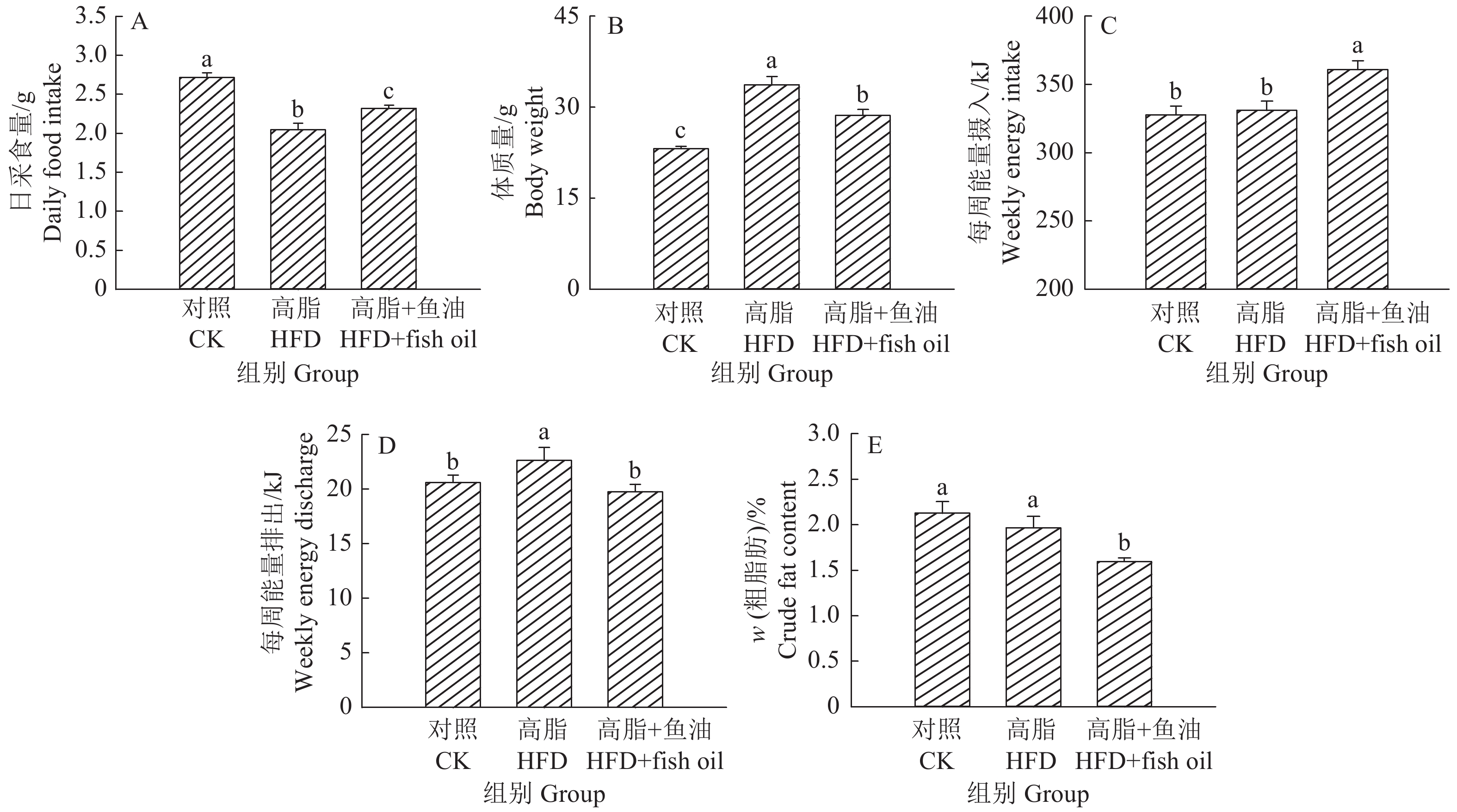
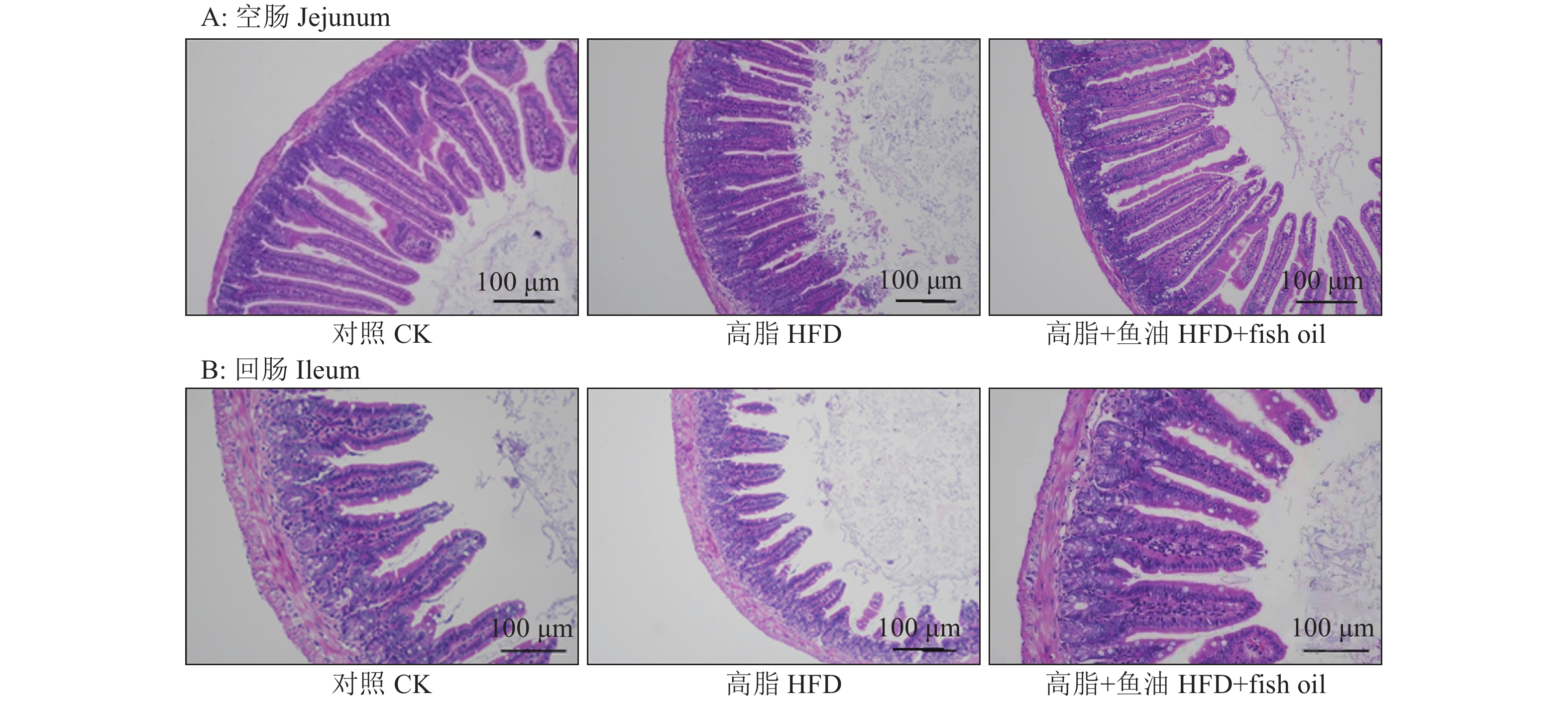
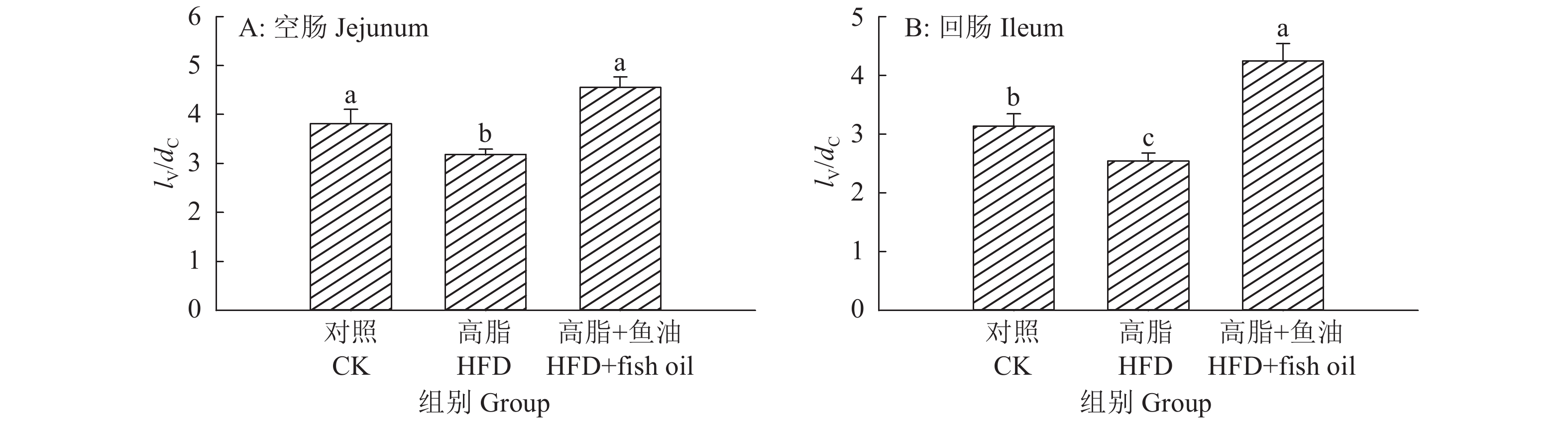
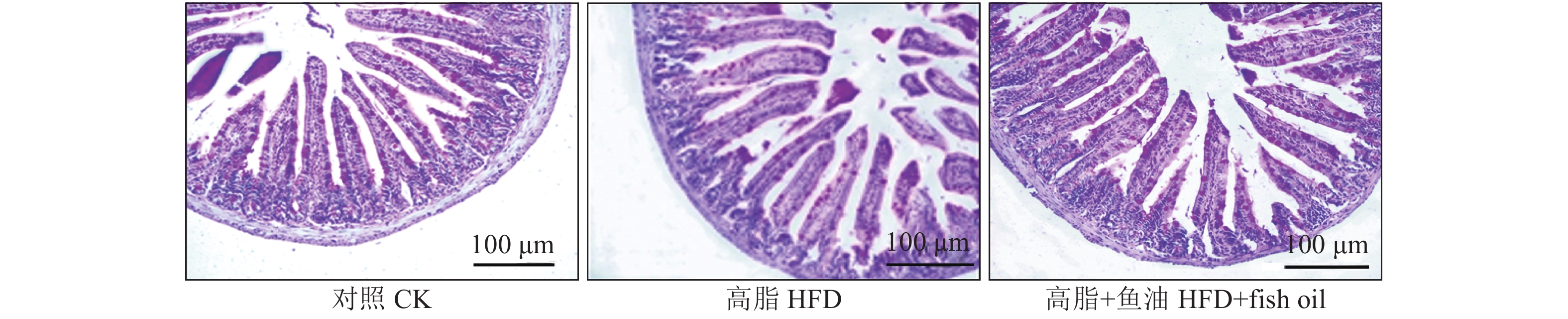
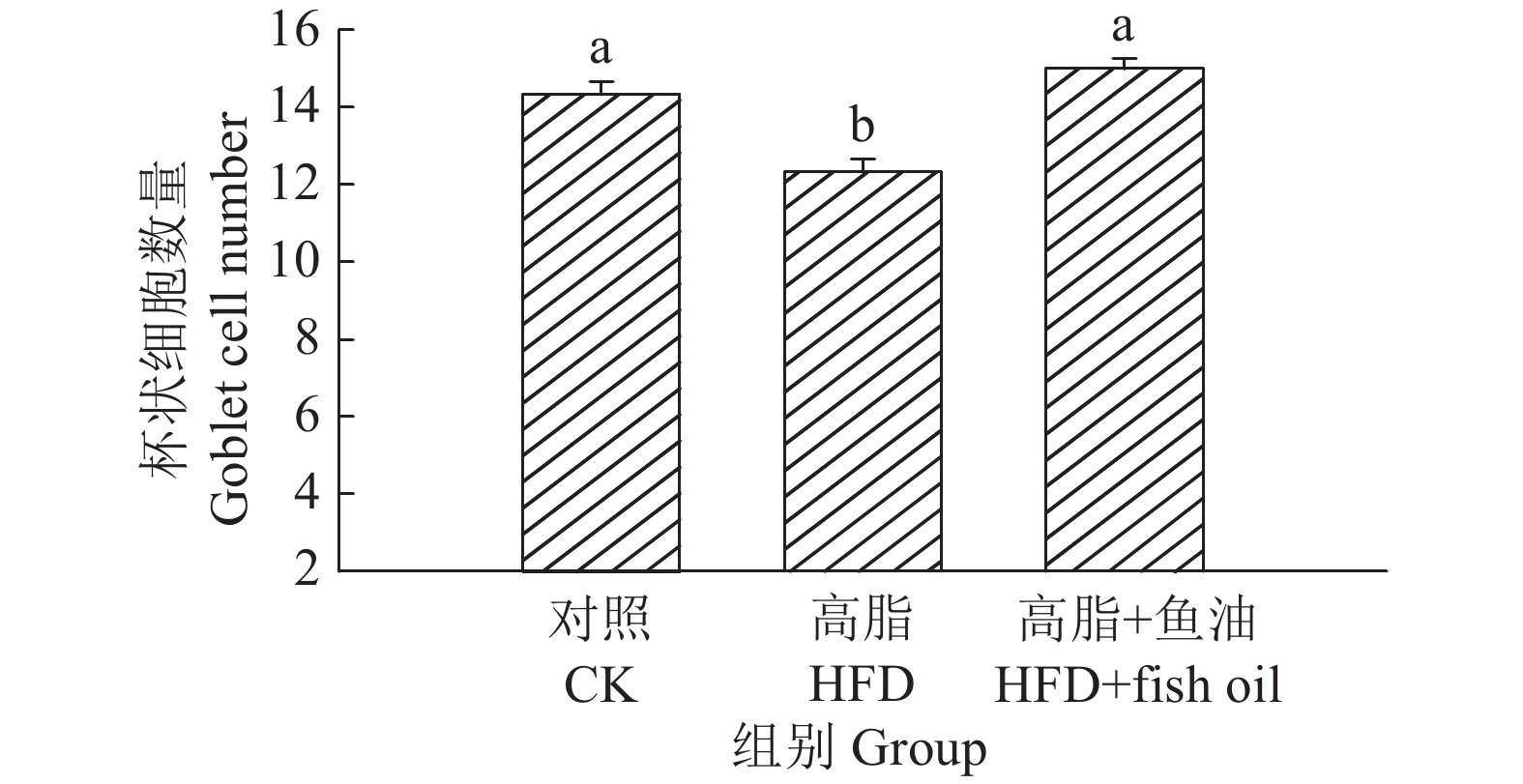
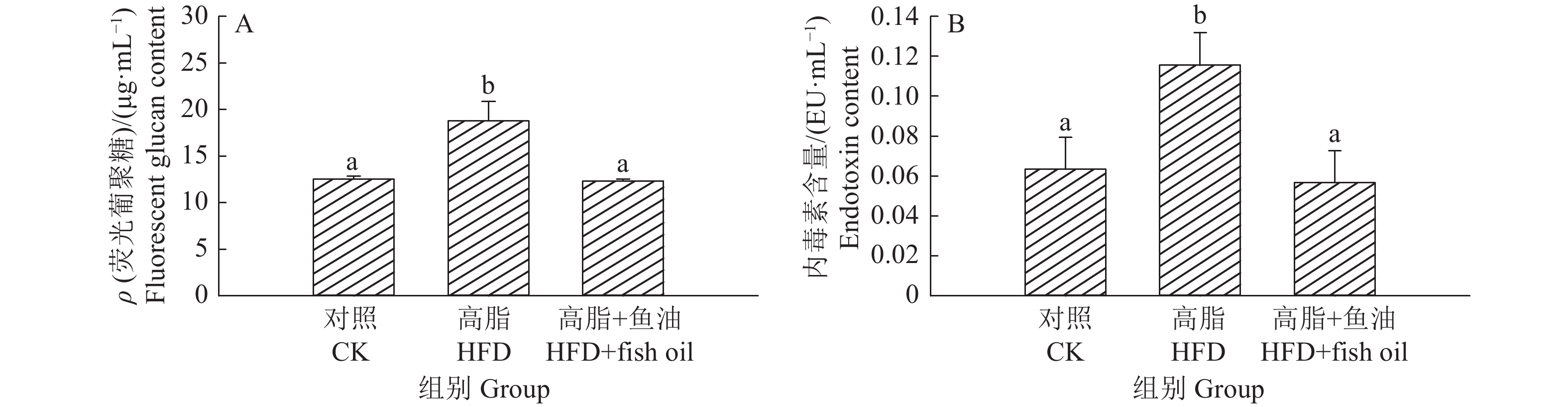
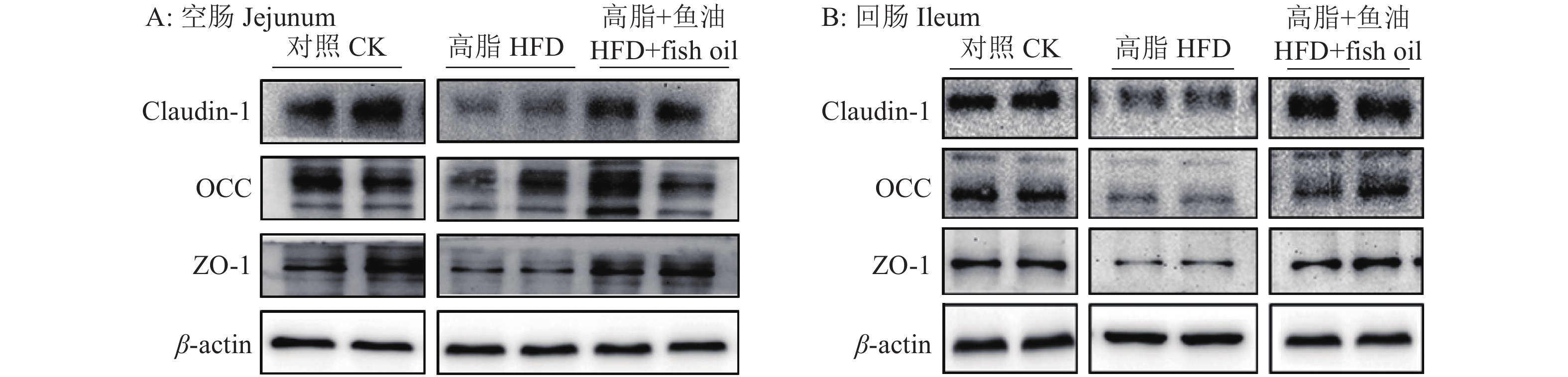
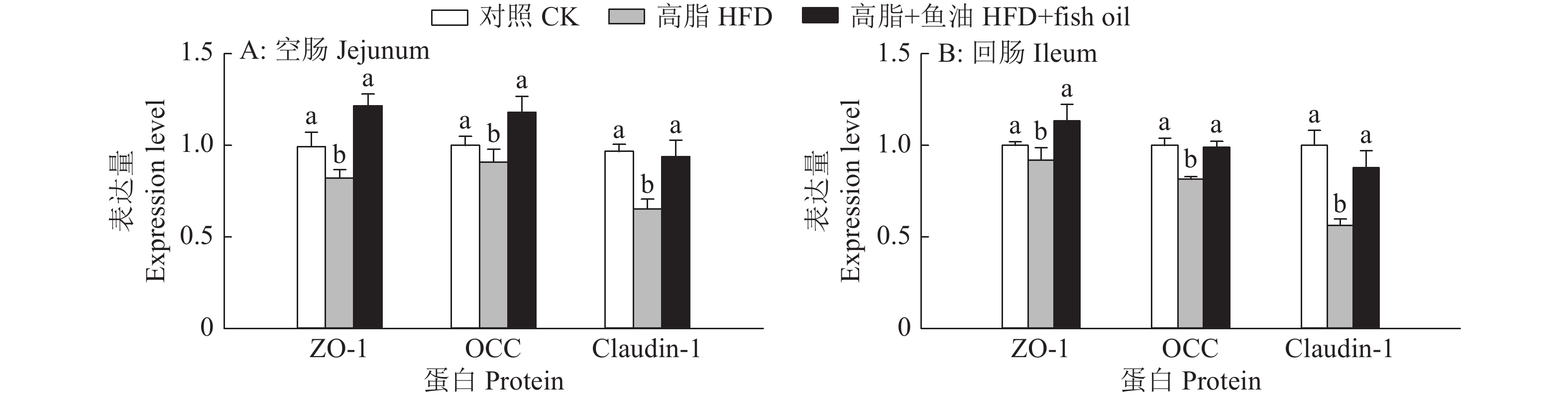
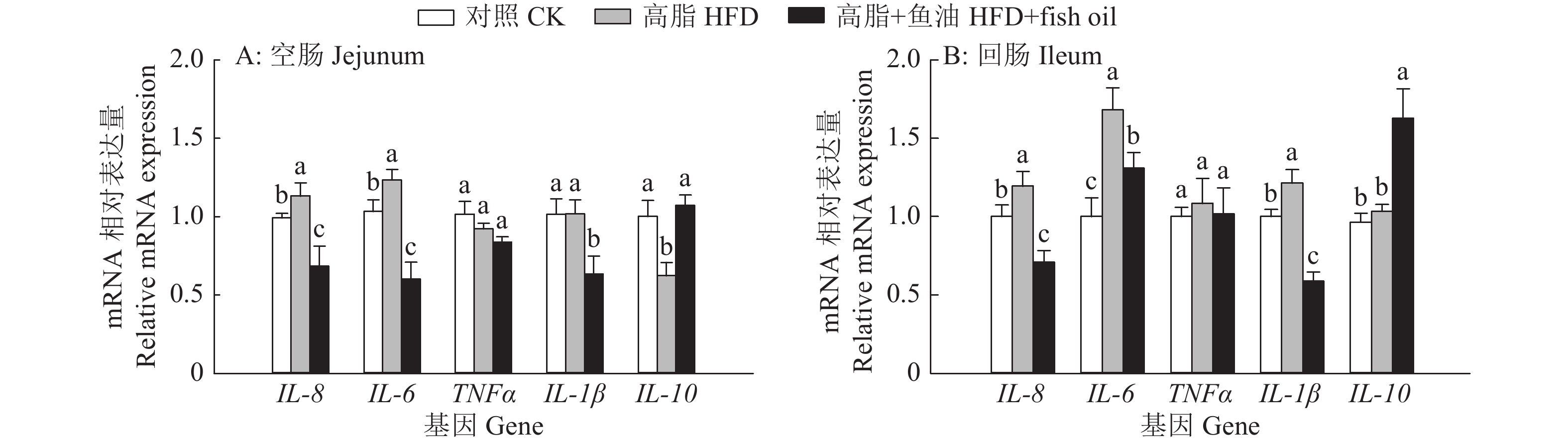
结果与高脂组相比,日粮添加鱼油显著提高了小鼠采食量和能量摄入、降低了粪便中粗脂肪的含量和能量排出,显著降低了小鼠体质量(P<0.05)。在肠道形态方面,与高脂组相比,添加鱼油使小鼠空肠和回肠的绒毛高度与隐窝深度比值(lV/dC)分别提高了43.1%和67.5%,使回肠绒毛杯状细胞的数量增多了16.7%(P<0.05)。与高脂组相比,添加鱼油使血清荧光葡聚糖和内毒素水平分别降低了34.3%和50.4%(P<0.05),并逆转了高脂日粮造成的肠道紧密连接蛋白表达的降低。在炎症因子表达方面,与高脂组相比,添加鱼油显著降低了空肠和回肠内促炎因子IL-8、IL-6和IL-1β的表达,同时显著增加了抗炎因子IL-10的表达(P<0.05)。
结论日粮添加鱼油可降低由高脂日粮导致的小鼠肠道屏障功能损伤,这可能与鱼油降低肠道炎症有关。
Abstract:ObjectiveTo investigate the effect of dietary supplementation of fish oil on the barrier function of mouse fed with high-fat diet (HFD).
Method36 C57BL/6J female mice (4-week-old) were randomly divided into control group (CK), HFD group, and HFD +fish oil group, with 12 mice in each group. Mice in three groups were fed with basal diet, HFD and HFD supplemented with 5% fish oil (iso caloric with HFD), respectively. The experiment lasted for 21 weeks, and the food intake and body weight of mice were measured weekly. During the experiment, intestinal permeability of each mouse was measured, and the fat content and energy in feces were determined. At the end of the experiment, endotoxin levels in serum were detected, and intestinal morphology, the number of intestinal goblet cells, and the expressions of intestinal tight junction proteins and inflammatory factors were examined.
ResultCompared with HFD group, addition of fish oil in diet significantly increased food intake and energy intake, decreased fecal crude fat content and energy excretion, while significantly reduced body weight of mice (P<0.05). In terms of intestinal morphology, compared with HFD group, addition of fish oil significantly increased the ratio of villus height to crypt depth (lV/dC) by 43.1% in mouse jejunum and 67.5% in ileum and the number of goblet cells in ileum villous by 16.7% (P<0.05). Compared with HFD group, addition of fish oil reduced the fluorescent glucan and endotoxin levels in serum by 34.3% and 50.4% respectively (P<0.05). Addition of fish oil also reversed the decrease in expressions of intestinal tight junction proteins caused by HFD. In terms of expression of inflammation factors, compared with HFD group, addition of fish oil significantly decreased the expressions of proinflammatory factors includingIL-8, IL-6 and IL-1β, and significantly elevated the expression of anti-inflammatory factor IL-10 in mouse jejunum and ileum (P<0.05).
ConclusionDietary supplementation of fish oil can reduce the HFD-induced impairment of intestinal barrier function, which might be associated with the fish oil reducing intestinal inflammation.
-
Keywords:
- mouse /
- fish oil /
- high-fat diet /
- intestinal barrier /
- tight junction protein /
- inflammation
-
水稻Oryza sativa L.是世界上超过一半人口的主要粮食作物,深入挖掘重要的功能基因对水稻主要农艺性状的遗传改良具有重要意义。高密度遗传图谱的构建为基因的精准定位和克隆创造了必要条件。
本研究使用的重组自交系(Recombinant inbred lines,RILs)群体是由籼稻‘MDS’和籼稻‘R315’构建的高代重组自交系,具有稳定的表型性状,是一个良好的永久性遗传群体。自1988年McCouch等[1]利用籼稻‘IR34583’与爪哇稻‘Bulu Dalam’衍生的F2群体构建了第1张含135个限制性内切酶片段长度多态性(Restriction fragment length polymorphism,RFLP)标记的水稻分子连锁图谱以来,水稻的遗传图谱相继诞生。传统的图谱构建通常利用RFLP、简单重复序列(Simple sequence repeat,SSR)标记和随机扩增多态性DNA(Random amplified polymorphic DNA,RAPD)标记。结合多种分子标记技术进行遗传图谱构建可进一步增加标记的密度。徐建龙等[2]利用272个均匀分布的标记(141个RFLP标记、99个SSR标记、29个RAPD标记和3个形态标记)构建了连锁图用于QTL分析,该连锁图总共覆盖基因组2 777.7 cM,相邻标记间平均距离为10.2 cM。早期的分子标记,作图距离通常较大,后期精细定位工作需要大量分离的F2代个体。随着DNA测序技术的快速发展,基于高通量测序的新型分子标记越来越多地应用于高密度遗传图谱的构建[3-4]。Chen等[5]利用148个子代组成的RIL群体构建了1 680.9 cM的遗传图谱,平均遗传距离为1.16 cM,共定位到23个耐盐相关QTLs,其中,位于第1、4、12号染色体上的3个QTLs表现出累加效应。单核苷酸多态性(Single nucleotide polymorphism,SNP)标记作为第3代新型分子标记技术,具有数量多、遗传稳定性高以及易于自动化分析等优点[6],已成为近年来水稻高密度遗传图谱构建的优先选择。
本研究利用全基因组测序(Whole genome sequencing,WGS)技术对籼稻‘MDS’和籼稻‘R315’构建的1个RIL群体进行全基因组测序,先鉴定出两亲本间的SNP,再利用SNP构建bin标记,最后构建1张高密度遗传图谱,以期为进一步深入挖掘和研究重要农艺性状基因奠定有利基础。
1. 材料与方法
1.1 试验材料
本研究使用的材料为国家植物航天育种工程技术研究中心前期收集的籼稻地方品种‘MDS’和‘R315’。父本‘MDS’是大穗、抗倒、高产型的地方籼稻品种,具有高光效、高养分利用率等特点。母本‘R315’是在‘象牙香占’基础上改良的籼稻恢复系,具有抗病、优质、配合力好等特点,父母本杂交,F2代通过单粒传法繁殖获得高世代RILs。
1.2 CTAB法提取植物叶片DNA
2019年晚季在华南农业大学校内教学科研试验基地的试验田中种植水稻亲本和RILs群体(含192个株系),每个材料按6行×6株的规模种成小区,株行距均为20 cm,单苗插植,常规栽培管理。F5代单株收种。亲本及其RILs(F6代)群体取20粒饱满种子萌发,取各个株系的幼嫩叶片(每个株系随机取5株混样),按CTAB法[7]提取DNA后送至北京诺禾致源生物信息科技有限公司进行测序分析。
1.3 DNA文库构建及测序
检测合格的DNA样品通过酶切、加测序接头、纯化、PCR扩增等步骤完成整个文库制备。构建好的文库通过Illumina(测序仪)进行测序。
1.4 测序数据质量评估及分析
检测合格的DNA文库进行HiSeq测序,产出Raw reads,结果以fastq文件格式存储。经过过滤,得到高质量的Clean reads。对192个子代及亲本测序数据进行统计,包括测序reads数量、数据产量、测序错误率、Q20、Q30、GC含量等。另外,将Clean data与NCBI的核苷酸数据库进行比对,以评估是否有其他来源的DNA污染。将2个亲本及192个子代测序数据与参考基因组( http://www.mbkbase.org/R498/)进行比对,反映测序数据与参考基因组的相似性,覆盖深度和覆盖度能够反映测序数据的均一性及与参考序列的相似性。
1.5 单核苷酸多态性检测与标记开发
SNP主要是指在基因组水平上由单个核苷酸的变异所引起的DNA序列多态性,包含单个碱基的转换、颠换等。基于Burrows-Wheeler aligner (BWA)比对结果,利用群体检测SNP的方式对亲本和192个子代进行SNP检测。对BWA比对结果进行过滤:将比对到水稻参考基因组上唯一位置的reads挑选出来,采用GATK(The genome analysis toolkit)[8]对过滤后的bam文件进行群体SNP的检测。为减少测序错误造成的假阳性SNP,要求亲本SNP碱基支持数不少于5,子代SNP碱基支持数不少于3,统计杂合SNP数、纯合SNP数和杂合SNP比例(杂合SNP数/总SNP数)。
基于亲本基因型检测结果,进行亲本间多态性标记开发,并选择RIL群体的可用标记类型(“aa×bb”型),即2个亲本的某个SNP基因型都为纯合且不相同。完成标记开发后,提取192个子代在亲本多态性标记位点的基因型,对分型后的标记进行筛选。首先进行异常碱基检查,子代分型结果中,可能会出现少数亲本中没有出现的碱基型,则认为该碱基是异常碱基,碱基缺失用“—”表示;基于上述结果继续进行异常基因型检查,本研究群体类型为RILs,在子代分离群体中,主要以纯合为主,杂合类型占比很低,杂合标记也视为异常基因型,转化为缺失。
1.6 高密度图谱构建及质量评估
利用最终获得的高质量SNP标记,对每个个体使用15个SNP滑动窗口、步移长度为1的策略检测RILs间的重组断点,得到群体重组断点分布图。针对每个连锁群使用JoinMap4.0对每个连锁群的bin标记进行排序(连锁群使用回归算法排序,采用Kosambi函数计算遗传距离)。根据获得的bin标记的遗传距离,使用perl SVG模块绘制连锁图,并依据文献[9]对标记在基因组上的位置和遗传图谱进行共线性分析。
2. 结果与分析
2.1 亲本性状差异及测序数据信息分析
通过对两亲本的农艺性状数据进行差异显著性分析,发现两亲本在每穗颖花数、粒长、每穗实粒数、叶宽、株高和二级枝梗数上具有极显著差异(P<0.01)(图1),每穗颖花数、粒长、每穗实粒数、叶宽、株高、二级枝梗数是后续研究重点关注性状。
通过对两亲本和RILs群体192个子代检测合格的DNA文库进行HiSeq测序,总共获得549 496 399 500 bp测序量。亲本‘MDS’得到4 140 981 000 bp Raw reads,过滤后得到Clean reads 4 134 873 600 bp,平均测序深度为9.33×;亲本‘R315’ 共得到4 395 794 100 bp Raw reads,过滤后得到4 390 405 500 bp Clean reads,平均测序深度9.66×。RILs群体192个子代中平均每个个体的Raw reads 约2 817 557 919 bp,平均测序深度6.33×。亲本总体测序质量高,Q20≥95%,Q30≥89%,GC分布正常,‘MDS’和‘R315’中GC含量分别为43.73%和44.12%。
将2个亲本及192个子代的测序数据与参考基因组比对。参考基因组大小为390 983 850 bp,192个子代样本比对率均在91%以上,1×覆盖度(至少有1个碱基的覆盖)平均为92.45%,对参考基因组捕获区域的平均覆盖深度为6.30×;比对结果可用于后续的变异检测及相关分析。
2.2 SNP识别与基因分型
基于2个亲本的基因型分析结果,开发的标记类型及数量如图2所示,父母亲本间共鉴定出具有多态性的位点470 833个,可用标记类型为“aa×bb”型,共计221 494个。
对分型后的遗传标记进行筛选,未发现异常碱基,说明基因分型准确性较好。基于筛选的结果对子代分型结果进行异常基因型检查,未发现杂合类型,说明RILs子代群体中,杂合类型占比较低。最终获得221 494个有效标记用于连锁性分析。
2.3 高密度遗传图谱构建及质量评估
基于获得的221 494个SNP标记,对每个个体使用15个SNP滑动窗口、步移长度为1的策略[9]检测RILs间的重组断点,得到群体重组断点图(图3)。利用图2的标记信息,可追踪到192个子代中每个子代的每条染色体的重组事件发生的位置。
使用JoinMap4.0对每个连锁群的bin标记进行排序(连锁群使用回归算法排序,使用Kosambi函数计算遗传距离),最终获得bin标记1 612个,均匀分布在各染色体上(图4)。用perl SVG模块绘制连锁图,总图距1 327.82 cM,覆盖了12个连锁群(分布在水稻的12条染色体上),标记间的平均图距为0.82 cM。各个连锁群bin标记数量、总图距、平均图距等基本信息如表1所示。其中第1号染色体(Chr 1)连锁群图距最长,为170.19 cM,包含bin标记最多,为194个,标记间平均图距是0.88 cM;第11号染色体(Chr 11)连锁群图距最短,为60.18 cM,包含bin标记最少,为68个,标记间的平均图距是0.89 cM;连锁群中最大间隔(Maximum gap)长度小于5 cM的比例高达98.2%。
表 1 遗传连锁群信息Table 1. Characteristics of genetic linkage group染色体编号
Chromosome number标记数量
Marker number总图距/cM
Total map distance平均图距/cM
Average map distance最大间隔/cM
Maximum gap1 194 170.19 0.88 9.73 2 137 100.75 0.74 5.39 3 164 139.83 0.85 18.29 4 174 125.12 0.72 18.53 5 144 114.72 0.80 14.73 6 125 114.46 0.92 7.75 7 151 128.06 0.85 11.96 8 132 113.11 0.86 19.60 9 116 94.48 0.81 7.68 10 95 68.13 0.72 5.23 11 68 60.18 0.89 5.24 12 112 98.79 0.88 6.07 合计 Total 1 612 1 327.82 0.82 19.60 共线性分析结果(图5)显示,各个连锁群上大部分标记与在基因组上保持一致,共线性较好,图谱质量高。
![]() 图 5 遗传图谱和物理图谱的共线性分析左侧刻度为相对遗传距离;Chr 1~12:染色体编号;Lg 1~12:连锁群编号;红色为连锁群,蓝色为参考基因组R498染色体Figure 5. Collinearity analysis between genetic map and physical mapThe left scale is relative genetic distance; Chr 1−12: Chromosome number; Lg 1−12: Linkage group number; Red area is linkage group and blue area is chromosome of reference genome R498
图 5 遗传图谱和物理图谱的共线性分析左侧刻度为相对遗传距离;Chr 1~12:染色体编号;Lg 1~12:连锁群编号;红色为连锁群,蓝色为参考基因组R498染色体Figure 5. Collinearity analysis between genetic map and physical mapThe left scale is relative genetic distance; Chr 1−12: Chromosome number; Lg 1−12: Linkage group number; Red area is linkage group and blue area is chromosome of reference genome R4983. 讨论与结论
高通量测序技术的迅速发展加速了水稻重要基因的挖掘和应用,在育种上也可以应用相关分子标记提高材料选育的准确性,加快品种选育。运用高通量测序获得高质量SNPs并构建遗传图谱进行QTL鉴定是目前的研究热点。
亲本的选择是获得高质量图谱的第一步,对后续的QTL定位也至关重要。亲本间的DNA具有多态性是选材的首要条件,在某一表型或者多个表型具有极端差异的2个材料是理想的选择。在研究产量[10-12]、粒形[13-14]等性状时,亲本的目的性状要存在极端差异。前期观察分析发现籼稻‘MDS’和‘R315’在多个农艺性状上均存在明显差异,包括株高、叶色、叶长、叶宽、粒形、穗粒数等。进一步的分析发现双亲在每穗粒数、叶宽、每穗实粒数、粒长、二次枝梗数、株高等性状上均存在极显著差异,预示着双亲中可能存在多个控制水稻产量的基因或者QTLs。接下来我们将对群体的多个表型数据进行分析,结合构建的高密度遗传图谱开展深入的研究。
基于重测序获得高质量的SNPs,再划分bin标记能大幅度提高作图的精度与效率,Huang等[9]对150个子代的RIL群体在F8代使用287个分子标记进行基因分型,构建的遗传图谱标记间平均遗传距离为5 cM,平均物理距离为1.4 Mb,需要3个人通过1年的工作完成;而在F11代使用重测序,每40 kb就获得1个SNP,将重组断点的分辨率提高了35倍,仅花费2周时间,将每15个SNPs划分为1个bin标记,标记间平均遗传距离为2.3 cM,平均物理距离为600 kb。本研究在前人基础上构建的图谱标记间平均遗传距离为0.82 cM,平均物理距离为242 kb,平均每16 kb就能产生1个SNP,进一步提高了重组断点的分辨率。
标记的数量也是遗传图谱的一个重要指标,籼粳杂交能获得丰富的多态性位点[1],但会定位到大量的QTLs,使得后续的研究难以进行。所以进一步精细定位高级的作图群体,主要指近等基因系类群体,其通过连续重复回交获得,特征是群体中个体间遗传背景相似,仅带有少数供体片断,从而消除背景的干扰和主效基因对微效QTLs的掩盖作用,如导入系(Introgression lines,ILs)和替换系(Substitution lines,SLs)[15-16],其目的为在保证遗传背景更加相似的情况下得到准确的结果。本研究选择了在表型上具有较大差异的2个籼稻品种作为亲本,以期在去除相同的遗传背景后得到一定的多态性遗传标记,准确关联到差异表型的QTLs。
QTL及基因鉴定的终极目的是应用于育种。针对水稻的重要性状,当前已经定位和克隆了一些重要基因,但大部分的QTLs或基因都只停留在试验阶段,没能与育种实践结合起来。其中主要的1个原因就是部分QTLs受遗传背景影响很大,很难在不同群体中检测到相同的QTL位点,这很可能是因为QTL的上位性占据了主导地位[17]。主效QTL或基因的定位,通常会选择遗传背景有较大差异的亲本构建群体,例如常用的籼粳杂交群体,对于群体中发现的有价值的QTL想用于选育出好的品种进行推广,还需要进行多次回交、自交,严重影响育种进程。与此同时,得到的结果会因为材料或者鉴定的环境改变而无法在育种中展开,最终导致定位到的QTL或基因与育种实践相脱节[18-19]。本研究选择的2个籼稻品种,在遗传背景相对相似的情况下,获得的QTL或基因能更加稳定地表达,而且选择双亲时要注重在性状上互补,在高世代的RILs群体中才可以直接筛选到能稳定遗传的目标株系用于水稻品种选育,从而达到使QTL鉴定与育种同步进行、互相验证的目的。
-
图 3 日粮添加鱼油对小鼠空肠和回肠的绒毛高度与隐窝深比值(lV/dC)的影响
各图中,柱子上方的不同小写字母表示差异显著(P<0.05,Duncan’s法)
Figure 3. Effect of dietary supplementation of fish oil on the ratio of villus length to crypt depth (lV/dC) in mouse jejunum and ileum
In each graph, different lowercase letters on bars indicate significant differences(P<0.05, Duncan’s method)
图 8 日粮添加鱼油对小鼠空肠和回肠紧密连接蛋白表达的影响
各图中,相同蛋白柱子上方的不同小写字母表示组间差异显著(P<0.05,Duncan’s法)
Figure 8. Effect of dietary supplementation of fish oil on the expression of tight junction protein in mouse jejunum and ileum
In each graph, different lowercase letters on bars of the same protein indicate significant differences among groups(P<0.05, Duncan’s method)
图 9 日粮添加鱼油对小鼠空肠和回肠炎症因子表达的影响
各图中,相同基因柱子上方的不同小写字母表示组间差异显著(P<0.05,Duncan’s法)
Figure 9. Effect of dietary supplementation of fish oil on the expression of inflammatory factor in mouse jejunum and ileum
In each graph, different lowercase letters on bars of the same gene indicate significant differences among groups(P<0.05, Duncan’s method)
表 1 小鼠日粮成分组成
Table 1 The dietary composition for mice
项目
Item组成
Component对照组
CK group高脂组
HFD group高脂+鱼油组
HFD+ fish oil group原料及质量分数/(g·kg−1)
Ingredient and content玉米淀粉 Corn starch 397.5 0 0 酪蛋白 Casein 200.0 261.7 261.7 麦芽糖糊精 Maltodextrin 132.0 163.6 163.6 蔗糖 Sucrose 100.0 89.8 89.8 豆油 Soybean oil 70.0 32.7 32.7 猪油 Lard 0 320.6 273.7 纤维素 Cellulose 50.0 65.4 65.4 混合矿物质 Mineral Mix 35.0 45.8 45.8 混合维生素 Vitamin Mix 10.0 13.1 13.1 L−胱氨酸 L−cystine 3.0 3.9 3.9 氯化胆碱 Choline chloride 2.5 3.3 3.3 鱼油 Fish Oil 0 0 50.0 合计 Total 1 000.0 999.9 1 003.0 营养成分及质量分数/%
Nutrient and content蛋白 Protein 17.9 26.2 26.2 脂肪 Fat 7.0 34.9 34.9 碳水化合物 Carbohydrate 64.4 26.3 26.3 总能/(kJ·g−1)
Total energy15.07 21.93 21.93 表 2 小鼠炎症因子引物序列
Table 2 Sequences for primers of mouse inflammation factors
基因
Gene引物序列(5′→3′)
Primer sequence产物长度/bp
Product lengthIL-1β F:TCTCTGGCCTTGGAACATAGTCT
R:CAAAGCCATCAGTGAACTCATCA145 IL-6 F:TACCACTCCCAACAGACCTG
R:CAAGTGCATCATCGTTGTTCA135 IL-8 F:CACCCTCTGTCACCTGCTCAA
R:ATGGCGCTGAGAAGACTTGGT101 IL-10 F:CGGGAAGACAATAACTGCACCC
R:CAAAGCCATCAGTGACCTAATCA130 TNF-α F:AGGCACTCCCCCAAAAGATG
R:CAAAGCCATCAGTGACCTAATCA145 β-actin F:TCTCTGTCCTTGGAACATAGTCT
R:CAAAGCCATCAGTGACCTAATCA142 -
[1] 彭凯, 吴薇, 龙蕾, 等. 断奶仔猪的腹泻研究进展[J]. 饲料研究, 2015(13): 10-15. [2] JI Y, SAKATA Y, TSO P. Nutrient-induced inflammation in the intestine[J]. Curr Opin Clin Nutr, 2011, 14(4): 315-321. doi: 10.1097/MCO.0b013e3283476e74
[3] DONG L, ZHANG Y, YANG L, et al. Effects of a high-fat diet on adipose tissue CD8+ T cells in young vs adult mice[J]. Inflammation, 2017, 40(6): 1944-1958. doi: 10.1007/s10753-017-0635-0
[4] CREMONINI E, WANG Z W, BETTAIEB A, et al. (-)-Epicatechin protects the intestinal barrier from high fat diet-induced permeabilization: Implications for steatosis and insulin resistance[J]. Redox Biol, 2018, 14: 588-599. doi: 10.1016/j.redox.2017.11.002
[5] HAMILTON M K, BOUDRY G, LEMAY D G, et al. Changes in intestinal barrier function and gut microbiota in high-fat diet-fed rats are dynamic and region dependent[J]. Am J Physiol-Gastr L, 2015, 308(10): G840-G851.
[6] DING S L, CHI M M, SCULL B P, et al. High-fat diet: Bacteria interactions promote intestinal inflammation which precedes and correlates with obesity and insulin resistance in mouse[J]. PLoS One, 2010, 5(8): e12191. doi: 10.1371/journal.pone.0012191
[7] PETERSON L W, ARTIS D. Intestinal epithelial cells: Regulators of barrier function and immune homeostasis[J]. Nat Rev Immunol, 2014, 14(3): 141-153. doi: 10.1038/nri3608
[8] BENÍTEZ-PÁEZ A, GÓMEZ DEL PULGAR E M, KJØLBÆK L, et al. Impact of dietary fiber and fat on gut microbiota re-modeling and metabolic health[J]. Trends Food Sci Technol, 2016, 57: 201-212. doi: 10.1016/j.jpgs.2016.11.001
[9] MUHLROTH A, LI K S, RØKKE G, et al. Pathways of lipid metabolism in marine algae, co-expression network, bottlenecks and candidate genes for enhanced production of EPA and DHA in species of chromista[J]. Mar Drugs, 2013, 11(11): 4662-4697. doi: 10.3390/md11114662
[10] 左正三, 郭东升, 纪晓俊, 等. 肠道中多不饱和脂肪酸及其衍生物研究进展[J]. 中国生物工程杂志, 2018, 38(11): 66-75. [11] 李启艳, 谢强胜, 刁飞燕, 等. 鱼油的化学成分及其药理活性研究进展[J]. 药物分析杂志, 2016, 36(7): 1157-1161. [12] MORI T A, BEILIN L J. Omega-3 fatty acids and inflammation[J]. Curr Atheroscler Rep, 2004, 6(6): 461-467. doi: 10.1007/s11883-004-0087-5
[13] TONTONOZ P, SPIEGELMAN B M. Fat and beyond: The diverse biology of PPARγ[J]. Annu Rev Biochem, 2008, 77(1): 289-312. doi: 10.1146/annurev.biochem.77.061307.091829
[14] 龙烁, 王浩, 武书庚, 等. 二十二碳六烯酸的生理学功能及其在家禽生产中的应用[J]. 动物营养学报, 2017, 29(4): 1101-1109. doi: 10.3969/j.issn.1006-267x.2017.04.003 [15] 唐军旺, 方倩倩, 邵荣益, 等. 不同油脂对填饲期朗德鹅生产性能、血清指标及肝脏脂肪酸组成的影响[J]. 动物营养学报, 2018, 30(7): 2550-2560. doi: 10.3969/j.issn.1006-267x.2018.07.015 [16] 银忠. 地衣芽孢杆菌对菌群失调大鼠肠道微生态、黏膜结构和免疫细胞的影响[D]. 武汉: 华中农业大学, 2009. [17] HASAN A U, OHMORI K, KONISHI K, et al. Eicosapentaenoic acid upregulates VEGF-A through both GPR120 and PPARγ mediated pathways in 3T3-L1 adipocytes[J]. Mol Cell Endocrinol, 2015, 406: 10-18. doi: 10.1016/j.mce.2015.02.012
[18] 贺显晶, 孙东波, 武瑞. 鱼油对断奶SD大鼠生产性能、脏器指数及肠道形态的影响[J]. 黑龙江畜牧兽医, 2011(9): 144-146. [19] 张智, 单庆文, 王琳琳, 等. 培菲康对高脂饮食诱导脂肪肝病大鼠肠黏膜屏障的保护作用[J]. 世界华人消化杂志, 2013, 21(2): 130-137. [20] MOREIRA A P B, TEXEIRA T F S, FERREIRA A B, et al. Influence of a high-fat diet on gut microbiota, intestinal permeability and metabolic endotoxaemia[J]. Br J Nutr, 2012, 108(5): 801-809. doi: 10.1017/S0007114512001213
[21] TAKAHASHI Y, ISUZUGAWA K, MURASE Y, et al. Up-regulation of NOD1 and NOD2 through TLR4 and TNF-α in LPS-treated murine macrophages[J]. J Vet Med Sci, 2006, 68(5): 471-478. doi: 10.1292/jvms.68.471
[22] GREGOR M F, HOTAMISLIGIL G S. Inflammatory mechanisms in obesity[J]. Annu Rev Immunol, 2011, 29(1): 415-445. doi: 10.1146/annurev-immunol-031210-101322
[23] GEURTS L, NEYRINCK A M, DELZENNE N M, et al. Gut microbiota controls adipose tissue expansion, gut barrier and glucose metabolism: Novel insights into molecular targets and interventions using prebiotics[J]. Benef Mirbobes, 2014, 5(1): 3-17. doi: 10.3920/BM2012.0065
-
期刊类型引用(5)
1. 刘进,周慧颖,马小定,孟冰欣,崔迪,胡佳晓,涂夯,余丽琴,韩龙植,黎毛毛. 基于高密度遗传图谱定位水稻抽穗期耐热性QTL. 植物遗传资源学报. 2025(05): 962-973 .  百度学术
百度学术
2. 赵凌,张勇,魏晓东,梁文化,赵春芳,周丽慧,姚姝,王才林,张亚东. 利用高密度Bin图谱定位水稻抽穗期剑叶叶绿素含量QTL. 中国农业科学. 2022(05): 825-836 .  百度学术
百度学术
3. 宋博文,王朝欢,赵哲,陈淳,黄明,陈伟雄,梁克勤,肖武名. 基于高密度遗传图谱对水稻粒形QTL定位及分析. 作物学报. 2022(11): 2813-2829 .  百度学术
百度学术
4. 潘俊峰,崔克辉,刘彦卓,王昕钰,严博宇,梁开明. 利用高密度Bin图谱定位水稻叶绿素含量QTL. 广东农业科学. 2022(09): 132-140 .  百度学术
百度学术
5. 刘进,胡佳晓,马小定,陈武,勒思,Jo Sumin,崔迪,周慧颖,张立娜,Shin Dongjin,黎毛毛,韩龙植,余丽琴. 水稻RIL群体高密度遗传图谱的构建及苗期耐热性QTL定位. 中国农业科学. 2022(22): 4327-4341 .  百度学术
百度学术
其他类型引用(11)




 下载:
下载: