Cd-tolerant germplasm screen and QTL identification of single-segment substitution lines of Oryza glumaepatula at the germination period
-
摘要:目的
评价CdCl2溶液对展颖野生稻Oryza glumaepatula单片段代换系(SSSLs)种子发芽及根芽生长的影响,筛选耐Cd SSSLs材料,初步鉴定与芽期耐Cd性状相关的QTLs。
方法对6个栽培稻品种在0、30、50、100、500 μmol·L−1 CdCl2溶液条件下进行发芽试验,确定水稻种子芽期耐Cd性研究的处理浓度,筛选耐Cd SSSLs的性状指标。对SSSLs在CdCl2溶液处理下发芽第7天的根长与芽长分析,筛选P=0.01水平耐Cd性较强的SSSLs,鉴定相应性状QTLs。
结果在0、30、50和100 μmol·L−1 CdCl2浓度处理下,栽培稻品种的种子发芽率为91%~95%,差异不显著,但种子根和幼芽伸长生长受到抑制,品种间差异显著。在50和100 μmol·L−1 CdCl2溶液条件下,以发芽第7天的相对根长和相对芽长为指标,在P=0.01水平从8个SSSLs鉴定出5个相对根长QTLs,即qRRL1-1、qRRL2-1、qRRL3-1、qRRL3-2及qRRL6-1,其加性效应为0.19~0.60,表型贡献率为31.18%~100.59%;鉴定出5份SSSLs携带3个相对芽长QTLs,即qRSL1-1、qRSL1-2及qRSL2-1,其加性效应为0.08~0.18,表型贡献率为7.43%~18.95%。
结论展颖野生稻SSSLs携带芽期耐Cd QTLs,可以作为水稻耐Cd基因发掘的重要材料。
Abstract:ObjectiveTo evaluate effects of Cd stress on seed germination and growth of seminal root and shoot in chromosome single-segment substitution lines (SSSLs) of Oryza glumaepatula after seed germination, screen for Cd-tolerant SSSLs, and identify QTLs related to Cd-tolerant characters in bud.
MethodThe seed germination test was carried out using six varieties at CdCl2 concentrations of 0, 30, 50, 100, 500 μmol·L−1, and the proper treatment of CdCl2 concentration and the related character indexes to evaluate CdCl2 tolerance of SSSLs were determined. The lengths of seminal roots and shoots of experimental SSSLs were analyzed to screen for SSSLs with strong tolerance to CdCl2 at P=0.01 level and identify QTLs related to Cd-tolerant characters.
ResultAt the concentrations of 0, 30, 50, and 100 μmol·L−1 CdCl2, the seed germination rates of six varieties were distributed between 91%~95%, which were insignificant among different CdCl2 concentrations. However, the growth of seminal roots and shoots were significantly inhibited by CdCl2, and the significant differences were observed for the tolerance to CdCl2 among different varieties. Using relative root length and relative shoot length on the 7th day after germination as tolerance indexes, at the concentrations of 50 and 100 μmol·L−1, five relative root length QTLs including qRRL1-1, qRRL2-1, qRRL3-1, qRRL3-2 and qRRL6-1 were identified in eight SSSLs at P=0.01 level, the phenotypic contribution rates of additive effects ranged from 31.18% to 100.59%. Three relative shoot length QTLs including qRSL1-1, qRSL1-2, and qRSL2-1 were identified in five SSSLs, the phenotypic contribution rates of additive effects were 7.43%~18.95%.
ConclusionSSSLs of O. glumaepatula carry Cd-tolerant QTLs at the germination period, which will be useful for exploring beneficial Cd-tolerant genes in rice.
-
Keywords:
- Oryza glumaepatula /
- single segment substitution line /
- cadmium stress /
- QTL
-
兰花是兰科Orchidaceae植物的总称,但在中国,兰花是指兰科兰属Cymbidium植物,特别是其中的地生种类,也就是今天的国兰[1]。兰科是开花植物中最大的科之一,已鉴定的兰科植物有899属29 199种,约占开花植物的8%~10%,除极地和极端干旱的沙漠外,世界各地均有兰花分布[2-3]。兰花具有很高的观赏价值、药用价值、食用价值、生态价值和文化价值,是世界著名的观赏花卉,也是中国传统十大名花之一[3]。作为观赏花卉,兰花既可以做切花、也可以做盆花,既可以观花、也可以赏叶,同时也是园林造景优良植材,深受世界各国人民的喜爱。作为进化程度最高、种类最丰富的植物,兰花也是当今生物学领域研究生命和进化的理想模式植物。新品种选育是兰花产业自主和高质量发展的基础,而育种方法是快速高效选育兰花优良品种的关键。目前,兰花育种的主要方法有引种驯化、选择育种、杂交育种、诱变育种和多倍体育种等[4-5]。这些育种方法虽然有效,但可利用资源范围窄、育种周期长,不能定向培育市场所需品种。分子育种是采用转基因或基因编辑技术创造变异、或通过分子标记辅助选择技术培育新品种的方法,主要包括转基因育种、基因编辑育种和分子标记辅助选择育种。近年来,随着兰花组学技术的发展,兰花主要育种目标性状的分子遗传基础、基因鉴定和克隆、高密度分子图谱构建等取得巨大进步,兰花转基因技术和分子标记辅助选择技术也取得明显进展,本文对此进行综述并对未来兰花分子育种技术研究的重点和品种创新进行了展望,为进一步推动兰花分子育种技术研究和新品种选育提供参考。
1. 兰花基因组测序和功能基因鉴定
1.1 基因组测序
自2015年Cai等[6]完成小兰屿蝴蝶兰Phalaenopsis equestris 基因组测序以来,迄今有来自4亚科8属18种共27份兰花完成了基因组测序,包括附生、地生和腐生3类(表1)[6-31]。其中,广东舌唇兰Platanthera guangdongensis基因组最大(4.27 Gb)[20],深圳拟兰Apostasia shenzhenica基因组最小(348.73 Mb)[30],天麻Gastrodia elata预测基因数最少(17 895个)[25],染色体数最少的香荚兰Vanilla fragrans预测基因数最多(59 128个)[29]。基于基因组测序结果,对兰花叶艺、花型、花色、花期、适应性等性状的分子遗传基础分析结果表明,CH1基因家族显著缩减可能是导致墨兰Cymbidium sinense叶艺形成的重要原因[7];光合天线和代谢途径相关基因表达水平降低引起建兰C. ensifolium叶艺的形成,叶片中与花发育相关的MADS-box基因表达水平显著提高导致花被状叶的形成[8]。
表 1 兰花基因组测序Table 1. Genome sequencing of orchid物种
Species染色体数
No. of
chromosomes基因组
大小/Gb
Genome size预测基因数
No. of
predicted genes重复序列/%
Repetitive
sequence测序技术及文献
Sequencing technique
and reference墨兰 Cymbidium sinense 20 3.52 29 638 77.78 Illumina HiSeq 2000[7] 建兰 C. ensifolium 20 3.62 29 073 80.58 Illumina HiSeq 2500 PacBio[8] 春兰 C. goeringii 20 3.99 29 556 88.87 Illumina Hiseq 2500[9] 春兰 C. goeringii 20 4.10 29 272 77.65 Illumina HiSeq 2500 PacBio[10] 硬叶兰 C. mannii 20 2.88 27 192 82.80 MGISEQ-2000[11] 铁皮石斛
Dendrobium officinale19 1.35 35 567 63.33 Illumina HiSeq 2000 PacBio[12] 铁皮石斛 D. catenatum 19 1.12 29 257 78.10 Illumina Hiseq2000[13] 鼓槌石斛 D. chrysotoxum 19 1.37 30 044 62.81 MGISEQ-2000 NovaSeqPacBio[14] 铁皮石斛 D. officinale 19 1.23 25 894 76.77 Illumina Hiseq 4000 PacBio[15] 霍山石斛 D. huoshanense 19 1.285 21 070 74.92 Illumina HiSeq 2000 PacBio[16] 金钗石斛 D.nobile 19 1.16 29 476 61.07 Illumina Novaseq6000[17] 小兰屿蝴蝶兰
Phalaenopsis equestris19 1.13 29 545 61.53 Illumina HiSeq 2000[6] 蝴蝶兰‘KHM190’
P. ‘KHM190’19 3.10 41 153 59.74 Illumina HiSeq 2000[18] 台湾蝴蝶兰 P. aphrodite 19 1.03 28 902 60.30 Illumina Hiseq 2000[19] 紫金舌唇兰
Platanthera zijinensis21 4.15 24 513 77.38 Illumina Hiseq 4000 PacBio[20] 广东舌唇兰
Platanthera guangdongensis21 4.27 22 559 82.18 Illumina Hiseq 4000 PacBio[20] 天麻 Gastrodia elata 18 1.06 18 969 66.18 Illumina HiSeq 2500[21] 天麻 G. elata 18 1.12 24 484 68.34 Illumina HiSeq 2000[22] 天麻 G. elata 18 1.04 21 115 66.36 PacBio Sequel II[23] 天麻 G. elata 18 1.05 18 844 74.92 Illumina NovaSeq 6000 PacBio[24] 天麻 G. elata 18 1.09 17 895 63.89 Illumina HiSeq 4000[25] 勐海天麻 G. menghaiensis 18 0.99 17 948 65.08 Illumina HiSeq 2500[26] 白及 Bletilla striata 18 2.37/2.43 26 673 PacBio[27] 香荚兰 Vanilla planifolia 14 1.5 29 167 44.30 Illumina HiSeq 2000[28] 香荚兰 V. planifolia 14 3.4 59 128 72.00 Illumina HiSeq 2000[29] 深圳拟兰
Apostasia shenzhenica34 0.35 21 841 42.05 Illumina HiSeq 2000 PacBio[30] 多枝拟兰 A. ramifera 34 0.37 22 841 44.99 Illumina Hiseq 2000[31] MADS-box基因影响花发育和形态。通过测序分析,在多枝拟兰A. ramifera、深圳拟兰、天麻、紫金舌唇兰Platanthera japonica、广东舌唇兰、香荚兰、小兰屿蝴蝶兰、台湾蝴蝶兰P. aphrodite、鼓槌石斛Dendrobium chrysotoxum、铁皮石斛D. catenatum、春兰C. goeringii 、建兰和墨兰中分别鉴定出30、36、40、43、43、55、51、56、58、63、69、71和94个MADS-box基因[2, 7, 9, 19],且多数兰花中没有FLC、AGL12和AGL15基因。在小兰屿蝴蝶兰中有20个基因优先在花组织中表达,MIKC等5个基因只在花中表达,C/D类和B类基因AP3、AGL6基因家族的扩张和分化可能是兰花高度特化花型形成的原因[6]。CsSEP4基因正调控墨兰合蕊柱发育 [7]。C类基因CeAG-1和 CeAG-2在建兰花瓣中的高表达形成鼻状花瓣,在花芽中低表达时,则花中没有鼻,取而代之的是几轮花被片,形成具有多花被片分枝花序的花;CeSEP-2基因表达上调对兰花形成特化的唇瓣十分重要,下调则形成菊瓣花;唇瓣结构由CeAP3-1、CeAP3-2、CeAP3-3、CeAP3-4和CeAGL6-2基因控制,CeAP3-3、CeAP3-4和CeAGL6-2在萼片和花瓣中高表达则分别形成唇瓣状萼片和花瓣突变体[8]。
萜类化合物在兰花香气和抗逆性中起关键作用。在深圳拟兰、小兰屿蝴蝶兰、鼓槌石斛、金钗石斛D. nobile和墨兰中鉴定出TPS基因数分别为14、21、48、51和59个[6,7,14,17,30]。墨兰的花香与TPS基因家族扩张有关,与无香的墨兰相比,有香的墨兰TPS家族基因表达量更高[7]。单萜和倍半萜主要在花发育晚期和开花期形成,与其生物合成的相关基因GDPS、FDPS和LIS高表达有关,FDPS和GDPS主要在萼片、花瓣和唇瓣中表达,说明萜类化合物主要在花被中合成[8]。
花色是兰花主要育种目标性状。通过基因组测序和表达分析,在墨兰中鉴定出56个花青素合成代谢相关基因和125个MYBs,花青素合成代谢相关基因在绿色、黄色、粉色和紫黑色花中差异表达,其中,4个F3′H基因在红色和紫色花中高表达。调控花青素合成途径上游的MYBs一般在开紫黑色花的墨兰中表达上调,而调控下游的平行基因表达谱存在显著差异,此外,MYBs通过调控F3′5′H的表达影响墨兰的花色[7]。在白色和粉色台湾蝴蝶兰中,F3H的表达模式明显不同,R2R3-MYB在不同颜色蝴蝶兰中表达模式也不同[19]。
次生代谢物是药用兰花的主要育种目标性状。测序分析结果表明,铁皮石斛中SPS和SuSy基因扩张与石斛多糖形成有关[12];甲基赤藓糖醇磷酸途径中DXS、LUT1、LUT2、LCY1、LUT5等相关基因的丢失,导致天麻中叶黄素、胡萝卜素和脱落酸等物质的缺乏[23];OMT基因在秋水仙素生物合成中起重要作用[24]。
其他性状研究结果表明,墨兰CsSVP基因与其互作蛋白CsAP1和CsSOC1共同调控低温诱导开花[7]。附生兰耐热性与SDD1、PPP7和3MAT基因家族扩张有关[12]。鼓槌石斛花期短是由于在开花至凋谢过程中类胡萝卜素含量逐渐增加、叶黄素含量逐渐减少,导致ABA含量减少、乙烯含量增加所致[14]。
1.2 功能基因鉴定
功能基因鉴定是兰花分子育种的基础。迄今采用转基因、RNAi和VIGS等技术已从兰属、石斛属、蝴蝶兰属和文心兰属Oncidium兰花中鉴定出功能基因91个[32-103]。其中,通过将基因转入兰花中并验证功能的有24个,占比24.7%。已鉴定出功能的基因包括植株生长发育、叶色、花发育、花色、开花时间、多糖合成、抗病、抗逆和组培快繁特性等基因(表2),其中,花色、花发育、花期、抗逆和多糖合成的基因数分别为20、19、 15、13和 5个,占比分别为22.0%、20.9%、16.5%、14.3%和5.5%。
表 2 兰花功能基因鉴定Table 2. Identifications of functional genes in orchid性状
Trait基因
Gene来源
Source载体类型
Carrier type受体、结果及文献
Receptor, result and reference花色
Flower
colorDFR 大花蕙兰
‘Rosannagirl Mild’过表达 矮牵牛,转基因植株花色由白色变为粉红色[32] F3′5′H 蝴蝶兰‘TS444’ 瞬时表达和过表达 蝴蝶兰‘TS444’,花色由粉红色变为品红色[33] PeUFGT3 小兰屿蝴蝶兰 RNAi 小兰屿蝴蝶兰,花色出现不同程度褪色[34] PeMYB2/11/12 小兰屿蝴蝶兰 VIGS 小兰屿蝴蝶兰,红色色素、斑点和网纹丧失[35] DseCHS-B 石斛兰‘睡公主’ RNAi 石斛兰‘睡公主’,花青素积累受损[36] CHS 蝴蝶兰‘大辣椒’ RNAi 蝴蝶兰‘大辣椒’,花瓣颜色变淡、色素含量降低[37] MYBx1 蝴蝶兰‘大辣椒’ 过表达 矮牵牛,转基因植株花色素沉积降低[38] OgPSY 文心兰‘柠檬绿’ RNAi 文心兰‘柠檬绿’,叶黄素含量降低,花朵白色[39] DoFLS1 铁皮石斛 过表达 拟南芥,转基因植株花色苷含量降低、黄酮醇含量增
加[40]PeMYB4L 小兰屿蝴蝶兰 VIGS 小兰屿蝴蝶兰,红色素沉积降低[41] DoMYB5,DobHLH24 铁皮石斛 瞬时表达和过表达 烟草和铁皮石斛,花色苷积累增加[42] 开花时间
Flowering
timeOnFT,OnTFL1 文心兰‘南茜’ 过表达 拟南芥,过表达OnFT植株克服晚花缺陷、过表达OnTFL1抑制成花转变[43] PhalCOL 台湾蝴蝶兰 过表达 烟草,转基因植株花期提早[44] CgFT 春兰 过表达 烟草,转基因植株花期提早[45] CsFT 墨兰 过表达 拟南芥,转基因植株花期提前[46] OMADS1 文心兰 过表达 拟南芥和烟草,转基因植株花期提前[47] DoSOC1 铁皮石斛 过表达 拟南芥,转基因植株花期提前[48] PhFT 蝴蝶兰 Fortune Saltzman 过表达 拟南芥,转基因植株克服晚花缺陷[49] PaFT1,PaFD 台湾蝴蝶兰 过表达 拟南芥和水稻,转基因植株开花(抽穗)变早,叶片少 [50] CsFT 墨兰 过表达 拟南芥,转基因植株提前开花[51] DoAP1 石斛兰 Chao Praya Smile 过表达 拟南芥,过表达促进开花 [52] PhPEBPs 蝴蝶兰 Little Gem Stripes 过表达 拟南芥,PhFT1、 PhFT3、 PhFT5和 PhMFT 促进
开花,PhFT6抑制开花[53]花发育
Floral
developmentPeMADS6 小兰屿蝴蝶兰 过表达 拟南芥,转基因植株出现花瓣状萼片,花寿命增加
3~4倍[54]ORAP11/13 蝴蝶兰 Formosa Rose 过表达 烟草,开花提前,叶片和花器官结构改变[55] PeMADS1/7 小兰屿蝴蝶兰 过表达 拟南芥,PeMADS1挽救ag-4突变体花缺陷表型,PeMADS7抑制花被脱落,种子不育增加[56] PhapLFY 台湾蝴蝶兰 过表达 拟南芥,挽救lfy突变体的异常花不育表型[57] CsAG1 墨兰 过表达 拟南芥,转基因植株花瓣同一性被破坏[58] PaSPK1 台湾蝴蝶兰 VIGS 蝴蝶兰,双花序植株比例减少[59] DoAG1/2 石斛兰 Chao Praya Smile 过表达 拟南芥,挽救ag-4突变体花朵缺陷表型[60] PaFYF1/2 台湾蝴蝶兰 过表达和 VIGS 拟南芥和蝴蝶兰,基因过表达延迟拟南芥花衰老和脱落,且对乙烯处理不敏感;基因沉默蝴蝶兰花衰老和脱落提前[61] PeDL1/2 小兰屿蝴蝶兰 VIGS和
瞬时过表达小兰屿蝴蝶兰,基因沉默影响胚珠初始数量;瞬时过表达导致雌蕊胚珠和柱头腔发育异常[62] MIR390a/b/c 春兰 过表达 拟南芥,转基因植株花药长径比增大、柱头分离、花粉量减少、种子败育率增加[63] CemiR396 建兰 过表达 烟草,转基因植株矮小、叶片变窄、花被严重弯曲、花药发育异常、部分不育[64] 续表 2 Continued table 2 性状
Trait基因
Gene来源
Source载体类型
Carrier type受体、结果及文献
Receptor, result and reference多糖合成
Polysaccharide
synthesisDoUGE 铁皮石斛 过表达 拟南芥,转基因植株多糖积累提高、盐胁迫和渗透胁迫耐受性提高[65] DoGMP1 铁皮石斛 过表达 拟南芥,转基因植株甘露糖含量增加、盐胁迫下萌发率提高[66] DoMYB75 铁皮石斛 过表达 拟南芥,转基因种子水溶性多糖含量增加14%[67] DoRWA3 铁皮石斛 过表达 拟南芥,转基因种子、叶片和茎中多糖的乙酰化水平显著提高[68] 抗逆性
Abiotic
stress tolerancePaCDPK1::GUS 蝴蝶兰 ‘TS97K’ 启动子融合GUS 拟南芥,转基因植株PaCDPK1基因表达受寒冷、伤害和病原体攻击诱导[69] CfJMT 蕙兰 过表达 番茄,转基因植株MeJA 生物合成基因转录水平升高[70] DcCIPk24 铁皮石斛 过表达 拟南芥,转基因植株对干旱和盐胁迫耐受性增强[71] DnMSI1 金钗石斛 过表达 拟南芥,转基因植株NaCl 胁迫耐受性降低[72] CgWRKY18 墨兰 过表达 拟南芥,转基因植株根变长,对盐和渗透胁迫耐受性增强[73] PaCBF1 台湾蝴蝶兰 过表达 拟南芥,转基因植株低温胁迫下细胞膜完整性好[74] 抗病性
Disease resistancePaAGO5a/b 台湾蝴蝶兰 VIGS 蝴蝶兰,过表达PaAGO5a/b植株叶片中CymMV和ORSV积累显著降低[75] DcMYC2b 铁皮石斛 过表达 拟南芥,过表达DcMYC2b感染飞燕草菌核病后损伤小[76] 生长发育
Growth and developmentDsCKX1 石斛兰 ‘Sonia’ 过表达 拟南芥,转基因植株生物量降低,根系生长迅速,离体形成根系能力下降[77] cfJMT 蕙兰 过表达 矮牵牛,转基因植株叶片变小,花粉发育异常[78] CgWRKY57 春兰 过表达 拟南芥,转基因植株根长和萌发率降低[79] CgARF1 春兰 过表达 拟南芥和烟草,转基因植株叶片老化,叶绿素含量降低[80] DcWOX4/9/11 铁皮石斛 过表达 拟南芥,DcWOX4过表达导致植株显著矮小,叶缘羽状深裂,花期推迟2周;DcWOX9过表达导致植株矮化,叶缘锯齿状,开花推迟1周,强表型植株雌雄蕊均不育;DcWOX11过表达导致叶缘向下卷曲[81] 叶发育
Leaf developmentDoeREB5 铁皮石斛 过表达 拟南芥,转基因植株叶片形状和叶柄大小改变[82] 叶色
Leaf colorCsERF2 墨兰 过表达 烟草,转基因植株叶绿素含量下降,叶绿体异常[83] 叶片数量
No. of leavesCcMYB24 兰 ‘TRIR’ 过表达 拟南芥,转基植株叶片数量增加[84] 2. 转基因和基因编辑
转基因技术是兰花分子育种核心技术之一。自Kuehnlehe等[104]利用基因枪法将PRV CP基因转入石斛兰原球茎以来,兰花转基因技术研究取得巨大进展(表3)。迄今已建立蝴蝶兰、石斛兰、文心兰、大花蕙兰C. hybrida、春兰、墨兰、寒兰C. kanran、万代兰Vanda和小扇叶兰Erycina pusilla等兰花转基因技术体系,主要转基因方法为农杆菌介导法和基因枪法,涉及的性状包括花型、花色、花期、花寿命、次生代谢物、抗病、抗逆和组培快繁特性等[85-131]。通过过表达外源基因或自身基因、基因沉默、RNAi和激活标签系统等手段已获得花色变深的蝴蝶兰‘TS444’[33]和‘V3’[94],花期提前的石斛兰[102],抗除草剂小扇叶兰[89],多糖和甘露糖含量高、抗逆性强的铁皮石斛[96],PLB 形成能力增强的蝴蝶兰[97],顶端分生组织形成多芽和花期提前的石斛兰[98],花瓣中出现红色斑点的南茜文心兰Oncidium Gower Ramsey[101]和寒兰[103],鲜切花寿命增加、花蕾脱落延迟的石斛兰[119],抗病毒的蝴蝶兰[122,124]、石斛兰[104, 123]和抗低温的蝴蝶兰[131]等转基因兰花。
表 3 兰花转基因技术研究状况Table 3. Research status on transgenic technology of orchid方法
Method目标基因
Target gene受体
Receptor载体类型
Carrier type结果及文献
Result and reference农杆菌介导法Agrobacterium-
mediated methodDOH1 石斛 Madame Thong-In自交 F1 过表达 获得154个多芽转化体[85] hptII,gusA 文心兰 Sherry Baby‘OM8’ 过表达 获得28株转基因植株[105] hpt,gfp 蝴蝶兰‘White Hikaru’ 过表达 gfp检出率73.30% [106] GUS 蝴蝶兰 S122-2×S153 和 S153×S119-4的 F1 过表达 获得88株转基因植株[107] ORSV CP 玉花兰 过表达 遗传转化率64.00% [108] nptII,hpt,GUS 兰 ‘RY’、 ‘L4’和‘L23’ 过表达 获得抗潮霉素转基因植株[109] hpt,GUS 石斛兰 Ekapol‘Panda 1’ 过表达 遗传转化率44.40% [110] etr1-1 齿舌兰 Stirling Tiger和
Sweet Sugar过表达 获得转基因植株[86] hpt 大花蕙兰 过表达 遗传转化率62.50% [111] GUS 朵丽蝶兰 Sogo Beach 过表达 获得转基因植株[112] ACS 石斛兰 过表达 遗传转化率12.15% [87] PhaNPR1 台湾蝴蝶兰 基因沉默 获得转基因植株 [88] wheatwin1,wheatwin2,nptII 万代兰 Kasem’s Delight
Tom Boykin过表达 获得转基因植株[113] GUS 墨兰‘企剑白墨’ 过表达 遗传转化率0.75% [114] MSRB7 小扇叶兰 过表达 获得抗除草剂转基因植株,遗传转化率0.60% [89] GUS 石斛兰 Formidible ‘Ugusu’ 过表达 遗传转化率18.50% [115] GUS 金钗石斛 过表达 遗传转化率27.30% [116] eGFP,HptII 台湾蝴蝶兰‘M1663’(4n)、
朵丽蝶兰 Join Angel ‘TH274-1’
(4n)和台湾蝴蝶兰(2n)过表达 遗传转化率1.20%~5.20% [117] C3H,C4H,4CL,CCR,IRX 铁皮石斛 CRISPR/Cas9 遗传转化率93.60% [90] AcF3H 石斛兰‘5N’ 过表达 遗传转化率10.13% [91] KNAT1 毛药石斛 过表达 遗传转化率70.00% [92] DcObgC-GUS/GFP 铁皮石斛 过表达 遗传转化率56.50[93] PeMYB11 蝴蝶兰 Sogo Yukidian‘V3’ 过表达 转基因植株花色素苷积累升高[94] GUS 金钗石斛 过表达 遗传转化率34.44%~82.44% [118] MADS 小兰屿蝴蝶兰 CRISPR/Cas9 获得转基因植株[95] DoUGP 铁皮石斛 过表达 转基因植株总多糖和甘露糖含量升高,抗逆性增强[96] AntiCpACO 石斛兰 Sonia ‘睡公主’ 过表达 转基因植株花蕾脱落延迟,切花寿命增加[119] PaSTM 台湾蝴蝶兰 过表达 转基因植株 PLB再生能力增强[97] 续表 3 Continued table 3 方法
Method目标基因
Target gene受体
Receptor载体类型
Carrier type结果及文献
Result and reference基因枪法
Particle
bombardmentPRV CP 石斛兰‘K1346’、‘K1347’、
‘K1348’和‘K1349’过表达 获得抗病毒植株[104] DOH1 石斛兰 Madame Thong-In 过表达,
反义表达过表达转基因植株芽形成和发育受抑制,反义转基因植株顶端分生组织形成多芽、开花早,遗传转化率60.00%[98] DOMADS1::GUS 石斛兰 Madame Thong-In 基因表达 获得转基因植株[99] GUS 金钗石斛 过表达 愈伤组织和类原球茎转化率分别为12%和2%[120] GFP 石斛兰 Sonia 17 过表达 获得转基因植株[121] CymMV CP 蝴蝶兰 ‘TS340’ 过表达 转基因植株抗Cym MV能力增强[122] CymMV-CS CP 石斛兰 Hickam Deb 过表达 转基因植株抗Cym MV能力增强[123] CymMV CP,Pflp 蝴蝶兰 ‘TS97K’ 过表达 获得双抗转基因植株[124] GUS 石斛兰Jaquelyn Thomas 过表达 遗传转化率19.87% [125] DcOSEP1 石斛兰 Madame Thong-In和
Chao Praya Smile过表达 获得转基因植株[100] GFP 石斛兰 Sonia 17 过表达 遗传转化率1.70% [126] EgTCTP 蝴蝶兰 过表达 转基因植株类原球茎芽分化更慢[127] OgCHS 文心兰‘南茜’ 过表达 转基因植株花瓣出现红色斑点[101] DOFT 石斛兰 Chao Praya Smile 过表达,RNAi 过表达转基因植株开花提早,RNAi植株开花延迟[102] CkCHS-1,CkDFR,CkANS 寒兰 过表达 转基因植株花瓣和唇瓣中出现红色斑点[103] 子房注射法
Ovary
injectionhpt,GUS 金钗石斛 过表达 获得转基因植株[128] GUS, Kan 紫宝石蝴蝶兰 过表达 遗传转化率3.10% [129] 花粉管通道法
Pollen tube
pathwayhptII 蝴蝶兰和朵丽蝶兰 过表达 获得52个转化体[130] AtCBF1 蝴蝶兰 过表达 获得抗低温转基因植株[131] 基因编辑技术是一种有效定向育种技术。Kui等[90]以原球茎为受体,通过农杆菌介导法建立了铁皮石斛CRISPR/Cas9基因编辑技术体系,C3H、C4H、4CL、CCR和IRX基因编辑效率为10%~100%。Tong等[95]以培养30 d的原球茎为受体,对小兰屿蝴蝶兰MADS基因进行编辑,从20个外植体中共获得47个突变体,其中,46个突变体在3个位点均发生突变,总突变率为97.90%。
3. 分子标记辅助选择
高密度遗传连锁图谱构建对QTL定位、基因克隆和分子标记辅助选择等具有重要作用。在石斛兰、蝴蝶兰和兜兰Paphiopedilum等兰花上已构建出了高密度分子遗传图谱(表4)[19, 132-139]。Lu等[135]以细茎石斛D. moniliforme×铁皮石斛杂交后代为作图群体,构建了含 8573个SLAF标记、19个连锁群的石斛兰分子遗传图谱,标记间平均距离为 0.32 cM,鉴定出5个与茎多糖含量相关的QTLs。 Li等[136]以100个金钗石斛和大苞鞘石斛D. wardianum F1杂交后代为作图群体,构建出含9564 个SNP标记、19个连锁群的石斛兰分子遗传图谱,标记间平均距离为 0.41 cM,鉴定出2个与茎长和1个与茎粗相关的QTLs。Hsu等[138]通过测序基因分型(Genotyping-by-sequencing,GBS)鉴定出1191个SNPs,基于1191个SNPs和22个SSRs构建出含19个连锁群的蝴蝶兰高密度分子遗传图谱,通过基因组关联分析(Genome-wide association study,GWAS),鉴定出7个与1个花部颜色相关联的SNPs。Li等[139]以同色兜兰Paph. concolor和带叶兜兰Paph. hirsutissimum的95个杂种后代为作图群体,构建出具有13个连锁群、8410个SNP标记的遗传图谱,标记间平均距离为0.19 cM,筛选出与叶长、叶宽、叶厚和叶数连锁的SNP标记共12个。
表 4 兰花分子遗传图谱构建Table 4. Construction of genetic map in orchid by molecular marker作图群体(F1)
Mapping
population植株数
No. of
plants标记类型
Type of
marker图谱长度/cM
Length of
genetic map连锁群数
No. of
linkage groups标记间距离/cM
Marker
interval参考文献
Reference铁皮石斛×重唇石斛 Dendrobium
officinale×D. hercoglossum90 RAPD, SRAP ♀629.40,
♂1 304.60♀14,
♂19♀11.20,
♂11.60[132] 铁皮石斛×钩状石斛
D. officinale×D. aduncum140 SRAP, SSR 1 580.40 27 11.89 [133] 金钗石斛×细茎石斛
D. nobile×D. moniliforme90 RAPD, ISSR ♀1 474.00,
♂1 326.50♀15,
♂16♀14.75,
♂14.88[134] 细茎石斛×铁皮石斛
D. moniliforme×D. officinal111 SNP 2 737.49 19 0.32 [135] 金钗石斛×大苞鞘石斛
D. nobile×D. wardianum100 SNP 3612.12 19 0.41 [136] 蝴蝶兰‘462’×蝴蝶兰‘20’
Phalaenopsis ‘462’×P. ‘20’88 AFLP ♀878.30,
♂820.30♀14,
♂15♀5.00,
♂6.70[137] 台湾蝴蝶兰×羞花蝴蝶兰
P. aphrodite×P. modesta184 RAD 3 075.80 22 1.00 [19] 台湾蝴蝶兰×小兰屿蝴蝶兰
P. aphrodite×P. equestris117 SNP l5 192.05 27 0.13 [138] 同色兜兰×带叶兜兰 Paphiopedilum
concolor×Paph. hirsutissimum95 SNP 1 616.18 13 0.19 [139] 王健等[140]利用RAPD分子标记对16种有香和无香春兰进行分析,筛选到引物BA0088,该引物在有香春兰中扩增出一条特异性370 bp条带,带型清晰,重复性好。刘泽强[141]利用大花蕙兰和墨兰杂交后代F1群体筛选到2个与兰花香气性状紧密连锁的ISSR标记b19和b21,b19对兰花有香后代的预测准确率为84%、b21的预测准确率为88%,双标记预测准确率为98%。李晓红[142]筛选到8个与兰花纯黄绿色花连锁的SSR标记,这些标记辅助纯黄绿色花选择的准确率为52%~100%。肖文芳等[143]以黄金豹蝴蝶兰P. Frigdaas Oxford和白天使蝴蝶兰P. Join Angel及其杂交后代为材料,筛选到2个与蝴蝶兰花底色关联的SNP标记,Marker35886和Marker70907的2个SNP位点对花底色的鉴定准确率分别为66.67%和73.33%,双标记鉴定准确率达93.33%。
4. 展望
兰花种类繁多、用途广泛、市场前景广阔。随着经济发展和人们个性化需求的增加,市场对兰花新品种的需求逐渐提高,如何快速高效选育兰花新品种,满足市场需求已成为育种家急需解决的问题。分子育种能够最大限度利用种质资源,快速定向培育兰花新品种,目前已成为兰花育种方法研究的热点[2,5]。随着组学技术的发展,分子育种技术将成为影响兰花新品种选育、决定产业竞争力和高质量发展的关键核心技术。
21世纪以来,兰花分子育种技术研究取得了巨大进步,但鲜见利用分子育种方法培育出兰花新品种的报道,原因是兰花转基因、基因编辑和分子标记辅助选择等技术还处于技术研发阶段,且目前的研究主要是从技术创新而非品种创新的角度进行的。为了将分子育种技术更好地应用于品种创新,今后应加强以下几个方面的研究工作。
1)加强优良商业化品种转基因技术研究,建立稳定高效兰花转基因技术体系。转基因技术不仅是转基因和基因编辑育种的技术基础,也是挖掘兰花主要育种目标性状基因的关键技术。目前兰花转基因技术只在蝴蝶兰、石斛等少数兰花的个别材料中取得成功,而且转基因效率不高,今后应研究其他主要商业化兰花和优良品种的高效转基因技术,为选育具有商业化应用前景的兰花新品种奠定基础。
2)加强遗传图谱构建和标记辅助选择技术研究,构建以SSR、Indel等分子标记为主的高密度分子遗传图谱,建立分子标记辅助主要育种目标性状选择技术体系。虽然目前已构建出几种兰花高密度分子遗传图谱,但这些图谱主要是SNP标记图谱,育种应用价值不高,已建立分子标记辅助选择技术的只有花香和黄绿色花等少数性状,今后应加强筛选与育种早期无法选择或选择难度大、成本高和准确率低的性状紧密连锁分子标记,建立其辅助目标性状选择技术,实现育种早期高效定向选择的目的,以进一步提高育种效率和效益。
3)加强控制主要育种目标性状的主效基因挖掘。不管是转基因还是基因编辑育种,获得功能基因是前提,目前虽然鉴定出许多育种目标性状基因,但这些基因都是通过反向遗传学方法获得的,多数基因的功能未经验证,其效应和遗传规律不清楚,今后应加强采用正向遗传学方法或结合传统遗传学研究结果挖掘关键基因。
4)加强兰花基因编辑技术研究。利用CRISPR/Cas9 编辑兰花基因效率高[90,95],显示出其在兰花育种上的巨大应用潜力。因此,大力加强兰属兰花、卡特兰、文心兰等兰花基因编辑技术研究、建立基因编辑技术体系,对进一步推动兰花育种和产业高质量发展具有重要意义。
-
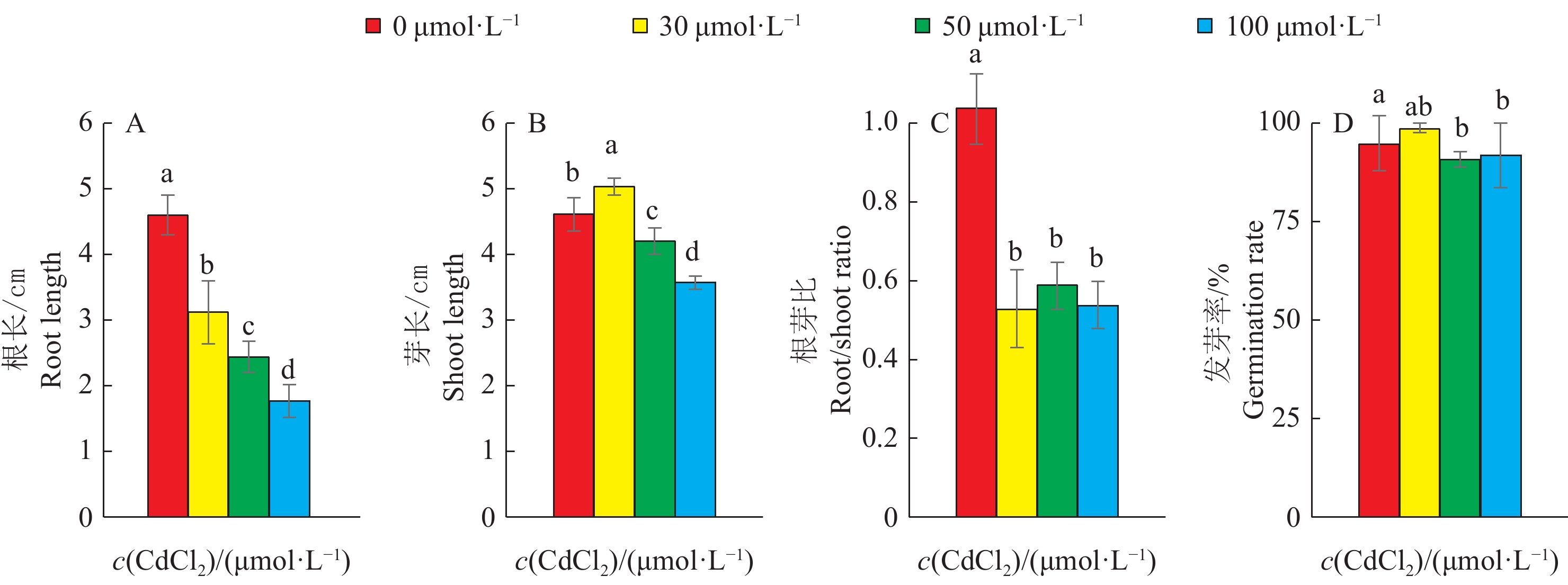
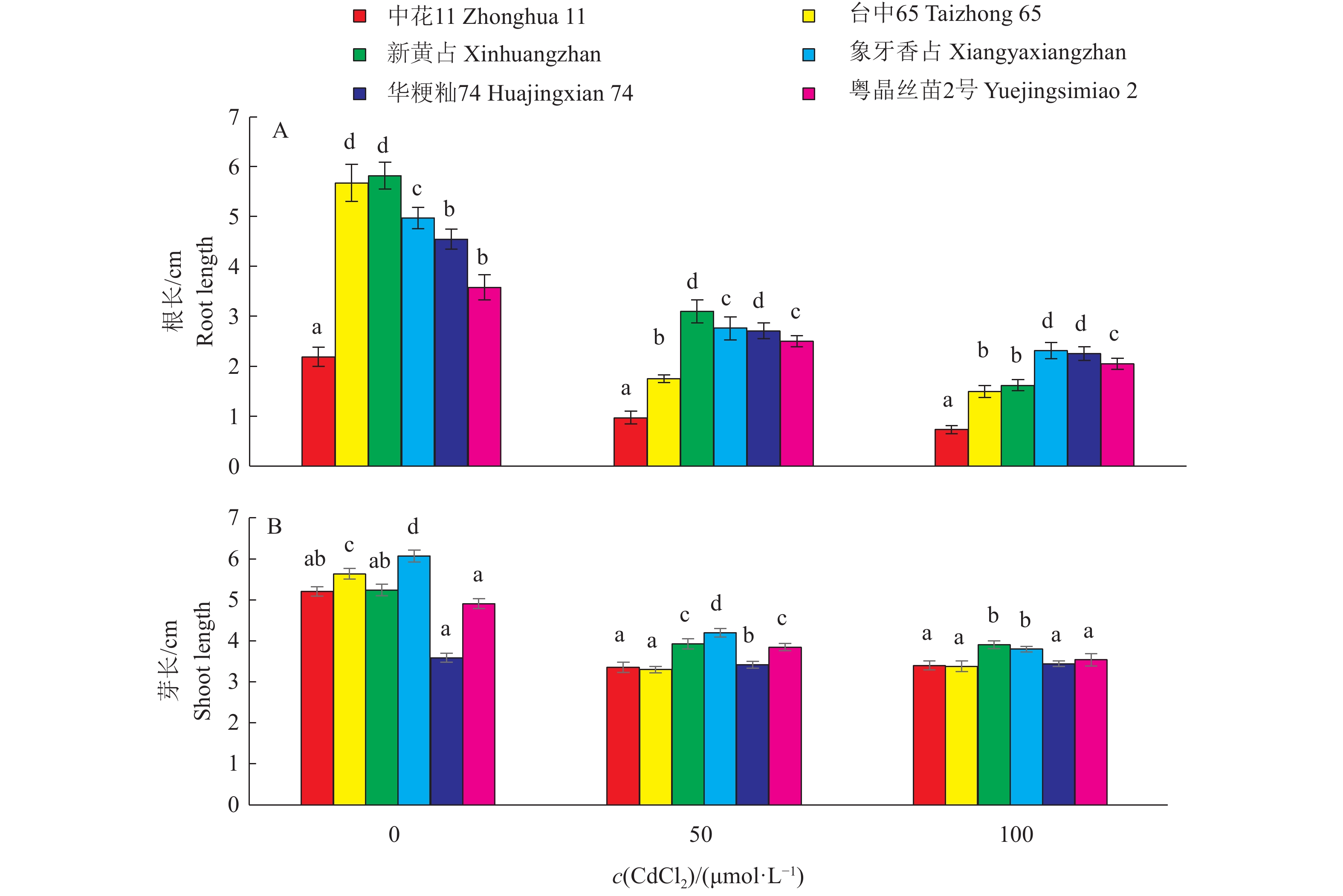
图 3 栽培稻品种在不同CdCl2处理浓度下的根长与芽长
相同CdCl2浓度不同柱子上的小写字母表示不同品种间差异显著(P<0.05,Duncan’ s法)
Figure 3. Root and shoot length of cultivated rice varieties at different CdCl2concentrations
Different lowercase letters on the columns of the same CdCl2 concentration indicate significant differences (P<0.05,Duncan’ s test)
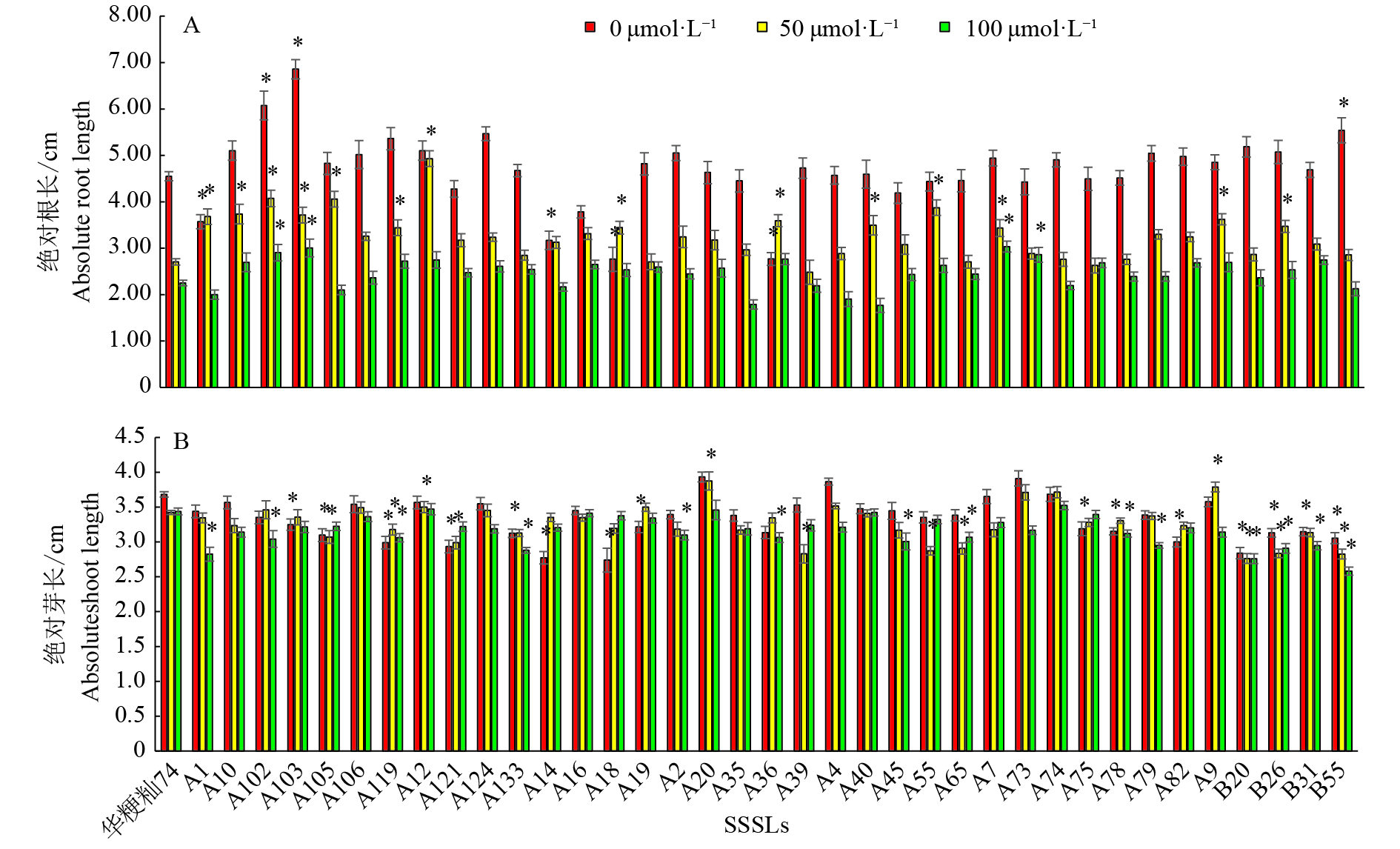
图 5 不同SSSLs在不同CdCl2处理浓度下根长和芽长的差异
“*”表示供试材料的相关性状值与‘华粳籼74’在P=0.01水平差异显著(单因素方差分析)
Figure 5. Differences of root and shoot length in SSSLs at different CdCl2 concentrations
“*” represents significant difference of relative character between experimental material and ‘Huajingxian 74’ at P=0.01 level (One-way ANOVA)
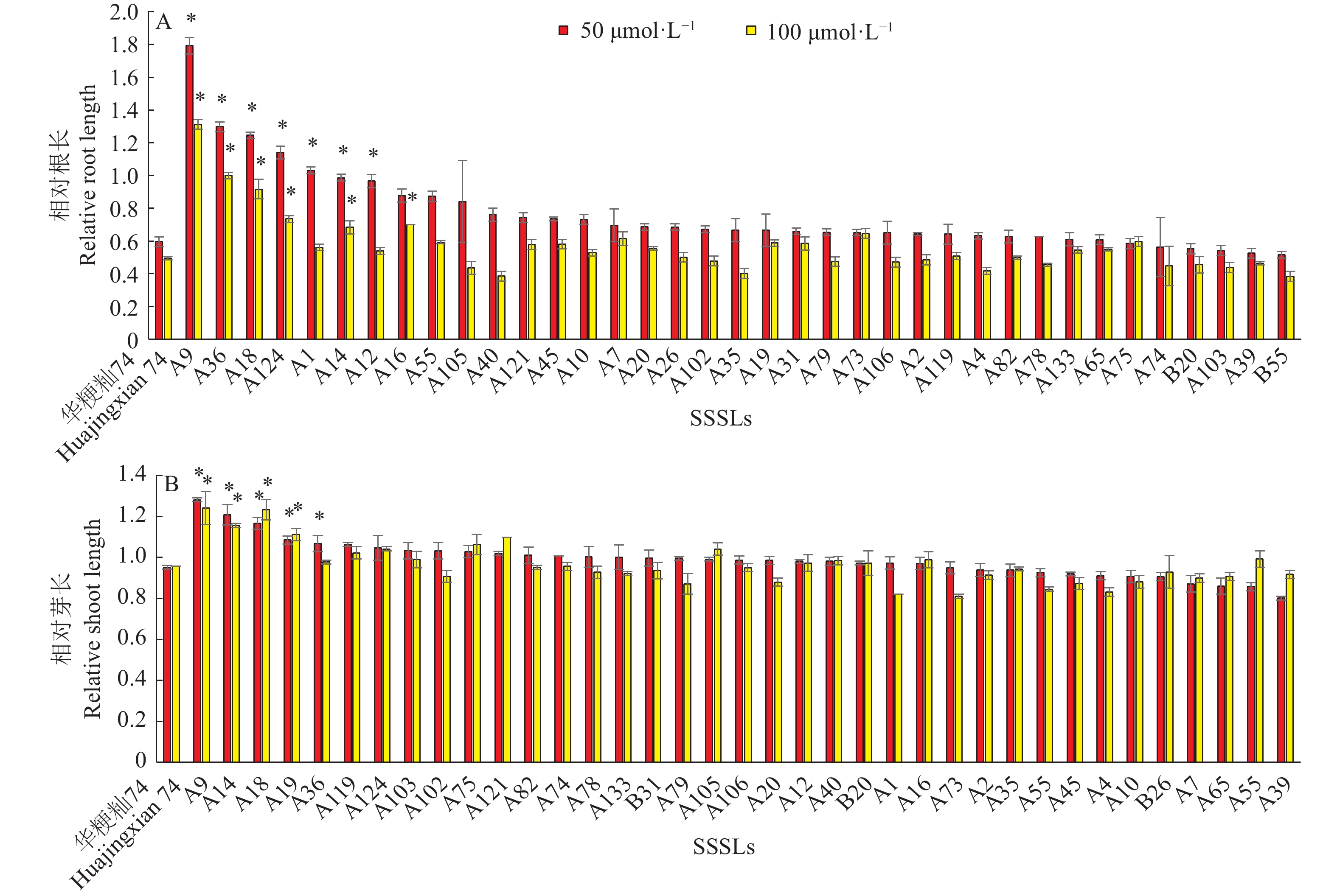
图 6 不同SSSLs在不同CdCl2处理浓度下相对根长和相对芽长的差异
“*”表示供试材料的相关性状值与‘华粳籼74’在P=0.01水平差异显著(单因素方差分析)
Figure 6. Differences of relative root and shoot length in SSSLs at different CdCl2 concentrations
“*” represents significant difference of relative character between experimental material and ‘Huajingxian 74’ at P=0.01 level (One-way ANOVA)
表 1 相对根长及相对芽长QTLs及其遗传效应1)
Table 1 Identified QTLs and genetic effects for relative root and shoot length
性状
CharacterSSSLs QTL 染色体
Chromosome位置
Position加性效应
Additive effect表型贡献率/%
Phenotypic contribution rate50 μmol·L−1
CdCl2100 μmol·L−1
CdCl250 μmol·L−1
CdCl2100 μmol·L−1
CdCl2相对根长
Relative root lengthA36 qRRL1-1 1 PSM012-RM572 0.35 0.25 59.08 50.91 A14 qRRL1-1 1 RM490-RM572 0.20 0.09 32.86 18.99 A9 qRRL1-1 1 RM490-RM572 0.60 0.41 100.59 82.63 A12 qRRL1-1 1 RM490-RM449 0.19 — 31.18 — A18 qRRL2-1 2 PSM375-end 0.33 0.21 54.71 42.53 A16 qRRL3-1 3 end-RM489 — 0.10 — 20.71 A1 qRRL3-2 3 RM3280-PSM379 0.22 — 36.64 — A124 qRRL6-1 6 PSM388-RM454 0.27 0.12 45.80 24.14 相对芽长
Relative shoot lengthA19 qRSL1-1 1 end-PSM024 0.08 0.08 8.40 7.98 A36 qRSL1-2 1 PSM012-RM572 0.07 — 7.43 — A14 qRSL1-2 1 RM490-RM572 0.14 0.10 15.02 10.27 A9 qRSL1-2 1 RM490-RM572 0.18 0.14 18.95 14.70 A18 qRSL2-1 2 PSM375-end 0.12 0.14 12.76 14.29 1) “—”表示未检测到QTL
1) “—” represents no QTL detected -
[1] 陶战. 农业环境中的Cd[J]. 环境保护, 1978(6): 31-33. [2] 何俊瑜, 任艳芳, 任明见, 等. 不同品种水稻种子萌发和幼苗生长的耐Cd性评价[J]. 中国农学通报, 2010, 26(9): 184-189. [3] 孟桂元, 唐婷, 周静, 等. 不同水稻品种种子萌发及根芽生长的耐Cd性差异研究[J]. 杂交水稻, 2015, 30(5): 65-69. [4] 孙亚莉, 刘红梅, 徐庆国. Cd胁迫对不同水稻品种种子萌发特性的影响[J]. 中国水稻科学, 2017, 31(4): 425-431. [5] 江淼, 余海娟, 李亮, 等. 水稻核心种质的耐Cd性鉴定[J]. 植物生理学报, 2015, 51(10): 1617-1624. [6] ISHIKAWA S, ABE T, KURAMATA M, et al. A major quantitative trait locus for increasing cadmium-specific concentration in rice grain is located on the short arm of chromosome 7[J]. J Exp Bot, 2010, 61(3): 923-934. doi: 10.1093/jxb/erp360
[7] HU D W, SHENG Z H, LI Q L, et al. Identification of QTLs associated with cadmium concentration in rice grains[J]. J Integr Agr, 2018, 17(7): 1563-1573. doi: 10.1016/S2095-3119(17)61847-1
[8] 程旺大, 姚海根, 张国平, 等. Cd胁迫对水稻生长和营养代谢的影响[J]. 中国农业科学, 农学通报, 2017, 33(17): 76-81. [9] DUAN G, SHAO G, TANG Z, et al. Genotypic and environmental variations in grain cadmium and arsenic concentrations among a panel of high yielding rice cultivars[J]. Rice, 2017, 10. doi: 10.1186/S12284-017-0149-2.
[10] 姚春馨, 隆四清, 和立忠, 等. 水稻镉积累基因型差异及其对镉胁迫的反应[J]. 湖南农业大学学报, 2007, 8(33): 37-41. [11] 林晗, 徐江民, 胡珊倩, 等. 水稻耐金属离子胁迫的QTL分析[J]. 中国水稻科学, 2018, 32(1): 23-34. [12] ZHANG M, PINSON S R M, TARPLEY L, et al. Mapping and validation of quantitative trait loci associated with concentrations of 16 elements in unmilled rice grain[J]. Theor App Gene, 2014, 127(1): 137-165. doi: 10.1007/s00122-013-2207-5
[13] LUO J, HUANG J, ZENG D, et al. A defensin-like protein drives cadmium efflux and allocation in rice[J]. Nat Commun, 2018, 9(1): 645-654. doi: 10.1038/s41467-018-03088-0
[14] SUI F Q, ZHAO D K, ZHU H T, et al. Map-based cloning of a new total loss-of-function allele of OsHMA3 causes high cadmium accumulation in rice grain[J]. J Exp Bot, 2019, 70(10): 2857-2871. doi: 10.1093/jxb/erz093
[15] 林辉锋, 熊君, 林文熊. 水稻苗期耐Cd胁迫的QTL定位分析[J]. 中国农学通报, 2009, 25(9): 26-31. [16] XUE D, CHEN M, ZHANG G. Mapping of QTLs associated with cadmium tolerance and accumulation during seedling stage in rice (Oryza sativa L.)[J]. Euphytica, 2009, 165(3): 587-596. doi: 10.1007/s10681-008-9785-3
[17] 陈志德, 仲维功, 王军, 等. 水稻苗期耐Cd2+胁迫的QTL定位研究[J]. 南京农业大学学报, 2010, 33(3): 1-5. [18] 李炜星, 欧阳林娟, 文文, 等. 水稻幼苗耐镉胁迫QTL的定位研究[J]. 江西农业大学学报, 2019, 41(1): 19-24. [19] ISHIKAWA S, AE N, YANO M. Chromosomal regions with quantitative trait loci controlling cadmium concentration in brown rice (Oryza sativa)[J]. New Phytol, 2005, 168(2): 345-350. doi: 10.1111/j.1469-8137.2005.01516.x
[20] ABE T, NONOUE Y, ONO N, et al. Detection of QTLs to reduce cadmium content in rice grains using LAC23/Koshihikari chromosome segment substitution lines[J]. Breed Sci, 2013, 63(3): 284-291. doi: 10.1270/jsbbs.63.284
[21] ZHAO J, YANG W, ZHANG S, et al. Genome-wide association study and candidate gene analysis of rice cadmium accumulation in grain in a diverse rice collection[J]. Rice, 2018, 11. doi: 10.1186/s12284-018-0254-x.
[22] 钟代彬, 罗利军, 应存山. 野生稻有利基因转移研究进展[J]. 中国水稻科学, 2000, 14(2): 103-106. doi: 10.3321/j.issn:1001-7216.2000.02.008 [23] ZHAO H, SUN L, XIONG T, et al. Genetic characterization of the chromosome single-segment substitution lines of O. glumaepatula and O. barthii and identification of QTLs for yield-related traits[J]. Mol Breed, 2019, 39(4). doi: 10.1007/s11032-019-0960-0.
[24] PATERSON A H, DeVERNA J W, LANINI B, et al. Fine mapping of quantitative trait loci using selected overlapping recombinant chromosomes, in an interspecies cross of tomato[J]. Genetics, 1990, 124(3): 735-742.
[25] McCOUCH S R, CHO Y G, YANO M, et al. Report on QTL nomenclature[J]. Rice Genet Newsl, 1997, 14: 11-13.
[26] ESHED Y, ZAMIR D. An introgression line population of Lycopersicon pennellii in the cultivated tomato enables the identification and fine mapping of yield-associated QTL[J]. Genetics, 1995, 141(3): 1147-1162.
[27] SONG Y, WANG Y, MAO W, et al. Dietary cadmium exposure assessment among the Chinese population[J]. PLoS One, 2017, 12(5): e0177978. doi: 10.1371/journal.pone.0177978
[28] NORDBERG G F. Historical perspectives on cadmium toxicology[J]. Toxicol Appl Pharmacol, 2009, 238(3): 192-200. doi: 10.1016/j.taap.2009.03.015
[29] 马孟莉, 卢丙越, 刘艳红, 等. 镉对云南省主栽水稻品种幼苗生长的影响[J]. 江苏农业科学, 2014, 42(3): 50-52. [30] 陈毓瑾, 欧阳林娟, 朱红, 等. 常规水稻耐镉性及镉低积累种质的筛选[J]. 石河子大学学报(自然科学版), 2017, 35(6): 701-706.



 下载:
下载: