Isolation, identification and phylogenetic analysis of a ranavirus isolated from Rana nigromaculata
-
摘要:目的
为探究四川某养殖场黑斑蛙Rana nigromaculata蝌蚪爆发传染病病因。
方法通过对患病蝌蚪进行病理学检查与病毒分离,并结合人工感染试验、电镜观察、PCR检测和系统发育分析对分离的病原进行鉴定。
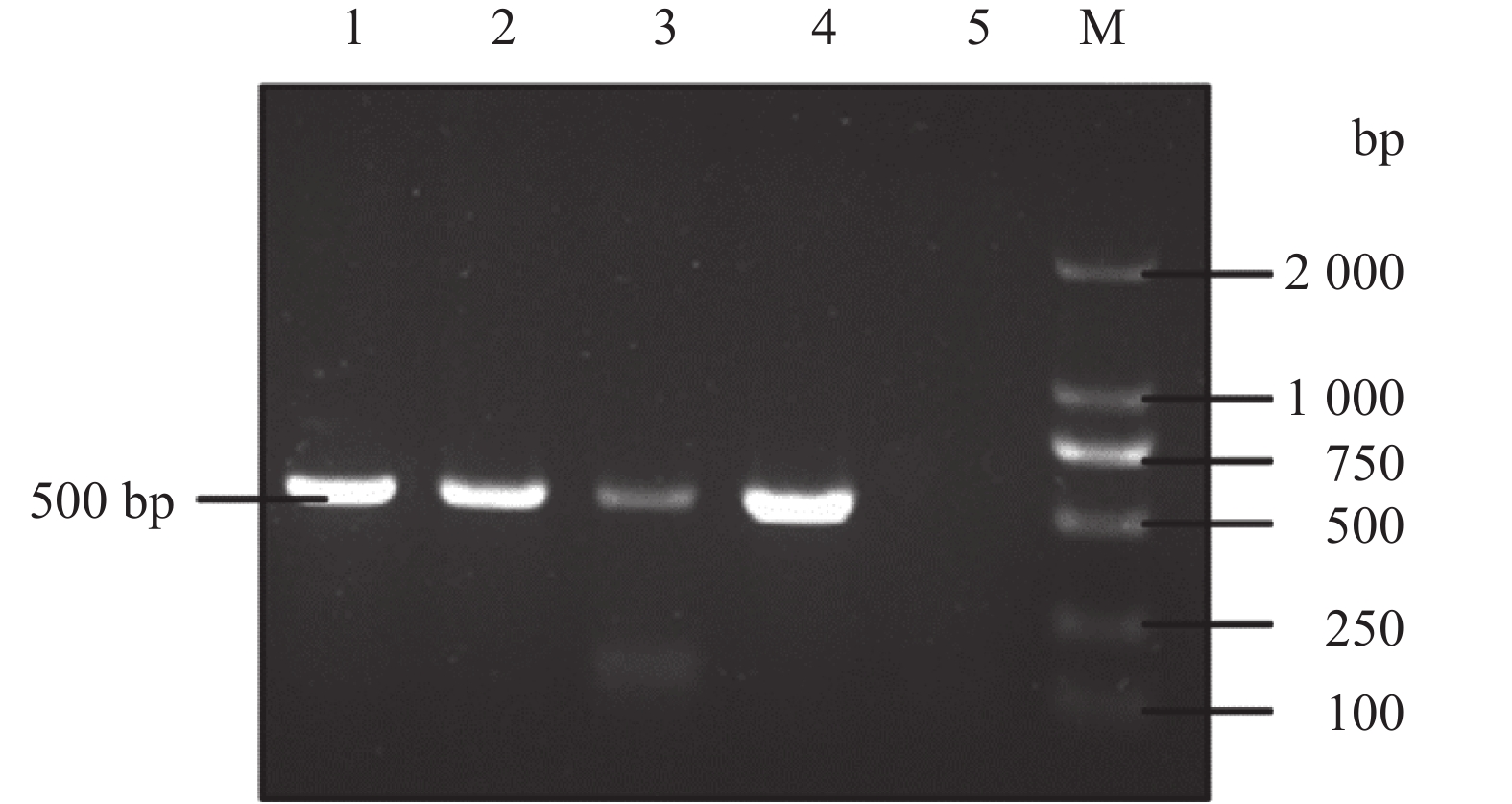
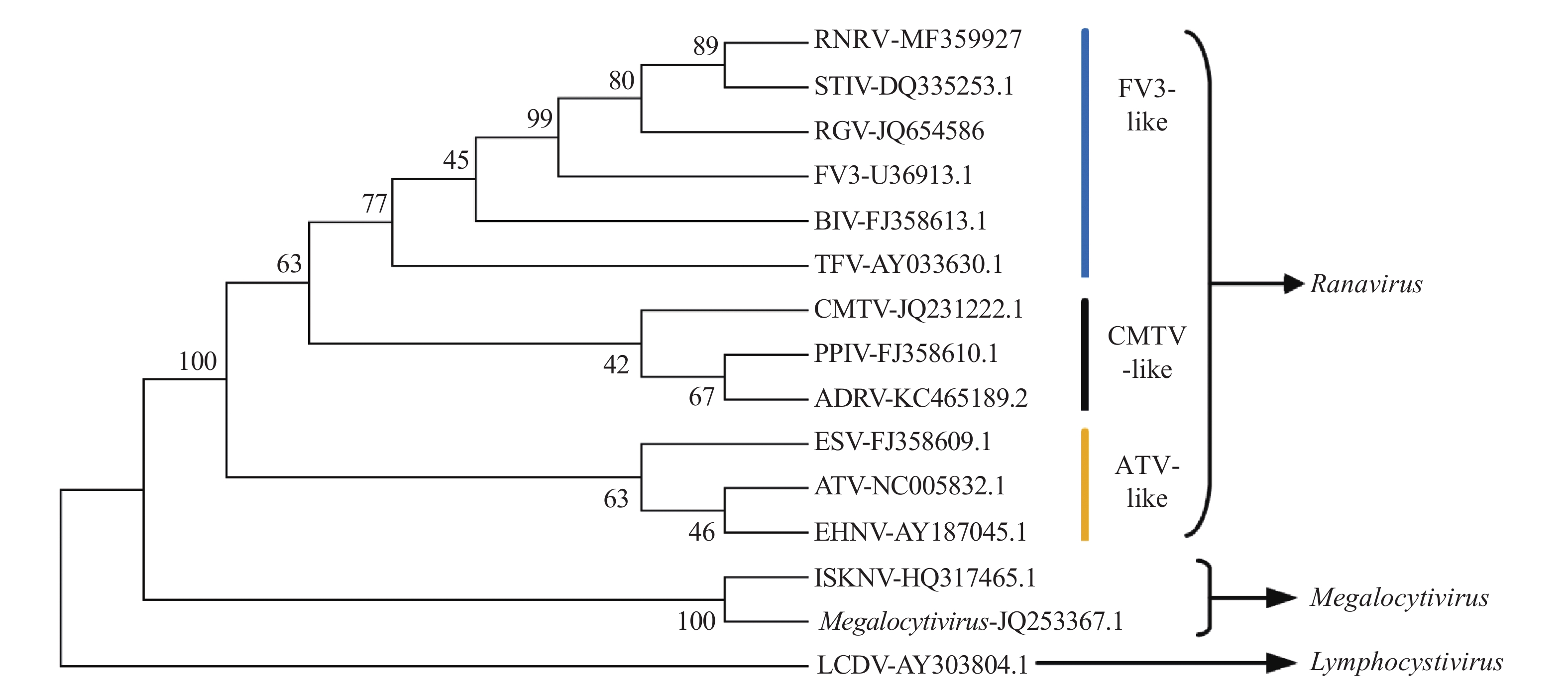
结果黑斑蛙患病蝌蚪主要临床特征为体表出血、腹部肿胀、腹腔内淡黄色腹水;组织病理学上,患病蝌蚪肝、肾、脾与胰腺等组织器官受损,出现明显的变性与坏死病灶,且在一些病变细胞胞浆内见嗜碱性包涵体。患病蝌蚪组织匀浆接种鲤鱼上皮瘤(EPC)细胞,25 ℃培养4 d后出现明显细胞病变效应(CPE),TCID50为108 mL–1。用病毒液进行人工感染试验,感病蝌蚪表现出与自然患病蝌蚪相似的症状,死亡率达到80%,证实分离病毒的病原性。电镜观察发现,病毒颗粒为正六边形,有囊膜,对角线直径(135±8) nm,在胞质中呈晶格状排列或游离状。针对蛙病毒MCP基因的PCR检测显示,自然患病蝌蚪、饲养水源以及分离病毒均为阳性,基于MCP全序列的遗传进化分析发现,分离病毒与蛙病毒属病毒的相似性在99%以上,且与蛙病毒属FV3病毒类群聚为同一分支。
结论证实导致此次黑斑蛙蝌蚪大量死亡的病原为蛙病毒属病毒,将其命名为黑斑蛙蛙病毒(Rana nigromaculata ranavirus,RNRV)。
Abstract:ObjectiveTo explore the etiology of a serious infectious disease occured in Rana nigromaculata tadpoles in a farm of Sichuan Province.
MethodPathological examination and virus isolation were carried out for the diseased tadpoles of R. nigromaculata. The isolated pathogen was identified by artificial infection test, transmission electron microscopy, PCR detection and phylogenetic analysis.
ResultExternal clinical signs included hemorrhage on body surface and swollen abdomen with yellow ascites. Based on histopathological observation, we found that liver, spleen, kidney, pancreas and other organs had damages with obvious degeneration and necrosis focus, and basophilic inclusions appeared in the cytoplasm of some pathological cells. The tissue homogenates of diseased tadpoles were inoculated into epithelioma papulosum cyprini (EPC) cells under 25 ℃ and caused typical cytopathic effect (CPE) after four days with the TCID50 of 108 mL–1. In the artificial infection test of virus fluid, the tadpoles showed the symptoms similar to those observed in naturally infective tadpoles and the mortality reached 80%, which suggested that the isolated virus was the determined pathogen of this disease. Transmission electron microscopic observation showed that the virus was regular hexagon with capsule, the diagonal diameter was (135±8) nm, and virus particles arrayed in crystalline or freely in the cytoplasm. PCR examination of the MCP gene showed positive results for samples of diseased tadpoles, aquaculture water source and isolated virus. Phylogenetic analysis based on MCP gene sequences indicated that the sequence of isolated virus had above 99% similarity to ranavirus, and the isolated virus belonged to the FV3-like virus group.
ConclusionThis study confirmed that ranavirus was the causative agent of this outbreak, and the virus is named as Rana nigromaculata ranavirus (RNRV).
-
全氟辛酸(Perfuorooctanoic aid, PFOA)是一种耐光解、水解和生物降解的人工合成的全氟类化合物,因含有诸多碳氟键而具有极其稳定的性质,常被用作防油脂或防水剂以及衣服、家具和其他产品的保护性涂层,此外还可用作地板抛光剂、黏合剂、消防泡沫和电线绝缘等[1-3]。随着PFOA的广泛应用,在大气、河流、土壤等环境介质中均检测出PFOA残留:上海市41个室内灰尘样本中PFOA平均质量分数为279.4 ng/g,长江流域重庆段地表水中PFOA的检出率为100%,质量浓度在1.16~49.87 ng/L之间,全国31个省(自治区、直辖市)土壤中PFOA 的平均质量分数为0.35 ng/g[4-6],人类和动物可通过饮食饮水等方式暴露于PFOA,且由于PFOA半衰期长,有生物累积效应,故能在体内聚积,进而引发毒性,但不同物种、不同暴露年龄,引发毒性的浓度不同且差异较大[7]。研究发现,PFOA具有免疫毒性、发育毒性和内分泌干扰毒性[8]。在雌性生殖系统中,PFOA暴露会抑制卵巢激素分泌,损害卵泡发育,导致卵巢功能丧失[9]。并且PFOA还可通过氧化应激和凋亡显著抑制孕鼠黄体功能[10]。此外,新生大鼠注射PFOA可以减少生长卵泡和次级卵泡的数量[11]。虽然已有研究报道了PFOA暴露对生殖系统的影响,但关于PFOA对卵母细胞影响的研究依然很少。已知PFOA可以通过血卵屏障进入卵泡液[12],本试验通过给小鼠灌服PFOA模拟体内暴露来探讨其对小鼠卵母细胞成熟率及成熟质量的影响。通过检测活性氧(Reactive oxygen species,ROS)水平、纺锤体形态、细胞骨架来评估卵母细胞暴露于PFOA后的细胞变化。本研究将有助于揭示PFOA影响卵母细胞发育过程的毒理学机制,并引起人们对PFOA安全性的关注。
1. 材料与方法
1.1 材料
1.1.1 试验动物
6周龄体质量相近的昆明雌性小鼠,购买于广东省实验动物中心。
1.1.2 试剂
PFOA(171468, Sigma),ROS检测试剂盒 (S0033, Beyotime),β-tubulin (T5293, Sigma),内磷酸化组蛋白H2A.X(Phospho-histone H2A.X,P-H2A.X,sc-51748, Santa Cruz),FITC偶联山羊抗鼠IgG (A11029, LIFE),Hoechst 33342 (H3570, LIFE),孕马血清促性腺激素(PMSG,宁波第二激素厂),人绒毛膜促性腺激素(hCG,宁波第二激素厂),透明质酸酶(H3506,Sigma)
1.1.3 试剂配制
PFOA:超纯水溶解,配制不同浓度的PFOA以使得最终基于小鼠体质量的质量分数为0、5、10和20 mg/kg。
1.1.4 仪器
CO2培养箱,体视显微镜,荧光倒置显微镜。
1.2 方法
1.2.1 试验动物分组
将160只6周龄的昆明小鼠随机分为对照组、低剂量组、中剂量组和高剂量组,每个剂量组5个重复,每个重复8只小鼠。分笼后,先适应环境7 d,再进行药物灌服试验。饲养环境为12 h光照、12 h 黑暗交替,饮食饮水自由。
1.2.2 药物灌服处理
适应环境1周后,以每天0、5、10、20 mg/kg的剂量分别给对照组、低剂量组、中剂量组和高剂量组小鼠灌服PFOA,每次灌服0.2 mL,连续灌服14 d。剂量及时间的选定参照PFOA相关的体内试验[13]。
1.2.3 卵母细胞的收集
小鼠连续灌服PFOA 2周后进行超排处理,每只小鼠注射10 IU PMSG,间隔48 h后注射10 IU hCG,再间隔13.5 h后颈部脱臼处死,用体积分数为75%的乙醇溶液浸泡30 s消毒,随后解剖取出输卵管,找到膨大部,在含有PBS缓冲液的培养皿中用尖头镊撕开膨大部,用口吸管移出卵母细胞,放入预热好的1 g/L的透明质酸酶溶液中,处理2 min,待颗粒细胞脱掉以后将卵母细胞转移至PBS缓冲液中洗3遍。收集同一剂量处理组的小鼠卵母细胞至少100个。
1.2.4 统计卵母细胞成熟率
卵母细胞排出第一极体视为成熟,取出卵母细胞后统计第一极体的排出率。
1.2.5 卵母细胞活性氧含量的检测
每个剂量组随机取25~30个卵母细胞放入含有1 μmol/L DCFH-DA的成熟培养液液滴中洗涤2~3遍,再放入37 ℃、CO2体积分数为5%的培养箱孵育20 min。而后用DPBS-PVA缓冲液洗3次,每次1 min。在荧光显微镜下用同一曝光参数观察并拍照,应用ImageJ软件分析平均荧光强度[14]。
1.2.6 卵母细胞免疫荧光染色分析
四孔板每个孔加入200 μL固定液,然后置于37 ℃、CO2体积分数为5%的培养箱预热30 min,每个剂量组随机取25~30个卵母细胞置入四孔板中,于培养箱中固定30 min。然后将卵母细胞放入加有洗脱缓冲液的四孔板中于培养箱内封闭2 h。再用β-tubulin(按照1∶1000的体积比稀释)或P-H2A.X(按照1∶200的体积比稀释) 4 ℃条件下孵育过夜。次日用洗脱缓冲液洗涤3次,每次10 min。然后与FITC偶联山羊抗鼠IgG(按照1∶100的体积比稀释)在37 ℃条件下孵育1 h。之后,避光环境下用洗脱缓冲液洗涤3次,每次10 min。用Hoechst 33342室温下进行DNA染色5 min。最后,将卵母细胞固定在载玻片上,并在荧光显微镜下观察和拍照。
1.3 统计分析
每组试验重复5次,用SPSS 23.0进行单因素方差分析,采用LSD法进行多重比较分析,数据结果以平均值±标准误表示,作图软件为GraphPad 8。
2. 结果与分析
2.1 灌服PFOA抑制小鼠卵母细胞体外成熟
与对照组相比,每日灌服不同剂量(5、10和20 mg/kg)PFOA小鼠的卵母细胞成熟率有明显下降(表1)。10和20 mg/kg剂量组小鼠的卵母细胞成熟率分别下降了14.28%和28.17%;5 mg/kg剂量组和对照组差异不显著(P>0.05),10 mg/kg组和对照组差异显著(P<0.05),20 mg/kg组和对照组差异极显著(P<0.01)。5、10和20 mg/kg组别之间两两相比差异显著(P<0.05)。
表 1 PFOA对小鼠卵母细胞成熟率的影响Table 1. Effect of PFOA on maturation of mouse oocytes每日剂量/(mg·kg−1)
Daily dose细胞总数
Total cell count第一极体排出率1)/%
Discharge rate of first polar body0(CK) 108 91.23±0.010a 5 111 85.50±0.123a 10 104 78.20±0.015b 20 101 65.53±0.372c 1) 同列数据后的不同小写字母表示差异显著(P<0.05, LSD法)
1)Different lowercase letters in the same column indicate significant differences(P<0.05, LSD method)2.2 灌服PFOA诱发卵母细胞氧化应激
与对照组相比,每日灌服不同剂量PFOA小鼠的卵母细胞内ROS含量有明显升高(图1)。10和20 mg/kg组中卵母细胞内ROS含量分别升高了135%和177%;5 mg/kg组和对照组差异不显著(P>0.05),10和20 mg/kg组与对照组相比差异显著(P<0.05),10与20 mg/kg组之间差异不显著(P>0.05)(图2)。
2.3 灌服PFOA诱发卵母细胞DNA损伤
每日灌服不同剂量PFOA的小鼠卵母细胞P-H2A.X免疫荧光结果显示,细胞内DNA损伤情况有明显升高(图3)。其中,5、10和20 mg/kg组P-H2A.X 比例分别比对照组升高了47%、133%和171%。5 mg/kg组与对照组差异显著(P<0.05),10、20 mg/kg组与对照组相比差异极显著(P<0.01),10和20 mg/kg组之间差异不显著(P>0.05)(图4)。
2.4 灌服PFOA诱发卵母细胞骨架受损
每日灌服不同剂量PFOA的小鼠卵母细胞β-tubulin、Hoechst 33342免疫荧光结果显示,细胞内纺锤体形态和染色体排列有明显异常(图5),且与PFOA剂量呈正相关。与对照组相比,10和20 mg/kg组中卵母细胞β-tubulin形态异常,染色体非整齐排列的比例分别升高了65.06%和75.60%。5 mg/kg组与对照组差异不显著(P>0.05),10、20 mg/kg组与对照组相比均差异显著(P<0.05),10和20 mg/kg组之间差异不显著(P>0.05)(图6)。
3. 讨论与结论
近年来,人们对环境污染物的关注度越来越高。PFOA作为一种稳定的有机化合物给工业和制造业带来便利的同时也带来了诸多“副作用”。PFOA在环境中持久存在,使得人类或动物很容易受到污染。饮食、饮水是人类暴露PFOA的主要途径。本试验通过给小鼠灌服PFOA模拟人类的暴露途径,观察PFOA对雌性哺乳动物的生殖毒性。结果证实了PFOA可通过氧化应激、DNA损伤和细胞骨架受损降低卵母细胞成熟率以及成熟质量。
ROS是细胞代谢的天然副产物,对细胞信号转导、稳态调节有着重要作用。当ROS的产生和中和不平衡时就会引起氧化应激。过量的ROS会导致脂质过氧化、蛋白降解、DNA损伤等[15]。研究发现,环境污染物和毒素往往会增加细胞内ROS的产生,最终诱导细胞内氧化应激并发挥毒性[16]。已有研究表明PFOA可引起小鼠卵巢内ROS升高,且呈剂量依赖性[15]。为了研究PFOA对卵母细胞发育能力的影响,我们检测了细胞内ROS水平,发现PFOA可显著增加细胞内ROS含量,诱导氧化应激,进而抑制卵母细胞发育,且剂量越高,氧化应激越强。
据报道,ROS相关氧化应激可诱导DNA损伤[17]。P-H2A.X被用作鉴定DNA损伤,在细胞发生DNA双链断裂的数分钟内,H2AX的139位丝氨酸残基被ATM、ATR、PRKC基因磷酸化形成P-H2A.X。因此,P-H2A.X的出现与DNA双链断裂紧密关联,故其可作为DNA双链断裂的标志物[18]。已有研究报道毒性化学制剂可诱导细胞DNA损伤,如双酚AF(Bisphenol AF)通过增加氧化应激和DNA损伤对小鼠卵母细胞体外成熟产生负面影响,对羟基苯甲酸丁酯(Butylparaben)通过DNA损伤抑制猪卵母细胞的体外成熟[19-20]。于是我们猜测,PFOA暴露会诱导卵母细胞DNA双链断裂。试验结果也证实了我们的猜想,PFOA处理组的P-H2A.X阳性卵母细胞比例显著高于对照组,提示PFOA暴露可通过诱导DNA双链断裂来抑制卵母细胞的成熟。
在减数分裂进程中,染色体的正确分离主要取决于染色体−微管的稳定连接。纺锤体微管的形态异常引起染色体的错误分离,导致卵母细胞和进一步胚胎发育过程中产生异倍体和基因组的不稳定现象。研究发现越来越多的环境毒素与纺锤体形态异常、染色体分裂错误有关。研究报道双酚A替代物双酚芴可引起卵母细胞骨架受损[21];邻苯二甲酸单酯能够干扰减数分裂过程中染色体分离和配子形成[22]。本研究中,PFOA处理后的卵母细胞有很大比例出现纺锤体异常和染色体错位。微管、肌动蛋白丝和染色质相互作用完成染色体分离,建立细胞不对称[23−24]。β-tublin在PFOA处理的卵母细胞中的异常定位是纺锤体缺陷的原因之一。纺锤体缺陷导致异常的染色体排列。因此,本文结果表明,PFOA暴露可通过诱导纺锤体缺陷和染色体排列异常进而抑制卵母细胞的成熟。这些发现有助于提高人们对PFOA生殖毒性的认识,为今后的研究提供参考依据。未来可以对PFOA损伤哺乳动物卵母细胞的分子机制做进一步研究。
综上所述,本研究评估了PFOA体内暴露对小鼠卵母细胞的影响,结果表明PFOA暴露会通过诱导ROS生成、DNA损伤、纺锤体形态发育缺陷、染色体排列异常等途径影响卵母细胞成熟率及成熟质量。
-
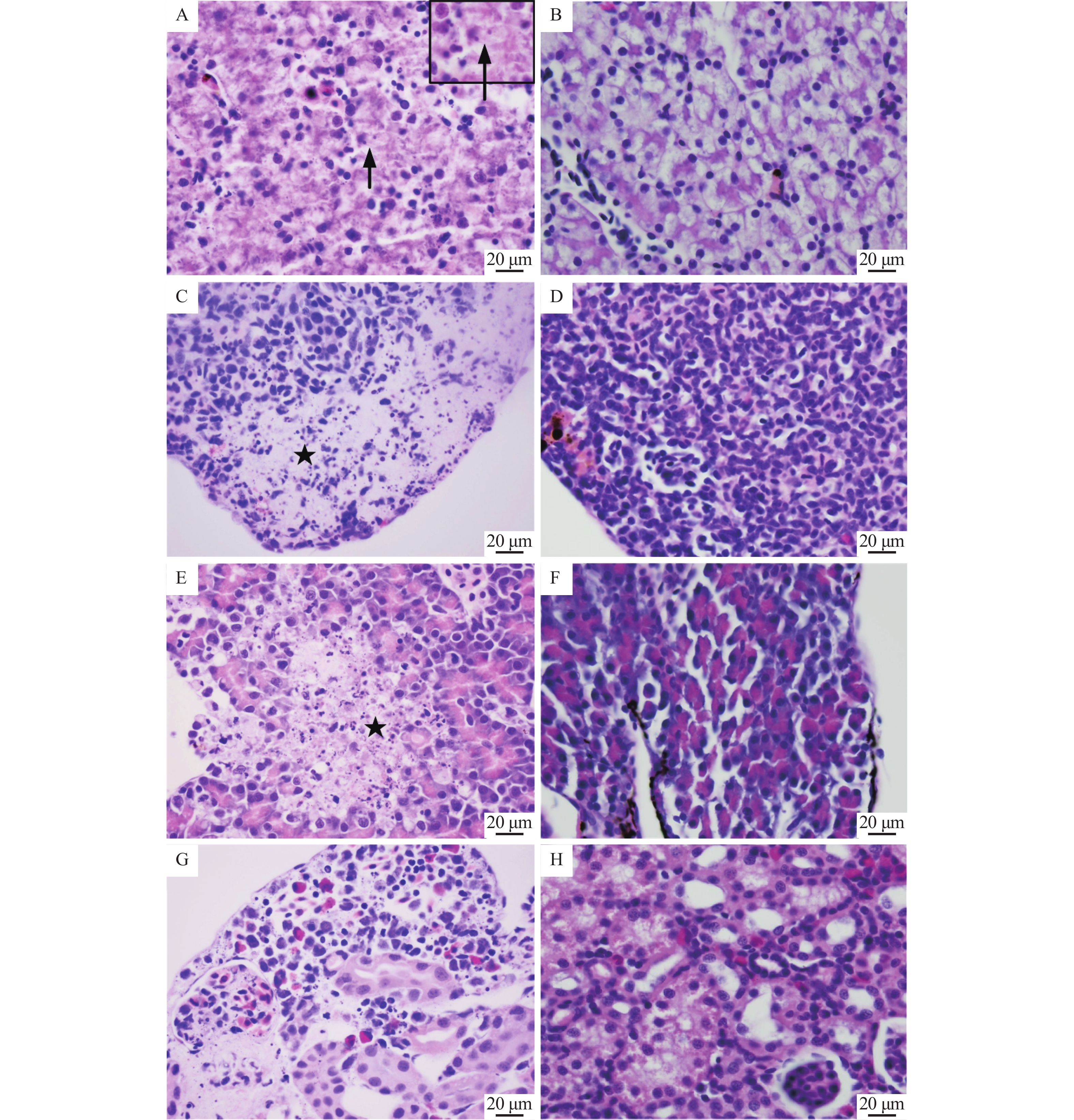
图 2 黑斑蛙患病蝌蚪的组织病理学损伤
A:肝细胞灶性坏死,胞浆内见嗜碱性包涵体(→);C:脾淋巴细胞坏死,数量明显减少(★);E:胰腺灶性坏死(★);G:肾小球坏死,肾间造血组织坏死;B、D、F和H分别为健康蝌蚪的肝、脾、胰腺和肾组织
Figure 2. Histopathological lesions of diseased tadpoles of Rana nigromaculata
A: Focal necrosis in hepatocytes, basophilic inclusions in intracytoplasm (→); C: Lymphocytes necrosis and reduction in spleen (★); E: Focal necrosis in pancreas (★); G: Necrosis of glomerulus and interrenal hematopoietic tissue; B, D, F and H are liver, spleen, prancreas and kindey tissues of healthy tadpoles respectively
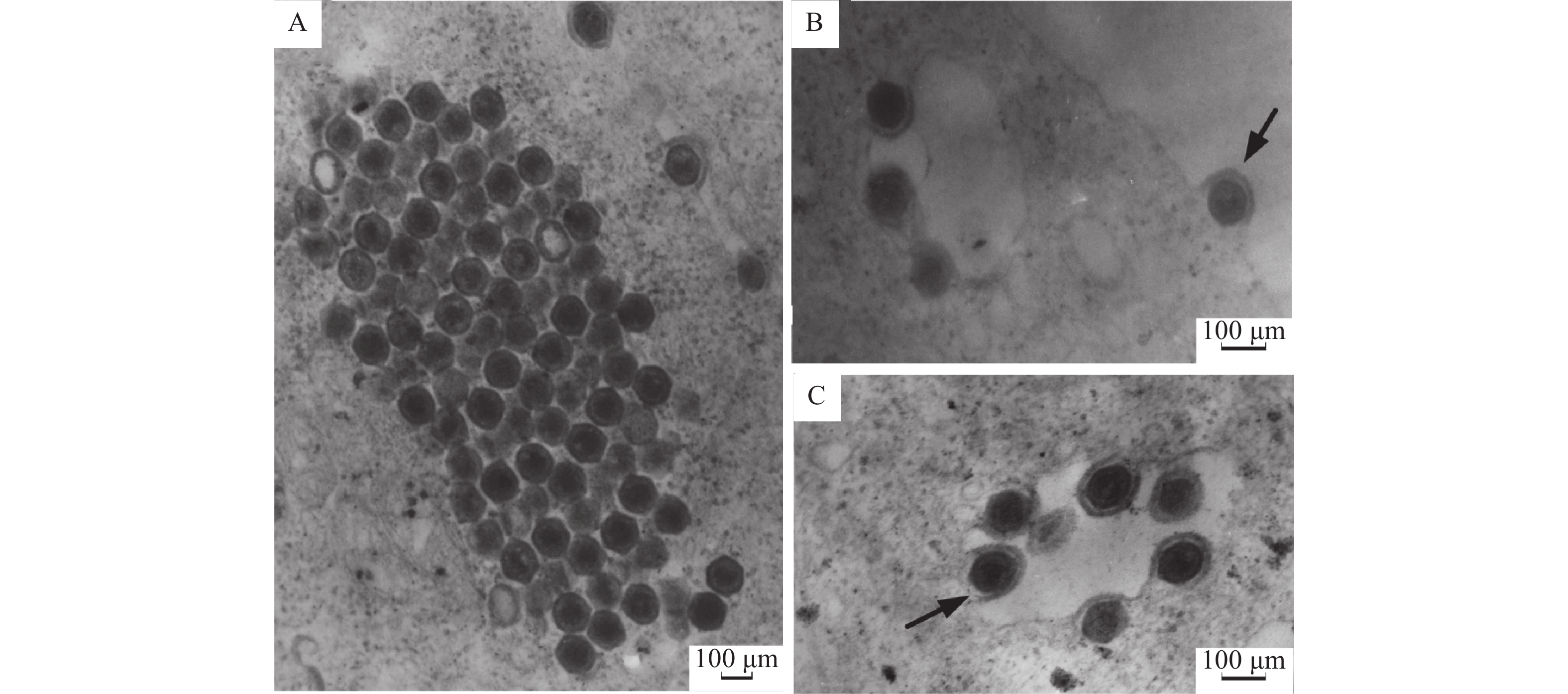
图 5 电镜观察感染EPC细胞的虹彩病毒样粒子
A:排列成晶格状的虹彩病毒样粒子;B:病毒以出芽方式从细胞膜释放并获得外膜(→);C:细胞质空泡内可见病毒粒子(→)
Figure 5. Electron micrograph of the iridovirus-like particles infecting EPC cells
A: Iridovirus-like particles arrayed in crystalline;B: Virion is budding through the cell membrane to obtain envelope (→);C: Virus particle in the cytoplasmic vacuole
-
[1] WILLIANS T, BARBOSASOLOMIEU V, CHINCHAR V G. A decade of advances in iridovirus research[J]. Adv Virus Res, 2005, 48(65): 173-178.
[2] CHINCHAR V G. Ranaviruses (family Iridoviridae): Emerging cold-blooded killers[J]. Arch Virol, 2002, 147(3): 447-470. doi: 10.1007/s007050200000
[3] KOLBY J E, SMITH K M, BERGER L, et al. First evidence of amphibian chytrid fungus (Batrachochytrium dendrobatidis) and ranavirus in Hong Kong amphibian trade[J]. PLoS One, 2014, 9(3): 907-913.
[4] 张奇亚, 李正秋. 沼泽绿牛蛙病毒的分离及其细胞感染的初步研究[J]. 水生生物学报, 1996, 12(4): 390-392. [5] 王晓红, 翁少萍, 何建国. 虎纹蛙病毒体外培养及其理化特性[J]. 水产学报, 2002, 26(4): 363-367. [6] GENG Y, WANG K Y, ZHOU Z Y, et al. First report of a ranavirus associated with morbidity and mortality in farmed Chinese Giant Salamanders (Andrias davidianus)[J]. J Ccmp Pathol, 2011, 145(1): 95-102. doi: 10.1016/j.jcpa.2010.11.012
[7] 马冬梅, 白俊杰, 邓国成, 等. 大口黑鲈溃疡综合征病毒MCP基因序列分析及PCR快速检测方法的建立[J]. 中国水产科学, 2010, 17(6): 1149-1156. [8] XU K, ZHU D Z, WEI Y, et al. Broad distribution of ranavirus in free-ranging Rana dybowskii in Heilongjiang, China[J]. Ecohealth, 2010, 7(1): 18-23. doi: 10.1007/s10393-010-0289-y
[9] 陈在贤, 郑坚川, 江育林. 从患“红脖子病”甲鱼体分离到虹彩病毒[J]. 中国兽医学报, 1998, 11(2): 135-139. [10] 范玉蕾, 耿毅, 周燕, 等. 一株似鲇高原鳅源蛙病毒的分离与鉴定[J]. 中国水产科学, 2015, 22(3): 556-562. [11] 汪建国. 两栖、爬行类疾病及其防治技术(1):蛙病[J]. 渔业致富指南, 2016, 15(21): 61-66. [12] 武正军, 李义明. 两栖类种群数量下降原因及保护对策[J]. 生态学杂志, 2004, 23(1): 140-146. doi: 10.3321/j.issn:1000-4890.2004.01.031 [13] REED L, MUENCH H. A simple, method of estimating 50 percent end point[J]. Am Ind Hyg Assoc J, 1938, 22(1): 112-117.
[14] MAO J H, HEDRICK R P, CHINCHAR V G. Molecular characterization, sequence analysis, and taxonomic position of newly isolated fish iridoviruses[J]. Virology, 1997, 229(1): 212-220. doi: 10.1006/viro.1996.8435
[15] 吴楚, 吴宗斌. 水中病毒的检测方法研究[J]. 现代农业科学, 2008, 10(8): 48-50. [16] HUANG X H, HUANG Y H, YUAN X P, et al. Electron microscopic examination of the viromatrix of Rana grylio virus in a fish cell line[J]. J Virol Methods, 2006, 133(2): 117-123. doi: 10.1016/j.jviromet.2005.10.029
[17] CHINCHAR V G, HYATT A, MIYAZAKI T, et al. Family Iridoviridae: Poor viral relations no longer[J]. Curr Top Microbiol, 2009, 328(1): 123-170.
[18] BAYLEY A E, HILL B J, FEIST S W. Susceptibility of the European common frog Rana temporaria to a panel of ranavirus isolates from fish and amphibian hosts[J]. Dis Aquat Organ, 2013, 103(3): 171-175. doi: 10.3354/dao02574
[19] 刘丹, 耿毅, 汪开毓, 等. 大鲵蛙病毒感染大鲵的动态病理损伤及病原的组织分布[J]. 中国水产科学, 2017, 24(1): 146-155. [20] CHENG K, JONES M E, JANCOVICH J K, et al. Isolation of a Bohle-like iridovirus from boreal toads housed within a cosmopolitan aquarium collection[J]. Dis Aquat Organ, 2014, 111(2): 139-152. doi: 10.3354/dao02770
[21] ROBERT J. Emerging ranaviral infectious diseases and amphibian decline[J]. Diversity, 2010, 2(3): 314-330. doi: 10.3390/d2030314
[22] BRENES R, GRAY M J, WALTZK T B, et al. Transmission of ranavirus between ectothermic vertebrate hosts[J]. PLoS One, 2014, 9(3): 924-931.
[23] BRUNNER J L, SCHOCK D M, COLLINS J P. Transmission dynamics of the amphibian ranavirus Ambystoma tigrinum virus[J]. Dis Aquat Organ, 2007, 77(2): 87-95.
[24] PEARMAN P B, GARNER T W J, STRAUB M, et al. Response of the Italian agile frog (Rana latastei) to a ranavirus, frog virus 3: A model for viral emergence in naive populations[J]. J Wildlife Dis, 2004, 40(4): 660-669. doi: 10.7589/0090-3558-40.4.660
-
期刊类型引用(4)
1. 楚秋霞,陈付英,冯亚杰,张子敬,师志海,施巧婷,王二耀,吕世杰,付晓鹤. 应用大蒜素缓解牛子宫内膜炎损伤的研究. 安徽农业科学. 2025(06): 85-88 .  百度学术
百度学术
2. 黄静雯,谭惠文,林怡妤,蒋博轩,陈瑞珠,贺瑞,高新征. 虾青素毒性的研究图谱分析及安全性评价. 广东化工. 2023(08): 102-104 .  百度学术
百度学术
3. 景永帅,袁鑫茹,代立霞,张瑞娟,张浩,郑玉光,吴兰芳. 纤维素酶协同超声波辅助提取北沙参多糖工艺优化及其理化性质和免疫调节活性研究. 食品工业科技. 2022(14): 185-193 .  百度学术
百度学术
4. 董学卫,孙敏,颜世超,贾怀峰,张伟,姜曼. 虾青素药理学作用及其在眼科疾病治疗中的应用. 山东化工. 2020(22): 133-135 .  百度学术
百度学术
其他类型引用(3)



 下载:
下载: