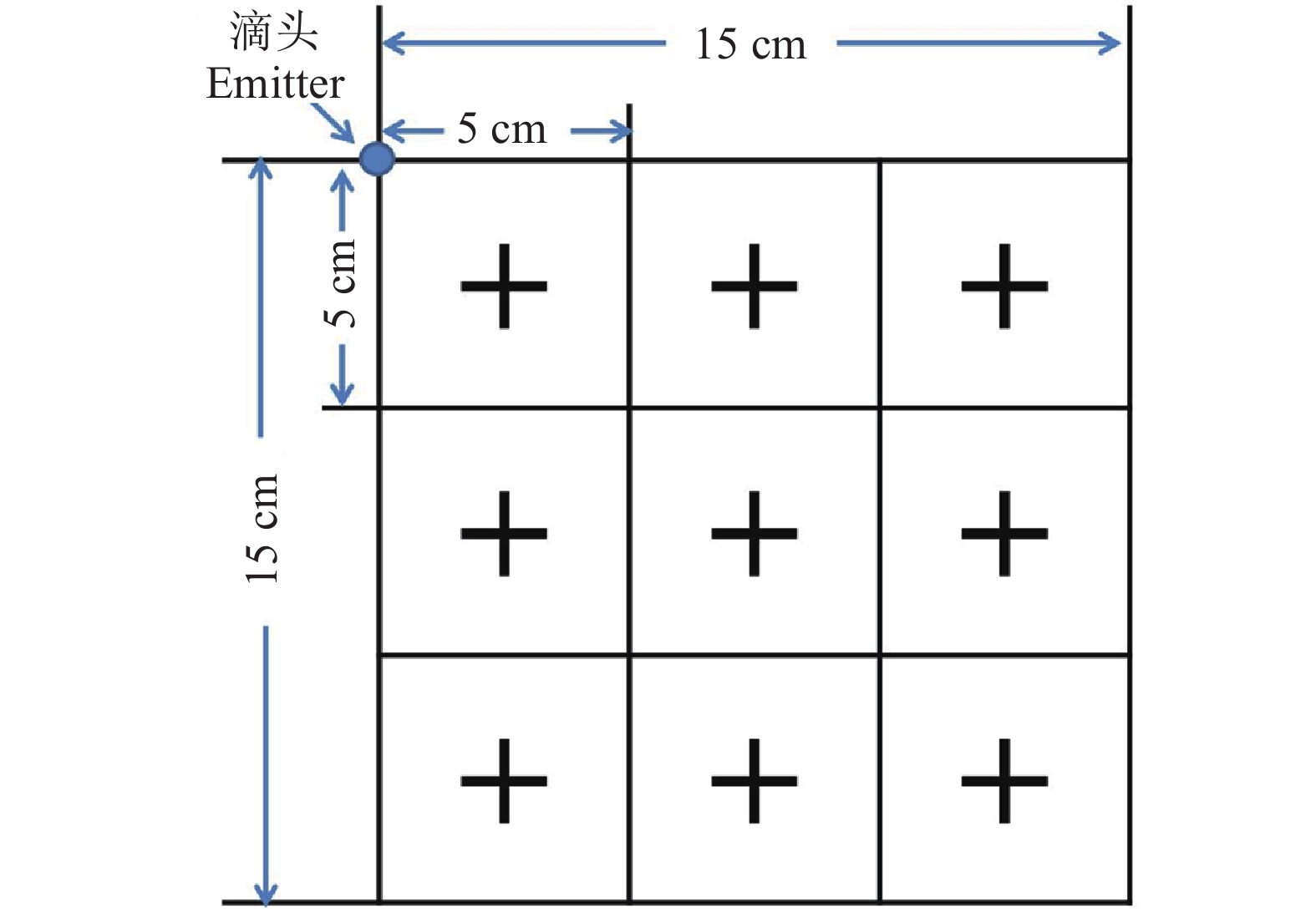
Control of Diaphorina citri by applying clothianidin through a drip irrigation system
-
摘要:目的
明确滴灌施药防治柑橘木虱Diaphorina citri Kuwayama的可行性,为田间控制柑橘黄龙病传播提供新的手段。
方法通过室内模拟滴灌施用噻虫胺,测定了噻虫胺在土壤中的分布以及柑橘叶片中含量,研究了滴灌施药对柑橘木虱防治效果。通过田间试验,检测分析了柑橘叶片中噻虫胺含量。
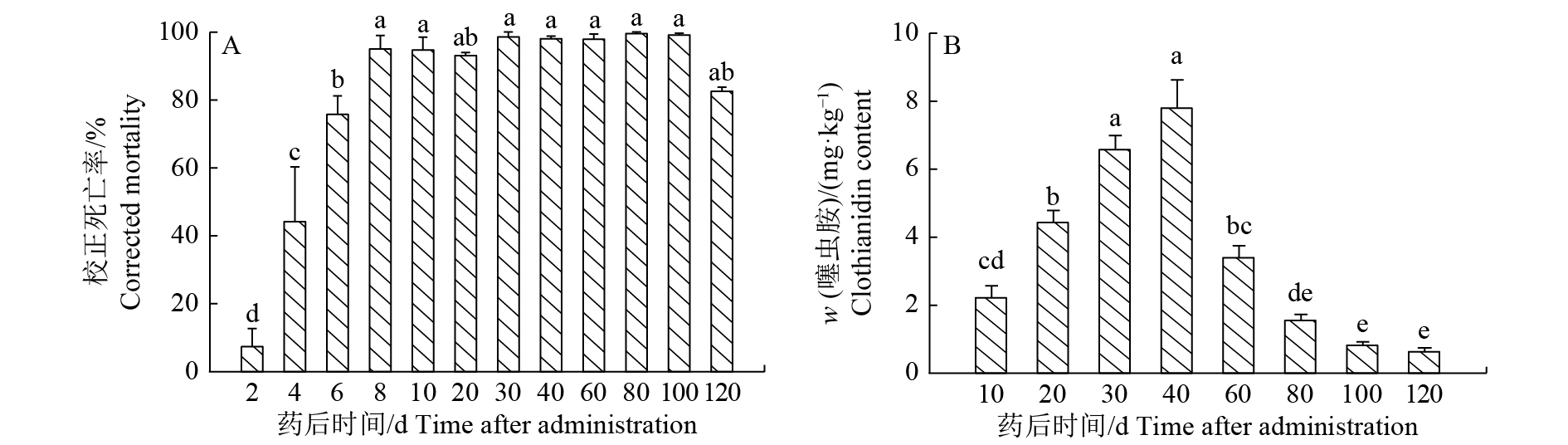
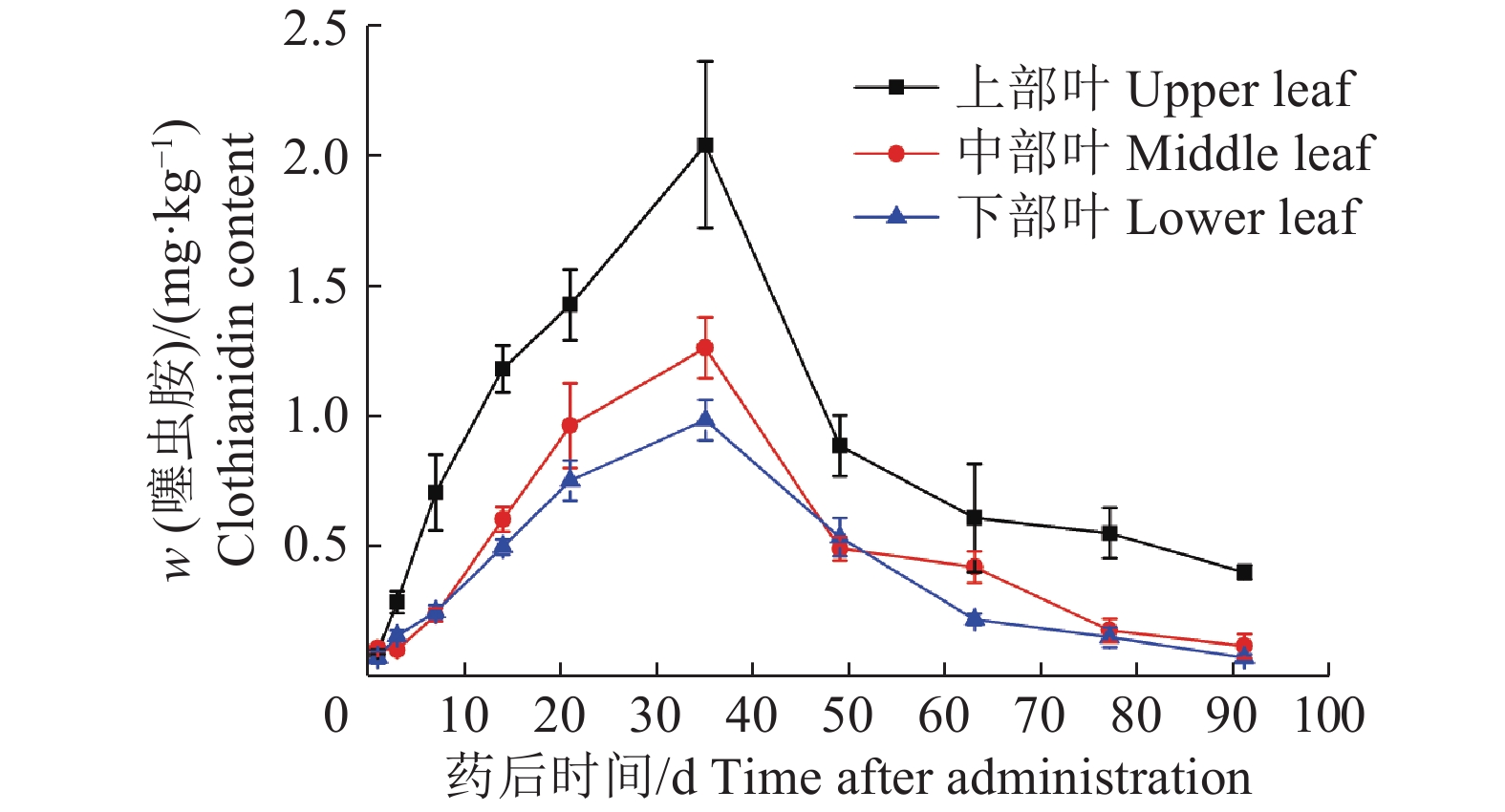
结果在室内条件下,一次滴灌施药对柑橘木虱的防治效果可长达4个月;噻虫胺在土壤中以滴头为起始点在土壤中呈半圆形迁移分布,当柑橘叶片中噻虫胺质量分数大于0.64 mg·kg–1时,对柑橘木虱的防治效果均高于80%。田间试验表明,在药后7~63 d柑橘上部叶片中噻虫胺的质量分数大于0.64 mg·kg–1。
结论滴灌施用噻虫胺能有效防治柑橘木虱,是田间控制柑橘黄龙病传播的有效手段。
Abstract:ObjectiveTo study the control effect of clothianidin on citrus psyllid(Diaphorina citri) under drip irrigation, and provide a new way for controlling Huanglongbing (HLB) spread.
MethodAn indoor simulation drip irrigation experiment was conducted for clothianidin. The distribution of clothianidin in soil and the content in citrus leaves were tested, and the clothianidin efficacy was studied under laboratory condition. The content of clothianidin in citrus leaves was detected and analyzed in field experiment.
ResultThe control effect of single drip irrigation could be as long as four months in greenhouse. The migration distribution of clothianidin was a semicircle with a drop head as a starting point in soil, and the control effects of D. citri were more than 80% when clothianidin contents of citrus leaves were greater than 0.64 mg·kg–1. Under field condition, the contents of clothianidin in upper leaves were also greater than 0.64 mg·kg–1 from 7 to 63 days after applying clothianidin.
ConclusionClothianidin application through a drip irrigation system exhibits excellent efficacy against citrus psyllid, which provides an effective measure for prevention and control of HLB.
-
Keywords:
- Huanglongbing /
- Diaphorina citri /
- drip irrigation /
- clothianidin /
- control effect
-
狂犬病(Rabies)是由狂犬病病毒(Rabies virus,RABV)感染引起的一种人兽共患中枢神经系统传染病,人类及所有的温血动物均易感,病死率几乎达100%[1]。现今狂犬病仍呈全球性流行,90%以上分布在亚洲和非洲,对公众健康安全构成严重威胁[2-3]。固有免疫是机体抵抗外来病原入侵的第一道防线,RABV感染激活宿主固有免疫主要是通过维甲酸诱导基因I(Retinoic acid induced gene I,RIG-I)识别病毒5'−三磷酸化的基因组RNA或者转录前导RNA链(Leader RNA),从而诱导I型干扰素(Type I interferon,IFN-I)通路的活化,发挥抵抗RABV的作用[4];IFN-I系统对于机体抗RABV感染起着非常重要的作用,敲除IFN-I受体的小鼠对RABV感染的敏感性增加[4];也有研究显示,敲除Toll样受体7(Toll-like receptor 7,TLR7)或者其下游关键接头分子MyD88(Myeloid differentiation primary response protein 88)的小鼠对于某些中强毒力RABV的保护力显著下降,说明TLR7介导的IFN-I途径也在抗RABV中发挥重要作用[5-6]。但是,RABV也进化出了拮抗IFN-I作用的方式[7]。一方面,RABV的磷蛋白(Phosphoprotein,P)能够与TBK-1(TANK-binding kinase 1)相互作用,阻断IRF3(Interferon regulatory factor 3)的磷酸化,阻断其二聚化以及核转移,从而抑制IFN-I的产生[8]。另一方面,P蛋白还能与激活后的STAT1/2(Signal transducer and activator of transcription 1/2)相互作用,阻止它们的核转移进而抑制下游干扰素刺激基因(IFN-stimulated genes,ISGs)的表达[9]。另外,RABV的核蛋白(Nucleoprotein,N)在一定程度上也可以通过抑制IRF3激活的方式,抑制下游IFN-I基因的表达。因此,通过改变N基因序列可达到减弱病毒毒力的效果[10]。但是,对病毒致病力起关键作用的糖蛋白(Glycoprotein,G)是否在调节或对抗IFN-I途径中发挥着作用?其在RABV抵抗IFN-I通路作用中扮演着什么样的角色?这些问题在目前的研究中都极少涉及。为了探究上述相关问题,我们利用RABV的反向遗传操作系统将弱毒Hep-Flury的G基因替换成CVS-11的G基因,拯救出重组病毒HepG,分别研究弱毒株Hep-Flury、攻毒固定毒株CVS-11和HepG在体内和体外感染对IFN-I通路激活和调控的差异,并对比分析它们在神经细胞中对抗IFN-I抗病毒作用的差异,拟阐释不同RABV的G蛋白与IFN-I通路的相互作用。
1. 材料与方法
1.1 病毒毒株及试验动物
RABV疫苗弱毒株Hep-Flury及致病固定毒株CVS-11由华南农业大学兽医学院兽医微生物学实验室保存。6周龄SPF级雌性昆明系(KM)小白鼠购自南方医科大学实验动物中心,其狂犬病病毒血清、抗体检测均为阴性,健康状况良好,在严格的饲养管理条件下进行试验。所有动物试验均在华南农业大学兽医学院动物生物安全三级(ABSL-3)实验室完成,所有试验程序和条件均遵守《中华人民共和国实验动物管理条例》,并通过了华南农业大学动物福利委员会审查。
1.2 细胞株及培养
细胞株:乳仓鼠肾细胞(BHK-21)、人神经母细胞瘤细胞(SK-N-SH)、小鼠神经母细胞瘤细胞(Neuro-2a)。其中,BHK-21、SK-N-SH培养于含10%(φ)FBS的DMEM培养基,Neuro-2a细胞培养于含10%(φ)FBS的RPMI-1640培养基,所有细胞均置于37 ℃、5%(φ)CO2细胞培养箱中培养。
1.3 重组毒株HepG的构建及拯救
利用基于Hep-Flury基因组骨架的反向遗传操作系统及无缝连接技术将弱毒株HEP-Flury的G基因替换成强毒的CVS-11的G基因,构建并拯救出重组毒株HepG,如图1所示。
在含Hep-Flury基因组全长cDNA的pHEP-3.0质粒的合适位置设计2对引物(表1),以pHEP-3.0为模板进行PCR,得到L片段和C区段(C区段包括N、P和M基因)。在CVS-11的G基因位置设计1对引物(表1),以CVS-11 cDNA为模板进行PCR,扩增G基因片段。以上引物均在相应的连接区设计15~20 bp的重叠序列。将上述3个片段扩增回收,利用无缝连接试剂盒(Vazyme)进行连接反应,筛选得到G基因替换的重组质粒pHepG。质粒转染及病毒拯救方法参照郭霄峰等[11],利用SuperFect Transfection Reagent(Qiagen)将pHepG和4个辅助质粒pH-N、pH-P、pH-L、pH-G共转染到BHK-21细胞中,培养6 d后,筛选并鉴定出重组病毒,全程以pHEP-3.0及辅助质粒拯救Hep-Flury作为阳性对照。
表 1 HepG构建的引物序列Table 1. Primer sequences for construction of HepG基因片段
Gene segment引物序列(5′→3′)
Primer sequenceHEP-L F: AGGCCGGTCATCCTTTTGACACCTCAAGTCCAGA R: ATTTTAGCATGTACAGGCTTTCATTAATGTCCGGC HEP-C F: GCCTGTACATGCTAAAATTCTTGTAYGATGCATCTTG R: CTTTCCTTAAGTCTTTTGAGGGATGTTAATAGTTTT CVS-G F: CAAAAGACTTAAGGAAAGATGGTTCCTCAGGTTCTT R: CAAAAGGATGACCGGCCTTCACAGTCTGATCTCACCT 1.4 直接免疫荧光法测定病毒滴度
将狂犬病病毒分别倍比稀释(10−1~10−8)并与BHK-21细胞混合后,铺于96孔细胞培养板中,每个稀释度重复4孔。在37 ℃、5%(φ)CO2培养箱中培养48 h。弃去细胞培养液,每孔加入预冷丙酮100 μL,然后将培养板放置于−20 ℃冰箱静置1 h。弃去丙酮,用200 μL PBS洗3遍。每孔避光加入25 μL抗RABV的N蛋白荧光抗体(Fujirebio),于37 ℃条件下孵育1 h。弃去荧光抗体,用200 μL PBS洗涤细胞3次。在荧光显微镜下观察并计数,按照Reed-Muench法计算病毒滴度。
1.5 RT-qPCR测定小鼠脑内的病毒载量及宿主基因表达量
1.5.1 RABV滴鼻接种小鼠
将RABV Hep-Flury、HepG、CVS-11分别对6周龄的SPF级KM小鼠进行滴鼻攻毒(每只小鼠105 FFU),每组10只小鼠。同时滴鼻DMEM为空白对照,每天观察小鼠状态并称量体质量。
1.5.2 小鼠的心脏灌流
为了排除血液中的细胞因子对检测小鼠脑组织中细胞因子的干扰,在取鼠脑之前对小鼠进行心脏灌流。攻毒后第4、7、10天分别从各试验组和对照组中取3只小鼠,麻醉后,进行活体心脏灌流。
1.5.3 鼠脑采集
小鼠心脏灌流完成后,在生物安全柜内取出完整鼠脑,放入无RNA酶的1.5 mL EP管中。对鼠脑进行编号、标记并称质量,加入适量的Trizol溶液进行研磨处理。
1.5.4 鼠脑总RNA的抽提及反转录
利用HiPure Universal RNA Kits (Magen)试剂盒抽提鼠脑样品总RNA,在抽提时加入DNase I去除基因组DNA污染。用NanoDrop 2000c微量分光光度计测定RNA浓度和纯度。取等质量的RNA进行反转录,按HiScript® II 1st Strand cDNA Synthesis Kit (Vazyme)反转录试剂盒说明书进行操作,引物为Oligo (dT)23和Random hexamers。
1.5.5 RT-qPCR
根据各检测基因的序列设计特异引物(表2),以GADPH为内参基因。使用AceQ qPCR SYBR Green Master Mix (Vazyme)荧光定量试剂盒进行RT-qPCR。反应结束后,对所有靶基因与内参基因GAPDH作均一化处理以消除试验误差,各基因转录水平通过2−ΔΔCt方法计算得出,表达倍数计为各组中不同基因的转录值与未感染细胞(Mock)组转录值的比值。各个样本靶基因的表达差异分析由GraphPad 5.0软件完成。显著性差异按双因素方差分析(Two-way ANOVA)法计算,以P<0.05、0.01、0.001记为差异显著。
表 2 RT-qPCR检测引物Table 2. Primers used for RT-qPCR基因
Gene上游引物序列(5′→3′)
Forward primer sequence下游引物序列(5′→3′)
Reverse primer sequenceRABV genome GACAGCGTCAATTGCAAAGCAAAAAT GGGTACTTGTACTCATATTGATCCACGAT N GCACTGGCAGATGACGGAAC TCGGCGAATGAGTTTGGACG Leader RNA TGTAGGGGTGTTACATTTTT ACGCTTAACAACAAAACC Cxcl10 TCCATATCGATGACGGGCCA CAACACGTGGGCAGGATAGG Dhx58 CCAGAGCACACACATGACCC CCATAGCGCACCACCACATT IFN-α4 AGCCTGTGTGATGCAGGAACC CAGCAAGTTGGTTGAGGAAGAG IFN-κ TGGAGTTGGGCAAGTATTTCTTC GGACTTGGAAAATATAATGAAACATCTTC IFN-β ACCTACAGGGCGGACTTCAA ACACTGTCTGCTGGTGGAGT IFN-γ TCAGCAACAGCAAGGCGAAA ATTGAATGCTTGGCGCTGGA IL6 TGCCTTCTTGGGACTGATGC GACAGGTCTGTTGGGAGTGGT IRF3 TCAGGATCCCGTGGAAGCAT TGACACGTCCGGCTTATCCT IRF7 ACTGGCTATTGGGGAGGTC ACGACCGAAATGCTTCCAGG ISG15 GACGCAGACTGTAGACACGC TTAGGCCATACTCCCCCAGC MDA5 GAGCACCTACGCACTTTCCC CCACCGTCGTAGCGATAAGC MyD88 TCATGTTCTCCATACCCTTGGT AAACTGCGAGTGGGGTCAG RIG-I CCTTGATTGCCCTGATGTTG ATTTCTCCCTGTCCCTCCAA RNF125 GGCGCACATAAGGACCTGTG TCATCCAGTTCCCGCTGACA TLR3 GTGAGATACAACGTAGCTGACTG TCCTGCATCCAAGATAGCAAGT TLR7 TCTTTGGGTTTCGATGGTTTCC GCAGTCCACGATCACATGGG TLR9 ATGGTTCTCCGTCGAAGGACT GAGGCTTCAGCTCACAGGG GAPDH AGAGTGTTTCCTCGTCCCGT CTGTGCCGTTGAATTTGCCG 1.6 病毒感染Neuro-2a细胞后IFN-I通路相关基因转录水平检测
将Hep-Flury、HepG和CVS-11病毒以相同的感染复数(MOI=3)感染6孔板中的Neuro-2a细胞,同时设置未接毒的Neuro-2a细胞为空白对照。接毒后6、12、24、48 h,在每孔细胞加入1 mL Trizol溶液处理并抽提RNA。利用上述RT-qPCR检测病毒的载量及IFN-I通路相关基因的表达水平。
1.7 IFN-I通路的激活对病毒复制的影响
将Neuro-2a和SK-N-SH细胞接种至直径为3.5 cm的细胞培养板中,细胞贴壁后用无血清培养基洗1遍,然后每板细胞利用脂质体转染50 ng的Poly(I:C),孵育6 h。之后弃去Poly(I:C)和培养基的混合液,用无血清的培养基洗3遍,以MOI=3接种不同RABV毒株。分别于接毒后1、2、3、4及5 d收集病毒培养上清液120 μL,测定上清液中病毒滴度。
2. 结果与分析
2.1 HepG病毒的拯救
将扩增得到的C、L片段和CVS-11 G基因(图2)回收后,进行无缝连接和重组质粒筛选,进一步利用Hep-Flury反向遗传操作系统拯救出重组病毒HepG(图3)。
将CVS-11、Hep-Flury和HepG滴鼻感染小鼠(105 FFU),CVS-11和HepG分别在第8天和第10天100%致死小鼠,试验小鼠均呈现麻痹型的狂犬病症状(图4),说明G蛋白对病毒的致病力起着关键作用。感染Hep-Flury的小鼠在感染第10天出现明显的体质量下降,之后第14天体质量开始回升,出现耸毛、弓背等症状,但16 d后逐渐恢复正常,所有小鼠均成活(图4)。
2.2 各病毒感染鼠脑内的病毒载量及IFN-I通路相关基因转录水平的变化
2.2.1 各病毒滴鼻感染鼠脑病毒载量及病毒基因表达变化
采用RT-qPCR分别检测Hep-Flury、HepG、CVS-11滴鼻感染鼠脑后第4天和第7天N、G基因,leader RNA和病毒基因组RNA的含量。
滴鼻感染小鼠后第4天,Hep-Flury、HepG和CVS-11在鼠脑中的整体复制水平比较低,CVS-11的基因组水平最高(图5A),而对于leader RNA、N和G基因的转录水平,Hep-Flury显著高于CVS-11 (P<0.05、P<0.01、P<0.05)(图5B~5D)。在感染第7天,CVS-11的复制程度超过Hep-Flury约4 000倍(P<0.001);HepG的复制水平及基因转录水平介于Hep-Flury和CVS-11之间(图5A)。在感染中后期,HepG和CVS-11的复制量大大增加,感染7 d后小鼠开始发病,10 d内全部死亡;Hep-Flury在脑内的总体复制水平较低,小鼠感染后不死亡(图5B~5D)。
2.2.2 各病毒感染鼠脑诱导IFN-I通路相关基因的表达
小鼠感染Hep-Flury、HepG和CVS-11后,利用RT-qPCR检测小鼠中枢神经系统中IFN-I通路相关分子的表达水平变化。
结果表明,在病毒感染的第4天,IFN-I通路上游基因RIG-I、MDA5、Dhx58以及下游基因ISG15、IL6均在Hep-Flury感染后有较高水平的表达(图6A~6C、6G和6H),HepG感染后对这些基因的激活水平处于Hep-Flury和CVS-11之间。在病毒感染后第7天,上述基因及TLR3在CVS-11和HepG感染后的激活水平显著高于Hep-Flury(图6A~6D、6F~6H)。另外,IRF3则在3种毒株的不同感染时间都没有显著的表达变化(图6E)。结果说明,弱毒Hep-Flury能够更早地激活IFN-I通路,而致病毒株CVS-11则在感染后期大大刺激IFN-I通路相关基因表达。HepG感染后对IFN-I通路相关基因的激活水平介于Hep-Flury和CVS-11之间,暗示着在RABV感染中枢神经系统中不同G基因对于IFN-I通路的激活具有一定的调节作用。
RT-qPCR检测不同RABV毒株感染后鼠脑中各IFN基因的表达变化,发现IFN-α4/β/γ/κ这4个基因在3种病毒感染的第4天表达量均较低,各毒株间无显著差异(图7A~7D),但在HepG和CVS-11感染后第7天诱导的IFN-α4/β/γ基因表达量显著超过了Hep-Flury,其中IFN-γ的表达水平上调最显著(图7C)。而IFN-κ则只在CVS-11感染后第7天显著上调(图7D)。
2.3 RABV感染Neuro-2a细胞对IFN-I通路相关基因转录水平的影响
为了研究Hep-Flury、HepG和CVS-11在感染体外细胞后,IFN-I通路相关基因表达量的变化,我们测定了它们感染(MOI=3)Neuro-2a细胞后的一步生长曲线,并利用RT-qPCR检测感染后6、12、24和48 h IFN-I通路上游和下游分子的表达情况。
不同RABV毒株感染Neuro-2a细胞时,病毒滴度均在感染后第3天达到峰值,CVS-11和HepG的滴度较高,超过了107 FFU/mL,Hep-Flury的滴度较低,接近106 FFU/mL,之后下降较快(图8)。 IFN-I通路上游因子TLR3、RIG-I和IRF7在RNBV感染后6 h即被激活表达,且被Hep-Flury和HepG感染激活的水平显著高于CVS-11(图9A、9E、9F),而TLR9在HepG感染后12 h和24 h有较高水平的表达(图9C)。MyD88则在Hep-Flury的感染后期(48 h)有显著的上调表达,在HepG和CVS-11感染细胞中的表达差异不显著(图9D)。TLR7在3种病毒感染的不同时间均未有激活表达(图9B)。结果表明,相较于CVS-11,Hep-Flury和HepG感染Neuro-2a细胞能够通过激活TLR3和RIG-I相关的通路,更强地激起体外神经细胞的IFN-I通路反应,HepG感染的激活强度相较Hep-Flury更弱一些。
![]() 图 9 RABV感染Neuro-2a细胞对IFN-I通路上游基因表达的影响“*”“**”“***”分别表示在 P<0.05、 P<0.01、 P<0.001水平差异显著(t检验)Figure 9. Effect of RABV infection on expression of upstream genes of IFN-I pathway in Neuro-2a cells“*”, “**” and “***” indicate significant differences at P <0.05, P <0.01 and P <0.001 levels, respectively (t test)
图 9 RABV感染Neuro-2a细胞对IFN-I通路上游基因表达的影响“*”“**”“***”分别表示在 P<0.05、 P<0.01、 P<0.001水平差异显著(t检验)Figure 9. Effect of RABV infection on expression of upstream genes of IFN-I pathway in Neuro-2a cells“*”, “**” and “***” indicate significant differences at P <0.05, P <0.01 and P <0.001 levels, respectively (t test)Hep-Flury和HepG感染Neuro-2a细胞后6 h即能快速地激活IFN-α4及下游基因CXCL10和ISG15的表达,在激活能力上,Hep-Flury略强于HepG(图10A、10C、10D)。较为特殊的是,在感染后48 h,只有HepG未上调IFN-β的表达(图10B)。
![]() 图 10 RABV感染Neuro-2a细胞对IFN-I通路下游基因表达的影响“*”“**”“***”分别表示在 P<0.05、 P<0.01、 P<0.001水平差异显著(t检验)Figure 10. Effect of RABV infection on expression of downstream genes of IFN-I pathway in Neuro-2a cells“*”, “**” and “***” indicate significant differences at P <0.05, P <0.01 and P <0.001 levels, respectively (t test)
图 10 RABV感染Neuro-2a细胞对IFN-I通路下游基因表达的影响“*”“**”“***”分别表示在 P<0.05、 P<0.01、 P<0.001水平差异显著(t检验)Figure 10. Effect of RABV infection on expression of downstream genes of IFN-I pathway in Neuro-2a cells“*”, “**” and “***” indicate significant differences at P <0.05, P <0.01 and P <0.001 levels, respectively (t test)2.4 IFN-I通路的激活对3种RABV复制的影响
为了检测体外细胞IFN-I通路激活对不同RABV毒株复制的影响,我们在病毒感染前6 h先用Poly(I:C)刺激神经细胞激活其IFN-I通路,之后再分别接种Hep-Flury、HepG、CVS-11 (MOI=3),在不同时间测定病毒滴度。从感染Neuro-2a和SK-N-SH的不同RABV复制动力学曲线(图11)可以看出,2种神经细胞在经Poly(I:C)处理后,对Hep-Flury复制的影响较为显著,病毒增殖滴度在早期下降明显,到了第4天和第5天影响减小,说明IFN-I对Hep-Flury接毒后前3天复制的抑制作用较强。CVS-11和HepG在感染Poly(I:C)刺激的Neuro-2a的前2天受到一定程度的抑制,之后回升到正常水平(图11A)。而在SK-N-SH上,CVS-11和HepG对于Poly(I:C)的刺激均不敏感,病毒复制几乎没有受到影响(图11B)。综合来看,2种神经细胞在预先用Poly(I:C)处理之后,能够较显著地抑制Hep-Flury的复制,而对替换了G基因的HepG的影响较弱,从一定程度上说明CVS-11的G基因具有抵抗IFN-I通路作用的能力。
![]() 图 11 Poly(I:C)处理体外神经细胞对RABV复制的影响“*”表示相同RABV毒株感染Poly(I:C)处理和未处理细胞在P<0.05水平差异显著(t检验)Figure 11. Effect of Poly(I:C) treatment on the replication of RABV for in vitro nerve cells“*” indicates significant differences between Poly(I:C) treated and untreated cells infected with the same RABV strain at P<0.05 level (t test)
图 11 Poly(I:C)处理体外神经细胞对RABV复制的影响“*”表示相同RABV毒株感染Poly(I:C)处理和未处理细胞在P<0.05水平差异显著(t检验)Figure 11. Effect of Poly(I:C) treatment on the replication of RABV for in vitro nerve cells“*” indicates significant differences between Poly(I:C) treated and untreated cells infected with the same RABV strain at P<0.05 level (t test)3. 讨论与结论
我们前期的研究结果表明弱毒Hep-Flury滴鼻感染小鼠能够更早(感染后第4天)、更强地激活IFN-I相关基因表达,而致病毒株CVS-11则在感染后第7天强烈地激活IFN-I相关基因表达[12]。为了探讨这2种毒株携带的G基因是否在调节IFN-I通路的作用上有差异,本研究将Hep-Flury的G基因替换成CVS-11的G基因,拯救出重组毒株HepG,分别在小鼠和细胞水平分析不同毒株感染对IFN-I通路相关基因表达调控的影响。结果显示,Hep-Flury在感染后够较快地诱导IFN-I上游基因的表达,重组病毒HepG感染鼠脑激活这些基因的表达水平介于亲本株Hep-Flury和CVS-11之间。这些结果说明不同毒株的G蛋白对于病毒感染激活IFN-I通路的程度具有一定的调节作用。已有研究表明,RABV感染激活宿主IFN-I通路的主要成分是病毒的基因组或转录出的leader RNA[13-15],本研究发现在病毒感染后第4天,弱毒Hep-Flury的基因组含量虽然比CVS-11少,但其转录出的leader RNA较多。因此,我们推测leader RNA对IFN-I的诱导能力可能比病毒基因组强,这使得Hep-Flury能够在感染后第4天较强地激活IFN-I通路。有文献报道RABV的G蛋白与病毒leader RNA的转录相关[14],据此推测,Hep-Flury的G蛋白也许在一定程度上能够较早地调控转录出leader RNA,使其更强地激活IFN-I通路。这种调控的具体机制还需要进一步研究。在感染后第4天,我们检测到3种毒株对IFN-α4/β/γ/κ这些基因的刺激都不显著,而在感染后第7天,CVS-11和HepG较显著地上调IFN-α4/β/γ,从而推测在感染早期, Hep-Flury虽然激活了IFN-I通路的上游基因,但受到了病毒P蛋白的抑制作用,使得IFN基因的表达未受到明显诱导,到了感染后期,由于CVS-11和HepG在脑内大量地增殖,产生的病毒基因组及leader RNA强烈诱导IFN-I通路,而使得P蛋白无法完全抑制该通路,导致了IFN-α4/β/γ的明显上调。
不管是RABV弱毒株还是致病株都能在鼠脑中激活IFN-I通路相关基因的表达,但它们的复制水平有显著差异,致病株CVS-11在感染后第7天鼠脑内病毒载量约是Hep-Flury的4 000倍。这表明中枢神经系统的IFN-I通路虽然被激活了,但其在对抗致病毒株的能力上似乎受到了限制。为了探究携带不同G基因的RABV在神经细胞中抵抗IFN-I作用的差异,我们预先用Poly(I:C)诱导激活神经细胞Neuro-2a和SK-N-SH的IFN-I通路,再测定3种病毒的复制水平,发现Hep-Flury在感染早期受到IFN-I通路的抑制最为明显,而CVS-11和HepG的复制只略微受到了影响。这些结果说明,CVS-11以及携带其G基因的HepG在神经细胞中具备较好的抵抗IFN-I作用的能力。这也从一个侧面解释了CVS-11和HepG在鼠脑内诱导激活IFN-I通路却依然能够高水平复制的原因。
综上所述,我们推测弱毒株Hep-Flury在感染早期,其G蛋白能够通过某种方式调控leader RNA较高水平地表达,从而较强地诱导IFN-I通路,有效地抑制病毒的复制。而致病毒株较晚诱导IFN-I通路,后期虽然IFN-I通路被强烈激活,但其G蛋白能够在神经细胞中有效地抵抗IFN-I的作用,因此,病毒依然能在脑中大量繁殖。关于致病株的G蛋白如何在神经细胞中抵抗IFN-I作用的疑问尚需更深入的研究进行阐释。
-
表 1 噻虫胺在柑橘叶片和土壤中的添加回收率
Table 1 Recovery rates and relative standard deviations (RSD) of clothianidin in citrus
leaves and soil n=5 样品
Sample噻虫胺添加量/(mg·kg–1)
Added clothianidin回收率/% Recovery rates RSD/
%1 2 3 4 5 平均 Average 叶片 Leaf 2.500 104.26 103.01 102.55 104.34 106.67 104.17 1.54 0.250 96.35 93.04 98.89 95.32 100.01 96.72 2.89 0.025 72.90 89.43 114.27 87.49 85.60 89.94 16.75 土壤 Soil 25.0 96.59 90.72 87.85 84.01 101.59 92.15 7.59 5.0 85.14 82.74 84.27 82.31 87.95 84.48 2.67 0.5 81.88 81.02 83.80 77.30 90.83 82.97 6.02 表 2 离滴头不同距离的土壤中噻虫胺的分布1)
Table 2 The distribution of clothianidin in soil at different distance from emitter
药后时间
Time after treatment土壤深度/cm
Soil depthw(噻虫胺)不同距离/(mg·kg–1) Clothianidin content at different distance 0~5 cm 5~10 cm 10~15 cm 2 h 0~5 24.90±6.73aA 21.32±3.44aA 5.50±0.31aB 5~10 25.04±8.67aA 17.16±1.42aA 4.38±0.35bB 10~15 6.52±1.78bA 6.95±0.36bA 0.83±0.42cB 45 d 0~5 0.38±0.03cC 1.14±0.16bAB 1.74±0.43aA 5 ~10 2.84±0.27bA 3.81±0.76aA 0.41±0.13bB 10~15 4.08±0.55aA 1.01±0.12bB 0.28±0.10bB 1) 相同施药时间、同列数据后的不同小写字母表示差异显著,同行数据后不同大写字母表示差异显著(P<0.05,Duncan’s 法)
1) Different lowercase letters in the same column and time indicated significant difference,different capital letters in the same row indicated significant difference (P<0.05, Duncan’s method) -
[1] DENG X L, GAO Y D, CHEN J C, et al. Current situation of“Candidatus Liberibacter asiaticus”in Guangdong, P. R. China, where citrus Huanglongbing was first described[J]. J Integr Agr, 2012, 11(3): 424-429. doi: 10.1016/S2095-3119(12)60027-6
[2] 张培, 关磊, 刘蕤, 等. 砂糖橘红鼻子果与韧皮部杆菌侵染相关性研究[J]. 热带作物学报, 2011, 32(4): 738-742. doi: 10.3969/j.issn.1000-2561.2011.04.033 [3] BOINA D R, BLOOMQUIST J R. Chemical control of the Asian citrus psyllid and of Huanglongbing disease in citrus[J]. Pest Manag Sci, 2015, 71(6): 808-823. doi: 10.1002/ps.3957
[4] XU M R, LIANG M D, CHEN J C, et al. Preliminary research on soil conditioner mediated citrus Huanglongbing mitigation in the field in Guangdong, China[J]. Eur J Plant Pathol, 2013, 137(2): 283-293. doi: 10.1007/s10658-013-0238-z
[5] BOVE J M. Huanglongbing: A destructive, newly-emerging, century-old disease of citrus[J]. J Plant Pathol, 2006, 88: 7-37.
[6] CEN Y J, YANG C L, HOLFORD P, et al. Feeding behaviour of the Asiatic citrus psyllid, Diaphorina citri, on healthy and Huanglongbing-infected citrus[J]. Entomol Exp Appl, 2012, 143(1): 13-22. doi: 10.1111/eea.2012.143.issue-1
[7] WU F N, HUANG J Q, XU M R, et al. Host and environmental factors influencing“Candidatus Liberibacter asiaticus”acquisition in Diaphorina citri[J/OL]. Pest Manag Sci, 2018. (2018-05-03). 10.1002/ps.5060">https://doi.org/ 10.1002/ps.5060. doi: 10.1002/ps.5060.
[8] 余继华, 黄振东, 张敏荣, 等. 亚洲柑橘木虱带菌率的周年变化动态[J]. 浙江大学学报(农业与生命科学版), 2017, 43(1): 89-94. [9] AJWA H A, TROUT T, MUELLER J, et al. Application of alternative fumigants through drip irrigation systems[J]. Phytopathology, 2002, 92(12): 1349-1355. doi: 10.1094/PHYTO.2002.92.12.1349
[10] KUHAR T P, WALGENBACH J F, DOUGHTY H B. Control of Helicoverpa zea in tomatoes with chlorantraniliprole applied through drip chemigation[J/OL]. Plant Health Progress, 2010. (2010-04-07). http://172.16.1.72/sub/php/research/2010/tomato/tomato.asp. doi: 10.1094/PHP-2009-0407-01-RS.
[11] 彭良志, 淳长品, 江才伦, 等. 滴灌施肥对‘特罗维它’甜橙生长结果的影响[J]. 园艺学报, 2011, 38(1): 1-6. [12] AMMAR E, WALTER A J, HALL D G. New excised-leaf assay method to test inoculativity of Asian citrus psyllid (Hemiptera: Psyllidae) with Candidatus Liberibacter asiaticus associated with citrus Huanglongbing disease[J]. J Econ Entomol, 2013, 106(1): 25-35. doi: 10.1603/EC12245
[13] 孙桂春. 试论柑桔木虱的分布消长及综合防治技术[J]. 中国南方果树, 1999, 28(6): 17-18. [14] HALL D G, RICHARDSON M L, AMMAR E, et al. Asian citrus psyllid, Diaphorina citri, vector of citrus Huanglongbing disease[J]. Entomol Exp Appl, 2013, 146(2): 207-223. doi: 10.1111/eea.12025
[15] 许长藩, 夏雨华, 柯冲. 柑桔木虱生物学特性及防治研究[J]. 植物保护学报, 1994, 21(1): 53-56. [16] 程保平, 赵弘巍, 彭埃天, 等. 柑橘黄龙病的传播介体:柑橘木虱在广东果园的发生调查[J]. 植物保护, 2016, 42(1): 189-192. doi: 10.3969/j.issn.0529-1542.2016.01.035 [17] 吴春笃, 王光亮, 沈林生. 久效磷在悬铃木植株体内动态分布的研究[J]. 农业工程学报, 1994, 10(4): 96-101. [18] 田鹏鹏. 树干注射吡虫啉在树体内的吸收传导分布研究[D]. 杨凌: 西北农林科技大学, 2008. [19] DELÉTAGE-GRANDON C, CHOLLET J F, FAUCHER M, et al. Carrier-mediated uptake and phloem systemy of a 350-dalton chlorinated xenobiotic with an alpha-amino acid function[J]. Plant Physiology, 2001, 125(4): 1620-1632. doi: 10.1104/pp.125.4.1620
[20] BROMILOW R H, CHAMBERLAIN K. The herbicide glyphosate and related molecules: Physicochemical and structural factors determining their mobility in phloem[J]. Pest Manag Sci, 2000, 56(4): 368-373. doi: 10.1002/(ISSN)1526-4998
[21] GHIDIU G, KUHAR T, PALUMBO J, et al. Drip chemigation of insecticides as a pest management tool in vegetable production[J]. J Integr Pest Manag, 2012, 3(3): 1-5.
[22] GHIDIU G M. Integrated pest management and pest control: Current and future tactics[M]. InTech Open Access Publisher, 2012: 173-190.
[23] WANG X, ZHU H, REDING M E, et al. Delivery of chemical and microbial pesticides through drip irrigation systems[J]. Appl Eng Agric, 2009, 25(6): 883-893. doi: 10.13031/2013.29242
[24] 张明媚, 孙克, 吴鸿飞, 等. 噻虫胺的合成[J]. 农药, 2010, 49(2): 94-96. doi: 10.3969/j.issn.1006-0413.2010.02.005 [25] LANGDON K W, ROGERS M E. Neonicotinoid-induced mortality of Diaphorina citri (Hemiptera: Liviidae) is affected by route of exposure[J]. J Econ Entomol, , 2017, 110(5): 2229-2234. doi: 10.1093/jee/tox231
[26] 陈红, 魏盛禄, 陈伟, 等. 30% 噻虫胺除虫脲悬浮剂防治柑橘木虱的田间药效试验[J]. 农业与技术, 2017, 37(10): 48. [27] ICHINOSE K, BANG D V, TUAN D H, et al. Effective use of neonicotinoids for protection of citrus seedlings from invasion by Diaphorina citri (Hemiptera: Psyllidae)[J]. J Econ Entomol, 2010, 103: 127-135. doi: 10.1603/EC09218
[28] MOFFAT C, BUCKLAND S T, SAMSON A J, et al. Neonicotinoids target distinct nicotinic acetylcholine receptors and neurons, leading to differential risks to bumblebees[J]. Sci Rep, 2016. doi: 10.1038/srep24764(2016).
-
期刊类型引用(2)
1. 李园园,袁倩,冯晓然,邓思,李娜,姚伦广,秦英惠. 1株乌鳢水泡病毒的分离与鉴定. 中国畜牧兽医. 2025(02): 811-822 .  百度学术
百度学术
2. 石凌云. 社区狂犬病暴露预防处置门诊对犬伤伤口处置、被动免疫、疫苗接种等措施的实施效果. 临床研究. 2024(08): 191-194 .  百度学术
百度学术
其他类型引用(0)




 下载:
下载: