Analyses of the fructokinase activity and its gene expression during the development of longan fruits
-
摘要:目的
以石硖龙眼Dimocarpus longan cv.shixia为材料, 研究了龙眼果实在发育过程中假种皮蔗糖、葡萄糖和果糖含量的变化规律, 以及果糖激酶活性及其基因的表达变化情况.
方法利用高效液相色谱测定果实糖含量变化; RT-qPCR测定基因表达变化量; 构建原核表达载体, 并在大肠埃希菌Escherichia coli Rosetta(DE3)中进行表达.
结果和结论随着龙眼果实的发育, 假种皮中蔗糖、葡萄糖和果糖的含量逐渐增加, 但进入成熟期后, 糖含量水平趋于稳定; 在果实成熟前, 果糖激酶活性随着果实发育逐渐降低, 由发育最初的25.97 μmol·g-1 ·h-1下降到13.18 μmol·g-1·h-1, 而在成熟时增大到22.44 μmol·g-1·h-1; 荧光定量分析显示, 龙眼果糖激酶基因的表达量在果实发育前期变化不大, 而在假种皮迅速膨大、含糖量迅速上升时期则呈下降趋势; SDS-PAGE结果表明, 成功构建了pET-32a-DlFRK原核表达载体, 经IPTG诱导能够在大肠埃希菌中得到高效表达.
Abstract:ObjectiveChanges in the contents of sucrose, glucose and fructose, the activity of fructokinase (FRK) and its gene expression during the development of longan (Dimocarpus longan Lour.cv. Shixia) fruit aril were studied.
MethodSugar contents were determinated using HPLC, and the FRK activity was analyzed using colorimetric method.Real-time qPCR was used to analyze the expression of DlFRK gene.Prokaryotic expression vector was constructed using in-fusion method to express DlFRK gene in Escherichia coli Rosetta (DE3).
Result and conclusionThe results showed that the contents of sucrose, glucose and fructose in the aril increased gradually with the development of longan fruits, and they tended to become stable at the mature stage.The fructokinase activity decreased gradually from 25.97 μmol·g-1·h-1to 13.18 μmol·g-1·h-1 at the early stages before maturation, and increased during maturation to 22.44 μmol·g-1·h-1 at full maturity.Quantitative RT-PCR analyses showed that the expression of fructokinase gene was relatively stable at the early stages, but it declined during the aril expanding period with a rapid sugar accumulation.The result of SDS-PAGE showed that pET-32a-DlFRK prokaryotic expression vector has been constructed.Gene expression has been successfully induced by IPTG in E.coil BL21.
-
Keywords:
- longan /
- fructokinase /
- quantitative RT-PCR /
- prokaryotic expression
-
龙眼Dimocarpus longan属无患子科龙眼属果树, 是原产于我国南方热带亚热带的名优果树之一, 其果实的果肉部分由假种皮发育而来, 属于糖直接积累型, 发育前期只有极少数的淀粉积累, 随后均以可溶性糖的形式贮藏于液泡中[1], 蔗糖是植物体内碳水化合物从源到库的主要运输形式, 蔗糖进入库器官后可以由转化酶分解为葡萄糖和果糖, 或由蔗糖合成酶分解为尿苷二磷酸葡萄糖和果糖[2-4].果糖在进入下一步代谢前必须由果糖激酶或己糖激酶进行磷酸化, 而果糖激酶是催化果糖磷酸化的主要酶[5].此外, 果糖激酶还可以作为植物的己糖感受器和信号分子, 通过影响植物的生长周期来调控植物的代谢和生长发育进程[6].因此, 研究龙眼果糖激酶基因的表达特性, 对研究龙眼果实中果糖代谢调节机制具有十分重要的意义.
果糖激酶首先从酵母细胞中提取分离出来, 在高等植物中则是先从小麦中分离鉴定到果糖激酶[7].到目前为止, 人们已经在拟南芥[8]、甜菜直根[9]、马铃薯块茎[10]、番茄果实[11]、水稻[12]、大豆[13]、毛果杨[14]、大麦叶片[15]、鳄梨[16]、和蜜柑[17]等植物组织中克隆和鉴定出果糖激酶基因.Jiang等[12]、Zhang等[18]和Qin等[19]对水稻、玉米和温州蜜柑中果糖基因的表达进行了分析.Schaffer等[20]的研究显示, 在番茄果实中果糖激酶能够调节蔗糖与淀粉之间的相互转化.目前对于果实中果糖激酶的研究主要集中在基因全长的克隆、酶的亚细胞定位、酶学特性的分析上[21].关于龙眼果实在发育过程中果糖激酶所起的作用及其表达情况的研究鲜见报道.
1. 材料与方法
1.1 材料
以石硖龙眼D.longan cv.Shixia作为试验材料, 采自广东省农业科学院果树研究所.
分别于花后59、73、87、94、101、110 d摘取不同发育阶段龙眼果实, 其中花后110 d为果实成熟采收时期.摘取的果实立即运回实验室, 去梗, 选取发育正常、外观良好的果实作为试验材料.
采集的假种皮样品于液氮中速冻, 置于- 80 ℃超低温冰箱中保存.所用引物均由上海生工生物工程有限公司合成(表 1).
表 1 引物序列与用途Table 1. Sequences of primers and their application
1.2 龙眼果实糖组分及其含量的测定
龙眼果实糖含量测定参照胡志群等[22]的方法并有所改进.准确称取龙眼假种皮磨成粉末后的速冻样品1 g, 放入研钵, 在微波炉杀酶30 s, 加入5 mL水研磨匀浆, 4 000 r·min-1离心15 min, 残渣加入5 mL水混匀再提取15 min, 4 000 r· min-1离心10 min, 合并上清液, 用水定容至10 mL; 从中移取2 mL溶液于离心管中, 13 000 r·min-1离心15 min, 再取1 mL上清液经Water Sep-Pak C18小柱纯化后待测.使用美国Agilent 1200 LC高效液相色谱仪, 该仪器配有RID示差检测器, 色谱柱为Transgenomic coregel 87 C色谱柱, 流动相为水, 流速0.6 mL·min-1, 柱温80 ℃, 进样量10 μL.所用标样为分析纯的果糖、葡萄糖和蔗糖.通过保留时间和峰面积的比较测定糖的种类和含量.设3个取样重复, 每个样品测定1次, 取平均值.
1.3 龙眼假种皮果糖激酶(FRK)活性测定
酶的提取参照Zhu等[23]的方法, 并略有改动.整个提取过程在0 ~ 4 ℃条件下进行, 将龙眼假种皮冻样用液氮研磨成粉末, 准确称量1 g冻粉, 加入1.5 mL的预冷提取缓冲液(50 mmol· L-1 Hepes-NaOH, 1 mmol· L-1 EDTA, 2.5 mmol· L-1 DTT, 5 mmol·L-1 MgCl2, 体积分数为0.05%的Triton-100, 0.5 mg·mL-1的BSA, 体积分数为10%的甘油)至2 mL离心管中, 4 ℃条件下13 000 r·min-1离心10 min, 取1 mL上清液过PD-10脱盐柱, 过滤后定容到2 mL, 作为酶提取液待用.每个样品重复3次.
参照Huber等[24]的方法测定果糖激酶(FRK)活性并略作修改.在0.4 mL的反应体系中含: 30 mmol·L-1 Hepes-NaOH (pH 7.5), 1 mmol · L-1 MgCl2, 0.6 mmol·L-1 Na2EDTA, 1 mmol·L-1 KCl, 1 mmol·L-1 NAD, 1 mmol·L-1 ATP, 1 U G-6-PDH, 酶提取液0.08 mL.测定酶活性时, 再顺序加入1 U的PGI (Sigma公司产品)和2 mmol·L-1的果糖启动反应.反应在37 ℃条件下进行, 根据一定时间内D340 nm的变化, 计算FRK活性.上述酶的提取和测定均重复3次.
1.4 龙眼假种皮RNA的提取和cDNA的合成
从龙眼各发育阶段假种皮中分别提取总RNA, 参照热硼酸方法[25], 并稍做改动.以纯度合格的RNA为模板(去除基因组DNA), 使用TaKaRa公司的反转录试剂盒合成第1链cDNA, 合成cDNA的方法详细参照说明书上的步骤进行, 产物于- 40 ℃条件下保存备用.
1.5 龙眼果糖激酶基因(DlFRK)的表达
为检测DlFRK基因在龙眼果实中的相对表达水平, 使用GAPDH为内参基因用于后期的RT-qPCR分析.RT-qPCR使用20 μL体系:cDNA模板1 μL, 上游引物P5和下游引物P6各1 μL, 反应MIX 10 μL (Toyobo公司产品), ddH2O 7 μL.荧光定量反应程序:50 ℃ 2 min, 95 ℃ 10 min; 95 ℃ 15 s, 60 ℃ 25 s, 72 ℃ 35 s, 40个循环.PCR扩增程序结束之后添加溶解程序, 得到溶解曲线.内参基因GAPDH扩增体系使用引物为P3和P4.
1.6 原核表达载体的构建及重组质粒的诱导表达和SDS-PAGE分析
之前已经克隆出DlFRK基因, NCBI登录号为JN166014.1.原核表达载体的构建方法参照文献[26], 将构建成功的重组质粒命名为pET-32a-DlFRK, 将测序正确的重组质粒转化到大肠埃希菌Escherichia coli Rosetta(DE3)感受态细胞中.
重组质粒的诱导表达和SDS-PAGE分析方法参照文献[26].
2. 结果与分析
2.1 龙眼果实发育过程中糖组分含量变化
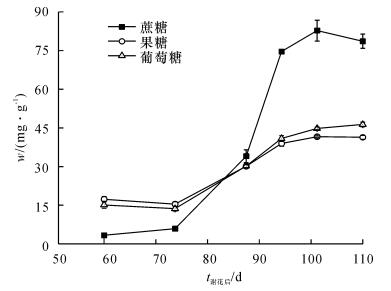
糖含量分析显示, 龙眼果实在不同发育时期蔗糖、葡萄糖和果糖在假种皮中的积累模式大致相同(图 1), 即在整个果实发育过程中3种糖的含量均随着果实发育不断积累, 蔗糖积累量在谢花后101 d达到最高值82.76 mg·g-1, 葡萄糖和果糖积累量均在谢花后110 d达到最高值46.31和41.37 mg·g-1.在果实整个发育过程中, 蔗糖与己糖积累均于花后73 d开始迅速增长, 进入糖分迅速积累阶段; 花后94 d则缓慢增长, 水平相对稳定, 说明此时糖分含量达到品种固有水平, 果实进入成熟阶段.成熟果实中蔗糖含量积累显著高于葡萄糖和果糖的各自积累量, 但是蔗糖的积累量与己糖的积累总量大致相等, 由此可知, 石硖龙眼果实属于胡志群等[22]分类的中间类型果实.
2.2 龙眼FRK酶活性变化
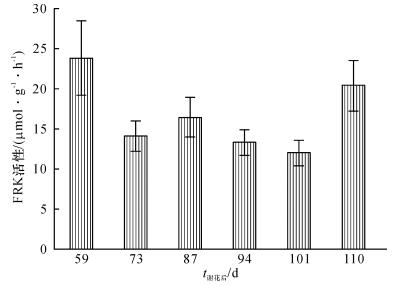
石硖龙眼果实在不同发育时期果糖激酶活性变化表明, 随着果实发育, 假种皮中果糖激酶的活性随着花后时间的推移而出现下降趋势, 到谢花后101 d达到最低值, 但谢花后110 d时又显著升高.结合龙眼果实发育期间糖含量变化可知, 在果糖激酶活性下降的过程中是果实糖分迅速积累的时期, 说明此阶段糖分解相关酶活性受到抑制, 成熟后期果糖激酶活性又出现上升, 可能与果实呼吸消耗和相关成熟衰老生理活动增加有关(图 2).
2.3 龙眼DlFRK基因的表达分析
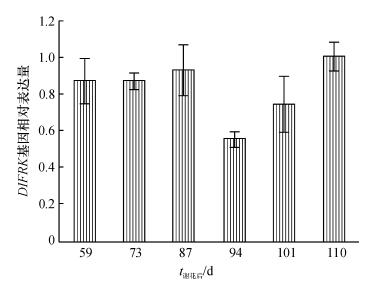
运用实时荧光定量PCR技术, 以龙眼GAPDH基因为内参, 检测龙眼果实发育期间的DlFRK基因的表达情况(图 3).检测后发现, 在果实发育前期(即花后87 d之前), DlFRK基因的相对表达量变化不大, 相对维持在较高的表达水平, 不利于果实发育阶段糖分的积累, 这段时间果实糖分积累量处在一个相对较低的水平(图 1).在谢花后94 d DlFRK基因的相对表达量达最低值, 此时果实糖分迅速积累结束, 进入缓慢增长期; 随着果实成熟, DlFRK基因表达量又逐渐上升, 这可能与果实成熟后呼吸等各方面生理活动旺盛, 从而消耗糖分有关.
2.4 龙眼DlFRK基因开放阅读框(ORF)的获得
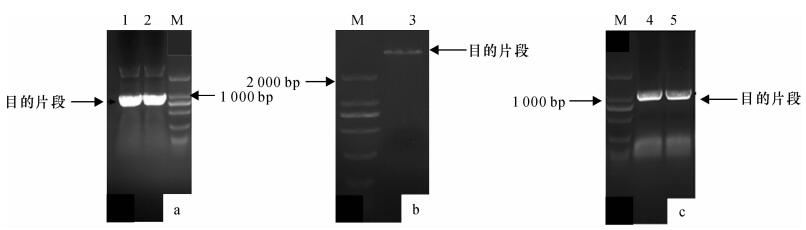
使用P1和P2引物进行PCR扩增获得1条长度约1 000 bp的条带(图 4a), 切胶回收, 连接、转化、测序后分析发现, 此序列为DlFRK基因的ORF序列, 并在起始密码子和终止密码子前面添加了In-Fusion连接片段.回收后的片段于- 40 ℃条件下保存, 用于In-Fusion连接.
使用BamH Ⅰ和Sal Ⅰ对原核表达载体pET-32a的质粒进行双酶切(图 4b), 回收酶切产物片段, 将带有In-Fusion连接片段的DlFRK基因的ORF片段与载体连接, 获得原核表达载体, 命名为pET-32a-DlFRK, 转化后挑选阳性克隆菌株进行菌液PCR和测序鉴定.菌液PCR检测结果表明, 在1 000 bp的时候有目的条带(图 4c), 送样测序比对后发现, 未出现碱基突变及移码现象, 结果表明成功构建了pET-32a-DlFRK原核表达载体.
2.5 原核表达产物的检测
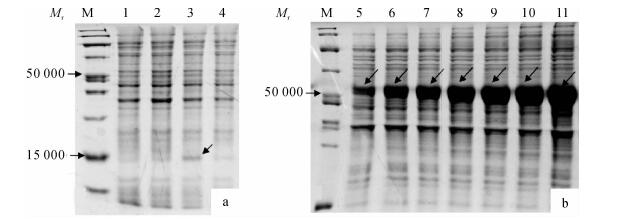
空载体pET-32a转入到大肠埃希菌Rosetta (DE3)中后, 使用0.4 mmol·L-1的IPTG诱导重组蛋白表达, 在相对分子质量18 000左右出现His表达标签蛋白条带(图 5a).把重组质粒pET-32a-DlFRK转入到Rosetta(DE3)中后, 使用0.4 mmol·L-1 IPTG诱导重组蛋白表达, 结果表明, 在相对分子质量54 200(含标签大小18 000)左右位置有目的蛋白的融合表达条带(图 5b), 表达的融合蛋白分子与理论预测值相符, 这表明融合蛋白在Rosetta(DE3)中成功表达.未诱导的pET-32a-DlFRK则没有在相对分子质量54 200左右出现条带(图 5a).
在0.4 mmol·L-1的IPTG和37 ℃条件下, 经过不同时间的诱导培养后, 目的融合蛋白的表达量随着诱导时间的延长持续增加, 但是诱导时间达5 h后表达量增加不显著, 表明在IPTG诱导5 h时表达量几乎达到最高值(图 5b).
3. 讨论
龙眼果实属于糖直接积累型[17], 假种皮中含有较高的可溶性糖, 其组分主要包括蔗糖、葡萄糖和果糖.胡志群等[22]根据龙眼果实单、双糖含量比例将龙眼果实分为3类:蔗糖积累型、单糖积累型和中间类型.本试验通过对石硖龙眼发育及成熟过程中糖含量的积累研究发现, 龙眼果实在发育过程中3种糖的积累随着果实发育不断增加, 尤其在成熟前3周内增加迅速, 至果实成熟分别达到最高值, 之后的2周时间内则保持稳定高水平, 其中以蔗糖水平最高, 约为葡萄糖和果糖含量的总和.由此可见, 石硖龙眼果实以糖分直接积累至固有水平作为其进入成熟阶段的形式, 而且属于糖分积累中间型.
在龙眼果实发育过程中, FRK活性的变化与糖组分的积累和含量变化显示出了密切的相关性. FRK活性随着糖分的积累增加出现了逐渐降低的趋势, 但是在果实采收期活性突然略有增加, 与秦巧平等[1]研究温州蜜柑果实发育过程果糖激酶活性变化相一致.其次, DlFRK基因相对表达量与糖分积累过程也呈现出一致性.实时荧光定量分析表明, 在果实发育前期(即谢花前87 d), DlFRK基因的相对表达量变化不大, 而且也维持在较高的水平, 结合果实发育阶段糖积累过程可知, 这段时间果实糖分积累量相对处于一个较低的水平, 在谢花后94 d出现表达量最低值, 比糖含量最高值和FRK酶活性最低值均提前1周的时间, 而这一阶段也是果实糖分积累变化最大时期, 说明酶的生理活性和相关产物的形成与对应基因的表达时间相比, 具有一定的滞后性.随着果实的成熟, DlFRK基因相对表达量逐渐上升, 这可能与后期成熟果实呼吸等各方面生理活动旺盛, 从而消耗糖分有关.可见在果实积累糖的过程中, 与糖分解相关酶活性及其基因表达的降低将有利于果实糖分的积累.
原核表达系统具有经济实惠、产量高、易操作、稳定性好等优点[27].为研究龙眼果糖激酶蛋白的功能提供了一条高效可行的途径.本研究成功构建原核表达载体pET-32a-DlFRK, IPTG进行诱导表达后SDS-PAGE凝胶电泳分析发现, pET-32a-DlFRK能够在Rosetta (DE3)中成功表达, 并且获得了1个相对分子质量为54 200左右的重组蛋白, 去除PET-32a相对分子质量约18 000的His标签蛋白, 由此可知DlFRK表达蛋白相对分子质量在38 200左右, 这与崔娜等[28]提到的FRK蛋白以二聚体形式存在, 其功能部位由相对分子质量为30 000 ~ 40 000的亚基组成的二聚体相吻合, 但其可溶性及酶活性如何还有待验证.因此有必要将得到的原核表达蛋白进一步进行纯化分离, 为深入研究果糖激酶的功能奠定基础.
-
表 1 引物序列与用途
Table 1 Sequences of primers and their application

-
[1] 秦巧平, 张上隆, 陈俊伟, 等.温州蜜柑果实发育期间果糖激酶与糖积累的关系[J].植物生理与分子生物学学报, 2004, 30(4):435-440. http://d.old.wanfangdata.com.cn/Periodical/zwslxb200404011 [2] OFFER C E, PATRICK J W. Cellular pathway and hormonal control of short distance transfer in sink regions[J]. Plant Biol, 1986, 1:295-306.
[3] 齐红岩, 李天来, 刘海涛, 等.番茄不同部位中糖含量和相关酶活性的研究[J].园艺学报, 2005, 32 (2):239-243. doi: 10.3321/j.issn:0513-353X.2005.02.010 [4] 崔娜, 李天来, 赵聚勇.外源生长素PCPA对番茄果实蔗糖代谢的影响[J].北方园艺, 2008(5):8-12. http://d.old.wanfangdata.com.cn/Periodical/bfyany200805003 [5] GRANOT D. Role of tomato hexose kinase[J]. Funct Plant biol, 2007, 34(6):564-570. doi: 10.1071/FP06207
[6] ROLLAND F, BAENA-GONZALEZ E, SHEEN J. Sugar sensing and signaling in plants: Conserved and novel mechanisms[J]. Annu Rev Plant Biol, 2006, 57:675-709. doi: 10.1146/annurev.arplant.57.032905.105441
[7] SALTMAN P. Hexokinase in higher plants[J]. J Biol Chem, 1953, 200:145-154. doi: 10.1105-tpc.9.1.5/
[8] KAPLAN C P, TUGAL H B, BAKER A. Isolation of a cDNA encoding an Arabidopsis galactokinase by functional expression in yeast[J]. Plant Mol Biol, 1997, 34 (3): 497-506. doi: 10.1023/A:1005816104743
[9] CHAUDRON F, HARRIS N, ROSS H A, et al. Partial purification and characterization of fructokinase from developing taproots of sugar beet (Beta vulgaris)[J]. Plant Sci, 1995, 110(10):181-186. doi: 10.1016-0168-9452(95)04206-A/
[10] TAYLOR M A, ROSS H A, GARDNER A, et al. Characterisation of a cDNA encoding fructokinase from potato (Solanum tuberosum L.)[J]. J Plant Physiol, 1995, 145 (3): 253-256. doi: 10.1016/S0176-1617(11)81885-7
[11] GERMAN M A, ASHER I, PETREIKOV M, et al. Cloning, expression and characterization of LeFRK3, the fourth tomato (Lycopersicon esculentum Mill.) gene encoding fructokinase[J]. Plant Sci, 2004, 166(2):285-291. doi: 10.1016/j.plantsci.2003.09.017
[12] JIANG H, DIAN W, LIU F Y, et al. Isolation and characterization of twofructokinase cDNA clones from rice[J]. Phytochem, 2003, 62(1):47-52. doi: 10.1016/S0031-9422(02)00428-4
[13] KUO T M, DOEHLERT D C, CRAWFORD C G. Sugar metabolism in germinating soybean seeds[J]. Plant Physiol, 1990, 93(4): 1514-1520. doi: 10.1104/pp.93.4.1514
[14] RALPH S G, CHUN H J E, COOPER D, et al. Analysis of 4664 high-quality sequence-finished poplar full-length cDNA clones and their utility for the discovery of genes responding to insect feeding[J]. BMC Genomics, 2008, 9: 57. doi: 10.1186/1471-2164-9-57
[15] BAYSDORFER C, KREMER D F, SICHER R C. Partial purification and characterization of fructokinase activity from barley leaves[J]. Plant Physiol, 1989, 134(2):156-161. doi: 10.1016/S0176-1617(89)80049-5
[16] COPELAND L, TANNER G J. Hexose kinases of avocado [J]. Plant Physiol, 2006, 74(3):531-536.
[17] 陈俊伟, 张上隆, 张良诚.果实中糖的运输、代谢与积累及其调控[J].植物生理与分子生物学学报, 2004, 30 (1):1-10. http://d.old.wanfangdata.com.cn/Periodical/zwslxb200401001 [18] ZHANG S, NICHOLS S E, DONG J G. Cloning and characterization of two fructokinases from maize[J]. Plant Sci, 2003, 165(5):1051-1058. doi: 10.1016/S0168-9452(03)00298-X
[19] QIN Q P, ZHANG S L, CHEN J W, et al. Isolation and expression analysis of fructokinase genes from Citrus[J]. Acta Bot Sinica, 2004, 46(12):1408-1415.
[20] SCHAFFER A A, PETREIKOV M. Sucrose-to-starch metabolism in tomato fruit undergoing transient starch accumulation[J]. Plant Physiol, 1997, 113(3):739-746. doi: 10.1104/pp.113.3.739
[21] 王卫平, 崔娜, 于志海, 等.番茄果实果糖激酶基因的克隆及其表达分析[J].华北农学报, 2011, 26(3):11-15. http://d.old.wanfangdata.com.cn/Periodical/hbnxb201103003 [22] 胡志群, 李建光, 王惠聪.不同龙眼品种果实品质和糖酸组分分析[J].果树学报, 2006, 23(4):568-571. http://d.old.wanfangdata.com.cn/Periodical/gskx200604018 [23] ZHU Y J, KOMOR E, MOORE P H. Sucrose accumulation in the sugarcane stem is regulated by the difference between the activities of soluble acid invertase and sucrose phosphate synthase[J]. Plant Physiol, 1997, 115(2):609-616. doi: 10.1104/pp.115.2.609
[24] HUBER S C, AKAZAWA T. A novel sucrose synthase pathway for sucrose degradation in cultured sycamore cells [J]. Plant Physiol, 1985, 81(4):1008-1013. doi: 10.1104-pp.81.4.1008/
[25] WAN C Y, WILKINS T A. A modified hot borate method significantly enhances the yield of high-quality RNA from cotton (Gossypium hirsutum L.)[J]. Anal Biochem, 1994, 223(1):7-12. doi: 10.1006/abio.1994.1538
[26] 帅良, 李静, 韩冬梅, 等.龙眼亚硫酸盐氧化酶(DlSO)基因的克隆及表达分析[J].果树学报, 2015, 32(1):43-50. http://www.cnki.com.cn/Article/CJFDTOTAL-GSKK201501009.htm [27] WANG D S. Making the most of affinity tags[J]. Trends Plant Biotechnol, 2005, 23(6):316-320. doi: 10.1016/j.tibtech.2005.03.012
[28] 崔娜, 王卫平, 林凤, 等.植物果糖激酶的研究进展[J].中国农学通报, 2010, 26(14):41-47. http://d.old.wanfangdata.com.cn/Periodical/zgnxtb201014010



 下载:
下载: