Physiological study on the flower color formation of five varieties of Lagerstroemia indica
-
摘要:目的
探讨不同花色紫薇开花过程中的颜色变化及其影响因素。
方法通过测定5个花色(红色、白色、淡粉色、粉色和紫色)紫薇在开花过程中4个时期的花瓣色度值,总叶绿素、类胡萝卜素、花色苷、总黄酮、可溶性糖和可溶性蛋白含量以及pH等理化指标,探讨影响紫薇呈色的生理因素。
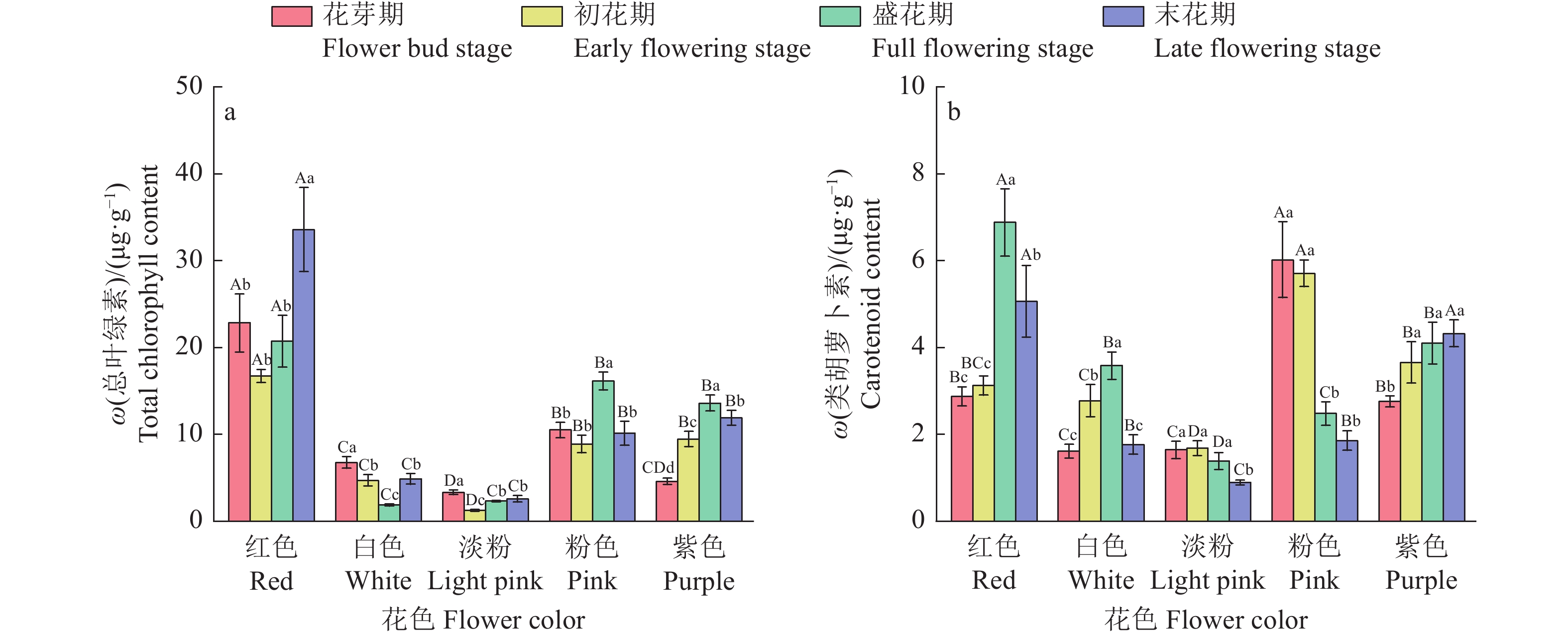
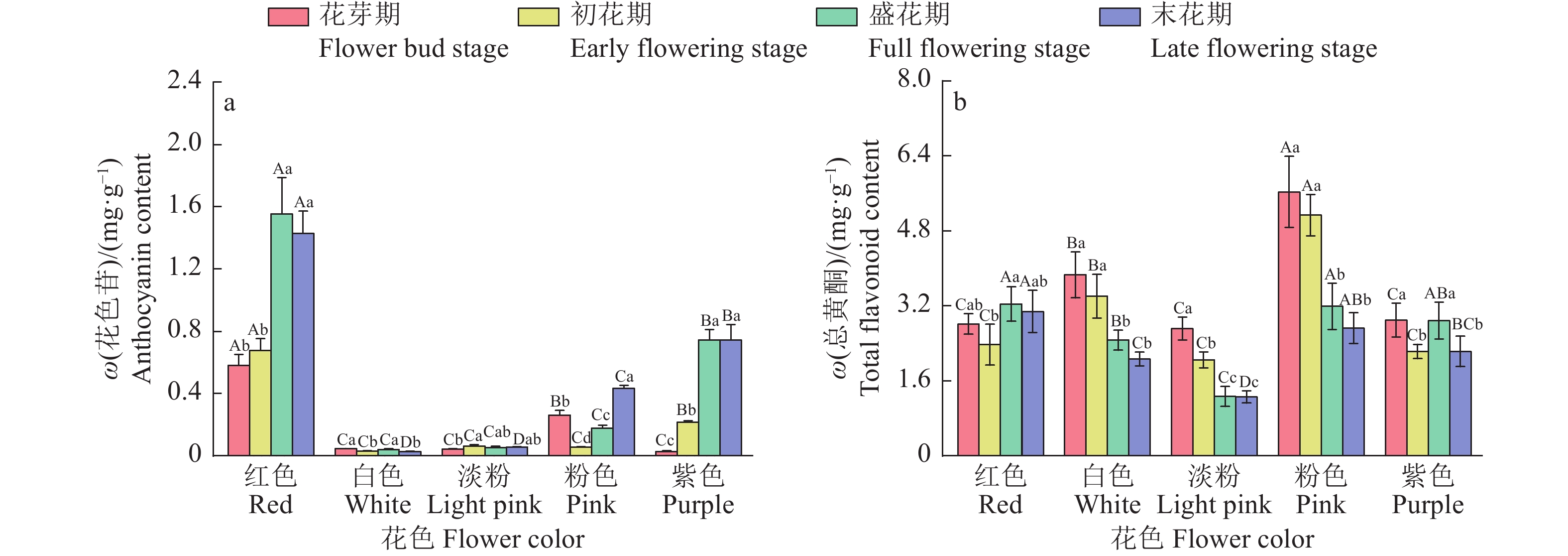
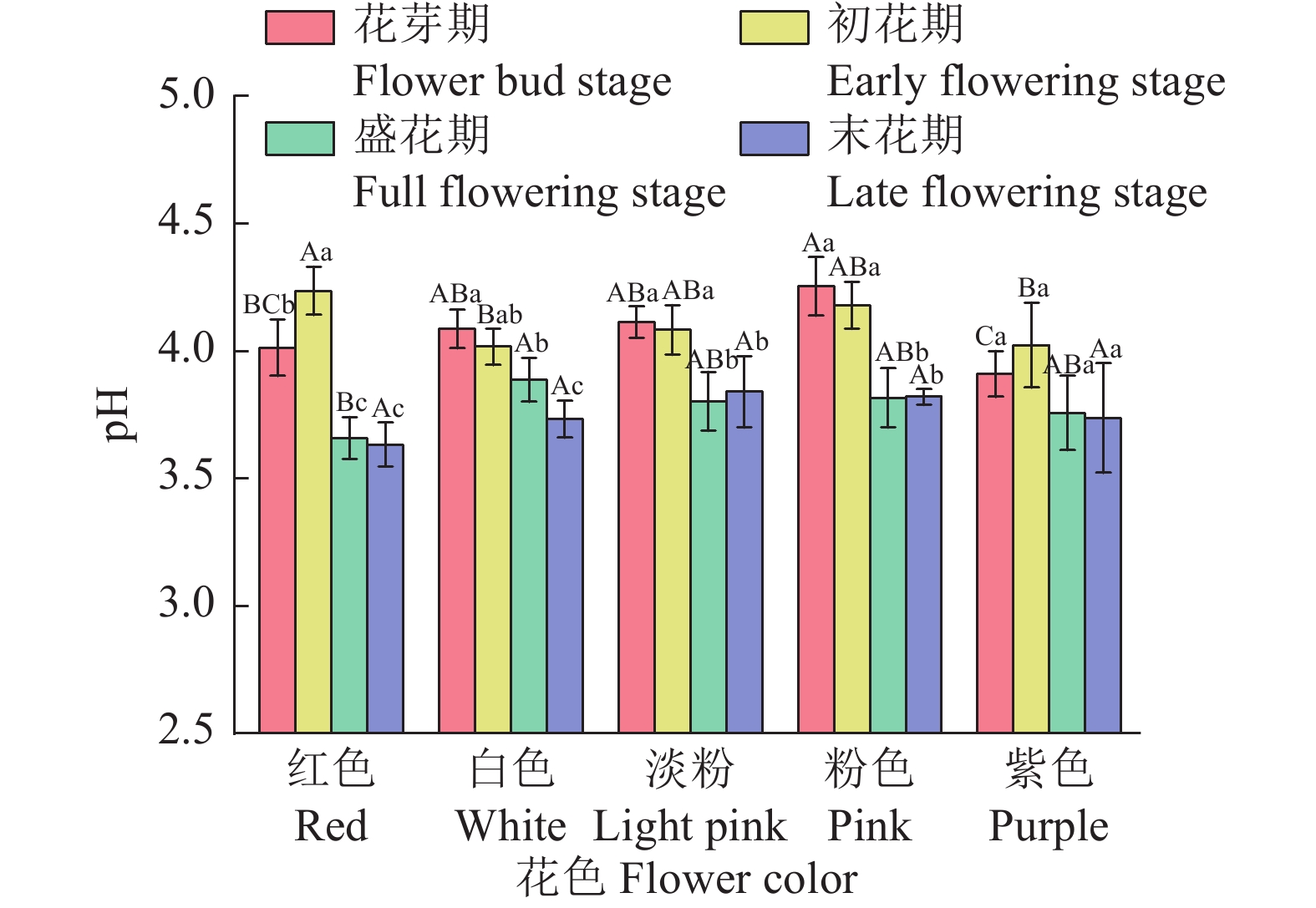
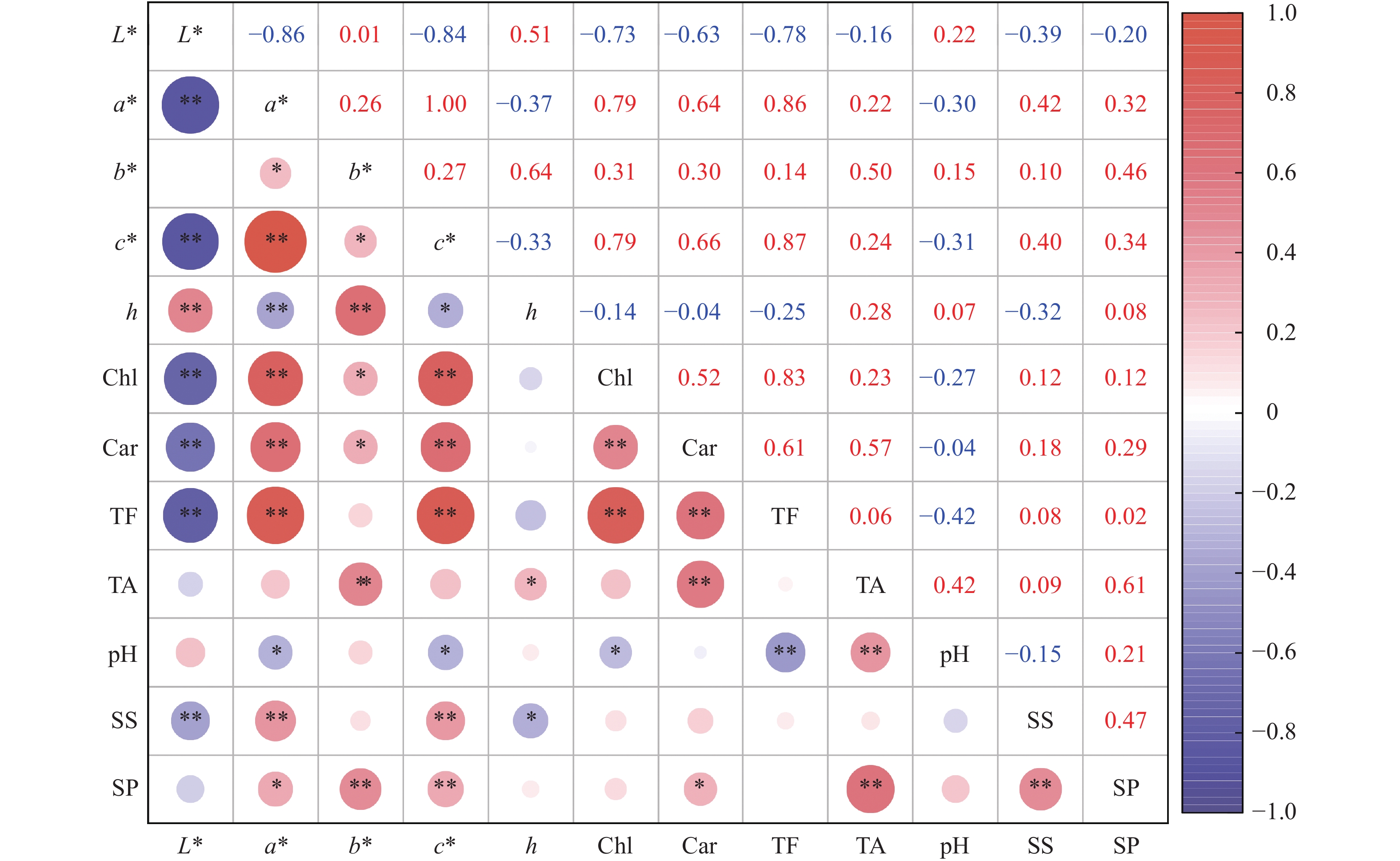
结果不同花色紫薇在开花过程中L*(明度)持续下降,a*(红绿值)和c*(饱和度)先上升后下降,b*(黄蓝值)和h(色调)变化趋势各异;白色花的L*和h最高,最大值分别为61.61和1.45,而红色花的a*、b*和c*最高,最大值分别为44.83、7.39和45.44;盛花期时,红色花中花色苷含量最高,为1.55 mg·g−1,而在白色花和淡粉色花中含量较低,仅为0.04和0.05 mg·g−1,粉色花的总黄酮含量最高,在开花过程中平均含量为4.17 mg·g−1。各色紫薇均在花芽期和初花期pH较高,而在盛花期和末花期pH显著下降(P<0.05)。色度值受色素含量调控,其中L*与总叶绿素、类胡萝卜素和花色苷含量呈极显著负相关(P<0.01);a*和c*与这3种色素含量呈极显著正相关(P<0.01);b*与总黄酮含量呈极显著正相关(P<0.01),与总叶绿素和类胡萝卜素含量呈显著正相关(P<0.05)。
结论色素含量影响花瓣的色度,pH通过影响花色苷稳定性进而影响花色,可溶性糖间接影响花色表现。本研究为揭示影响紫薇花色形成的生理因素提供了科学依据。
Abstract:ObjectiveThis study aims to explore the color changes and influencing factors of Lagerstroemia indica flowers with different flower colors during the blooming process.
MethodThe color values, contents of total chlorophyll, carotenoids, anthocyanins, total flavonoids soluble sugar, and soluble protein, as well as pH were measured at four stages for five flower colors (red, white, light pink, pink and purple). The physiological factors influencing the flower color expression of L. indica were investigated.
ResultThe L* (brightness) of L. indica flowers with different colors continuously decreased during the blooming process. The a* (red-green value) and c* (saturation value) first increased and then decreased. The b* (yellow-blue value) and h (hue) exhibited varying trends. The white flowers had the highest L* and h, with the maxima of 61.61 and 1.45, respectively, while the red flowers had the highest a*, b* and c*, with the maxima of 44.83, 7.39, and 45.44 respectively. At the full blooming stage, the anthocyanin content in red flowers was the highest at 1.55 mg·g−1, whereas it remained relatively low in white and light pink flowers with 0.04 and 0.05 mg·g−1, respectively. Pink flowers displayed the highest total flavonoid content, with an average of 4.17 mg·g−1 during the blooming process. The pH of L. indica flowers of all colors were relatively high at the bud and early blooming stages, but significantly decreased at the full and late blooming stages (P < 0.05). The color values of L. indica flowers were regulated by pigment contents. Specifically, the L* exhibited a highly significant negative correlation with total chlorophyll, carotenoids, and anthocyanin contents (P < 0.01). The a* and c* showed highly significant positive correlations with these three pigments (P < 0.01). The b* showed a highly significant negative correlation with total flavonoid content (P < 0.01) and a significant positive correlation with total chlorophyll and carotenoid contents (P < 0.05).
ConclusionPigment content influences petal color, pH affects flower color by influencing anthocyanin stability, and soluble sugars indirectly affect color expression. This study provides scientific evidence for understanding the physiological factors that influence the color formation of L. indica flowers.
-
Keywords:
- Lagerstroemia indica /
- Flower color /
- Pigment content /
- Coloration /
- Physiological factor
-
氯虫苯甲酰胺属于新型邻氨基苯甲酰胺类杀虫剂,其选择性地与鳞翅目昆虫受体鱼尼丁结合,并打开钙离子通道,使贮存在胞内的钙离子持续释放到肌浆中,导致肌肉细胞丧失收缩功能[1-4],从而使昆虫表现为取食停止、乏力、反胃和肌肉瘫痪,直至死亡[5-7]。氯虫苯甲酰胺不仅可经茎、叶表面渗透到植物体内,还可通过根部吸收并在木质部移动[8],具有良好的植物传导特性、耐雨水冲刷能力和抗光解性能及持效性[9],因其杀虫谱广、对哺乳动物毒性低、对非靶标生物(如鸟、鱼、蚯蚓以及微生物等)影响较小等优点[9-11],成为近年防治我国水稻害虫的主力品种之一。
2007年氯虫苯甲酰胺在菲律宾获准登记并销售,后在美国、澳大利亚、印度尼西亚、中国、韩国、巴西等50多个国家获准登记。氯虫苯甲酰胺200SC于2007年在中国获临时登记,用于防治稻纵卷叶螟Cnaphalocrocis medinalis Guenée[12]。田间应用表明,氯虫苯甲酰胺不仅对稻纵卷叶螟具有优异的防治效果,还对部分水稻品种具有促生长和增产作用。研究报道氯虫苯甲酰胺对水稻品种冈优881和高粱品种泸糯8号具有一定的增产作用[13-14],而对武运粳23号增产不明显[15]。
笔者在湖北水稻主要种植区黄冈和仙桃2地4点,进行了大田示范试验,旨在验证氯虫苯甲酰胺200SC对湖北主要水稻种植品种鄂中5号稻纵卷叶螟的防效以及对水稻植株生长和产量的影响,为其大面积示范和推广应用提供科学依据。
1. 材料与方法
1.1 材料
供试水稻Oryza sativa L.品种为鄂中5号,插秧种植。氯虫苯甲酰胺200SC,上海杜邦农化有限公司生产,用药量为30 g·hm-2;阿维菌素18EC,河北威远生物化工股份有限公司生产,用药量为27 g·hm-2。
1.2 方法
1.2.1 试验设计
田间试验在湖北省仙桃市和黄冈市试验点进行,试验点1:仙桃谢场镇新洲村;试验点2:仙桃海口镇陈家村;试验点3:黄冈麻城杨家冲村;试验点4:黄冈麻城刘角林村。各试验点选取一块100~150 m2的水稻田作为大区,大区周围设保护行,每大区分成3个处理区,各处理区之间设保护行并筑20~30 cm宽的田埂。试验区地势平整,水稻长势均匀,肥水管理一致。各试验点基本情况如表 1所示。
表 1 试验点基本情况Table 1. Background of the test sites
1.2.2 施药方法
各处理将氯虫苯甲酰胺200SC和阿维菌素18EC(阳性对照)按药剂试验设计用量兑水配成药液,以水稻常规防治稻纵卷叶螟方法对水稻植株进行茎叶喷雾处理。每平方米喷药液0.045 L,并按每平方米0.045 L用水量计算各处理区的用水量,空白对照区喷等量清水。
1.2.3 试验处理及调查
喷药前进行虫口基数调查,第1次药后14 d,第2次药后14 d进行药效调查,试验期间共调查3次。将各处理区分为2个部分:一部分用于对害虫的药效调查,每试验点各处理调查100蔸水稻,记录稻纵卷叶螟为害卷叶株数;另一部分用于产量的测定。
在施药前,调查卷叶株数、水稻叶色、分蘖数和长势。第1次药后14 d,调查卷叶数和水稻长势。第2次药后14 d,调查卷叶数、水稻叶色、分蘖数和长势。到收获期时,调查水稻无效穗数、每穗粒数、每穗的有效结实粒、千粒质量以及产量。
叶色:用国际水稻研究所LCC比色板为标准,评估每蔸水稻的颜色分级,每种处理随机抽取40蔸水稻,计算4个试验点平均叶色级别和平均长势。
分蘖数:每种处理随机抽取40蔸水稻,分别于药前调查并记录每蔸水稻株数和第2次药后14 d调查并记录每蔸水稻分蘖数,计算4个试验点平均分蘖数和增加率。在同一处理前期没调查过的另一半区域,随机抽取40蔸水稻,调查并记录有效分蘖数、无效分蘖数,计算4个试验点有效分蘖数的增加率和无效分蘖数的减少率。
每穗粒数及结实率:从调查有效穗数项目中的40蔸水稻里,随机抽取10个稻穗进行考种,调查并记录每穗粒数及有效粒数,计算4个试验点每穗粒数和每穗结实粒增加率。
千粒质量:从调查有效穗数项目中的40蔸水稻谷粒里,随机抽点1 000粒稻谷,抽取3次,干燥,直至谷粒含水量(w)为13%时称质量。
测产:用农业部规定的方法进行产量测定,每大区随机验收收割测规(20 m2)水稻,对其进行测产,并把亩产量转化成每公顷的产量,单位为t·hm-2,计算4个试验点增产率。
1.2.4 药效计算

2. 结果与分析
2.1 氯虫苯甲酰胺200SC的保叶效果
在本试验实施期间,氯虫苯甲酰胺200SC对稻纵卷叶螟药效试验调查结果见表 2。由表 2可知:第1次施药后14 d和第2次施药后14 d氯虫苯甲酰胺200SC的保叶效果分别为85.71%和69.69%,明显优于对照药剂阿维菌素18EC的67.21%和48.20%。
表 2 氯虫苯甲酰胺200SC对稻纵卷叶螟的药效1)Table 2. Effects of chlorantraniliprole 200SC on rice leaf roller
2.2 氯虫苯甲酰胺200SC对水稻生长及产量的影响
2.2.1 对水稻叶色及长势的影响
氯虫苯甲酰胺200SC对水稻叶色及长势的影响调查结果见表 3。从表 3可以看出:4个试验点2个处理,药前4个试验点长势一致;第2次药后14 d,氯虫苯甲酰胺200SC处理叶色优于空白对照,与阳性对照阿维菌素18EC差异不显著;氯虫苯甲酰胺200SC处理作物长势优于阳性对照阿维菌素18EC和空白对照。
表 3 氯虫苯甲酰胺200SC对水稻叶色及作物长势的影响1)Table 3. Influence of chlorantraniliprole 200SC on rice leaf color and crop vigor
2.2.2 对水稻分蘖的影响
氯虫苯甲酰胺200SC对水稻分蘖的影响调查结果显示第2次药后14 d,氯虫苯甲酰胺200SC处理4个试验点水稻分蘖数为10.49苗·蔸-1,阿维菌素18EC处理为9.40苗·蔸-1,与空白对照8.45苗·蔸-1相比,分别增加24.14%和11.24%。氯虫苯甲酰胺200SC对水稻分蘖有较明显的促进作用,并明显优于阳性对照药剂阿维菌素18EC。
氯虫苯甲酰胺200SC和阿维菌素18EC处理,4个试验点平均水稻有效分蘖分别为19.79和20.50株·蔸-1,比对照(19.40株·蔸-1)分别增加2.01%和3.35%,对照药剂阿维菌素18EC优于处理药剂氯虫苯甲酰胺200SC;无效分蘖分别为0.83和0.80株·蔸-1,分别比对照(1.34株·蔸-1)减少38.06%和40.30%,2种药剂间差异不显著。试验结果表明氯虫苯甲酰胺200SC可提高水稻有效分蘖和减少无效分蘖数。
2.2.3 对水稻每穗粒数及结实率的影响
4个试验点平均水稻每穗粒数和每穗结实粒数,氯虫苯甲酰胺200SC处理分别为177.00和133.10粒·穗-1,比对照(160.58和126.78粒·穗-1)分别增加10.23%和4.99%;对照药剂阿维菌素18EC分别为167.65和133.10粒·穗-1,比对照分别增加4.49%和4.99%。氯虫苯甲酰胺200SC处理每穗粒数增加效果优于对照药剂阿维菌素18EC;而每穗结实粒数与对照药剂阿维菌素18EC相当。但各药剂处理的4个试验点的每穗粒数和结实粒数差异显著,这可能与不同试验点药剂对稻纵卷叶螟防治效果相关。
2.2.4 对水稻千粒质量及产量的影响
氯虫苯甲酰胺200SC对水稻千粒质量及产量的影响调查结果见表 4。从表 4可以看出:氯虫苯甲酰胺200SC和阿维菌素18EC处理千粒质量分别为17.63和17.49 g,对照为17.17 g,氯虫苯甲酰胺200SC处理千粒质量增加效果优于对照药剂阿维菌素18EC;20 m2水稻产量分别为8.85和8.48 kg,对照为7.85 kg,与对照相比,氯虫苯甲酰胺200SC处理增产率为12.72%优于对照药剂阿维菌素18EC处理的7.89%。试验结果表明2种药剂处理均可增加水稻产量和千粒质量,且处理药剂氯虫苯甲酰胺200SC优于对照药剂阿维菌素18EC。
表 4 氯虫苯甲酰胺200SC对水稻千粒质量及产量的影响1)Table 4. Influence of chlorantraniliprole 200SC on thousand-grain weight and rice yield
3. 结论
4个试验点第1次施药后14 d和第2次施药后14 d氯虫苯甲酰胺200SC对稻纵卷叶螟防效分别为85.71%和69.69%,明显优于对照药剂阿维菌素18EC的67.21%和48.20%。与董波等[15]和赵阳等[16]研究结果基本一致,而保叶率效果低于束兆林等[17]和张志东等[13]报道的防效,这可能与稻纵卷叶螟产生抗药性有关。
氯虫苯甲酰胺200SC对水稻叶色和长势与对照药剂差异不显著。但第2次施药后14天,水稻分蘖数比空白对照平均增加2.04苗·蔸-1,每蔸水稻分蘖数平均增加了24.14%,而对照药阿维菌素18EC分蘖数增加0.95苗·蔸-1,每蔸水稻分蘖数平均增加了11.24%。因此,氯虫苯甲酰胺200SC对水稻分蘖有较明显的促进作用,并优于对照药剂。
氯虫苯甲酰胺200SC和阿维菌素18EC处理水稻有效分蘖数分别增加2.01%和3.35%,对照药剂阿维菌素18EC处理优于处理药剂氯虫苯甲酰胺200SC处理;无效分蘖数分别减少38.06%和40.30%,处理药剂之间差异不显著;而每穗粒数分别增加10.23%和4.40%,氯虫苯甲酰胺200SC处理优于对照药剂阿维菌素18EC处理;结实率分别增加4.49%和4.49%,处理药剂之间差异不显著;千粒质量分别增加2.68%和1.86%,每667 m2产量分别增加12.72%和7.89%,处理药剂氯虫苯甲酰胺200SC优于对照药剂阿维菌素18EC,与张志东等[13]报道一致,这可能与氯虫苯甲酰胺200SC诱导水稻每蔸分蘖数增加2.04棵苗,每穗粒数增加16.42粒和千粒质量增加0.46 g相关,因此,氯虫苯甲酰胺可诱导水稻分蘖数,每穗粒数和千粒质量增加,从而提高水稻的亩产量,其增产机理有待进一步的研究。
-
图 2 不同花色紫薇总叶绿素和类胡萝卜素含量变化
各图中,柱子上方的不同大写和小写字母分别代表不同花色和不同时期间差异显著(P<0.05,Duncan’s法)。
Figure 2. Changes in total chlorophyll and carotenoid contents in Lagerstroemia indica varieties with different flower colors
In each figure, different uppercase and lowercase letters on bars represent significant differences among different flower colors and different periods, respectively (P<0.05, Duncan’s method).
图 3 不同花色紫薇花色苷和总黄酮含量变化
各图中,柱子上方的不同大写和小写字母分别代表不同花色和不同时期间差异显著(P<0.05,Duncan’s法)。
Figure 3. Changes in anthocyanin and total flavonoid contents in Lagerstroemia indica varieties with different flower colors
In each figure, different uppercase and lowercase letters on bars represent significant differences among different flower colors and different periods, respectively (P<0.05, Duncan’s method).
图 4 不同花色紫薇pH变化
柱子上方的不同大写和小写字母分别代表不同花色和不同时期间差异显著(P<0.05,Duncan’s法)。
Figure 4. pH changes in Lagerstroemia indica varieties with different flower colors
Different uppercase and lowercase letters on bars represent significant differences among different flower colors and different periods, respectively (P < 0.05, Duncan’s method).
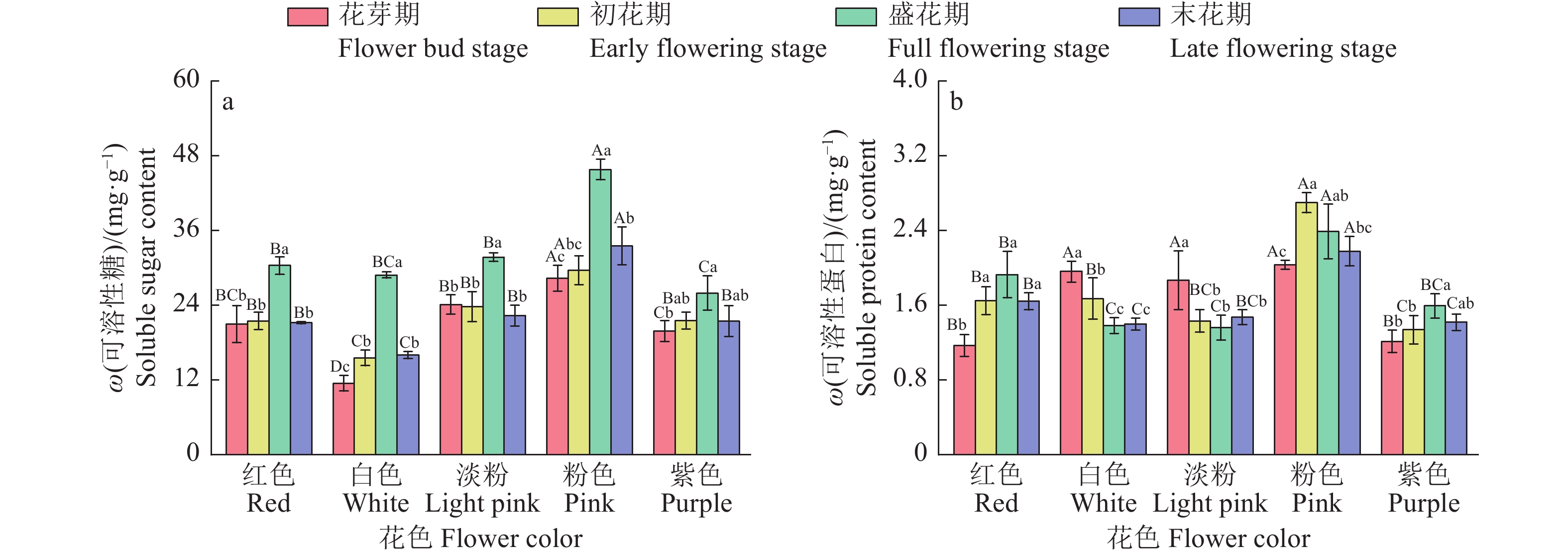
图 5 不同花色紫薇可溶性糖和可溶性蛋白含量变化
各图中,柱子上方的不同大写字母和小写字母分别代表不同花色和不同时期间差异显著(P<0.05,Duncan’s法)。
Figure 5. Changes in soluble sugar and soluble protein contents in Lagerstroemia indica varieties with different flower colors
In each figure, different uppercase and lowercase letters represent significant differences among different flower colors and different periods, respectively (P<0.05, Duncan’s method).
图 6 紫薇开花过程中各指标的相关性
Chl:总叶绿素含量;Car:类胡萝卜素含量;TA:花色苷含量;TF:总黄酮含量;SS:可溶性糖含量;SP:可溶性蛋白含量;*和**分别代表在P<0.05和P<0.01水平显著相关(Pearson法)。
Figure 6. Correlation of various indicators during flowering process of Lagerstroemia indica
Chl: Total chlorophyll content; Car: Carotenoid content; TA: Anthocyanin content; TF: Total flavonoid content; SS: Soluble sugar content; SP: Soluble protein content; * and ** indicate significant correlations at the levels of P<0.05 and P<0.01 respectively (Pearson method).
表 1 不同花色紫薇表型变化1)
Table 1 Phenotypic changes in Lagerstroemia indica varieties with different flower colors
品种 Cultivar
(颜色 Color)时期
PeriodRHSCC 明度
L*红绿值
a*黄蓝值
b*饱和度
c*色调
h丹红紫叶
Ebony Embers
(红色 Red)花芽期 67B 37.04±2.24Ca 11.57±0.44Bd 1.24±0.19Bc 11.63±0.46Bd 0.11±0.01Cc 初芽期 67C 26.21±3.84Db 22.46±1.58Ac 4.69±0.85Bb 22.96±1.42Ac 0.21±0.05Ca 盛花期 60A 20.58±1.41Cc 44.83±1.15Aa 7.39±0.94Aa 45.44±1.20Aa 0.16±0.02Bab 末花期 60B 19.49±0.99Dc 41.42±1.82Ab 5.32±0.51Ab 41.75±1.88Ab 0.13±0.01Cbc 飞雪紫叶
Ebony and Ivory
(白色 White)花芽期 NN155B 61.61±1.31Aa 0.59±0.09Db 4.99±0.52Aa 5.03±0.51Da 1.45±0.03Aa 初芽期 NN155B 60.79±1.06Aa 0.58±0.08Db 4.10±0.69Bb 4.14±0.69Db 1.43±0.02Aab 盛花期 NN155C 54.58±0.97Ab 0.89±0.13Ea 3.82±0.23Bb 3.92±0.25Db 1.34±0.02Ad 末花期 NN155C 54.67±0.95Ab 0.37±0.07Ec 1.82±0.20Cc 1.86±0.18Ec 1.37±0.06Acd Near East
(淡粉 Light pink)花芽期 62D 51.14±3.56Ba 5.60±0.54Cb −4.36±0.93Ca 7.15±0.19Cb −0.66±0.15Db 初芽期 62B 46.99±4.79Ba 10.52±1.29Ca −3.30±0.08Ca 11.03±1.24Ca −0.31±0.03Da 盛花期 62C 49.97±8.74Aa 9.34±1.62Da −4.22±1.93Ca 10.33±2.02Ca −0.41±0.15Ca 末花期 62D 48.76±4.82Ba 8.72±1.30Da −3.13±0.67Da 9.27±1.44Dab −0.34±0.03Da Tuscarora
(粉色 Pink)花芽期 54C 29.67±3.86Dab 24.41±2.12Aa 4.17±0.58Ab 24.77±2.10Aa 0.17±0.03Cb 初芽期 54D 37.04±3.65Ca 14.15±1.38Bc 6.04±0.24Aa 15.40±1.25Bc 0.41±0.04Ba 盛花期 54C 34.26±1.27Bab 24.64±1.45Ba 4.07±0.63Bb 24.98±1.44Ba 0.16±0.03Bb 末花期 54B 29.36±3.97Cb 20.01±0.77Bb 4.35±0.53Bb 20.48±0.86Bb 0.21±0.02Bb 紫悦 Ziyue
(紫色 Purple)花芽期 N155B 50.32±2.60Ba 2.10±0.35Dd 1.00±0.20Ba 2.34±0.27Ed 0.45±0.13Ba 初芽期 N80B 33.66±2.99Cb 10.75±1.00Cc −3.61±0.52Cb 11.34±1.11Cc −0.32±0.02Db 盛花期 N80A 23.86±2.54Cc 21.44±1.72Ca −9.07±0.66Dc 23.30±1.41Ba −0.40±0.05Cbc 末花期 N80B 24.70±2.00CDc 15.66±0.47Cb −9.18±0.15Ec 18.15±0.40Cb −0.53±0.02Dc 1) 表中数据为3次组间重复的平均值±标准偏差;RHSCC:皇家园艺学会比色卡;同列数据后的不同大写和小写字母分别代表不同花色和不同时期间差异显著(P<0.05,Duncan’s法)。
1) Data in the table represent the means ± standard deviations of three inter-group replicates. RHSCC: Royal Horticultural Society color card; Different uppercase and lowercase letters of the same column represent significant differences among different flower colors and different periods, respectively (P<0.05, Duncan’s method). -
[1] 张林娟, 李向茂, 奉树成. 紫薇种质资源与应用研究进展[J]. 广东农业科学, 2024, 51(2): 81-91. [2] 顾帆, 郑绍宇, 沈鸿明, 等. 基于灰色关联度分析评价紫薇品种花部观赏性状[J]. 江苏农业科学, 2019, 47(24): 93-100. [3] 乔中全, 王晓明, 李永欣, 等. 38个紫薇品种亲缘关系的ISSR分析[J]. 浙江农业学报, 2019, 31(4): 565-571. doi: 10.3969/j.issn.1004-1524.2019.04.08 [4] YU C M, LIAN B L, FANG W, et al. Transcriptome-based analysis reveals that the biosynthesis of anthocyanins is more active than that of flavonols and proanthocyanins in the colorful flowers of Lagerstroemia indica[J]. Biologia Futura, 2021, 72(4): 473-488. doi: 10.1007/s42977-021-00094-0
[5] 乔中全, 王晓明, 蔡能, 等. 紫薇新品种‘丹霞’[J]. 园艺学报, 2019, 46(10): 2069-2070. [6] 王梦瑶, 顾翠花. 紫薇品种间杂交亲和性分析[J]. 分子植物育种, 2022, 20(7): 2366-2371. [7] XU W, CAI M, PAN H T, et al. Novel hybrids with floral scent between Lagerstroemia caudata and three L. indica cultivars[J]. Scientia Horticulturae, 2023, 316: 112017. doi: 10.1016/j.scienta.2023.112017
[8] WANG Y X, GU C H, BAI S B, et al. Cadmium accumulation and tolerance of Lagerstroemia indica and Lagerstroemia fauriei (Lythraceae) seedlings for phytoremediation applications[J]. International Journal of Phytoremediation, 2016, 18(11): 1104-1112. doi: 10.1080/15226514.2016.1183581
[9] 王湘莹, 魏溧姣, 王晓明, 等. 淹水胁迫对紫薇苗生长及生理特性的影响[J]. 北方园艺, 2024(15): 60-66. [10] 胡卫霞, 邱国金, 王红梅. 3个彩叶紫薇品种的扦插繁殖对比试验[J]. 安徽农业科学, 2024, 52(7): 99-103. doi: 10.3969/j.issn.0517-6611.2024.07.025 [11] WU Y J, LU Q Y, GONG Y, et al. Optimizing nitrogen, phosphorus, and potassium fertilization levels for container plants of Lagerstroemia indica ‘whit III’ based on the comprehensive quality evaluation[J]. HortScience, 2023, 58(2): 222-230. doi: 10.21273/HORTSCI16980-22
[12] ZHOU W, WANG X M, CHEN J H, et al. Abortion categories and characteristics of acarpous crape myrtle floral organs[J]. Journal of the American Society for Horticultural Science, 2019, 144(6): 387-393. doi: 10.21273/JASHS04757-19
[13] 周围, 陈建华, 王晓明, 等. 结实与不结实紫薇花芽发育形态及生理特性[J]. 中南林业科技大学学报, 2023, 43(10): 148-157. [14] 马晓华, 陈春青, 叶胜忠, 等. 不同花色紫薇花瓣的花色苷化合物组分及含量比较[J]. 亚热带农业研究, 2023, 19(1): 56-63. [15] 林启芳, 刘婷婷, 刘洁茹, 等. 紫薇属与黄薇属植物花瓣类黄酮组成及含量分析[J]. 园艺学报, 2021, 48(10): 1956-1968. [16] ZHANG J, WANG L S, GAO J M, et al. Determination of anthocyanins and exploration of relationship between their composition and petal coloration in crape myrtle (Lagerstroemia hybrid)[J]. Journal of Integrative Plant Biology, 2008, 50(5): 581-588. doi: 10.1111/j.1744-7909.2008.00649.x
[17] 谢燕, 贺英, 周宁智, 等. 蜡梅‘美人醉’花色变化过程中生理生化特性研究[J]. 西北植物学报, 2023, 43(4): 611-617. doi: 10.7606/j.issn.1000-4025.2023.04.0611 [18] 董胜君, 范雯萱, 张云程, 等. 粉花西伯利亚杏花色变化的生理特性研究[J]. 沈阳农业大学学报, 2023, 54(2): 140-148. doi: 10.3969/j.issn.1000-1700.2023.02.002 [19] 何娜, 杨祎凡, 江皓, 等. 观赏海棠花色与花瓣pH、表皮细胞形态特征的关系[J]. 福建农业学报, 2021, 36(9): 1025-1032. doi: 10.3969/j.issn.1008-0384.2021.9.fjnyxb202109005 [20] JIANG T, MAO Y, SUI L S, et al. Degradation of anthocyanins and polymeric color formation during heat treatment of purple sweet potato extract at different pH[J]. Food Chemistry, 2019, 274: 460-470. doi: 10.1016/j.foodchem.2018.07.141
[21] SIGURDSON G T, ROBBINS R J, COLLINS T M, et al. Spectral and colorimetric characteristics of metal chelates of acylated cyanidin derivatives[J]. Food Chemistry, 2017, 221: 1088-1095. doi: 10.1016/j.foodchem.2016.11.052
[22] MENG L S, XU M K, WAN W, et al. Sucrose signaling regulates anthocyanin biosynthesis through a MAPK cascade in Arabidopsis thaliana[J]. Genetics, 2018, 210(2): 607-619. doi: 10.1534/genetics.118.301470
[23] JIN Z Q, WANG Y D, SI C C, et al. Effects of shading intensities on the yield and contents of anthocyanin and soluble sugar in tubers of purple sweet potato[J]. Crop Science, 2023, 63(5): 3013-3024. doi: 10.1002/csc2.21076
[24] ZHANG D L, XIE A Q, YANG X, et al. Analysis of physiological and biochemical factors affecting flower color of herbaceous peony in different flowering periods[J]. Horticulturae, 2023, 9(4): 502. doi: 10.3390/horticulturae9040502
[25] 周琦, 赵峰, 张慧会, 等. 香水莲花开花过程中花色变化规律研究[J]. 热带作物学报, 2024, 45(1): 122-133. doi: 10.3969/j.issn.1000-2561.2024.01.013 [26] 袁美静, 马誉, 巫瑞, 等. 影响月季花瓣呈色的理化因子及花色苷组分分析[J]. 西北植物学报, 2024, 44(2): 255-269. [27] 周兵, 闫小红, 雷艺涵, 等. 紫茉莉开花过程中花色和花色素的变化规律[J]. 植物研究, 2022, 42(3): 475-482. doi: 10.7525/j.issn.1673-5102.2022.03.017 [28] 蒋朵朵, 李林. 2种茄科植物花色变化的生理生化机制[J]. 河南农业科学, 2021, 50(8): 133-145. [29] 勾昕, 胡薇薇, 范亚飞, 等. 文心兰切花不同开放阶段花被的生理生化变化[J]. 热带生物学报, 2016, 7(1): 70-75. [30] ONDER S, TONGUC M, ONDER D, et al. Flower color and carbohydrate metabolism changes during the floral development of Rosa damascena[J]. South African Journal of Botany, 2023, 156: 234-243. doi: 10.1016/j.sajb.2023.03.026
[31] ZHOU Y W, YIN M, ABBAS F, et al. Classification and association analysis of Gerbera (Gerbera hybrida) flower color traits[J]. Frontiers in Plant Science, 2022, 12: 779288. doi: 10.3389/fpls.2021.779288
[32] 李浙浙, 张一丹, 王波, 等. 木槿开花过程中花色素的变化规律及其影响因素[J]. 植物研究, 2023, 43(4): 550-561. doi: 10.7525/j.issn.1673-5102.2023.04.008 [33] 关超, 潘占冬, 孙阳, 等. 3种鸡蛋花开花过程中花色与花色素的变化规律[J/OL]. 分子植物育种, 2023: 1-23. (2023-05-18)[2024-12-08]. http: //kns. cnki. net/kcms/detail/46. 1068. S. 20230517. 1427. 026. html. [34] 刘智媛, 叶康, 杜习武, 等. 藤本月季花瓣形态结构和色素含量相关性分析[J]. 北京农学院学报, 2022, 37(1): 1-10. [35] LUNA-VITAL D, LI Q, WEST L, et al. Anthocyanin condensed forms do not affect color or chemical stability of purple corn pericarp extracts stored under different pHs[J]. Food Chemistry, 2017, 232: 639-647. doi: 10.1016/j.foodchem.2017.03.169
[36] ZHOU X Y, XIE W, JING H, et al. Analysis of anthocyanins and total flavonoids content in functional rice and its recombination inbred lines[J]. Frontiers in Plant Science, 2023, 14: 1113618. doi: 10.3389/fpls.2023.1113618
[37] HONG S D, WANG J, WANG Q, et al. Decoding the formation of diverse petal colors of Lagerstroemia indica by integrating the data from transcriptome and metabolome[J]. Frontiers in Plant Science, 2022, 13: 970023. doi: 10.3389/fpls.2022.970023
[38] GU C H, HONG S D, WANG J, et al. Identification and expression analysis of the bZIP and WRKY gene families during anthocyanins biosynthesis in Lagerstroemia indica L[J]. Horticulture, Environment, and Biotechnology, 2024, 65: 169-180. doi: 10.1007/s13580-023-00551-w
[39] 许芳祺, 柯玲俊, 余惠文, 等. 不同龙船花的花色与色素含量分析[J]. 福建热作科技, 2024, 49(3): 30-33. doi: 10.3969/j.issn.1006-2327.2024.03.009 [40] 韩美玲, 赵宇珩, 李厚华, 等. 开花过程中不同海棠花瓣酚类物质动态变化与花色淡化原因分析[J]. 北方园艺, 2023(16): 64-70. doi: 10.11937/bfyy.20224807 [41] ZHANG C, FU J X, WANG Y J, et al. Glucose supply improves petal coloration and anthocyanin biosynthesis in Paeonia suffruticosa ‘Luoyang Hong’ cut flowers[J]. Postharvest Biology and Technology, 2015, 101: 73-81. doi: 10.1016/j.postharvbio.2014.11.009
[42] GUO Y Z, QIU Y J, HU H, et al. Petal morphology is correlated with floral longevity in Paeonia suffruticosa[J]. Agronomy, 2023, 13(5): 1372. doi: 10.3390/agronomy13051372
[43] WANG X Y, WU Z H, ZHOU Q, et al. Physiological response of soybean plants to water deficit[J]. Frontiers in Plant Science, 2022, 12: 809692. doi: 10.3389/fpls.2021.809692



 下载:
下载: