Effects of rice-fish coculture on growth and yield of ratoon rice with different stubble heights
-
摘要:目的
探究华南双季稻区稻鱼共作对不同留茬高度再生稻生长及产量的影响,为再生稻−鱼共作系统的水稻栽培及茬口管理提供科学依据。
方法以‘野香优油丝’为供试再生稻品种,通过设置稻作模式(水稻单作和稻鱼共作)与再生稻的头季稻留茬高度(留茬高10和30 cm)双因素田间试验,探究稻鱼共作对头季稻不同留茬高度的再生季水稻的生长特性及产量构成因素的影响。
结果高留茬处理下稻鱼共作的再生季水稻产量显著高于水稻单作,稻作模式和头季稻留茬高度对再生季水稻产量具有显著的交互作用影响。稻鱼共作条件下再生季水稻有效穗数和结实率较水稻单作分别显著提高了18.2%和53.2%,但穗粒数显著降低了17.9%,表明稻鱼共作通过提高再生季水稻群体有效穗数和结实率来弥补其穗粒数的不足,从而提高再生季水稻的产量。头季稻收获的留茬高度显著影响再生季水稻齐穗期的叶片氮含量。头季稻成熟期根的玉米素核苷含量与成熟期叶片氮含量存在显著的正相关性,表明提高头季稻成熟期叶片氮含量可能有利于增加其根部玉米素核苷含量,从而间接促进再生季水稻腋芽的萌发。
结论在本试验条件下,华南双季稻区若发展再生稻单作生产,头季稻收割时宜采取低留茬(10 cm)处理,若采取再生稻−鱼共作生产,头季稻收割时宜采取高留茬(30 cm)处理,这样有利于促进后续再生季水稻的生长和产量提高。
Abstract:ObjectiveTo investigate the effects of rice-fish coculture on growth and yield of ratoon rice with different stubble heights in the double rice cropping area of South China, and provide a scientific reference for rice cultivation and stubble management of the ratoon rice-fish coculture system.
MethodUsing‘YeXiangYouYouSi’ as the ratoon rice variety for testing, a two-factor field experiment was conducted by setting rice cropping patterns (rice monoculture and rice-fish coculture) and stubble heights of the main season rice for ratoon rice (10 and 30 cm stubble heights), to explore the effects of rice-fish coculture on the growth characteristics and yield components of ratooning season rice with different stubble heights in the main season.
ResultUnder the treatment of high stubble, the rice yield of the ratooning season was significantly higher in the rice-fish coculture than that in the rice monoculture, and the rice yield was significantly affected by the interaction of the rice cropping pattern and stubble height of the main season rice. Compared with those in the rice monoculture, the effective number of spikes and seed setting rate of the ratooning season rice in the rice-fish coculture significantly increased by 18.2% and 53.2% respectively, while the number of grains per spike significantly decreased by 17.9%, which indicated that the rice-fish coculture compensated for the insufficient number of grains per spike by improving the effective number of spikes and seed setting rate of ratooning season rice population, thus enhancing the yields. In addition, stubble height significantly affected the leaf nitrogen content at the heading stage of the ratooning season rice. During the maturity stage of the main season rice, there was a significant positive correlation between the zeatin riboside content of roots and the nitrogen content of leaves, suggesting that increasing the nitrogen content of leaves at maturity might be beneficial to increase the zeatin riboside content of roots and thus indirectly promote axillary bud germination.
ConclusionUnder the conditions of this experiment, the low stubble (10 cm) treatment was more appropriate for the ratoon rice monoculture system, while the high stubble (30 cm) treatment was suitable for the ratoon rice-fish coculture in the double rice cropping area of South China, which might be favorable to the subsequent growth and yield improvement of the ratooning season rice .
-
Keywords:
- Rice-fish coculture /
- Ratoon rice /
- Stubble height /
- Zeatin riboside /
- Yield /
- Growth characteristic
-
防风Saposhnikovia divaricata (Turcz.) Schischk.为伞形科多年生草本植物,主要分布在中国、韩国和日本[1],以未抽薹的干燥根入药[2]。防风药用历史悠久,在中医临床实践中已有
2000 多年的历史,是我国传统中药材的重要组成部分,具有解表祛风、胜湿、止痛解痉的功效[3]。现代研究表明防风中含有挥发油、色原酮、有机酸、香豆素以及多糖等多种类别的化学成分,其中,香豆素类是防风的主要药效成分之一,具有抗炎、抗病毒、抗菌、保护心脏、诱导癌细胞凋亡等药理作用[4]。香豆素类化合物通过苯丙烷途径产生,根据母核上的取代基及其位置的不同,可分为简单香豆素、呋喃香豆素和吡喃香豆素,具有多种生物活性;在香豆素合成通路中多数基因均是以基因家族的形式存在于植物中,对香豆酰辅酶A 2'−羟化酶(p-Coumaroyl CoA 2'-hydroxylase, C2'H)参与香豆素合成,属于2−氧代戊二酸依赖性双加氧酶(2-Oxoglutarate-dependent dioxygenase,2OGD)超家族[5]。邻羟基化反应是香豆素生物合成的关键步骤,C2'H通过催化对香豆酰辅酶A和阿魏酰辅酶A的邻位羟基化,生成伞形酮前体与东莨菪碱前体,最后通过自发或酶促环化形成香豆素核心骨架。目前,在拟南芥[6]、甘薯[7]、芸香[8]、白花前胡[9]等物种中发现C2'H对对香豆酰辅酶A和阿魏酰辅酶A这2种底物均具有高度特异性;然而,在防风中尚未克隆到C2'H基因。因此,本研究拟克隆防风SdC2'H基因,解析其对香豆素生物合成的调控作用。
毛状根是发根农杆菌Agrobacterium rhizogenes侵染植物受伤部位使植物表面产生的一种病理表现[10],具有遗传稳定、繁殖速度快、容易进行基因操作等优点。毛状根不仅是研究植物基因功能的良好遗传体系[11],还可以合成具植物特征的次生代谢产物,因此在药用植物研究方面,毛状根的培养技术受到诸多关注,在丹参[12]、人参[13]、长春花[14]等药用植物中取得显著进展。近年来,很多学者利用毛状根培养体系在不同植物中进行基因功能研究。例如,在丹参毛状根中过表达SmSCR1基因显著提高毛状根中丹参酮的含量[15];在黄芩毛状根中过表达肉桂酸4−羟化酶(Cinnamate 4-hydroxylase,C4H)和4−香豆酰辅酶A连接酶(4-Coumaroyl coenzyme A ligase,4CL)基因显著增加毛状根中黄酮的含量[16];在何首乌毛状根中过表达2种尿苷二磷酸依赖性糖基转移酶(Uridine-diphosphate-dependent glycosyltransferases,UGTs)基因使毛状根中2, 3, 5, 4'−四羟基二苯乙烯−2−O−β−D−葡萄糖苷(2, 3, 5, 4'- Tetrahydroxy stilbene-2-O-β-D-glucoside,THSG)含量显著提高[17]。而在防风毛状根中进行基因过表达功能验证的研究报道较少。本研究前期利用茉莉酸甲酯(Methyl jasmonate,MeJA)诱导的防风毛状根转录组测序数据[18]筛选出香豆素生物合成途径的关键基因C2'H,利用无缝克隆技术,构建含有SdC2'H基因的过表达载体,利用毛状根遗传转化体系开展SdC2'H基因功能研究,解析该基因在防风香豆素生物合成中的作用,为阐明香豆素生物合成的分子调控网络提供基础。
1. 材料与方法
1.1 试剂与仪器
植物RNA提取试剂盒(货号:ZP405)、cDNA合成试剂盒(货号:AT311)、快速高保真DNA聚合酶(货号:AS131)、同源重组无缝克隆试剂盒(货号:CU201)购于北京全式金生物科技有限公司;SanPrep柱式DNA胶回收试剂盒(货号:B518131)、限制性内切酶Bg1 II和BstE II、SanPrep柱式质粒DNA小量抽提试剂盒(货号:B518191)、植物DNA提取试剂盒(货号:B518262)以及大肠埃希菌DH5α感受态细胞购于上海生工生物工程股份有限公司;pMD-19T载体以及DNA marker(BM2000、BM15000)购于TaKaRa公司;K599发根农杆菌感受态细胞采购自华越洋生物科技(北京)有限公司。
仪器包含PCR仪ProFlex™(美国ThermoFish)、恒温振荡培养箱YAMATOIC412C(美国Yamato)、离心机(美国ThermoFish)、琼脂糖凝胶电泳仪DYY-8C(北京六一)、凝胶成像系统GIS-2010(上海Tanon)。
1.2 PCR引物及程序
由上海生工生物工程股份有限公司完成所有PCR引物合成及测序工作,试验所用引物信息及PCR反应程序参见表1、2。
表 1 引物信息Table 1. Primer information编号
Code项目
Item名称
Name正向序列(5′→3′)
Forward sequence反向序列(5′→3′)
Reverse sequenceS1 SdC2'H基因克隆 SdC2'H-1 ATGCATATTGTTAATCATGG TCATATCTTTGCAAACTCGA S2 SdC2'H基因过表达载体构建 SdC2'H-2 TGACCATGGTAGATCTATGCATA
TTGTTAATCATGGAGTCCCCAATTCGAGCTGGTCACCTCATATC
TTTGCAAACTCGAGAGTGTCCS3 植物双元表达载体构建 1304 GCAACAGGATTCAATCTTAAGA ATTGTGAAGATAGTGGAAAAGG S4 毛状根中rolB验证 rolB GCCAGCATTTTTGGTGAACT GGCACTGAACTTGCCGTTAT S5 转基因毛状根外源SdC2'H鉴定 hrHyg ATCATCGAAATTGCCGTCAA ATGGCGTGATTTCATATGCG S6 利用RT-qPCR检测EF1-α表达 EF1-α AGGCTCTTCAGGAGGCTCTTC CAATGTGACAGGTGTGGCAATC S7 利用RT-qPCR检测SdC2'H表达 q-C2'H ATGCATATTGTTAATCATGGAGTCC GCAACGCAAAGAATCTACGA 1.3 防风SdC2'H基因克隆及生物信息学分析
采用植物RNA提取试剂盒提取新鲜防风叶片总RNA,采用cDNA合成试剂盒逆转录获得cDNA。使用Vector N TI设计引物S1(表1)对SdC2'H基因进行PCR扩增,采用反应程序1(表2);反应体系(20 μL)为cDNA 1.0 μL、2× TransTag HiFi PCR SuperMixⅡ 10.0 μL、上游引物(10 μmol·L−1)1.0 μL、下游引物(10 μmol·L−1)1.0 μL、ddH2O 7.0 μL。利用琼脂糖凝胶电泳纯化PCR扩增产物,在16 ℃恒温条件下与pMD-19T载体过夜连接。将连接产物转入大肠埃希菌DH5α感受态细胞,在含50 mg·L−1 Amp的LB平板上筛选阳性克隆,随机选取若干阳性克隆进行PCR鉴定,对确认符合要求的阳性菌液样本进行测序。
表 2 PCR 程序Table 2. PCR programs编号
Code项目
Item程序
Program1 SdC2'H基因克隆 94 ℃ 5 min;94 ℃ 30 s, 45 ℃ 30 s,72 ℃ 1 min,35次循环;72 ℃ 10 min 2 SdC2'H基因过表达载体构建 94 ℃ 3 min;94 ℃ 30 s,68 ℃ 30 s,72 ℃ 1 min,35次循环;72 ℃ 10 min 3 植物双元表达载体构建 95 ℃ 5 min;95 ℃ 30 s,55 ℃ 30 s,72 ℃ 1.5 min,35次循环;72 ℃ 10 min 4 毛状根中rolB验证 94 ℃ 5 min;94 ℃ 30 s,55 ℃ 30 s, 72 ℃ 1 min,35次循环;72 ℃ 10 min 5 转基因毛状根外源SdC2'H鉴定 94 ℃ 5 min;94 ℃ 30 s,55 ℃ 55 s,72 ℃ 1 min,35次循环;72 ℃ 10 min 6 利用RT-qPCR检测EF1-α表达 95 ℃ 30 s;95 ℃ 5 s,58 ℃ 30 s,72 ℃ 10 s,40次循环 7 利用RT-qPCR检测SdC2'H表达 95 ℃ 30 s;95 ℃ 5 s,58 ℃ 30 s,72 ℃ 10 s,40次循环 基于Expasy-ProtParam在线平台解析SdC2'H蛋白的理化参数;通过SOPMA在线工具预测其二级结构组成;利用Swiss-Model进行三级结构建模;通过SiqnalP6.0 Server在线平台进行信号肽特征预测;借助NCBI的CD-search工具进行保守结构域鉴定;从GenBank选取16个跨物种同源序列,将其与本研究获得的防风SdC2'H序列共同导入MEGA 11软件进行多序列比对,基于近邻聚类算法构建系统进化树。
1.4 构建过表达SdC2'H基因的植物双元表达载体
选取pCAMBIA1304载体Bg1 II与BstE II酶切位点作为SdC2'H基因插入位点,按照同源重组无缝克隆试剂盒的要求设计同源臂引物S2(表1),并进行PCR扩增,采用反应程序2(表2);对质粒pCAMBIA1304进行Bg1 II和BstE II双酶切处理(37 ℃、1 h);按照Basic Assembly反应体系对琼脂糖凝胶电泳纯化扩增产物的目标基因及线性化载体(物质的量比2∶3)进行重组连接,在PCR仪中于50 ℃温育15 min;将重组连接产物转化至大肠埃希菌Trans1-T1感受态细胞,在含50 mg·L−1 Kan的LB固体培养基上随机挑选阳性单菌落;对扩大培养的阳性菌液进行PCR分子鉴定与测序验证,将确认无误的重组质粒命名为pCA-SdC2'H。
1.5 构建重组发根农杆菌K599
利用冻融法将重组pCA-SdC2'H质粒导入发根农杆菌K599感受态细胞,在含50 mg·L−1 Kan、50 mg·L−1 Str的YEB固体培养基上随机选取阳性克隆;选取引物S3(表1)配合PCR程序3(表2)对阳性克隆进行PCR检测与测序;将经测序确认的重组农杆菌接种至含有相应抗生素的YEB液体培养基中,于28 ℃摇床以180 r·min−1振荡培养至对数期,测定菌液D600 nm为0.6~1.0时离心,收集菌体,以等体积1/2MS液体培养基进行重悬[18]。
1.6 过表达SdC2'H基因防风毛状根的诱导、验证及培养
在超净工作台中将防风无菌苗的叶片剪出伤口,并放置在重悬于等体积1/2MS液体培养基的菌液中,于28 ℃摇床中震荡侵染;10 min后取出外植体在滤纸上擦干,接种于MS固体培养基,放置于25 ℃恒温培养箱共培养3 d;3 d后将外植体在无菌水中冲洗掉多余农杆菌,吸干水分并转接到含有50 mg·L−1 Cef的固体MS培养基中除菌培养[18]。以发根农杆菌K599诱导防风毛状根建立空白对照组(CK),同时分别利用携带pCAMBIA1304空载体的工程菌诱导防风毛状根构建阴性对照组(NC),以及携带SdC2'H过表达载体的工程菌诱导防风毛状根构建过表达组(SdC2'H+);每周继代培养并梯度降低Cef质量浓度,直至诱导获得防风毛状根;随后通过植物DNA提取试剂盒获取各处理组毛状根系基因组DNA,分别选取引物S4、S5(表1)配合程序4、5(表2)进行rolB基因及hrHyg外源基因的PCR鉴定。参照西芸霏[18]的方法对上述鉴定正确的防风毛状根进行液体扩大培养,操作如下:无菌条件下称取1.5 g长势一致的防风毛状根系样本,接种于含1/2MS液体培养基的锥形瓶中,置于25 ℃恒温摇床以130 r·min−1进行振荡培养,每7 d更换1次新鲜培养基;持续培养21 d后收获毛状根样本,经蒸馏水冲洗后用于后续SdC2'H基因表达量检测与香豆素含量测定。每个处理设3次生物学重复。
1.7 防风毛状根中SdC2'H基因表达水平检测
通过植物RNA提取试剂盒提取各处理组毛状根系总RNA,并选用cDNA合成试剂盒进行cDNA合成,反应体系为防风毛状根RNA 4 μL、Anchored Oligo (dT)18 1 μL、2× TS Reaction Mix 10 μL、TransScript RT/RI Enzyme Mix 1 μL、gDNA Remover 1 μL、RNase-free Water 1 μL,反应条件为42 ℃孵育15 min,85 ℃加热5 s失活TransScript RT/RI与gDNA Remover。以防风EF1-α基因作为内参基因,利用RT-qPCR检测防风毛状根样品中SdC2'H基因的表达水平;以引物S6(表1)对EF1-α进行扩增,采用PCR反应程序6(表2),以引物S7(表1)对SdC2'H进行扩增,采用PCR程序7(表2),反应体系均为基因1.0 μL、上游引物(10 μmol·L−1)1.0 μL、下游引物(10 μmol·L−1)1.0 μL、SYBR Green Master Mix 10.0 μL、ddH2O 7.0 μL;采用2−△△CT法计算SdC2'H基因的相对表达水平[19]。
1.8 防风毛状根中香豆素含量的测定
用蒸馏水将毛状根冲洗干净,并用滤纸吸干水分后置于60 ℃烘箱,干燥后的毛状根用研钵磨成细粉,过0.6 mm孔径筛,称取0.2 g样品,加入6 mL甲醇,于60 ℃超声提取1 h,冷却,滤纸过滤,过0.22 μm滤膜。采用HPLC测定香豆素含量[20]。
2. 结果与分析
2.1 SdC2'H基因克隆与生物信息学分析
如图1所示,PCR扩增产物呈现813 bp的特异性条带,经测序证实其实际长度与预期完全一致,包含完整的813 bp开放阅读框。
BLAST比对结果显示,该序列与Kitagawia praeruptora的C2'H cDNA序列相似性为93.33%,氨基酸序列相似性为94.44%,确证其为防风SdC2'H基因序列,并成功提交至GenBank数据库(登录号:PV169361)。生物信息学分析显示,防风SdC2'H蛋白分子式为C
1386 H2 191N357O401S9,理论相对分子质量为305603330 ,等电点为6.61,不稳定指数为37.50(<40),是一个不稳定蛋白;亲水性为−0.184(<0),为亲水性蛋白。SdC2'H蛋白质的二级结构以α−螺旋和卷曲结构为主,分别占比34.81%和47.41%,另外延伸链占据17.78%。由三级结构模型预测可知,该蛋白主要由α−螺旋和无规则卷曲组成。SdC2'H蛋白位于跨膜区和膜内部的概率很低,主要定位于膜外。信号肽预测值均为0,说明不含典型信号肽序列。保守结构域分析结果进一步显示,防风SdC2'H属于PLN03178超家族,聚类分析结果如图2所示。防风SdC2'H的氨基酸序列与伞形科植物紫花前胡Angelica decursiva和K. praeruptora的序列聚在一起,亲缘关系较近,说明防风SdC2'H和其他伞形科植物C2'H具有相似的功能。2.2 过表达SdC2'H基因防风毛状根的验证
基于图3所示方法构建防风pCA-SdC2'H双元表达载体,经PCR验证(图4)显示,特异性扩增条带长度为813 bp,与SdC2'H基因预期长度一致,测序比对证实其与GenBank注册序列(PV169361)相似性为100%,确证成功构建了防风pCA-SdC2'H双元表达载体。侵染7、30 d后的毛状根样本如图5所示,空白对照(CK)、空载体阴性对照(NC)及过表达SdC2'H(SdC2'H+)3个处理组均长势良好。
图6a为各处理防风毛状根系中rolB基因的PCR验证结果,扩增获得长度为703 bp的条带,经测序比对,与K599发根农杆菌中rolB基因序列完全匹配(相似性100%)。如图6b所示,SdC2'H+组特异性扩增出418 bp条带,经测序比对,与hrHyg基因序列完全匹配(相似性100%),确证SdC2'H基因成功外源整合至毛状根基因组,并排除内源性基因干扰。上述结果证实,本研究成功诱导了过表达SdC2'H基因的防风毛状根。
![图 6 基于rolB (a)和hrHyg (b)扩增的防风毛状根鉴定]() 图 6 基于rolB (a)和hrHyg (b)扩增的防风毛状根鉴定SdC2'H+:过表达SdC2'H,NC:空载体阴性对照,CK:空白对照,M:DNA marker。Figure 6. Identification of Saposhnikovia divaricata hairy roots based on rolB (a) and hyHyg (b) amplificationSdC2'H+: Overexpressing SdC2'H, NC: Negative control containing empty vector, CK: Blank control, M: DNA marker.
图 6 基于rolB (a)和hrHyg (b)扩增的防风毛状根鉴定SdC2'H+:过表达SdC2'H,NC:空载体阴性对照,CK:空白对照,M:DNA marker。Figure 6. Identification of Saposhnikovia divaricata hairy roots based on rolB (a) and hyHyg (b) amplificationSdC2'H+: Overexpressing SdC2'H, NC: Negative control containing empty vector, CK: Blank control, M: DNA marker.2.3 防风毛状根中SdC2'H基因的表达水平
通过RT-qPCR定量检测防风毛状根中SdC2'H基因表达水平,应用GraphPad Prism 9.5软件进行t检验。如图7所示,SdC2'H+处理组基因表达水平显著高于空白对照组(CK) (P<
0.0001 )。![图 7 SdC2'H在不同处理防风毛状根系中的相对表达水平]() 图 7 SdC2'H在不同处理防风毛状根系中的相对表达水平CK:空白对照,NC:空载体阴性对照,SdC2'H+:过表达SdC2'H;****表示在P<0.000 1水平差异显著(t检验)。Figure 7. Relative expression levels of SdC2'H in Saposhnikovia divaricata hairy roots of different treatmentsCK: Blank control, NC: Negative control containing empty vector, SdC2'H+: Overexpressing SdC2'H; **** indicates significant difference at P<0.000 1 level (t test).
图 7 SdC2'H在不同处理防风毛状根系中的相对表达水平CK:空白对照,NC:空载体阴性对照,SdC2'H+:过表达SdC2'H;****表示在P<0.000 1水平差异显著(t检验)。Figure 7. Relative expression levels of SdC2'H in Saposhnikovia divaricata hairy roots of different treatmentsCK: Blank control, NC: Negative control containing empty vector, SdC2'H+: Overexpressing SdC2'H; **** indicates significant difference at P<0.000 1 level (t test).2.4 防风毛状根中香豆素含量
如图8所示,经1/2MS液体培养基培养21 d后,各处理防风毛状根均长势良好。采用HPLC检测各处理组防风毛状根系中香豆素含量(图9),经采用GraphPad Prism 9.5软件进行t检验,SdC2'H+组香豆素含量均显著高于空白对照组(CK) (P<0.001)与空载体阴性对照组(NC) (P<0.01)。
![图 9 不同处理防风毛状根系中的香豆素含量]() 图 9 不同处理防风毛状根系中的香豆素含量CK:空白对照,NC:空载体阴性对照,SdC2'H+:过表达SdC2'H;**和***分别表示在P<0.01和P<0.001水平差异显著(t检验)。Figure 9. Coumarin contents in Saposhnikovia divaricata hairy roots of different treatmentsCK: Blank control, NC: Negative control containing empty vector, SdC2'H+: Overexpressing SdC2'H; ** and *** indicate significant differences at P<0.01 and P<0.001 levels respectively (t test).
图 9 不同处理防风毛状根系中的香豆素含量CK:空白对照,NC:空载体阴性对照,SdC2'H+:过表达SdC2'H;**和***分别表示在P<0.01和P<0.001水平差异显著(t检验)。Figure 9. Coumarin contents in Saposhnikovia divaricata hairy roots of different treatmentsCK: Blank control, NC: Negative control containing empty vector, SdC2'H+: Overexpressing SdC2'H; ** and *** indicate significant differences at P<0.01 and P<0.001 levels respectively (t test).3. 讨论与结论
香豆素作为苯骈−α−吡喃酮类的芳香族天然产物,在药用植物中广泛存在,具有抗肿瘤、抗凝血及抗氧化等重要的药理活性[21]。本研究从防风中成功克隆SdC2'H基因,其开放阅读框为813 bp,编码蛋白含270个氨基酸。SdC2'H蛋白一级结构分析显示其具有亲水性及结构不稳定特征,且缺乏典型信号肽序列。二级结构以α−螺旋和无规则卷曲为主,初步解析了该蛋白的折叠构象特征。由C2'H蛋白构建的系统进化树可见,防风SdC2'H蛋白与伞形科植物紫花前胡亲缘关系最近,推测防风SdC2'H可能与紫花前胡C2'H具有相似功能,为后续解析防风香豆素生物合成的分子机制提供了依据。
近年来,有关功能基因对药用成分生物合成调控的研究日益深入。Hwang等[22]利用根瘤菌注射法,在黄芪茎外植体中诱导过表达AmUGT15基因的毛状根,其黄芪甲苷总量是野生型对照组的4.2倍。侯嘉铭等[23]利用发根农杆菌转化法将CHI基因在甘草毛状根中过表达,其黄酮类有效成分的含量显著增加。本研究在防风中构建过表达载体pCA-SdC2'H,利用发根农杆菌诱导防风子叶外植体,获得过表达SdC2'H基因的防风毛状根系,其SdC2'H基因的表达水平显著高于空白对照,且香豆素含量显著高于空白对照和空载体阴性对照,证实该基因通过增强对对香豆酰辅酶A的催化效率正向调控香豆素合成通路。前人通过系统进化树分析发现,白花前胡PpC2'H与欧防风PsC2'H具有较高的序列相似性[24]。已有研究表明,C2'H及F6'H介导的邻位羟基化反应是香豆素生物合成的关键步骤,其中游离肉桂酸衍生物作为非活性底物参与催化过程[8, 25],例如,拟南芥AtF6'H1和甘薯IbF6'H1对阿魏酰辅酶A表现出严格的底物特异性。本研究中SdC2'H基因对香豆素合成具有正向调控作用,这一结果也与在拟南芥中过表达F6'H1促进东莨菪碱生成的研究结果[26]相似,说明防风中SdC2'H基因和AtF6'H1基因可能具有高度相似的功能。
本研究成功构建了过表达SdC2'H基因的防风毛状根培养体系,明确了SdC2'H基因在香豆素生物合成中的促进作用。今后,将继续以防风毛状根为研究对象,对影响香豆素生物合成的其他关键基因进行研究,进一步解析香豆素生物合成的分子调控机制。
-
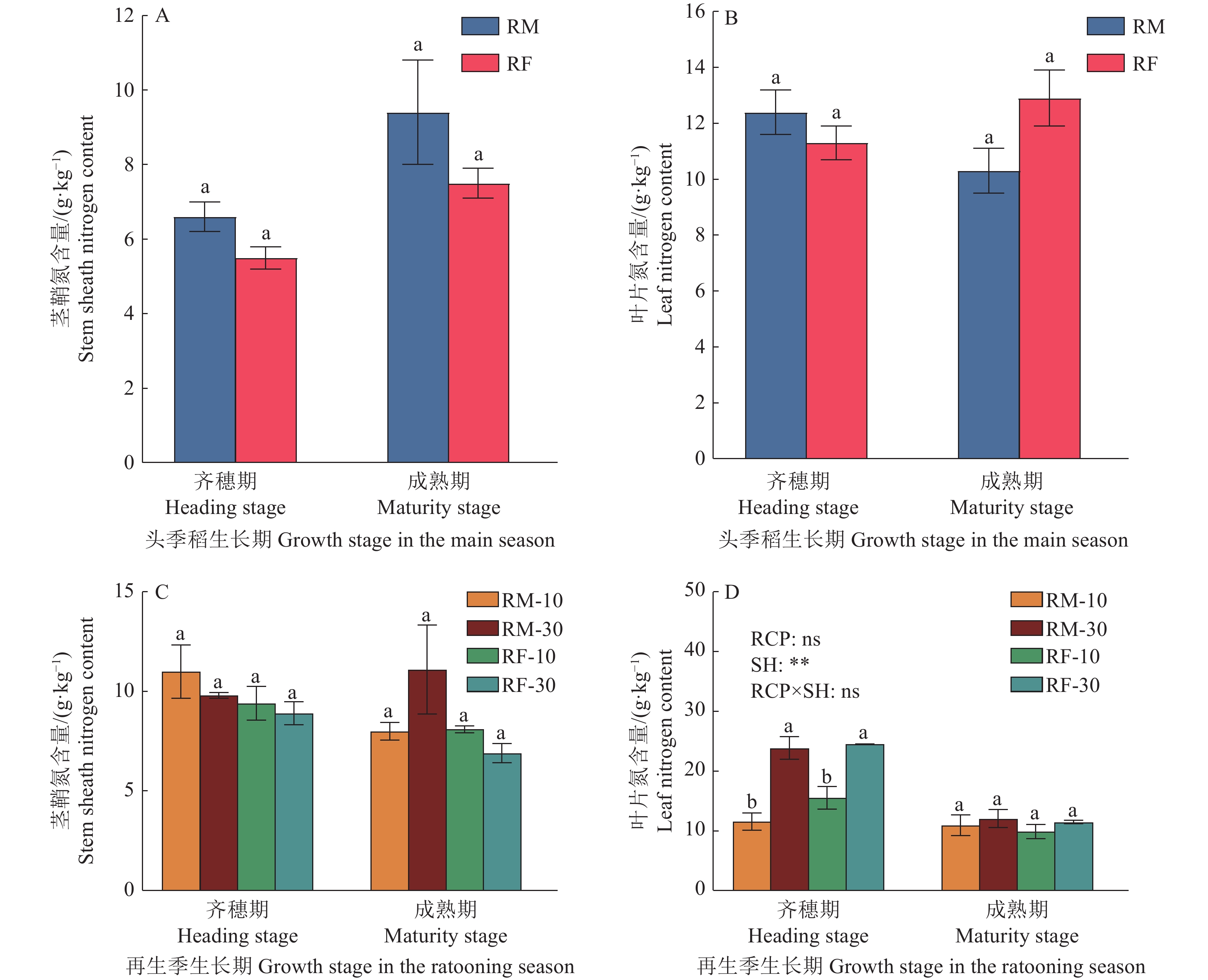
图 1 不同处理下头季和再生季水稻齐穗期及成熟期茎叶的氮含量
A和B为头季,C和D为再生季;RM:水稻单作,RF:稻鱼共作,RCP:稻作模式,SH:留茬高度;图中头季稻茎鞘和叶片氮含量数据为6次重复的平均值±标准误,其余数据为3次重复的平均值±标准误;同一时期柱子上方凡是有一个相同小写字母者,表示差异不显著(P>0.05,LSD法);ns表示不显著(P>0.05),**表示F值达极显著(P<0.01)水平。
Figure 1. Nitrogen contents of rice stem sheath and leaves at heading and maturity stages of different treatments
A and B are in the main season, C and D are in the ratooning season; RM: Rice monoculture, RF: Rice-fish coculture, RCP: Rice cropping pattern, SH: Stubble height; The data in the figure for stem and leaf nitrogen contents of the main season rice are the means ± standard errors of six replicates, and the rest are the means ± standard errors of three replicates; Where there is one same lowercase letter above bars in the same stage, it indicates that the difference is not significant (P>0.05, LSD method); ns indicates no significance(P>0.05), and ** indicates that the F-value reaches highly significant (P<0.01) level.
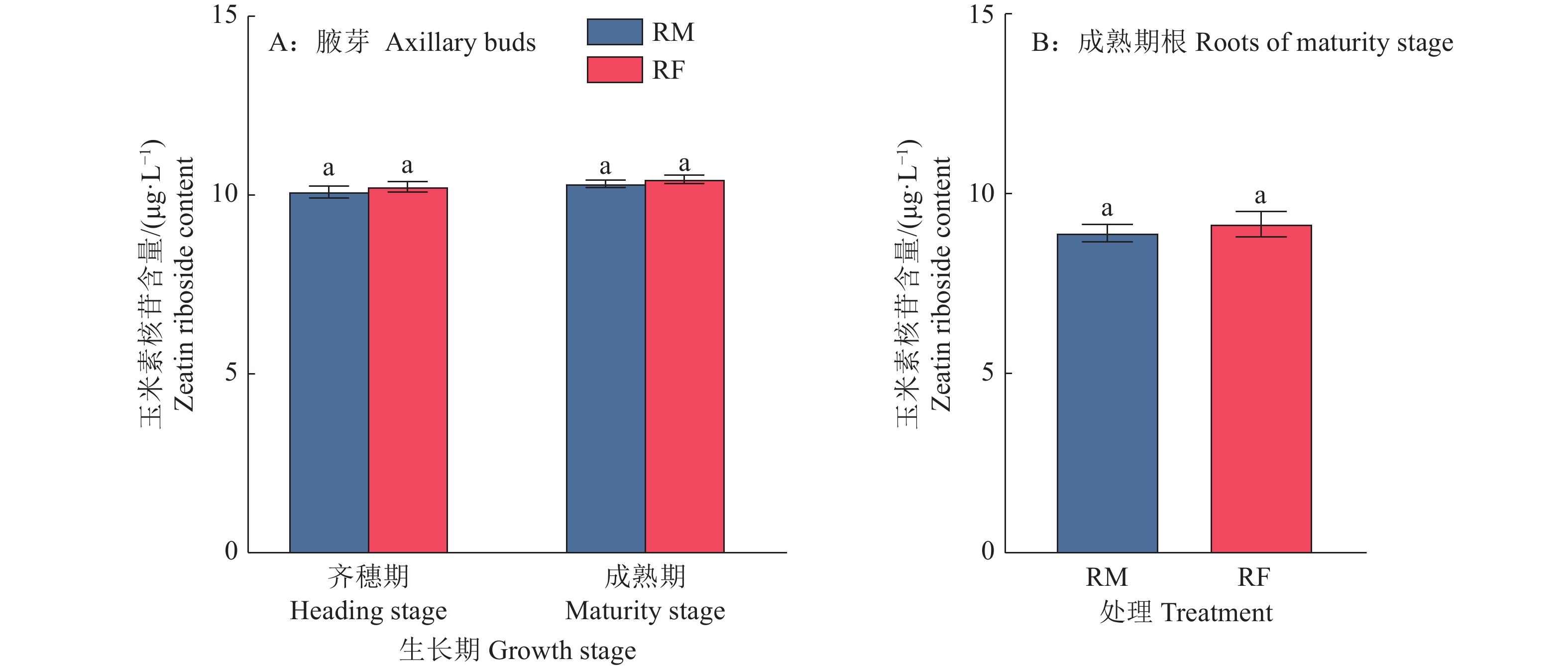
图 2 稻鱼共作对头季稻齐穗期和成熟期水稻腋芽及根部玉米素核苷含量的影响
RM:水稻单作,RF:稻鱼共作;图中数据为6次重复的平均值±标准误;同一时期柱子上方凡是有一个相同小写字母者,表示差异不显著(P>0.05,LSD法)。
Figure 2. Effects of rice-fish coculture on zeatin riboside contents in axillary buds and roots of rice at heading and maturity stages of main season rice
RM: Rice monoculture, RF: Rice-fish coculture; The data in the figure are the means ± standard errors of six replicates; Where there is one same lowercase letter above bars in the same stage, it indicates that the difference is not significant (P>0.05, LSD method).
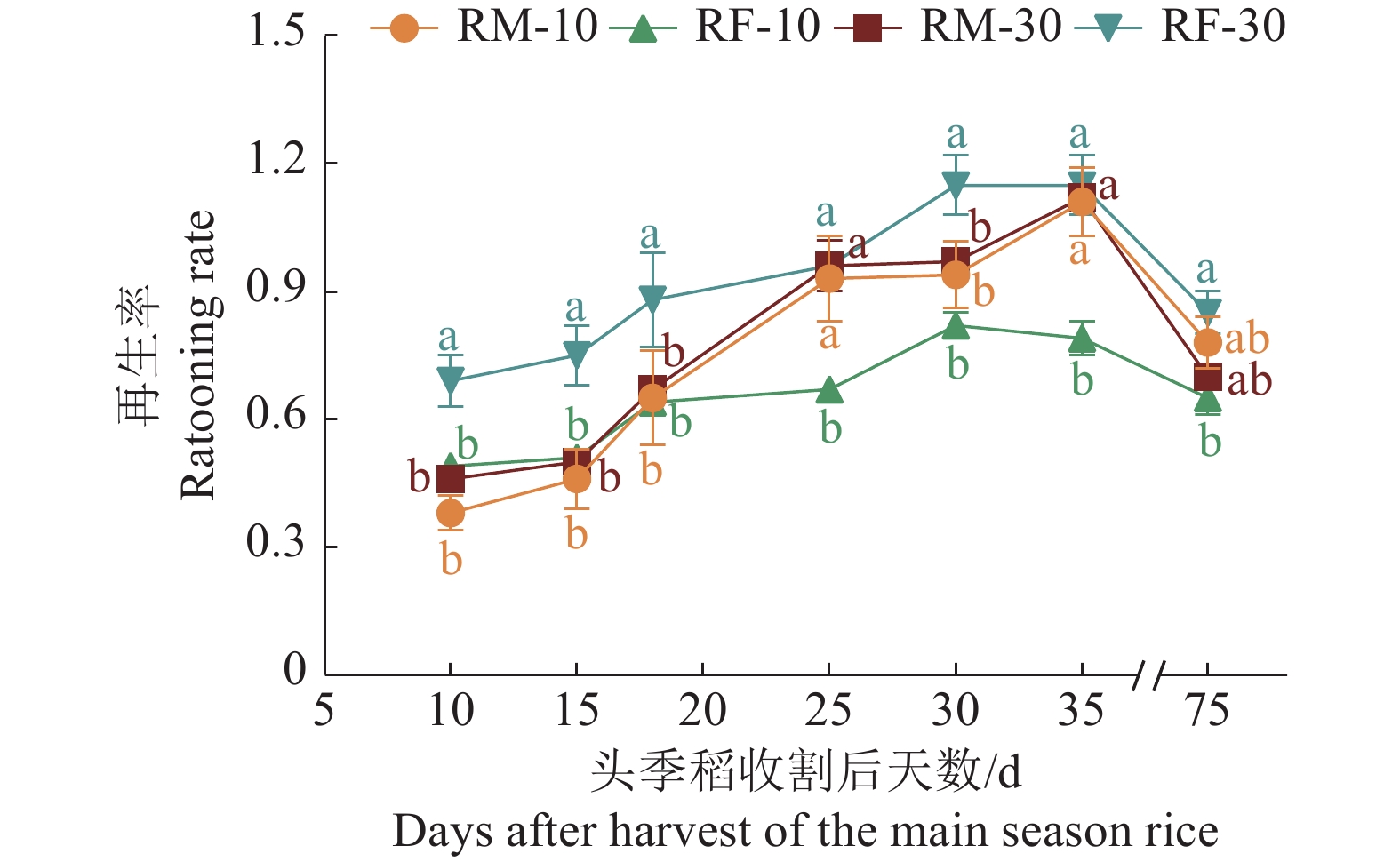
图 3 头季稻收割后再生季水稻茎蘖再生率的动态变化
RM:水稻单作,RF:稻鱼共作;图中第75天的再生率为最终再生率;图中同一时间凡是有一个相同小写字母者,表示差异不显著(P>0.05,LSD法)。
Figure 3. Dynamics of tiller ratooning rate of ratooning season rice after harvest of the main season rice
RM: Rice monoculture, RF: Rice-fish coculture; The ratooning rate at day 75 is the final ratooning rate; Where there is one same lowercase letter at the same time, it indicates that the difference is not significant (P>0.05, LSD method).
表 1 稻鱼共作对头季稻及不同留茬高度的再生季水稻株高(h)的影响1)
Table 1 Effects of rice-fish coculture on plant heights (h) of main season rice and ratooning season rice with different stubble heights
h/cm 稻作模式
Rice cropping
pattern (RCP)留茬高度/cm
Stubble
height (SH)头季 Main season 再生季 Ratooning season 抽穗期
Heading stage成熟期
Maturity stage分蘖期
Tillering stage抽穗期
Heading stage成熟期
Maturity stageRM 10 112.6±1.7a 116.1±1.2a 68.3±1.3b 78.9±2.6a 87.2±2.1a 30 113.1±1.3a 115.9±1.5a 83.6±0.4a 84.8±2.0a 87.8±0.9a RF 10 113.3±0.8a 116.3±1.7a 66.0±2.3b 79.9±0.5a 87.9±1.6a 30 114.9±0.1a 118.5±0.5a 84.7±1.6a 78.6±1.9a 89.9±0.7a 总方差
Total varianceRCP 1.08 1.22 0.16 1.53 0.69 SH 0.80 0.55 133.68** 1.16 0.64 RCP×SH 0.23 0.90 1.42 2.91 0.18 1) RM:水稻单作,RF:稻鱼共作;株高数据为3次重复的平均值±标准误,同列数据后凡是有一个相同小写字母者,表示差异不显著(P>0.05,LSD法);**表示F值达极显著(P<0.01)水平。
1) RM: Rice monoculture, RF: Rice-fish coculture; The data of plant heights are the means ± standard errors of three replicates, and the data in the same column followed by one same lowercase letter indicate that the difference is not significant (P>0.05, LSD method); ** indicates that the F-value reaches highly significant (P<0.01) level.表 2 稻鱼共作对头季稻及不同留茬高度的再生季水稻叶片SPAD值的影响1)
Table 2 Effects of rice-fish coculture on leaf SPAD values of main season rice and ratooning season rice with different stubble heights
稻作模式
Rice cropping
pattern (RCP)留茬高度/cm
Stubble
height (SH)头季 Main season 再生季 Ratooning season 抽穗期
Heading stage成熟期
Maturity stage分蘖期
Tillering stage抽穗期
Heading stage成熟期
Maturity stageRM 10 31.0±0.4a 19.9±1.0a 43.7±0.8a 38.8±0.4c 16.0±0.5b 30 31.6±0.5a 21.1±0.4a 43.3±0.9a 43.9±0.4a 16.5±0.6b RF 10 33.1±0.7a 18.7±1.1a 43.3±0.9a 40.9±0.4b 26.2±1.2a 30 31.6±1.0a 18.3±1.0a 41.9±1.6a 44.0±0.7a 18.9±0.9b 总方差
Total varianceRCP 2.12 6.07* 0.68 4.73 51.35** SH 0.37 0.24 0.68 63.21** 14.87** RCP×SH 1.87 0.97 0.20 4.18 19.54** 1) RM:水稻单作,RF:稻鱼共作;SPAD值数据为3次重复的平均值±标准误,同列数据后凡是有一个相同小写字母者,表示差异不显著(P>0.05,LSD法);*和**分别表示F值达显著(P<0.05)和极显著(P<0.01)水平。
1) RM: Rice monoculture, RF: Rice-fish coculture; The data of SPAD values are the means ± standard errors of three replicates, and the data in the same column followed by one same lowercase letter indicate that the difference is not significant (P>0.05, LSD method); * and ** indicate that the F-values reach significant(P<0.05) and highly significant (P<0.01) levels, respectively.表 3 稻作模式和留茬高度对再生季水稻再生率的影响的方差分析1)
Table 3 Analysis of variance for the effects of rice cropping pattern and stubble height on ratooning rate of ratooning season rice
处理
Treatment头季稻收割后不同时间的再生率
Ratooning rate at different days after harvest of the main season rice10 d 15 d 18 d 25 d 30 d 35 d 75 d 稻作模式(RCP) Rice cropping pattern 20.76** 9.5* 2.56 4.15 0.31 5.47 0.08 留茬高度(SH) Stubble height 14.65** 8.68* 4.33 6.34* 12.71* 8.55* 1.68 RCP×SH 2.40 4.22 3.10 4.15 8.47* 7.94* 9.12* 1) 表格中第75天的再生率为最终再生率;*和**分别表示F值达显著(P <0.05)和极显著(P <0.01)水平。
1) The ratooning rate at day 75 in the table is the final ratooning rate; * and ** indicate that the F-values reach significant (P<0.05) and highly significant (P<0.01) levels, respectively.表 4 稻鱼共作对头季稻及不同留茬高度的再生季水稻产量的影响1)
Table 4 Effects of rice-fish coculture on yield of main season rice and ratooning season rice with different stubble heights
稻作模式
Rice cropping
pattern
(RCP)留茬高度/cm
Stubble
height
(SH)头季 Main season 再生季 Ratooning season 产量/
(kg·hm−2)
Yield有效穗数/
(万穗·hm−2)
Effective spikes穗粒数
Grains number
per spike结实率/%
Seed setting
rate千粒质量/g 1000 -grain
weight产量/
(kg·hm−2)
YieldRM 10 7814.3 a274.3ab 98.4a 28.3b 16.8b 1244.5 ab30 7814.3 a240.6b 58.0c 34.5b 18.2ab 955.5b RF 10 7961.3 a306.5a 75.4b 40.6b 17.8ab 1229.0 ab30 7961.3 a302.0a 53.0c 55.6a 18.9a 1550.0 a总方差
Total varianceRCP 10.326* 8.254* 19.256** 2.602 10.109* SH 1.716 41.574** 7.709* 5.492 0.031 RCP×SH 1.007 3.381 1.337 0.075 11.220* 1) RM:水稻单作,RF:稻鱼共作;表中头季水稻产量数据为6次重复的数据的平均值±标准误,其余数据为3次重复的平均值±标准误;同列数据后凡是有一个相同小写字母者,表示差异不显著(P>0.05,LSD法);*和**分别表示F值达显著(P<0.05)和极显著(P<0.01)水平。
1) RM: Rice monoculture, RF: Rice-fish coculture; The data of main season rice yield are the means ± standard errors of six replicaties, and the rest of the data are the means ± standard errors of three replicates; Data in the same column followed by one same lowercase letter indicates that the difference is not significant (P>0.05, LSD method); * and ** indicate that the F-values reach significant(P<0.05) and highly significant (P<0.01) levels, respectively.表 5 头季稻成熟期腋芽和根部的玉米素核苷含量、头季稻植株氮含量与再生季产量构成因子之间的相关性分析1)
Table 5 Correlation analysis between zeatin riboside contents in axillary buds and roots at maturity stage of main season rice, plant nitrogen content of main season rice, and yield factors of ratooning season rice
指标 Index a b c d e f g h i j a 1.000 b −0.429 1.000 c 0.362 −0.036 1.000 d 0.221 0.621* −0.084 1.000 e −0.207 0.289 −0.208 −0.292 1.000 f 0.394 0.216 −0.104 0.452 0.209 1.000 g −0.077 0.145 −0.141 −0.354 0.028 −0.005 1.000 h −0.369 0.144 −0.092 0.100 −0.010 −0.347 −0.609* 1.000 i 0.351 −0.006 −0.171 0.485 0.191 0.225 −0.690* 0.542 1.000 j 0.497 −0.051 −0.178 0.553 0.416 0.642* −0.177 −0.034 0.697* 1.000 1) a:腋芽玉米素核苷含量,b:根玉米素核苷含量,c:茎鞘氮含量,d:叶片氮含量,e:最终再生率,f:有效穗数,g:穗粒数,h:千粒质量,i:结实率,j:产量;*表示相关性达显著水平(P<0.05,Pearson法)。
1) a: Zeatin riboside content of axillary bud, b: Root zeatin riboside content, c: Stem sheath nitrogen content, d: Leaf nitrogen content, e: Final ratooning rate, f: Effective spikes, g: Grain number per spike, h:1000 -grain weight, i: Seed setting rate, j: Yield; * indicates correlation at significant level(P<0.05, Pearson method). -
[1] CHEN W, XU Z, TANG L. 20 years’ development of super rice in China: The 20th anniversary of the super rice in China[J]. Journal of Integrative Agriculture, 2017, 16(5): 981-983. doi: 10.1016/S2095-3119(16)61612-X
[2] 张强, 张戈丽, 朱道林, 等. 1980—2018年中国水稻生产变化的时空格局[J]. 资源科学, 2022, 44(4): 687-700. [3] 陈风波, 汪峤, 喻雯, 等. 广东省农户水稻生产成本收益及种粮意愿分析[J]. 广东农业科学, 2019, 46(3): 144-153. [4] 李俊杰, 李建平. 水稻生产成本效益国际比较及中国发展前景[J]. 中国稻米, 2021, 27(4): 22-30. [5] 陈欣, 唐建军, 胡亮亮. 生态型种养结合原理与实践[M]. 北京: 中国农业出版社, 2019. [6] CUI J, LIU H, WANG H, et al. Rice-animal co-culture systems benefit global sustainable intensification[J]. Earth’s Future, 2023, 11(2): e2022EF002984. doi: 10.1029/2022EF002984
[7] REN L P, LIU P P, XU F, et al. Rice-fish coculture system enhances paddy soil fertility, bacterial network stability and keystone taxa diversity[J]. Agriculture, Ecosystems & Environment, 2023, 348.
[8] BERG H, LAN T, TAM N T, et al. An ecological economic comparison between integrated rice-fish farming and rice monocultures with low and high dikes in the Mekong Delta, Vietnam[J]. Ambio, 2023, 52(9): 1462-1474. doi: 10.1007/s13280-023-01864-x
[9] YU H, ZHANG X, SHEN W, et al. A meta-analysis of ecological functions and economic benefits of co-culture models in paddy fields[J]. Agriculture, Ecosystems & Environment, 2023, 341: 108195.
[10] WAN N, LI S, LI T, et al. Ecological intensification of rice production through rice-fish co-culture[J]. Journal of Cleaner Production, 2019, 234: 1002-1012.
[11] 全国水产技术推广总站中国水产学会. 中国稻渔综合种养产业发展报告(2024)全文发布[J]. 中国水产, 2024(8): 12-17. [12] 欧茜, 熊瑞, 周文涛, 等. 稻鱼共生养鱼密度对稻田甲烷排放的影响[J]. 农业环境科学学报: 1-12. [13] 徐峰, 刘德普, 彭俊明, 等. 南方双季稻栽植机械化发展的影响因素和关键技术措施[J]. 中国农机化学报, 2023, 44(2): 1-7. [14] 于秀娟, 郝向举, 党子乔, 等. 中国稻渔综合种养产业发展报告(2022)[J]. 中国水产, 2023(1): 39-46. [15] 罗茵. 广东省农业科学院水稻研究所副所长钟旭华 广东应加快发展稻渔综合种养[J]. 海洋与渔业, 2019(8): 27-28. [16] 朱永川, 熊洪, 徐富贤, 等. 再生稻栽培技术的研究进展[J]. 中国农学通报, 2013, 29(36): 1-8. [17] PENG S, ZHENG C, YU X. Progress and challenges of rice ratooning technology in China[J]. Crop and Environment, 2023, 2(1): 5-11. doi: 10.1016/j.crope.2023.02.005
[18] 彭少兵. 对转型时期水稻生产的战略思考[J]. 中国科学: 生命科学, 2014, 44(8): 845-850. [19] 林文雄, 翁佩莹, 林文芳, 等. 中国机收再生稻研究现状与展望[J]. 应用生态学报, 2024, 35(3): 827-836. [20] 黄新杰, 屠乃美, 李艳芳, 等. 杂交稻不同节位再生稻的产量形成及其与头季稻的关系[J]. 湖南农业大学学报(自然科学版), 2012, 38(5): 470-475. [21] 黄振标, 胡香玉, 钟旭华, 等. 粤北地区不同留桩高度下适宜再生稻品种筛选及产量构成分析[J]. 广东农业科学, 2023, 50(12): 160-171. [22] 李阳, 杨晓龙, 汪本福, 等. 头季留茬高度对水稻再生季产量和稻米品质的影响[J]. 作物杂志, 2021(6): 164-170. [23] 余贵龙, 刘祥臣, 丰大清, 等. 不同留茬高度对豫南再生稻生育期及产量的影响[J]. 中国稻米, 2018, 24(5): 112-115. [24] YANG D, PENG S, ZHENG C, et al. Effects of nitrogen fertilization for bud initiation and tiller growth on yield and quality of rice ratoon crop in central China[J]. Field Crops Research, 2021, 272: 108286.
[25] CHEN Y, ZHENG H, WANG W, et al. Early harvesting and increasing stubble-cutting height enhance ratoon rice yield[J]. Experimental Agriculture, 2023, 59: e20. doi: 10.1017/S0014479723000157
[26] 邓穗生, 洪彩香. 靛酚蓝比色法测定植物全氮含量方法的改进[J]. 热带农业科学, 2013, 33(4): 5-7. [27] BOLLMARK M, KUBÁT B, ELIASSON L. Variation in endogenous cytokinin content during adventitious root formation in pea cuttings[J]. Journal of Plant Physiology, 1988, 132(3): 262-265. doi: 10.1016/S0176-1617(88)80102-0
[28] 李亚贞, 郑伟, 肖小军, 等. 赣中北红壤稻田三熟制下机收留桩高度对再生稻产量的影响研究[J]. 杂交水稻, 2021, 36(1): 87-92. [29] 唐浩, 陈立云, 杨益善, 等. 水稻的再生率及其与产量性状的关系[J]. 杂交水稻, 2003(3): 58-61. [30] ZHANG Q, LIU X, YU G, et al. Reasonable nitrogen regime in the main crop increased grain yields in both main and ratoon rice[J]. 2022, 12(4): 527.
[31] YANG D, PENG S, ZHENG C, et al. Stubble height affects the grain yield of ratoon rice under rainfed conditions[J]. Agricultural Water Management, 2022, 272: 107815. doi: 10.1016/j.agwat.2022.107815
[32] CHEN H, YAO F, YANG Y, et al. Progress and challenges of rice ratooning technology in Fujian Province, China[J]. Crop and Environment, 2023, 2(3): 121-125. doi: 10.1016/j.crope.2023.05.001
[33] 隆斌庆, 陈灿, 黄璜, 等. “稻+鱼+再生稻”模式对稻田土壤氮、磷、钾养分含量的影响[J]. 作物研究, 2019, 33(5): 408-414. [34] 刘杨, 王强盛, 丁艳锋, 等. 氮素和6-BA对水稻分蘖芽发育的影响及其生理机制[J]. 作物学报, 2009, 35(10): 1893-1899. [35] 杨建昌, 彭少兵, 顾世梁, 等. 水稻结实期籽粒和根系中玉米素与玉米素核苷含量的变化及其与籽粒充实的关系[J]. 作物学报, 2001, 27(1): 35-42. [36] 廖健程, 胡德勇, 裴毅, 等. 控制灌溉条件下增氧对超级稻根系生长及水分利用效率的影响[J]. 排灌机械工程学报, 2018, 36(9): 920-924. [37] 秦华东, 江立庚, 肖巧珍, 等. 水分管理对免耕抛秧水稻根系生长及产量的影响[J]. 中国水稻科学, 2013, 27(2): 209-212. [38] 徐国伟, 陆大克, 刘聪杰, 等. 干湿交替灌溉和施氮量对水稻内源激素及氮素利用的影响[J]. 农业工程学报, 2018, 34(7): 137-146. [39] 万定海. 不同母体营养条件下低节位再生稻生长和产量特性研究[D]. 长沙: 湖南农业大学, 2012. [40] HARRELL D L, BOND J A, BLANCHE S. Evaluation of main-crop stubble height on ratoon rice growth and development[J]. Field Crops Research, 2009, 114(3): 396-403.
[41] 易镇邪, 周文新, 屠乃美. 留桩高度对再生稻源库性状与物质运转的影响[J]. 中国水稻科学, 2009, 23(5): 509-516. doi: 10.3969/j.issn.1001-7216.2009.05.10 [42] 谢磊, 许晖, 曹纯海, 等. 江汉平原再生稻机械化生产的产量构成因素分析和品种适应性研究[J]. 湖北农业科学, 2016, 55(10): 2462-2465. [43] 胡润, 朱勤, 张玲霞, 等. 留茬高度对早籼类型再生稻生育期及产量的影响[J]. 安徽农学通报, 2019, 25(13): 51-52. [44] 刘爱中, 邹冬生, 屠乃美, 等. 留桩高度对再生稻生长发育及产量的影响[J]. 安徽农业科学, 2007, 35(17): 5120-5121. [45] 易镇邪, 屠乃美, 陈平平. 留桩高度对再生稻根系的影响[J]. 杂交水稻, 2005, 20(1): 59-62. [46] 郭海松, 罗衡, 李丰, 等. 不同水稻栽培密度下青田稻−鱼共生系统的土壤肥力[J]. 水产学报, 2020, 44(5): 805-815. [47] 吴敏芳, 张剑, 胡亮亮, 等. 稻鱼系统中再生稻生产关键技术[J]. 中国稻米, 2016, 22(6): 80-82. [48] 张桂莲, 屠乃美, 袁菊红, 等. 播种期对再生稻腋芽萌发和产量的影响[J]. 湖南农业大学学报(自然科学版), 2005, 32(3): 229-232. [49] 夏桂龙, 欧阳建平, 柳开楼, 等. 促芽肥用量和留茬方式对赣东北地区再生稻产量和再生能力的影响[J]. 中国稻米, 2016, 22(2): 27-30. [50] SAOWAKOON S, SAOWAKOON K, JUTAGATE A, et al. Growth and feeding behavior of fishes in organic rice-fish systems with various species combinations[J]. Aquaculture Reports, 2021, 20: 100663. doi: 10.1016/j.aqrep.2021.100663
[51] CAO QUOC N, VROMANT N, TRAN THANH B, et al. Investigation of the predation potential of different fish species on brown planthopper (Nilaparvata lugens (Stål)) in experimental rice-fish aquariums and tanks[J]. Crop Protection, 2012, 38: 95-102. doi: 10.1016/j.cropro.2012.03.003
[52] WANG Q, LI M, ZHANG J, et al. Suitable stocking density of fish in paddy field contributes positively to 2-acetyl-1-pyrroline synthesis in grain and improves rice quality[J]. Journal of the Science of Food and Agriculture, 2023, 103(10): 5126-5137.



 下载:
下载: