Effects of titanium dioxide spraying agents on photosynthesis and chlorophyll fluorescence parameters of upper tobacco leaves
-
摘要:目的
探讨二氧化钛喷施剂对烤烟上部烟叶光合作用及叶绿素荧光参数的影响,为提高上部烟叶的可用性提供参考。
方法以溶胶–凝胶法特制的二氧化钛为材料,研究了不同浓度和配方的喷施剂对成熟期上部烟叶光合色素含量、光合生理指标及叶绿素荧光参数的影响。
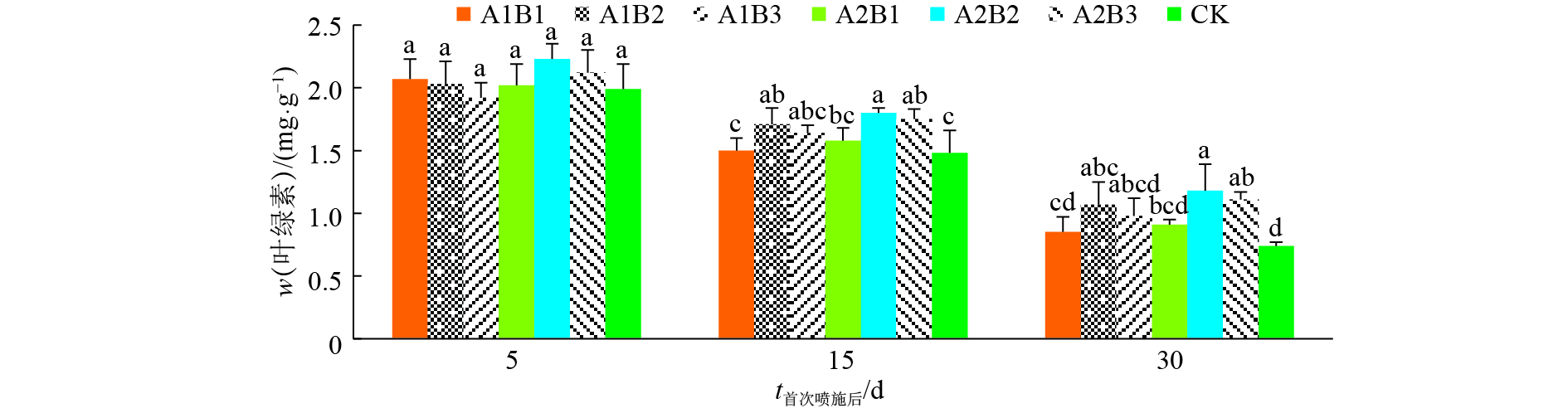
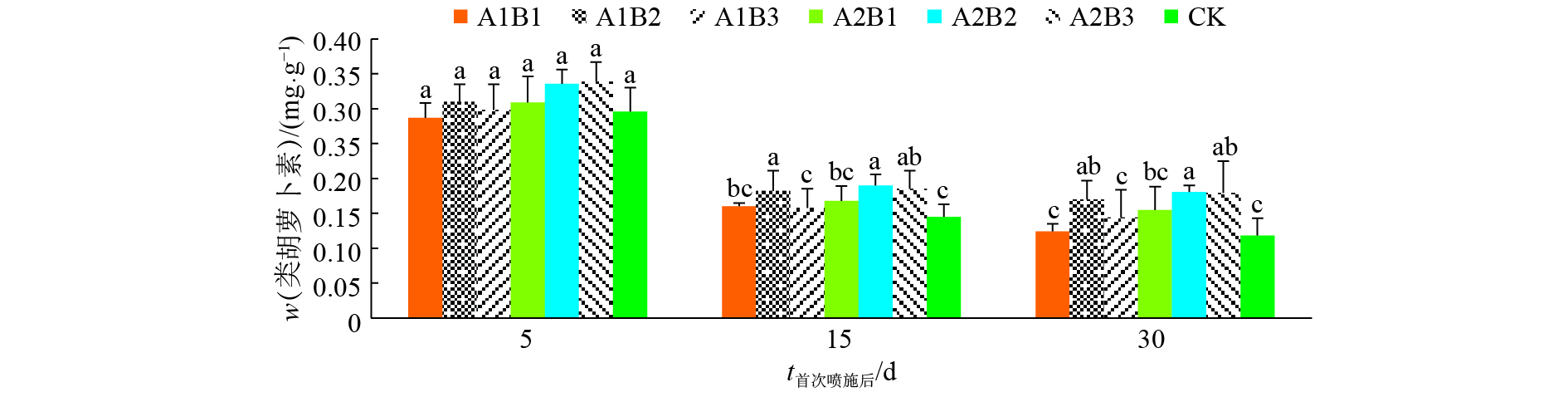
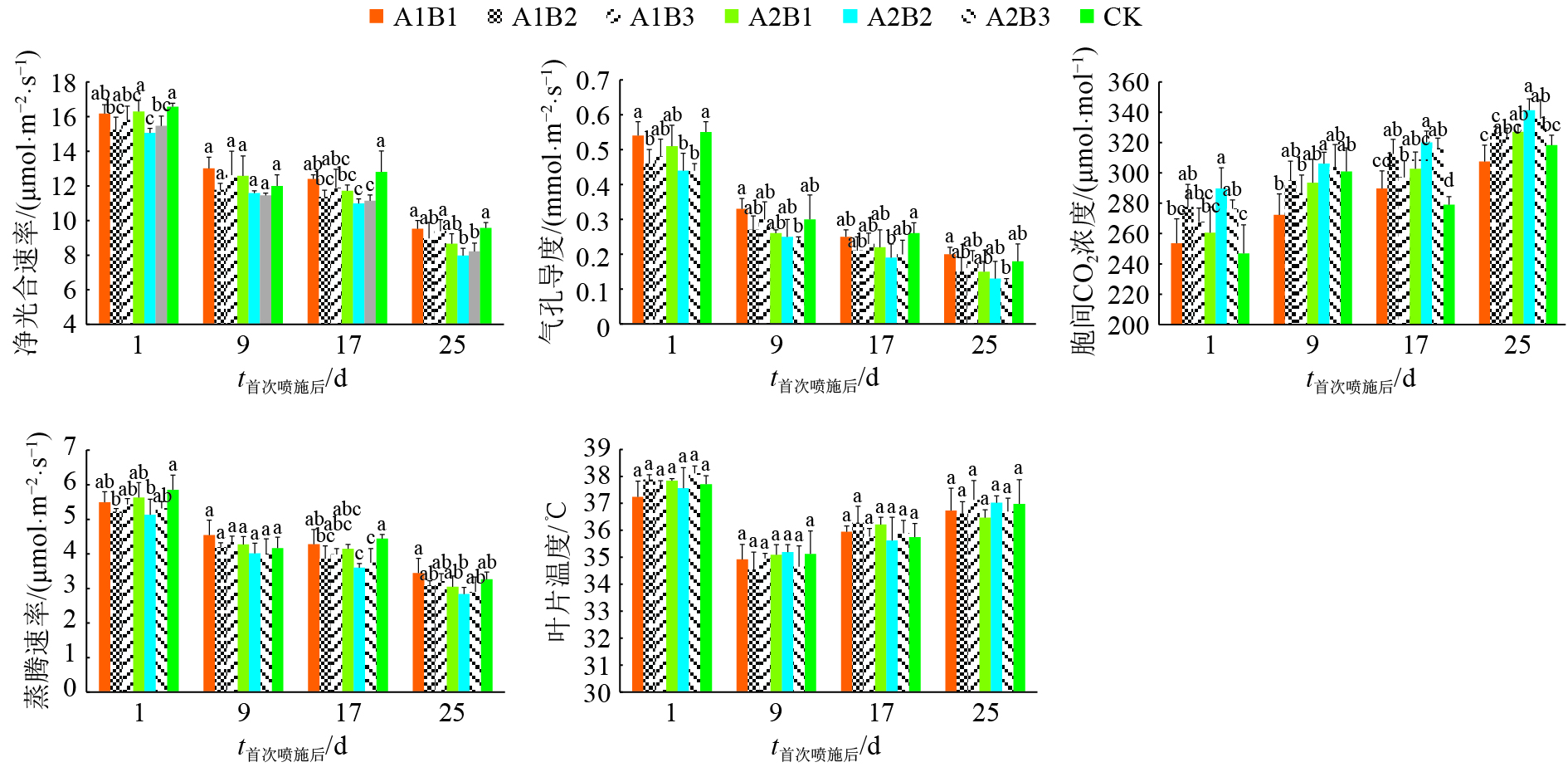
结果二氧化钛喷施剂延缓了上部烟叶中叶绿素和类胡萝卜素的降解速度。二氧化钛喷施剂对上部烟叶的光合作用和叶绿素荧光参数影响显著,喷施剂降低了上部烟叶的净光合速率、气孔导度、蒸腾速率,提高了胞间二氧化碳浓度,对叶温的影响不明显;喷施剂处理的PSⅡ最大光化学效率(Fv/Fm)、PSⅡ潜在活力(Fv/Fo)、光化学淬灭系数(qP)均高于清水对照处理,初始荧光(Fo)、非光化学淬灭系数(NPQ)低于清水对照处理。二氧化钛和二氧化钛复合氧化石墨烯2种喷施剂对光强的吸收效能均以质量浓度为0.45 g·L–1的喷施处理表现最好。
结论喷施二氧化钛的烤烟上部烟叶在一定程度上能够吸收紫外线,其中,二氧化钛复合氧化石墨烯喷施剂对光强的吸收效果较好;喷施剂作用于烟叶的光能吸收效果有一定浓度阈值。
-
关键词:
- 二氧化钛 (TiO2) /
- 烤烟 /
- 上部烟叶 /
- 光合作用 /
- 叶绿素荧光参数
Abstract:ObjectiveTo explore the effect of TiO2 spraying agent on photosynthesis and chlorophyll fluorescence parameters of upper tobacco leaves, and provide a reference for improving the availability of upper tobacco leaves.
MethodTiO2 spraying agent was preparated by means of sol-gel method. The effects of different concentrations and formulas of TiO2 spraying agent on photosynthetic pigment content, photosynthetic physiological indexes and chlorophyll fluorescence parameters of upper tobacco leaves at maturity were studied.
ResultTiO2 spraying agents retarded the degradation rates of chlorophyll and carotenoid of upper tobacco leaves. The spraying agents reduced photosynthetic rate, stomatal conductance and transpiration rate of upper tobacco leaves, increased the intercellular CO2 concentration in upper tobacco leaves, but leaf temperature was unaffected. Photosynthesis and chlorophyll fluorescence parameters of upper tobacco leaves were significantly affected by TiO2 spraying agents. Compared with the spraying water control, the spraying agents increased Fv/Fm, Fv/Fo and qP , and decreased Fo and NPQ. The absorption efficiency of light intensity of tobacco leaves sprayed titanium dioxide or titanium dioxide composite graphene was the best at the concentration of 0.45 g·L–1.
ConclusionTobacco leaves can absorb ultraviolet (UV) to a certain extent, and the efficiency of spraying titanium dioxide composite graphene was better. There was a threshold of spraying agent concentration for light absorption efficiency.
-
苦楝Melia azedarach又名翠树、楝树、紫花树、森树等,为楝科楝属落叶乔木,分布于中国、韩国、日本、印度、斯里兰卡、印度尼西亚和澳大利亚等地,欧洲、美洲也有栽培[1]。苦楝生长速度快、木材材质优良、纹理美丽,易加工,可用于家具、建筑、农具、船舶、乐器等方面,木材抗白蚁、抗虫蛀、耐腐。苦楝耐烟尘、能大量吸收有毒有害气体,是优良的城市及工矿区绿化树种,也是我国南方四旁绿化常用树种[2-3]。苦楝的根、皮、花、果均可入药,也可作为植物源农药[4]。分子标记是继形态学标记、细胞学标记、生化标记之后最为可靠的遗传标记技术[5~6]。目前已有少量文献对部分苦楝种源的遗传多样性进行分析,程诗明[7]采用7对AFLP引物对分层随机抽样的8个群体240个个体基因组进行研究分析,共扩增得到658条清晰谱带,其中650条为多态性谱带,各群体多态位点百分率为51.4%~76.29%;陈羡德[8]利用筛选出的20个RAPD引物对15个不同来源的苦楝进行分析,20个随机引物共扩增出193条重复性好、清晰的谱带,其中多态性谱带共计189条,占97.9%。夏海涛[9]采用筛选出的24个简单重复序列间多态性(Inter-simple sequence repeat,ISSR)引物对13个种源苦楝优树DNA进行分析,共扩增出382个位点,多态位点百分率为98.43%,其中南宁和仓山种源的多态位点百分率最高,为54.97%,延平的多态位点百分率最低,为43.98%,说明13个种源苦楝的遗传多样性丰富。但是,苦楝分布广泛,以前的研究采样点偏少,不足以准确地反映全分布区苦楝的遗传多样性。本项研究从国内18个省(区、市)37个县(市)采集苦楝种子,并收集肯尼亚内罗毕苦楝种子,采取相关序列扩增多态性(Sequence-related amplified polymorphism, SRAP)分子标记方法进行遗传多样性分析。此外,SRAP分子标记结合了扩增片段长度多态性(Amplified fragment length polymorphism, AFLP)及随机扩增的多态性DNA(Random amplified polymorphic DNA, RAPD)各自的优点,方便快速,只需要极少量DNA材料,且不需要预先知道DNA序列信息,即可快速获得大量的信息,试验结果稳定可靠,且再现性较高,重复性较好[10~11]。
1. 材料与方法
1.1 试验材料
以国内全分布区的37个种源和肯尼亚内罗毕1个种源为对象进行苦楝SRAP遗传多样性分析,采种点地理位置及编号见表 1。试验材料采于广州市华南农业大学苗圃1年生苦楝,采集幼嫩枝条上嫩叶6~8片,低温保存用于提取DNA。
表 1 苦楝材料及来源Table 1. Materials and sources of Melia azedarach
1.2 试验仪器与设备
试验仪器主要有超微量紫外分光光度计(Thermo nanodrop 2000),PCR扩增仪(PTC-200),DYY-Ⅲ型恒压恒流电泳仪(北京六一仪器公司),凝胶成像系统(Bio-rad),高速离心机(Eppendorf)等。试验用TaqDNA聚合酶、dNTPs、Mg2+及100 bp DNA ladder等购自TaKaRa公司,琼脂糖和Gold View核酸染料购自广州鼎国生物科技有限公司,酚、三氯甲烷、乙醇、异丙醇、硫代硫酸钠、硼酸、甲醛、冰醋酸、硝酸银等其他试剂为国产分析纯。SRAP引物由上海生工生物工程有限公司合成,本研究所用引物序列见表 2。
表 2 用于苦楝SRAP分析的引物序列Table 2. Primer sequences used for SRAP analysis of Melia azedarach
1.3 苦楝DNA提取和SRAP-PCR扩增
苦楝基因组DNA提取参照上海生工生物工程有限公司柱式基因组DNA提取试剂盒说明书。所提取的基因组DNA用8 g·L-1琼脂糖凝胶电泳检测质量,超微量紫外分光光度计检测浓度后稀释至50 ng·μL-1,置于-20 ℃条件下保存备用。通过单因子及正交试验建立并优化苦楝SRAP-PCR最佳反应体系为模板DNA 30 ng、dNTPs浓度0.125 mmol·L-1、Mg2+浓度2.25 mmol·L-1、引物浓度0.48 μmol·L-1、Taq DNA聚合酶0.75 U(25 μL)。SRAP-PCR反应程序为: 94 ℃预变性5 min;94 ℃变性1 min,35 ℃复性1 min,72 ℃延伸1 min,5个循环;94 ℃变性1 min,50 ℃复性1 min,72 ℃延伸1 min,30个循环;72 ℃延伸10 min。
1.4 数据统计与分析方法
电泳结果统计时将具有相同迁移率的扩增片段,按0/1系统纪录,有带记为1,无带记为0,并参照标准Marker带估计扩增片段的大小,形成0/1矩阵。将图形资料转换成数据资料,并输入Excel 2007中建立0/1数据矩阵,使用NTSYS-pc2.10e软件计算遗传距离和相似系数,使用非加权平均法(UPGMA)进行聚类分析。
2. 结果与分析
2.1 SRAP扩增多态性条带统计
本研究采用20对SRAP引物对苦楝38个不同种源进行扩增,分析结果见表 3。由表 3可知,引物扩增条带多数集中在100~1 500 bp之间,20对引物组合对全部样品进行分析,共扩增出247条带,其中多态性条带101条,平均多态性百分率为40.89%。20对引物扩增的条带数从5条(Me11/Em29)到17条(Me20/Em7)不等,平均为12.1条。多态性条带的数量从1条(Me11/Em29、Me6/Em29)到12条(Me20/Em7)不等,多态性比率最高的引物组合为Me24/Em14(88.89%),其次为Me20/Em7(70.59%)、Me1/Em9(60.00%);多态性比率最低的引物组合为Me6/Em29(12.50%),总体而言,引物多态性比率较高。
表 3 SRAP引物组合扩增信息分析Table 3. Analysis of amplification with SRAP primer combination
多态性信息量(Polymorphism information content,PIC)是用来衡量不同引物对反应多态性高低的程度,20对引物组合的PIC为0.188~0.488,其中Me1/Em9扩增引物总条带数(15条)、多态性条带数(9条)以及PIC(0.387)均较高,该引物组合可以成为苦楝SRAP分子标记的骨干引物[12],20对引物的平均PIC为0.299,介于0.25~0.50之间,说明所选的SRAP引物可以很好地反映苦楝的遗传多样性[13]。引物Me1/Em9的扩增图谱见图 1。
![]() 图 1 Me1/Em9引物对苦楝群体材料的扩增聚丙烯电泳图M:100 bp DNA ladder;1~38分别为种源编号A04、A09、B01、B03、B04、B06、C02、C03、C04、C10、D01、D05、E01、E02、E03、F01、F04、G01、G03、H03、H06、I01、I02、J01、J02、J03、K01、K02、L01、M01、M02、O01、P03、P04、Q01、Q02、U01、Z01的DNA。Figure 1. Amplified products of samples from different provenances of Melia azedarach on polyacrylamide gels with the primer combination of Me1/Em9
图 1 Me1/Em9引物对苦楝群体材料的扩增聚丙烯电泳图M:100 bp DNA ladder;1~38分别为种源编号A04、A09、B01、B03、B04、B06、C02、C03、C04、C10、D01、D05、E01、E02、E03、F01、F04、G01、G03、H03、H06、I01、I02、J01、J02、J03、K01、K02、L01、M01、M02、O01、P03、P04、Q01、Q02、U01、Z01的DNA。Figure 1. Amplified products of samples from different provenances of Melia azedarach on polyacrylamide gels with the primer combination of Me1/Em92.2 38个不同苦楝种源的聚类分析
根据SRAP标记分析结果,对苦楝38个种源间基于Nei’s的遗传距离进行UPGMA聚类分析,从聚类分析结果(图 2)可知,以0.350为阈值,38个种源可以分为7类,A04、A09、B01、B04、B06、C02、C03、C10、H03、H06、Z01为第1类,这一类主要分布在海南、广东、广西等地理位置偏南的地区,其中肯尼亚内罗毕的种源Z01也在这一类;B03、E02、E03、F01、F04、I01、J01、J02、K02为第2类,这一类主要分布在广东、福建、浙江、江苏东部沿海省份;E01、G01、G03、I02、J03、K01、L01、M02、P03、P04、U01为第3类,主要分布在湖南、湖北、陕西、河北等地;D01、D05、M01为第4类,主要为云南种源;Q01、Q02为第5类,来自甘肃。O01和C04各为一类,分别来自河南内乡和广西永福。
3. 讨论
本试验从783对引物组合中筛选获得多态性较好的引物组合20对,这些引物组合多态性百分率平均为40.89%,PIC平均为0.299,说明SRAP分子标记可以较好地应用于苦楝的遗传多样性分析[13],并为充分开发、利用苦楝资源及完善苦楝遗传背景分析奠定基础。通过本试验开发出了多态性比率和PIC均较高的可用于苦楝SRAP分析的骨干引物(Me4/Em5、Me1/Em9),可将大部分种源划分为准确的类型,为快速分析苦楝不同种源提供了方法。
根据SRAP标记分析结果,以0.350为阈值,可将38个苦楝种源划分为7类。其中,O01和C04各为一类,分别来自河南内乡和广西永福。由于这2类仅各含1个种源,代表性不强,为稳妥起见,河南内乡和广西永福暂不独立成类,将其余的36个种源,划分5个类群。苦楝种源类群划分有明显的地理趋势和气候生态特征。例如第1类群的种源来自海南、广东、广西等偏南省份,属于纬度较低,沿海地区的苦楝,这些地方水热条件充足。肯尼亚内罗毕种源聚在此类,这可能因为当地气候条件与我国两广、海南岛的气候更相似;第2类群种源主要分布在广东、福建、浙江、江苏东部沿海省份,其气温和降水量普遍低于第1类种源地;第3类群种源主要分布在湖南、湖北、陕西、河北等地,其气温和降水量低于第2类种源地;第4、5类群分别为云南、甘肃种源,两地区的气候差异很大,与前3类也有较大差异。
将该聚类结果与苦楝果核及种子性状做比对[14],果实主要表型特征为第1类的果实种子形态较小且质量较轻、棱粒较小;第2类的果实果核棱纹明显、果核单果棱数及粒数较少;第3类的果实种子较宽,果核形态近球形且棱纹不明显;第4类的果实种子形状较大且质量较重,果核皮较厚,果核单果棱数较多,但种粒数较少;第5类的果实果核和种子的质量及形态较大,核果皮较厚且棱纹较明显,果核单果棱数及粒数较多。
-
表 1 不同处理对上部烟叶叶绿素荧光参数的影响1)
Table 1 The effects of different treatments on chlorophyll fluorescence parameters of upper tobacco leaves
处理 初始荧光
(Fo)PSⅡ最大光化学效率
(Fv/Fm)PSⅡ潜在活力
(Fv/Fo)PSⅡ量子效率
(ФPSⅡ)光化学淬灭系数
(qP)非光化学淬灭系数
(NPQ)A1B1 140.94±6.20ab 0.75±0.03bcAB 3.06±0.48bcAB 0.537±0.014b 0.622±0.092ab 0.166±0.011abAB A1B2 132.86±8.06ab 0.78±0.02abAB 3.56±0.45abAB 0.578±0.048ab 0.669±0.038ab 0.123±0.017bcBC A1B3 136.80±4.79ab 0.76±0.02abcAB 3.33±0.33abcAB 0.548±0.041b 0.634±0.042ab 0.159±0.013abAB A2B1 135.30±5.94ab 0.77±0.01abAB 3.42±0.10abcAB 0.561±0.045ab 0.659±0.027ab 0.131±0.043bcABC A2B2 126.65±6.40b 0.80±0.02aA 3.95±0.44aA 0.598±0.058ab 0.710±0.080a 0.093±0.023cC A2B3 129.54±12.91b 0.79±0.02aA 3.77±0.39aAB 0.624±0.028a 0.719±0.041a 0.111±0.009cBC CK 145.68±5.73a 0.74±0.01cB 2.83±0.08cB 0.543±0.021b 0.572±0.030b 0.186±0.028aA 1) 同列数据后凡是有一个相同大、小写字母者,分别表示不同喷施处理在0.01、0.05水平差异不显著(单因素方差分析) 表 2 光合色素含量与叶绿素荧光参数的相关性分析1)
Table 2 Correlation analysis between photosynthetic pigment content and chlorophyll fluorescence parameter
光合色素
含量初始荧光(Fo) PSⅡ最大光化学效率(Fv/Fm) PSⅡ潜在活力(Fv/Fo) PSⅡ量子效率(ФPSⅡ) 光化学淬灭
系数(qP)非光化学淬灭
系数(NPQ)叶绿素总量 –0.454* 0.479* 0.452* 0.378 0.590** –0.550** 类胡萝卜素 –0.152 0.399 0.355 0.544* 0.632** –0.526* 1) “*”、“**”分别表示达到0.05、0.01水平的显著相关 -
[1] 周冀衡, 朱小平, 王彦亭, 等. 烟草生理与生物化学[M]. 合肥: 中国科学技术大学出版社, 1996. [2] SHI L, LI C, CHEN A, et al. Morphological structure of nanometer TiO2-Al2O3 composite powders synthesized in high temperature gas mediumsreactor[J]. Chem Eng J, 2001, 84(3): 405-411.
[3] 丛野, 秦云, 李轩科, 等. 二氧化钛涂覆多壁碳纳米管的制备及可见光催化活性[J]. 物理化学学报, 2011, 27(6): 1509-1515. [4] 唐玉朝, 李薇, 胡春, 等. TiO2形态结构与光催化活性关系的研究[J]. 化学进展, 2003(5): 379-384. [5] MANCINI M, KUBIAK P, GESERICK J, et al. Mesoporous anatase TiO2 composite electrodes: Electrochemical characterization and high rate performances[J]. J Power Sources, 2009, 189(1): 585-589.
[6] TARANKAR P, QIAO Q, JIANG H, et al. Hyperbranched conjugated polylectrolyte bilayers for solar cell applications[J]. J Am Chem Soc, 2007, 129(29): 8958-8959.
[7] BROWN P, KARNAT P V. Quantum dot solar cells: Electrophoretic deposition of CdSe-C60 composite films and capture of photogenerated electrons with nC60 cluster shell[J]. J Am Chem Soc, 2008, 130(28): 8890-8891.
[8] 萧浪涛, 王三根. 植物生理学实验技术[M]. 北京: 中国农业出版社, 2005. [9] GENTY B, BRIANTAIS J M, BAKER N R. The relationship between the quantum yield of photosynthetic electron transport and photochemical quenching of chlorophyll fluorescence[J]. Biochimica et Biophysica Acta, 1989, 990(1): 87-92.
[10] 岳红宾. 不同氮素水平对烟草碳氮代谢关键酶活性的影响[J]. 中国烟草科学, 2007, 28(1): 18-20. [11] 李合生. 现代植物生理学[M]. 北京: 高等教育出版社, 2006. [12] 闫萌萌, 王铭伦, 王洪波. 光质对花生幼苗叶片光合色素含量及光合特性的影响[J]. 应用生态学报, 2014, 25(2): 483-487. [13] FARQUHAR G D, SHARKEY T D. Stomatal conductance and photosynthesis[J]. Annu Rev Plant Phys, 1982, 33: 317-345.
[14] 战吉宬, 黄卫东, 王利军. 植物弱光逆境生理研究综述[J]. 植物学通报, 2003, 20(1): 43-50. [15] 杨建昌, 朱庆森, 王志琴. 亚种间杂交稻光合特性及物质积累与运转的研究[J]. 作物学报, 1997, 23(1): 82-88. [16] PARIDA A K, DAS A B. Salt tolerance and salinity effects on plants: A review[J]. Ecotox Environ Safe, 2004, 60(3): 324.
[17] 周琪, 钟永辉, 陈星, 等. 石墨烯/纳米TiO2复合材料制备及其光催化性能[J]. 复合材料学报, 2014, 31(2): 255-262. [18] ZHAO D, WANG X. Enhanced photocatalytic degradation of methylene blue under visible irradiation on grapheme/TiO2 dyade structure[J]. Catalysis B: Environmental, 2012(111/112): 303-308.
[19] 张守仁. 叶绿素荧光动力学参数的意义及讨论[J]. 植物学通报, 1999, 16(4): 444-448. [20] GUO D, GUO Y, ZHAO J. Photosynthetic rate and chlorophyll fluorescence in leaves of stem mustard (Brassica juncea var. tsatsai) after turnip mosaic virus infection[J]. Plant Sci, 2004, 168(1): 57-63.
[21] 赵会杰, 邹琦, 于振文. 叶绿素荧光分析技术及其在植物光合机理研究中的应用[J]. 河南农业大学学报, 2000, 34(3): 248-251. [22] 宋丽丽, 郭延平, 徐凯. 温州蜜柑叶片光合作用光抑制的保护机理[J]. 应用生态学报, 2003, 14(1): 47-50. [23] 刘建新, 王金成, 王鑫. 外源NO对NaHCO3胁迫下黑麦草幼苗光合生理响应的调节[J]. 生态学报, 2012, 32(11): 3460-3466. [24] 黄勇. 烟叶结构与代谢产物差异及光因素影响的研究[D]. 长沙: 湖南农业大学, 2007. [25] 过伟民, 张艳玲, 蔡宪杰, 等. 光质对烤烟品质及光合色素含量的影响[J]. 烟草科技, 2011(9): 65-70. [26] 杨兴有, 刘国顺. 成熟期光强对烤烟理化特性和致香成分含量的影响[J]. 生态学报, 2007, 27(8): 3450-3456. -
期刊类型引用(0)
其他类型引用(1)



 下载:
下载: