Effects of temperature on culture in vitro and pathogenicity of Cyprinid herpesvirus 3
-
摘要:目的
证实温度对锦鲤疱疹病毒CyHV-3体外增殖和致病性的影响。
方法选用CyHV-3-EGFP病毒株为研究对象,采用间接免疫荧光染色法测定病毒滴度,使用荧光显微镜观察病毒体外增殖,研究病毒的热稳定性、以及温度对病毒的体外培养和体内致病性的影响。
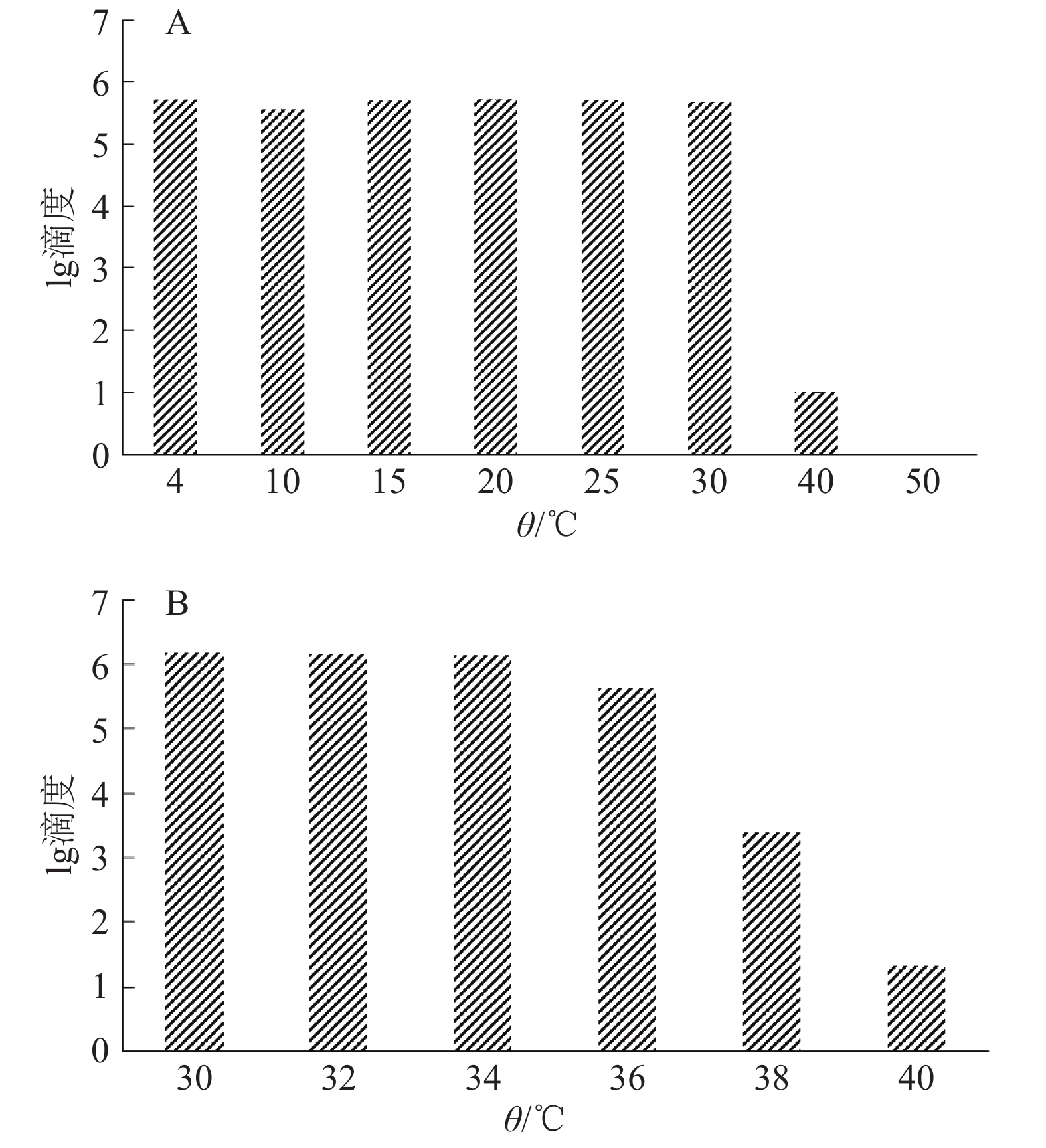
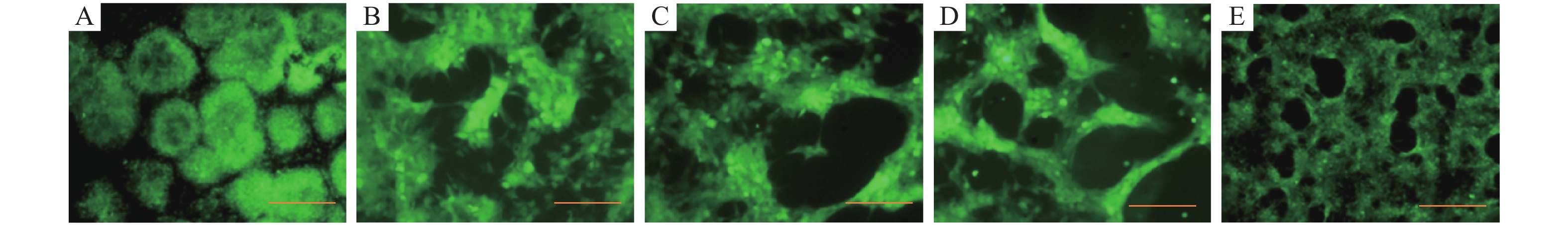
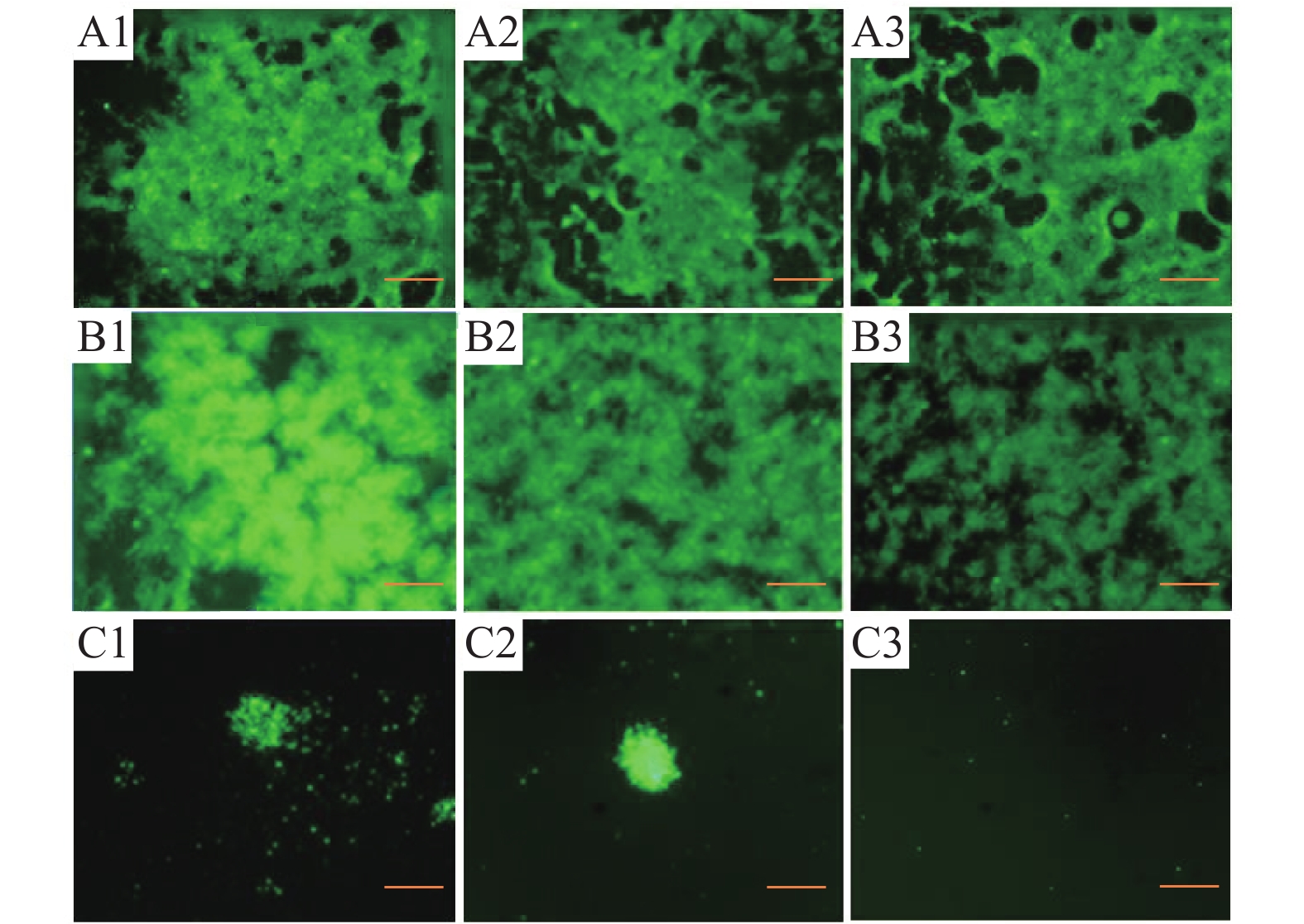
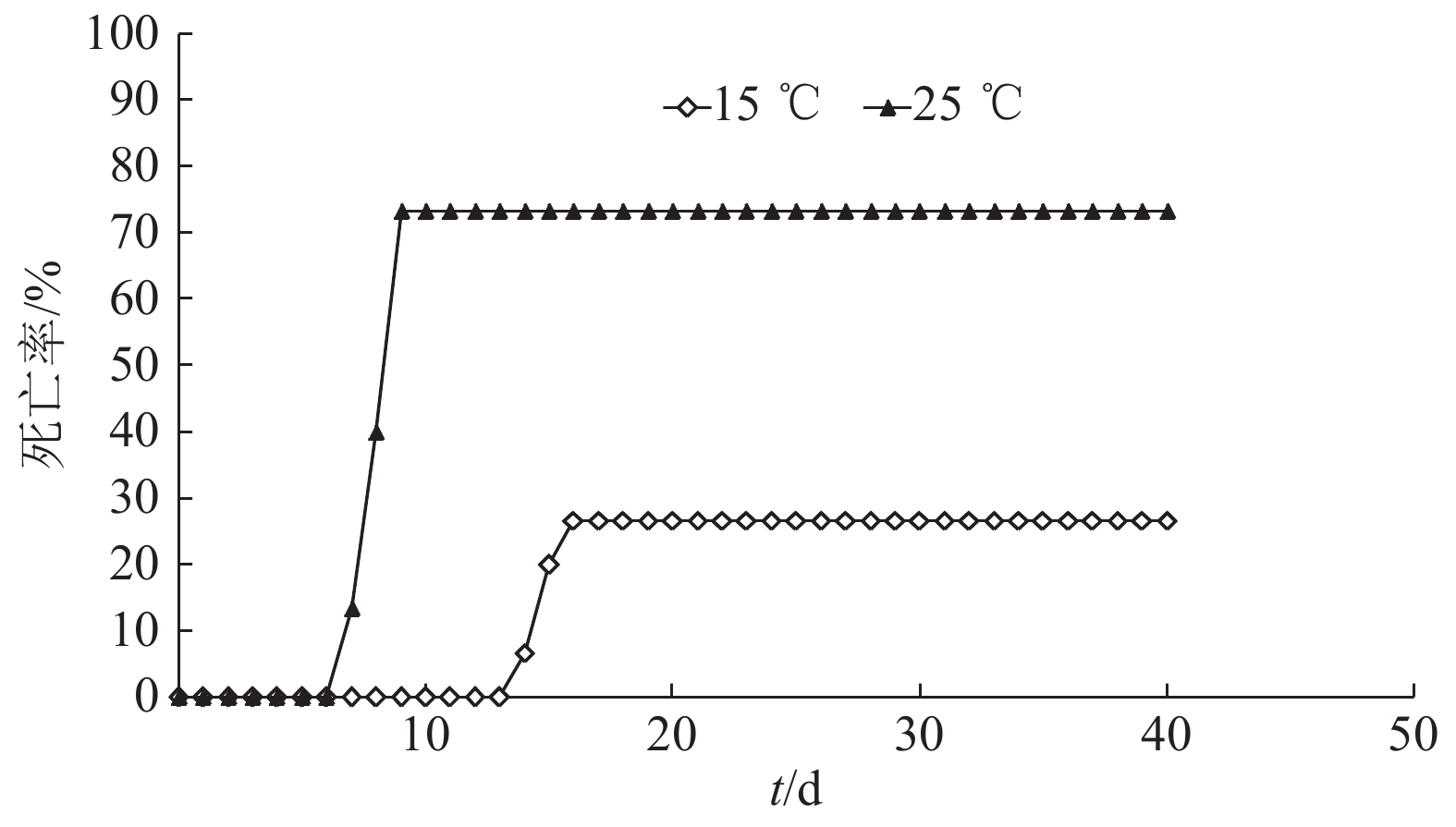
结果CyHV-3在4~36 ℃条件下具有很好的稳定性,温度超过36 ℃后,病毒活力随着温度升高而降低,50 ℃时病毒活力完全丧失。感染温度对CyHV-3病毒活力影响不大,高温(37 ℃)和低温(4 ℃)时病毒都具有感染能力。但是,孵育温度明显影响病毒活力,温度高于30 ℃时,CyHV-3的增殖能力减退甚至消失。鲤鱼感染CyHV-3病毒后,低温组(15 ℃)的死亡率为26.67%,常温组(25 ℃)的死亡率为73.33%,高温组(30 ℃)和对照组的死亡率均为0。
结论证实了CyHV-3病毒在低温下能够增殖并且具有致病性,解释了近年来锦鲤疱疹病毒(KHVD)的暴发及流行不再受限于春秋季节的现象。
Abstract:ObjectiveTo confirm the effect of temperature on proliferation in vitro and pathogenicity of Cyprinid herpesvirus 3 (CyHV-3).
MethodCyHV-3-EGFP strain was used in this study. Viral titer was measured by the indirect immunofluorescence staining assay. The proliferation of virus in vitro was observed using a fluorescence microscope. The thermal stability, and the effect of temperature on proliferation in vitro and pathogenicity in vivo of virus were studied.
ResultCyHV-3 had good thermal stability at 4-36 ℃. The viability of CyHV-3 decreased with the increase of temperature when the temperature exceeded 36 ℃. The virus viability was completely lost at 50 ℃. The infection temperature had little effect on the viability of CyHV-3, and the virus showed infectivity at both high (37 ℃) and low (4 ℃) temperatures. However, incubation temperature significantly affected the virus viability. CyHV-3 proliferation capacity decreased or even disappeared when the temperature exceeded 30 ℃. After CyHV-3 infection, the mortality rates for the carps at low temperature (15 ℃) and room temperature (25 ℃) were 26.67% and 73.33% respectively, and the mortality rates for the carps at high temperature (30 ℃) and in the control group with no virus infection were 0.
ConclusionThe results confirm that CyHV-3 can proliferate and has pathogenicity at low temperature, which explain the phenomenon that the outbreak and rapid spread of KHVD in recent years are no longer restricted in spring and autumn seasons.
-
Keywords:
- Cyprinid herpesvirus 3 /
- Cyprinus carpio /
- koi herpesvirus disease /
- temperature /
- pathogenicity /
- proliferation /
- infection
-
劳氏黏虫Leucania loreyi (Duponchel)属鳞翅目夜蛾科,在我国分布广泛,是黏虫Mythimna separata (Walker)的近缘种,常与其混杂发生,主要为害玉米Zea mays、水稻Oryza sativa等禾谷类作物[1]。劳氏黏虫幼虫取食禾本科作物叶片、玉米苞叶及籽实,劳氏黏虫发生严重地块的叶片被食成缺刻甚至仅留叶脉,严重影响作物的产量和品质[2]。由于劳氏黏虫与黏虫形态、为害状相似,在田间调查时易将两者混淆。现已有学者对黏虫和劳氏黏虫的形态特征进行了比较[3-5],对黏虫的生物学特性、发生规律、危害特点等进行了较为广泛、系统地研究[6-9],对劳氏黏虫在玉米和水稻上的生物学特性也进行了初步研究[10-11]。
植食性昆虫与寄主植物间存在相互作用的关系[12]。研究表明,植食性昆虫通过视觉、嗅觉、触觉一系列行为来确定寄主植物,寄主植物内存在不同的营养物质和次生代谢产物,这使得植食性昆虫对不同的寄主植物有不同的趋性反应,也影响着昆虫的生长发育和繁殖[13-15]。张勇等[16]研究发现棉铃虫Helicoverpa armigera (Hübner)在取食不同寄主植物后,幼虫发育历期、蛹质量、成虫繁殖力和寿命等都会发生改变。尹娇等[17]研究表明取食不同寄主植物不仅影响草地螟Loxostege sticticalis L.的生长发育,还影响其产卵量和交配率。相似的,斜纹夜蛾Prodenia litura (Fabricius)、小地老虎Agrotis ypsilon (Rottemberg)取食不同的寄主植物对幼虫或成虫的生物学特性都存在或多或少的影响[18-19]。然而,有关劳氏黏虫取食不同寄主植物的生物学特性在国内外鲜见有关报道。本研究以禾本科主要作物玉米、水稻和甘蔗Saccharum officinarum,禾本科杂草稗草Echinochloa crusgalli为食料,系统地研究不同寄主植物对劳氏黏虫生长发育及繁殖的影响,为劳氏黏虫的预测预报及防治提供理论依据。
1. 材料和方法
1.1 材料
水稻采用感虫水稻品种‘TN1’,由广西农业科学院植物保护研究所提供;甘蔗采用杂交品种‘桂糖29号’,由广西农业科学院甘蔗研究所提供;玉米采用杂交玉米品种‘桂单0810’,由广西农业科学院玉米研究所提供。稗草采自广西农业科学院田间。
劳氏黏虫幼虫采自广西农业科学院水稻田,室内饲养条件为温度(24±1)℃,湿度(75±5)%,光周期为12 h光∶12 h暗。劳氏黏虫幼虫用玉米叶饲养繁殖1代后,将初孵化的幼虫分别用供试寄主植物饲养,以建立各个寄主植物上的试验种群。各寄主植物上的劳氏黏虫试验种群在繁殖1代后,分别取出一定量的初孵幼虫作为供试虫源。
1.2 试验方法
1.2.1 劳氏黏虫生长发育试验
取生长发育状况一致的劳氏黏虫初孵幼虫,分别用4种寄主植物新鲜叶片单头饲养于养虫杯中(直径4.5 cm、高4 cm),用纸巾和纱布封口,于人工气候箱内饲养,温度为(24±1)℃,湿度为(75±5)%,光照周期为12 h光∶12 h暗,每天更换足量新鲜叶片,每组(1种寄生植物即1组)接虫40头,重复3次。每天09:00和15:00观察记录各养虫杯内幼虫蜕皮情况和存活情况。幼虫化蛹后第2天辨别雌、雄并称取蛹质量。
1.2.2 劳氏黏虫繁殖力试验
取不同寄主植物上初羽化的雌、雄虫各1头置于塑料杯中(直径7.5 cm、高9 cm),杯中放蘸有φ为10%蜂蜜水的棉花球供成虫取食,聚丙烯塑料绳供其产卵,用纱布及皮筋封口,每组重复10次,每天更换新鲜蜂蜜水及产卵绳,观察并记录其产卵前期、产卵量及成虫寿命,期间若雄虫死亡补充雄虫,直至雌虫死亡。同时,在产卵期间取出一定量的卵块,以观察卵的发育历期与孵化率。
1.2.3 生命表组建
取“1.2.1”和“1.2.2”中寄主植物上雌成虫所产的卵,每株寄主植物取200粒左右,参照“1.2.1”记录卵历期及存活率,待卵孵化后每天记录各个虫期的发育历期和存活率,成虫期交配后参照“1.2.2”每天记录雌成虫产卵量和成虫寿命,通过以上资料参照张孝羲[20]的方法,组建劳氏黏虫在各个寄主植物上的试验种群生命表。
1.3 数据处理
数据处理和分析参照文献[21]的方法,用Microsoft Office Excel 2007和DPS 7.05软件处理数据,百分数数据先反正弦平方根后再进行比较,各处理平均数经过方差分析后采用Duncan’s法进行多重比较。
生命表参数种群净增殖率(R0)、平均世代周期(T)、内禀增长率(rm)、周限增长率(λ)、种群加倍时间(td)的计算公式分别为:
$${R_{_0}} = \sum {l_x}{m_x}\text{,}$$ (1) $$T = \sum {l_x}{m_x}x/{R_{_0}}\text{,}$$ (2) $${r_{\rm m}} = \ln {R_{_0}}/T\text{,}$$ (3) $$\lambda = {{\rm e}^{r_{\rm m}}}\text{,}$$ (4) $${t_{\rm d}} = \ln 2/{r_m} = 0.693\;1/{r_{\rm m}}\text{,}$$ (5) 式中,lx是在x期开始时的存活概率,mx表示x期间平均每雌产雌数。
采用Weibull方程[22]描述雌成虫特定年龄存活率,方程公式为:
$${S_{\rm p}}\left(t \right) = {{\rm e}^{ - \left({t/b} \right)c}}\text{,}$$ (6) 式中,Sp (t)为年龄t时的存活率,b为尺度参数,c为形状参数,b和c均大于0。
2. 结果与分析
2.1 不同寄主植物对劳氏黏虫发育历期的影响
劳氏黏虫取食4种寄主植物均能完成整个生活史(表1)。不同寄主植物对劳氏黏虫的幼虫发育历期有明显影响(F=39.25,df=3、103,P=0.000),幼虫发育历期为取食玉米(20.18 d)<取食水稻(21.29 d)<取食稗草(24.84 d)<取食甘蔗(25.24 d),除取食稗草和甘蔗之间差异不显著外(P>0.05),其他两两之间均存在显著差异(P<0.05)。劳氏黏虫幼虫期取食不同寄主植物对其预蛹期、蛹期、雌成虫寿命和雄成虫寿命影响不显著(P>0.05),但取食不同寄主植物后劳氏黏虫育出的卵的发育历期存在差异(F=4.67,df=3、800,P=0.034),其中以取食玉米所育出的劳氏黏虫卵历期最短,为3.92 d,取食甘蔗的卵历期最长,为5.09 d。因劳氏黏虫在取食不同寄主植物后,卵历期和幼虫历期的差异,导致该虫在全世代周期存在差异(F=6.34,df=3、96,P=0.000 6),在玉米和水稻上的全世代周期无显著差异(P>0.05),但显著短于取食甘蔗和稗草(P<0.05),且在甘蔗组和稗草组之间差异不显著(P >0.05)。
表 1 劳氏黏虫在4种寄主植物上的发育历期1)Table 1. Development durations of Leucania loreyi on four host plants发育期 玉米 水稻 甘蔗 稗草 卵期 3.92±0.19b 4.27±0.27ab 5.09±0.37a 4.40±0.27ab 1龄幼虫 4.68±0.13b 4.89±0.14b 5.61±0.15a 5.41±0.15a 2龄幼虫 2.37±0.08b 2.67±0.12b 3.26±0.12a 3.25±0.13a 3龄幼虫 2.62±0.13b 2.72±0.13b 3.17±0.15a 3.26±0.17a 4龄幼虫 2.47±0.09b 2.58±0.11b 3.34±0.17a 3.07±0.17a 5龄幼虫 2.58±0.11c 3.00±0.17bc 3.50±0.15a 3.39±0.19ab 6龄幼虫 5.33±0.19b 5.28±0.24b 6.15±0.28a 5.81±0.25ab 全幼虫期 20.18±0.24c 21.29±0.45b 25.24±0.28a 24.84±0.32a 预蛹期 2.07±0.05a 2.11±0.06a 2.20±0.08a 2.08±0.06a 蛹期 11.59±0.22a 11.62±0.25a 12.08±0.35a 11.83±0.32a 产卵前期 3.83±0.32b 4.18±0.35ab 5.00±0.30a 4.90±0.35a 雌成虫寿命 11.42±0.78a 11.18±0.30a 10.55±0.39a 10.10±0.43a 雄成虫寿命 12.27±0.36a 12.33±0.51a 11.46±0.57a 11.08±0.50a 全世代 45.67±0.59b 46.85±0.70b 50.58±0.44a 51.35±2.13a 1)同行数据后凡具有一个相同字母者,表示不同寄主植物间差异不显著(P>0.05,Duncan’s 法) 2.2 寄主植物对劳氏黏虫卵、幼虫、蛹、雌成虫存活率的影响
劳氏黏虫整个卵期、幼虫期和蛹期的存活率以在稗草和甘蔗上的较低(图1),但仍分别有58%和60%的卵能发育成成虫,在玉米和水稻上分别有68%和65%的卵能发育为成虫。并且从图1中还可看出,在各寄主植物上从卵到发育成成虫期间的死亡主要发生在卵期和低龄幼虫期。
对雌成虫的存活率采用Weibull模型进行拟合(图2),各寄主植物上雌成虫实际存活率均能与Weibull模型较好拟合,且其形状参数(c)均大于1,这表明雌成虫在4种寄主植物上大多能实现平均寿命。
2.3 寄主植物对劳氏黏虫产卵量、卵孵化率及蛹质量的影响
从雌成虫特定年龄产雌率曲线可以看出每日平均产雌数的动态变化(图2),以玉米为寄主的劳氏黏虫雌虫mx曲线高峰来的最早,在第5天达到高峰,而在其余3种寄主植物上的mx曲线都会出现1个以上的高峰,这表明雌虫在产卵时间分布上存在较大的个体差异。并且,以稗草和甘蔗为寄主时,雌成虫的产卵历期较以玉米和水稻为寄主的短。
从表2可知,幼虫期食物对雌成虫产卵量(F=5.53,df=3、40,P=0.003)和卵孵化率(F=12.46,df=3、962,P=0.000)有显著影响。幼虫期取食玉米的雌虫,其单雌产卵量最多(1019.42粒),卵孵化率最高(93.59%),均显著高于甘蔗组和稗草组(P<0.05),但与水稻组差异不显著(P>0.05)。取食不同寄主植物的幼虫化蛹后,其雌、雄虫蛹质量均表现为玉米>水稻>甘蔗>稗草,并且存在显著差异(P<0.05),其中在稗草上雌成虫蛹质量最低,为22.61 mg。
表 2 劳氏黏虫取食4种寄主植物对产卵量、孵化率及蛹质量的影响Table 2. Effects of four host plants on the fecundity, hatching rate and pupal weight of Leucania loreyi寄主植物 单雌产卵量/粒 孵化率/% m蛹/mg 雌虫 雄虫 玉米 1 019.42±95.22a 93.59±0.93a 32.43±0.36a 35.49±0.39a 水稻 999.73±52.01ab 92.54±0.85a 28.82±0.67b 31.84±0.82b 甘蔗 665.27±60.71c 86.98±1.61b 25.40±0.84c 28.14±0.62c 稗草 790.50±71.03bc 87.56±1.56b 22.61±0.69d 24.46±0.62d 1)同列数据后凡具有一个相同字母者,表示差异不显著(P>0.05,Duncan’s 法) 2.4 寄主植物对劳氏黏虫种群增长的影响
在温度为(24±1)℃,湿度为75%±5%,光照周期为12 h光∶12 h暗的饲养条件下,劳氏黏虫分别取食玉米、水稻、甘蔗和稗草后,得到表3的生命表参数。从表3中可以看出,劳氏黏虫取食玉米叶时,净增殖率(R0)、内禀增长率(rm)和周限增长率(λ)最高,分别为226.54、0.13和1.13,世代平均周期和种群加倍时间最短(td),分别为43.14和5.51,取食水稻叶次之,接下来是稗草,最后是甘蔗。劳氏黏虫在4种寄主植物上的内禀增长率(rm)都大于0,表明种群均能够快速增长。在甘蔗上的净增殖率(R0)最低,但每经过1个世代种群仍能增殖153.71倍。
表 3 不同寄主植物上劳氏黏虫的生命表参数Table 3. The life table parameters of Leucania loreyi on different host plants寄主植物 净增殖率(R0) 世代平均周期(T) 内禀增长率(rm) 周限增长率(λ) 种群加倍时间(td) 玉米 226.54 43.14 0.13 1.13 5.51 水稻 211.48 46.30 0.12 1.12 5.99 甘蔗 153.71 52.83 0.10 1.10 7.27 稗草 171.83 49.20 0.10 1.11 6.63 3. 讨论与结论
田间调查发现劳氏黏虫在广西地区分布广泛。姜玉英等[23]研究认为黏虫的发生面积与黏虫优异寄主小麦、玉米、水稻3种作物的种植面积有直接关系。从广西作物的种植情况来看,2016年禾本科作物种植面积居前3位的分别是水稻(198.39×104 hm2)、甘蔗(97.37×104 hm2)和玉米(62.26×104 hm2)[24]。因此,本研究选取水稻、甘蔗和玉米以及田间常见的禾本科杂草稗草作为劳氏黏虫的食料,研究劳氏黏虫在这4种寄主植物上的生长发育及繁殖能力。
食物营养对昆虫的生长发育及生殖能力产生很大影响[25-26]。本试验结果表明,劳氏黏虫取食不同寄主植物后其幼虫历期和成虫繁殖力均表现出一定的差异。在3种禾本科作物之间,劳氏黏虫取食玉米后,其幼虫发育历期最短,非成虫期存活率最高、雌成虫寿命最长、单雌产卵量最大,其次是取食水稻,最后是甘蔗,这一结果与吴荣宗[27]研究基本一致。田间调查时也发现,当有玉米和水稻种植的季节,劳氏黏虫常见于玉米和水稻上,偶尔危害甘蔗,与本试验结果相吻合。郭松景等[11]研究报道,劳氏黏虫取食玉米后雌成虫寿命为7 d,平均产卵量为266粒。而本试验中雌成虫平均寿命为11.42 d,单雌平均产卵量1 019.42粒,结果出现较大差异可能是由于采用的劳氏黏虫种群不同,郭松景等[11]试验中采用的劳氏黏虫为田间种群,而本试验中采用的是田间采集的幼虫经过室内繁殖饲养1代后的种群。以稗草为寄主植物时,劳氏黏虫除了雌、雄虫蛹质量低于甘蔗组外,其幼虫发育历期、雌成虫寿命、单雌产卵量等与甘蔗组差异均不显著,并且在稗草上的单雌平均产卵量为790.50粒,高于甘蔗组(665.27粒),可见劳氏黏虫取食稗草不仅能够正常的生长发育,还具有较强的繁殖能力,稗草是劳氏黏虫合适的中间寄主。吴荣宗[27]认为龄期数目与幼虫食料有关,当劳氏黏虫取食小麦时幼虫期均为6龄,而以高粱饲养时为7龄,本试验中取食4种寄主植物劳氏黏虫幼虫期均以6龄为主,但均有个别幼虫蜕皮至7龄却不能顺利化蛹的现象,具体原因还有待进一步分析。从研究结果可以看出,与取食稗草和甘蔗相比,取食玉米和水稻的劳氏黏虫不仅在幼虫期发育较快、存活率较高,在蛹质量及产卵量上也相对较重(高),可见,劳氏黏虫幼虫期的食物不仅对幼虫期生长发育有一定影响,对其种群的增殖也有重要影响。
在昆虫生命表参数中,内禀增长率反映了种群在特定环境下的数量增长能力[28]。劳氏黏虫在玉米、水稻、甘蔗和稗草上的内禀增长率分别为0.13、0.12、0.10和0.10,净增殖率分别为226.54、211.48、153.71和171.83,因此在适宜的条件下劳氏黏虫种群均能够在4种寄主植物上增殖,其中在玉米上增长最快,其次是水稻。田间调查发现,在冬季,劳氏黏虫常发现于禾本科杂草、稻桩上,待早春宿根蔗发芽开始为害并繁殖,这势必给翌年的农业生产造成威胁。可见,虽然相比之下取食水稻、甘蔗和稗草的种群增长潜能不如玉米,但它们却为劳氏黏虫越冬提供了丰富的食料。因此,建议在收割农作物的同时应及时清理秸秆并清除田边杂草,冬季时深耕勤耙,在春耕时节再翻耕整畦可有效消除越冬的幼虫和蛹,并在宿根蔗萌芽发苗时注意防治劳氏黏虫。
-
-
[1] RAKUS K, OUYANG P, BOUTIER M, et al. Cyprinid herpesvirus 3: An interesting virus for applied and fundamental research[J]. Vet Res, 2013, 44(1): 85.
[2] ANTYNCHOWICZ J, REICHERT M, MATRAS M, et al. Epidemiology, pathogenicity and molecular biology of koi herpesvirus isolated in Poland[J]. B Vet I Pulawy, 2005, 49(4): 367-373.
[3] HEDRICK R P, GILAD O, YUN S, et al. A herpesvirus associated with mass mortality of juvenile and adult koi, a strain of common carp[J]. J Aquat Anim Health, 2000, 12(1): 44-57.
[4] TU C, WENG M C, SHIAU J R, et al. Detection of koi herpesvirus in koi Cyprinus carpio in Taiwan[J]. Fish Patho, 2009, 39(2): 109-110.
[5] SANO M, ITO T, KURITA J, et al. First detection of koi herpesvirus in cultured common carp Cyprinus carpio in Japan[J]. Fish Patho, 2004, 39(39): 165-167.
[6] 刘荭, 史秀杰, 高隆英, 等. 进口锦鲤暴发病病原的nested-PCR鉴定[J]. 华中农业大学学报, 2002, 21(5): 414-418. [7] 朱霞, 李新伟, 王好, 等. 一株锦鲤疱疹病毒的分离与鉴定[J]. 中国预防兽医学报, 2011, 33(5): 340-343. [8] 李莹莹, 王庆, 曾伟伟, 等. 锦鲤疱疹病毒GZ1301株的分离与鉴定[J]. 水产学报, 2014, 38(8): 1159-1166. [9] HARAMOTO E, KITAJIMA M, KATAYAMA H, et al. Detection of koi herpesvirus DNA in river water in Japan[J]. J Fish Dis, 2007, 30(1): 59-61.
[10] MINAMOTO T, HONJO M N, UCHII K, et al. Detection of Cyprinid herpesvirus 3 DNA in river water during and after an outbreak[J]. Vet Microbiol, 2009, 135(3/4): 261-266.
[11] MINAMOTO T, HONJO M N, YAMANAKA H, et al. Nationwide Cyprinid herpesvirus 3 contamination in natural rivers of Japan[J]. Res Vet Sci, 2012, 93(1): 508-514.
[12] MINAMOTO T, HONJO M N, KAWABATA Z. Seasonal distribution of Cyprinid herpesvirus 3 in lake Biwa, Japan[J]. Appl Environ Microb, 2009, 75(21): 6900-6904.
[13] PIKARSKY E, RONEN A, ABRAMOWITZ J, et al. Pathogenesis of acute viral disease induced in fish by carp interstitial nephritis and gill necrosis virus[J]. J Virol, 2004, 78(17): 9544-9551.
[14] 郑树城, 王庆, 李莹莹, 等. 鲤疱疹病毒3型研究进展[J]. 病毒学报, 2016(1): 108-120. [15] 邢程, 王好, 周井祥等. 一例冰下低温爆发的锦鲤疱疹病毒病的鉴定[J]. 水产学杂志, 2014(1): 46-49. [16] COSTES B, RAJ V S, MICHEL B, et al. The major portal of entry of koi herpesvirus in Cyprinus carpio is the skin[J]. J Virol, 2009, 83(7): 2819-2830.
[17] 张奇亚. 水生低等脊椎动物病毒生态学研究[J]. 病毒学报, 2001, 17(3): 277-281. [18] 温周瑞. 气候变化对鱼类病毒病和细菌病的影响[J]. 当代水产, 2013(8): 76-77. [19] RAKUS K L, IRNAZAROW I, ADAMEK M, et al. Gene expression analysis of common carp (Cyprinus carpio L.) lines during Cyprinid herpesvirus 3 infection yields insights into differential immune responses[J]. Dev Comp Immunol, 2012, 37(1): 65-76.
[20] 罗丹, 梁利国, 谢骏, 等. 鲤疱疹病毒Ⅰ、Ⅱ、Ⅲ型研究进展[J]. 水生态学杂志, 2014, 35(3): 94-100. [21] RONEN A, PERELBERG A, ABRAMOWITZ J, et al. Efficient vaccine against the virus causing a lethal disease in cultured Cyprinus carpio[J]. Vaccine, 2003, 21(32): 4677.
[22] 高立容, 于慧, 周井祥, 等. 白山市鸭绿江网箱养鲤冰下爆发锦鲤疱疹病毒病的鉴定[J]. 水产养殖, 2017, 38(4): 7-11.









 下载:
下载: