Effects of C/N ratio and pH value on the decomposition of a mixture of Populus alba×P. berolinensis-Hosta plantaginea fallen leaves and turf grass clippings
-
摘要:目的
以银中杨Populus alba×P. berolinensis–玉簪Hosta plantaginea落叶和草坪碎屑为基础材料,通过对混料C/N、pH的调控,筛选混料腐解的最佳条件。
方法采用室内培养法对银中杨–玉簪落叶及草坪碎屑混料进行60 d恒温好氧腐解,设置物料C/N为10、15和20以及pH为4、7和10,探讨其对混料腐解过程中水溶性有机碳(WSOC)、可提取腐殖酸碳(HEC)、胡敏酸碳(HAC)、富里酸碳(FAC)及胡敏素碳(HuC)含量的影响。
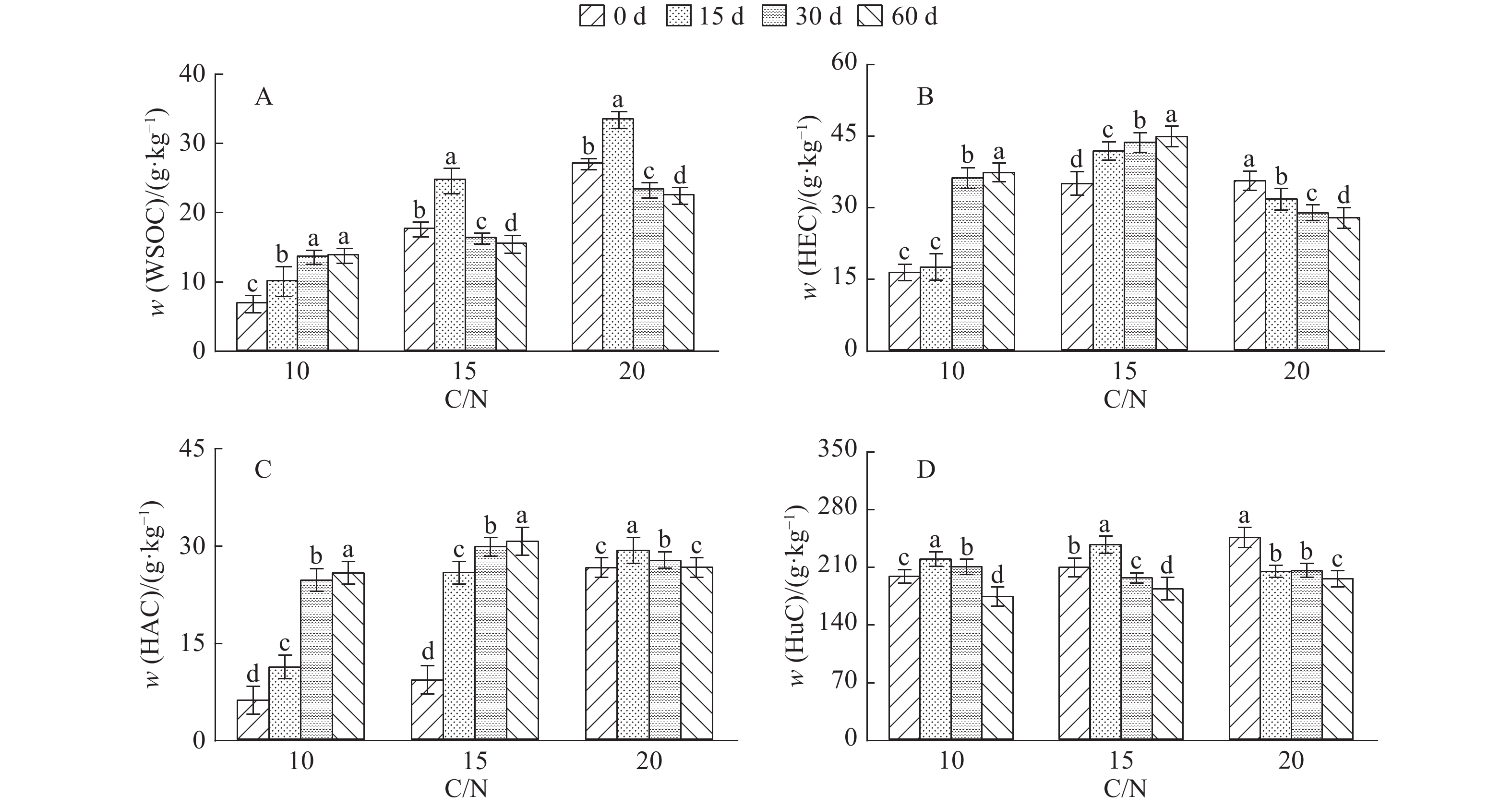
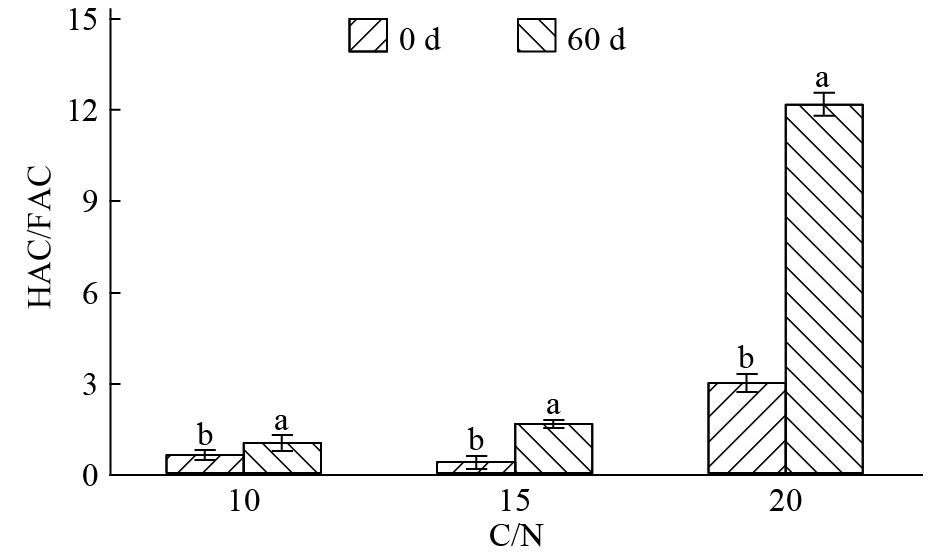
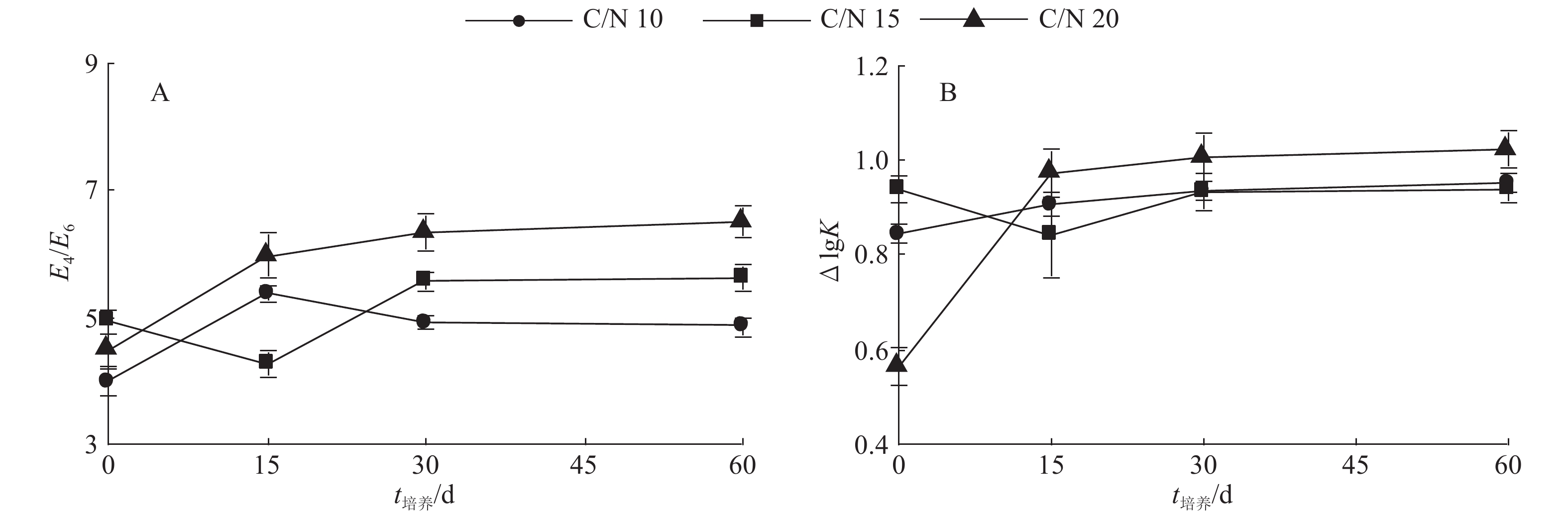
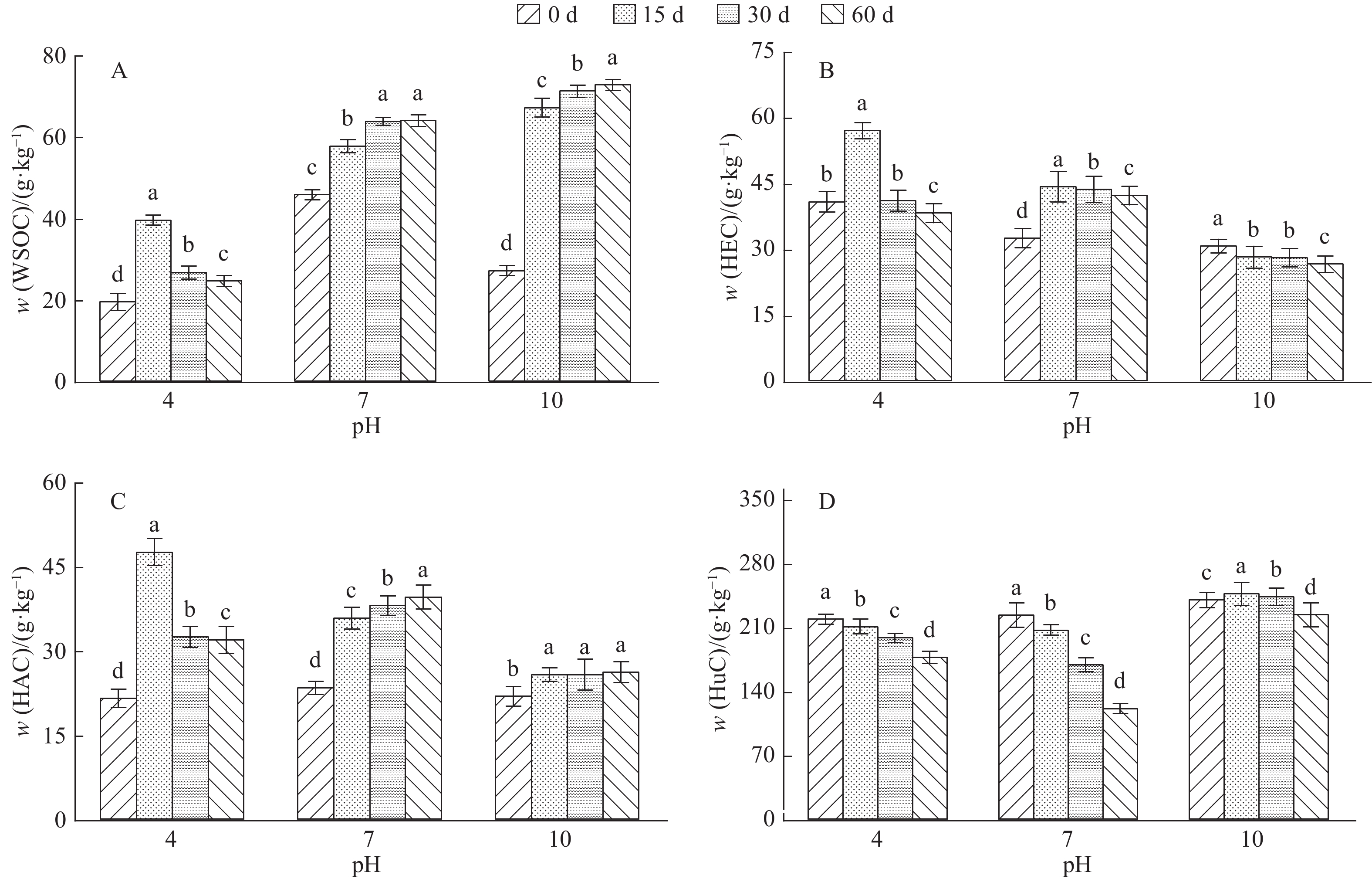
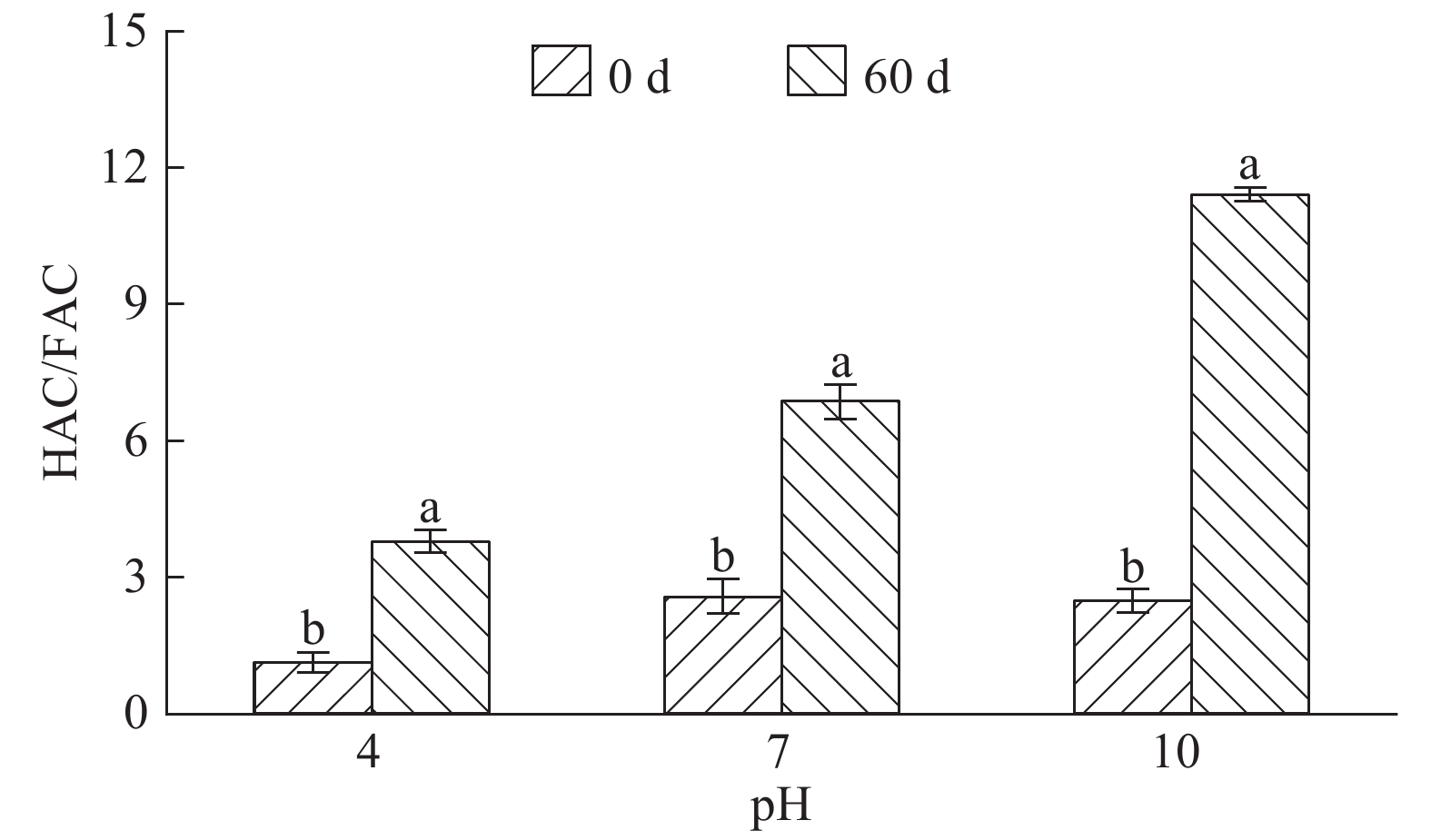
结果将C/N设为10或15时,培养结束后混料HEC及HAC均有所累积,而将混料C/N设为20则更有利于微生物对WSOC、HEC及HuC的矿化及周转。C/N为15或20时,培养结束后混料腐殖质品质有所改善,而在混料中添加更多氮素使C/N为10时,则在一定程度上阻碍了FAC向HAC的转化。混料C/N为20更有利于其胡敏酸(HA)分子结构的简单化,其次是C/N为10,而C/N为15时更有利于HA分子结构的稳定;混料pH为7有利于微生物对HuC的矿化,使HEC和HAC含量分别增高30.0%和69.0%。混料pH为10时对HAC/FAC的促进程度最大,使之增加78.3%,pH为4或7时对混料HAC/FAC的促进程度较小。
结论C/N为15、pH为7时,对银中杨–玉簪落叶及草坪碎屑混料腐解的促进作用最为显著。
Abstract:ObjectiveUsing Populus alba×P. berolinensis-Hosta plantaginea fallen leaves and turf grass clippings as basic materials, to screen the optimum decompositon condition of mixed materials by adjusting C/N ratio and pH value.
MethodThe mixed materials of P. alba×P. berolinensis-H. plantaginea fallen leaves and turf grass clippings were cultured in thermostatic room for 60 days to conduct aerobic decomposition. Different C/N ratios (10, 15, 20) and pH values (4, 7, 10) were setted to explore their effects on contents of water soluble organic carbon (WSOC), humic-extracted acid C(HEC), humic acid C(HAC), fulvic acid C(FAC) and humin C(HuC) during the decomposition process.
ResultHEC and HAC extracted from the mixed materials were both accumulated at the end of culture while C/N ratio was 10 or 15, and C/N ratio of 20 was more beneficial to the microbial mineralization and turnover of WSOC, HEC and HuC. When C/N ratio was 15 or 20, the humic quality of mixed materials was enhanced after 60 days of culture. The transformation of FAC to HAC was partly restrained if C/N ratio was set to 10 by applying more nitrogen into the mixed materials. The C/N ratio of 20 was more beneficial to the simplification of humic acid (HA) molecular structure, followed by C/N ratio of 10. C/N ratio of 15 was more favorable to the stabilization of HA molecular structure. The microbial mineralization of HuC could be promoted when pH value of mixed materials was 7, and the contents of HEC and HAC were increased by 30.0% and 69.0% respectively in the decomposition process. When pH value of mixed materials was adjusted to 10, HAC/FAC ratio was mostly promoted and increased by 78.3%, while pH value of 4 or 7 had relatively smaller effect on HAC/FAC ratio promotion.
ConclusionThe combination of C/N ratio of 15 and pH value of 7 mostly promotes the decomposition of mixed materials composed with P. alba×P. berolinensis-H. plantaginea fallen leaves and turf grass clippings.
-
木尔坦棉花曲叶病毒Cotton LeafCurl Multan Virus(CLCuMV)属双生病毒科菜豆金黄花叶病毒属,含DNA-A组分,并伴随有卫星DNA β分子,该病毒是引起棉花曲叶病的主要病原之一[1-2].该病毒通过烟粉虱Bemisia tabaci进行传播和扩散,危害严重[3-6].已在我国广东、广西、海南及云南的棉花Gossypium hirsutum L.[2]、朱槿Hibiscus rosa-sinensis Linn.[7-9]、黄秋葵Abelmoschus esculentu L.[10]、垂花悬铃木Malvaviscus arboreus Cav. var. penduliflocus(DC.)Schery[11]和红麻Hibiscus cannabinus[8]等锦葵科植物检测到该病毒.已有利用测序比对CLCuMV在不同寄主间的变异程度的研究[12].
实时荧光定量PCR(Real time fluorescence quantitative PCR,RT-PCR)是在PCR定性技术基础上发展起来的核酸定量技术[12],被广泛用于医学病理学及分子生物学等领域[13],主要包括荧光染料法和探针法.利用RT-PCR探针法定量检测了发病番茄叶片和介体昆虫烟粉虱的番茄黄化曲叶病毒含量[14]、发病番茄植株中番茄黄化曲叶病毒和番茄黄化皱叶病毒的含量[15],也检测了蓟马虫体内番茄斑点枯萎病毒的含量[16],为解释病毒共同侵染、预测病毒传播提供了有效的依据.目前鲜见利用荧光染料法对CLCuMV定量检测的报道.
本文基于SYBR Green I检测技术,构建CLCuMV实时荧光定量PCR定量检测体系,并比较其与常规PCR定量检测该病毒的灵敏度差异;定量测定寄主植物朱槿的健康及显症植株及介体昆虫烟粉虱虫体内的CLCuMV含量,为深入研究木尔坦棉花曲叶病的发病过程、致病机理以及该病毒与寄主植物、介体昆虫的互作提供有效的定量检测技术.
1. 材料与方法
1.1 材料
2014年7月在广东省广州市南沙区蒲园的绿化地朱槿病株上采集供试感病叶片.病株表现为叶脉膨大且颜色加深,叶片边缘上卷,有脉突和耳突等木尔坦棉花曲叶病的典型症状.对照叶片是在未显症状的健康朱槿植株上采集的.
介体昆虫为室内饲养于朱槿植株上的MEAM1隐种(B型)烟粉虱试验种群.
质粒标准品为含有CLCuMV基因组的质粒pBin PLUS-1.85A,由广东省农业科学院植物保护研究所蔬菜病害防控研究室提供.
高纯度质粒小量快速提取试剂盒(北京天根生化科技有限公司);血液组织细胞基因组提取试剂盒(北京天根生化科技有限公司);植物基因组提取试剂盒EasyPureTM Plant Genomic DNA Kit(北京全式金生物技术有限公司);2XGoTaqTM Green Master Mix(普洛麦格生物技术有限公司);2 × SYBR Green PCR Master Mix(北京天根生化科技有限公司);Alpha1506微量分光光度计(上海谱元仪器有限公司).
1.2 方法
1.2.1 质粒提取与引物设计
取出保存于- 80 ℃并含有pBin PLUS-1.85A的农杆菌菌株(GV3101)培养后,用试剂盒提取质粒pBin PLUS-1.85A,再将其转化到大肠埃希菌感受态细胞(DH5α),继续培养.取D600 nm为0.6 ~ 0.8的适量菌液,用试剂盒提取质粒,微量分光光度计测定质粒浓度,将该质粒作为标准样品母液,- 20 ℃保存备用.
质粒中病毒基因组拷贝数= N × 10-9 × ρ/Mr,式中,N为阿伏伽德罗常数,ρ为核酸质量浓度(ng·μL-1),Mr为相对分子质量.由该公式计算出母液质粒浓度为5.02 × 109 μL-1.
基于CLCuMV的DNA-A基因组序列(GenBank登录号为:EF465535.1[17]),用Primer 5.0软件设计并合成检测引物CLCMuV 492-F:5′-TCCAGATGTCCGCACAAATA-3′,CLCMuV 492-R:5′-AACCAGGTCAGCACATTTCC-3′.
1.2.2 PCR反应体系及条件
常规PCR反应体系(25 μL):2XGoTaqTM Green Master Mix 12.5 μL,CLCMuV 492-F和CLCMuV 492-R各1 μL,样本DNA 1 μL,用ddH2O补足25 μL.阴性对照不加DNA,加1 μL DEPC(焦磷酸二乙酯)水.反应条件:94 ℃ 7 min;94 ℃ 35 s,49 ℃ 35 s,72 ℃ 45 s,35个循环;72 ℃ 10 min,4 ℃保存.在10 g·L-1琼脂糖凝胶电泳检测PCR产物.
荧光定量PCR反应体系(20 μL):2 × SYBR Green PCR Master Mix 10 μL、10 μmol·L-1CLCMuV 492-F和CLCMuV 492-R各0.5 μL、样本DNA 1 μL、用ddH2O补至20 μL.阴性对照不加DNA,加1 μL DEPC水.反应条件:94 ℃,7 min;94 ℃,35 s,49 ℃,35 s,72 ℃,45 s,35个循环;95 ℃,10 s,95 ℃,5 s.
1.2.3 CLCuMV实时荧光定量PCR
用DEPC水以10倍梯度稀释质粒标准样品母液,获得8个供试的质粒浓度:5.2 × 108、5.2 × 107、5.2 × 106、5.2 × 105、5.2 × 104、5.2 × 103、5.2 × 102和5.2 × 101 μL-1,进行实时荧光定量PCR,获得质粒浓度与其循环阈值(Ct值)之间关系,建立其检测标准曲线.
CLCuMV以5.2 × 109、5.2 × 108、5.2 × 107、5.2 × 106、5.2 × 105、5.2 × 104、5.2 × 103、5.2 × 102、5.2 × 101和5.2 μL-1为供试浓度,对其进行常规PCR和实时荧光定量PCR,比较其检测的灵敏度.以不加DNA模板作为阴性对照.
1.2.4 朱槿显症叶片DNA提取及CLCuMV定量检测
选取5株朱槿发病植株,分别采集显症的嫩叶、成熟叶片,分开标记编号,每袋1片样叶,带回实验室并保存于- 80 ℃冰箱中.试验时,试剂盒提取朱槿DNA,用健康朱槿上的叶片作对照.微量分光光度计测定各样本的总DNA质量浓度,再将其稀释为100 ng·μL-1,备用.
1.2.5 烟粉虱饲毒处理及CLCuMV定量检测
以显症的朱槿作为病毒来源,在放置病株的养虫笼(50 cm × 50 cm × 50 cm)中释放B型烟粉虱300头.接虫24、48 h后分别从接虫朱槿植株的上、中、下部叶片上随机吸取饲毒成虫,共10头,并放于φ为95%的乙醇溶液保存,待测.从健康朱槿植株上饲养的供试成虫中吸取10头,作为对照.试剂盒提取介体昆虫DNA,微量分光光度计测定各样本的总DNA质量浓度,将其稀释为10 ng·μL-1,备用.
1.3 数据处理
采用t检验对已显症状朱槿嫩叶与成熟叶片处理的CLCuMV含量、饲毒24与48 h烟粉虱虫体CLCuMV含量进行显著性检验.采用SPSS 19.0进行统计分析.
2. 结果与分析
2.1 CLCuMV实时荧光定量PCR标准曲线的建立
用DEPC水以10倍梯度稀释质粒母液获得8个浓度,并对其进行荧光定量PCR,获得8个标准样品的浓度与Ct值之间的关系,其标准曲线关系式为y = - 3.75x + 40.56(朱槿)、y = - 4.13x + 41.43(烟粉虱),其中y为循环阈值(Ct值)、x为质粒标准品的初始浓度拷贝数的对数值.
2.2 实时荧光定量PCR与常规PCR检测CLCuMV的灵敏度
将5.2 ~ 5.2 × 109 μL-1 10个浓度的质粒标准样品分别进行实时荧光定量PCR和常规PCR.实时荧光定量PCR扩增曲线表明,空白对照无DNA模板,Ct值高于35,当质粒标准样品为5.2 × 109,5.2 × 108、5.2 × 107、5.2 × 106、5.2 × 105、5.2 × 104、5.2 × 103、5.2 × 102、5.2 × 101和5.2 × 100 μL-1,其Ct值分别为4.72、8.56、12.89、16.31、20.05、23.23、26.66、29.65、32.87和35.22,其中5.2 μl-1的Ct值高于35,其余的均小于35,说明利用实时荧光定量PCR可定量检测出质粒标准样品的最低浓度为5.2 × 101 μL-1.利用常规PCR检测上述10个浓度质粒标准样品时,5.2 × 109、5.2 × 108、5.2 × 107、5.2 × 106、5.2 × 105、5.2 × 104、5.2 × 103和5.2 × 102 μL-1的质粒标准样品可扩增出清晰的492 bp的目的条带(图 1),判定该方法检测最低浓度为5.2 × 102 μL-1.分析表明,利用实时荧光定量PCR检测CLCuMV的灵敏度约是常规PCR的10倍.
2.3 朱槿病株的CLCuMV定量检测
利用上述实时荧光定量PCR技术,对供试的朱槿上显症的嫩叶、成熟叶及对照进行CLCuMV定量检测.结果表明,显症的嫩叶和老熟叶片的Ct平均值分别为20.66 ± 0.89和22.70 ± 0.32,均可检测到病毒,但所有健康叶片样本的Ct值均大于35,未检测到病毒.根据试验所建立的检测朱槿的标准曲线,获得显症嫩叶和显症老熟叶片的CLCuMV浓度分别为(9.00 ± 3.80)× 105和(1.60 ± 0.25)× 105 μL-1,虽然后者小于前者,但两者间无显著性差异(t = - 2.173,P = 0.095).
2.4 烟粉虱虫体CLCuMV定量检测
利用实时荧光定量PCR对未饲毒和饲毒的单头烟粉虱虫体进行检测,结果表明对未经饲毒烟粉虱扩增的Ct值均大于35,说明对照中的烟粉虱不带毒;饲毒后24和48 h烟粉虱的扩增Ct值为32.44 ± 0.24和31.92 ± 0.73,说明饲毒24和48 h的烟粉虱均能检测到病毒,根据建立的检测烟粉虱标准曲线,推算出饲毒24和48 h的烟粉虱含有CLCuMV(4.0 ± 1.6)× 102和(1.3 ± 0.2)× 102 μL-1,前者显著性地大于后者(t = 2.445,P = 0.04).结果分析表明,利用实时荧光定量PCR可对介体内的CLCuMV进行定量检测.
3. 讨论与结论
本试验建立了一种用实时荧光定量PCR检测木尔坦棉花曲叶病毒的方法,本方法的灵敏度约是常规PCR的10倍,检测最低浓度达到5.2 × 101 μL-1.王洪星等[18]应用RT-PCR检测甘蔗黄叶病毒和高粱花叶病毒,检出水平分别为5 × 102和2.5 × 102 μL-1.李金磊等[19]建立的RT-PCR检测猪传染性胃肠炎病毒灵敏度可达5 × 101μL-1,与本试验灵敏度类似.
本研究利用实时荧光定量PCR检测寄主植物及介体昆虫的CLCuMV带毒量,检测的显症嫩叶与显症老熟叶片的CLCuMV含量并无显著差异.笔者还发现将烟粉虱转移到非番茄黄化曲叶病毒寄主植物上时,随着时间延长,昆虫体内番茄黄化曲叶病毒含量递减.本试验结果表明,饲毒24 h烟粉虱获毒量显著性地高于饲毒48 h烟粉虱获毒量,但CLCuMV在昆虫介体烟粉虱中的增殖情况还需要进一步的试验验证.
建立并完善CLCuMV的检测体系,将有助于比较CLCuMV在不同寄主植物中的传播情况,也可以监测CLCuMV在昆虫介体中的繁殖动态,最终有效预防木尔坦棉花曲叶病的传播.
-
图 1 C/N对混料腐解过程中水溶性有机碳(WSOC)以及可提取腐殖酸碳(HEC)、胡敏酸碳(HAC)和胡敏素碳(HuC)含量的影响
各图中相同C/N的不同柱子上方凡是具有一个相同小写字母者,表示不同腐解时间之间差异不显著(P>0.05,Duncan’s法)
Figure 1. Effects of C/N ratios on contents of water soluble organic carbon (WSOC), humic-extracted acid C(HEC), humic acid C(HAC) and humin C(HuC) extracted from the mixed materials during the decomposition process
图 4 pH对混料腐解过程中水溶性有机碳(WSOC)以及可提取腐殖酸碳(HEC)、胡敏酸碳(HAC)和胡敏素碳(HuC)含量的影响
各图中相同pH的不同柱子上方凡是具有一个相同小写字母者,表示不同腐解时间之间差异不显著(P>0.05,Duncan’s法)
Figure 4. Effects of pH values on contents of water-soluble organic carbon (WSOC), humic-extracted acid C(HEC), humic acid C(HAC) and humin C(HuC) extracted from the mixed materials during the decomposition process
-
[1] 徐玉坤, 孙向阳, 栾亚宁, 等. 园林废弃物堆肥红外光谱特性分析[J]. 土壤通报, 2014, 45(5): 1071-1076. [2] AMIR S, ABOUELWAFA R, MEDDICH A, et al. PLFAs of the microbial communities in composting mixtures of agro-industry sludge with different proportions of household waste[J]. Int Biodeter Biodegr, 2010, 64(7): 614-621.
[3] LI R, WANG J J, ZHANG Z Q, et al. Nutrient transformations during composting of pig manure with bentonite[J]. Bioresour Technol, 2012, 121: 362-368.
[4] 张强, 孙向阳, 任忠秀, 等. 调节C/N及添加菌剂与木酢液对园林绿化废弃物堆肥效果的影响[J]. 植物营养与肥料学报, 2012, 18(4): 990-998. [5] WU S H, SHEN Z Q, YANG C P, et al. Effects of C/N ratio and bulking agent on speciation of Zn and Cu and enzymatic activity during pig manure composting[J]. Int Biodeter Biodegr, 2017, 119: 429-436.
[6] GAO M , LIANG F , YU A, et al. Evaluation of stability and maturity during forced-aeration composting of chicken manure and sawdust at different C/N ratios[J]. Chemosphere, 2010, 78(5): 614-619.
[7] KAZEMI K, ZHANG B, LYE L M , et al. Design of experiment (DOE) based screening of factors affecting municipal solid waste (MSW) composting[J]. Waste Manage, 2016, 58: 107-117.
[8] YUAN X, REN F, ZENG G, et al. Adsorption of surfactants on a Pseudomonas aeruginosa strain and the effect on cell surface lypohydrophilic property[J]. Appl Microbiol Biotechnol, 2007, 76(5): 1189-1198.
[9] KULCU R, SÖNMEZ I, YALDIZ O, et al. Composting of spent mushroom compost, carnation wastes, chicken and cattle manures[J]. Bioresour Technol, 2008, 99(17): 8259-8264.
[10] ZHU N W. Effect of low initial C/N ratio on aerobic composting of swine manure with rice straw[J]. Bioresour Technol, 2007, 98(1): 9-13.
[11] 吴阳, 徐乐中, 梅娟. C/N调控对园林绿化废弃物堆肥效果的影响[J]. 安全与环境工程, 2016, 23(1): 64-69. [12] ZHANG L, SUN X. Improving green waste composting by addition of sugarcane bagasse and exhausted grape marc[J]. Bioresour Technol, 2016, 218: 335-343.
[13] 王帅, 李昕洋, 于楠楠, 等. 不同玉米栽培模式对中温带典型暗棕壤腐殖质组成的短期影响[J]. 东北林业大学学报, 2016, 44(4): 54-59. [14] 褚慧, 宗良纲, 汪张懿, 等. 不同种植模式下菜地土壤腐殖质组分特性的动态变化[J]. 土壤学报, 2013, 50(5): 931-939. [15] 葛顺峰, 周乐, 李红娜, 等. 土壤C/N对苹果植株生长及氮素利用的影响[J]. 中国生态农业学报, 2013, 21(7): 795-800. [16] 张雪辰, 邓双, 杨密密, 等. 畜禽粪便堆腐过程中有机碳组分与腐熟指标的变化[J]. 环境科学学报, 2014, 34(10): 2559-2565. [17] 孙晓杰, 王洪涛, 陆文静, 等. 粪渣与树叶静态好氧共堆肥的最佳配比[J]. 清华大学学报(自然科学版), 2009, 49(12): 1988-1991. [18] 刘卫, 袁兴中, 欧阳建新, 等. 利用污泥熟肥作为高含水率污泥堆肥调理剂[J]. 环境工程学报, 2013, 7(6): 2349-2354. [19] 王帅, 王楠, 窦森, 等. 真菌及混合菌对锯木屑类腐殖质形成和转化的影响[J]. 水土保持学报, 2012, 26(1): 227-231. [20] 姬红利, 颜蓉, 吴永红, 等. 秸秆粪便生物水解好氧堆肥处理研究及应用[J]. 安徽农业科学, 2010, 38(13): 6885-6888. [21] 陈鲜妮, 来航线, 田霄鸿, 等. 接种微生物条件下牛粪+麦秸堆腐过程有机组分的动态变化[J]. 农业环境科学学报, 2009, 28(11): 2417-2421. [22] 张亚宁, 李国学. 化肥作为补充N源对堆肥碳素转化和污染物去除的影响[J]. 农业环境科学学报, 2005, 24(1): 154-157. [23] WEBER J, KARCZEWSKA A, DROZD J, et al. Agricultural and ecological aspects of a sandy soil as affected by the application of municipal solid waste composts[J]. Soil Biol Biochem, 2007, 39(6): 1294-1302.
[24] ZHOU Y, SELVAM A, WONG J W, et al. Evaluation of humic substances during co-composting of food waste, sawdust and Chinese medicinal herbal residues[J]. Bioresour Technol, 2014, 168: 229-234.
[25] 赵建荣, 高德才, 汪建飞, 等. 不同C/N下鸡粪麦秸高温堆肥腐熟过程研究[J]. 农业环境科学学报, 2011, 30(5): 1014-1020. [26] 郑卫聪, 王俊, 王晓明, 等. 不同堆置措施对园林有机废弃物堆肥有机物降解的影响[J]. 华南农业大学学报, 2012, 33(1): 28-32. [27] 张红, 吕家珑, 曹莹菲, 等. 不同植物秸秆腐解特性与土壤微生物功能多样性研究[J]. 土壤学报, 2014, 51(4): 743-752. [28] 付利波, 计思贵, 苏帆, 等. EM 菌对不适用鲜烟叶堆腐过程中腐殖质组分的影响[J]. 云南农业大学学报(自然科学版), 2015, 30(4): 607-611. [29] 张蓓. 碳氮比及腐熟菌剂对玉米秸秆发酵的影响[D]. 兰州: 甘肃农业大学, 2012. [30] 吴景贵, 王明辉, 姜亦梅, 等. 玉米秸秆还田后土壤胡敏酸变化的谱学研究[J]. 中国农业科学, 2005, 38(7): 1394-1400. [31] 邓荀, 郭卫东, 卓健富. pH值对雨水中溶解有机物荧光光谱特征的影响[J]. 光谱学与光谱分析, 2012, 32(1): 137-141. [32] NAKASAKI K, YAGUCHI H, SASAKI Y, et al. Effects of pH control on composting of garbage[J]. Waste Manage Res, 1993, 11(2): 117-125.
[33] 姜海. 吉林玉米带土壤腐殖质组成及其与土壤酸度的关系[D]. 长春: 吉林农业大学, 2013. [34] 刘小宁, 马剑英, 孙伟, 等. 高山植物稳定碳同位素沿海拔梯度响应机制的研究进展[J]. 山地学报, 2010, 28(1): 37-46. [35] 王海斌, 叶江华, 陈晓婷, 等. 连作茶树根际土壤酸度对土壤微生物的影响[J]. 应用与环境生物学报, 2016, 22(3): 480-485.




 下载:
下载: