Preparation of bacterial agent based on Bacillus subtilis BSF01 and its biodegradation effect on beta-cypermethrin
-
摘要:目的
制备高效氯氰菊酯(β-CP)的降解菌菌剂。
方法将前期分离驯化的β-CP高效降解菌株枯草芽孢杆菌Bacillus subtilis BSF01,通过各助剂成分及含量优化,获得菌剂最佳配方。采用室内模拟试验,检验该菌剂对土壤中β-CP的降解效果。
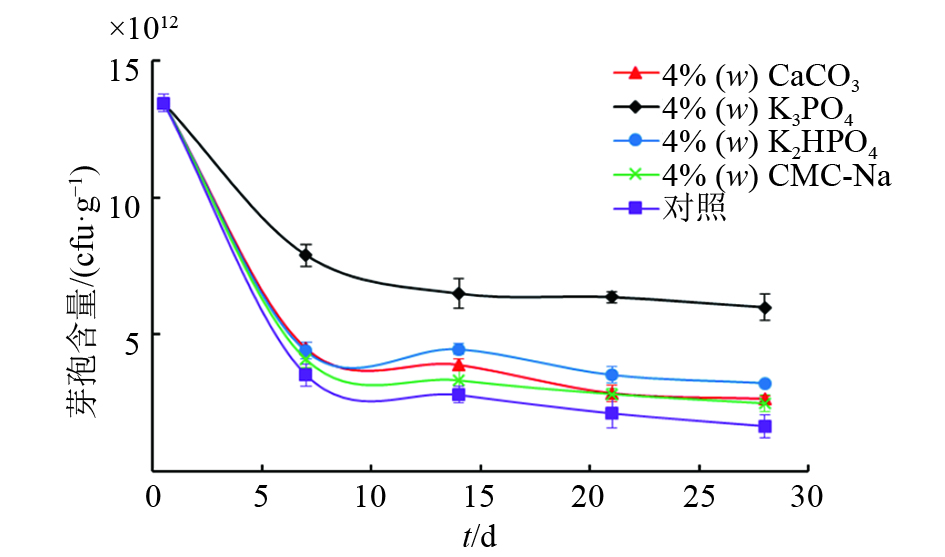
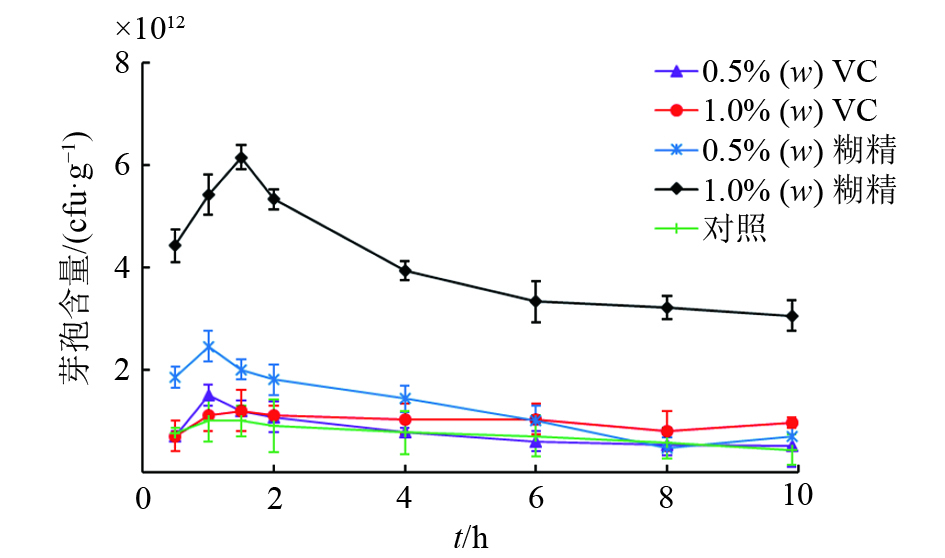
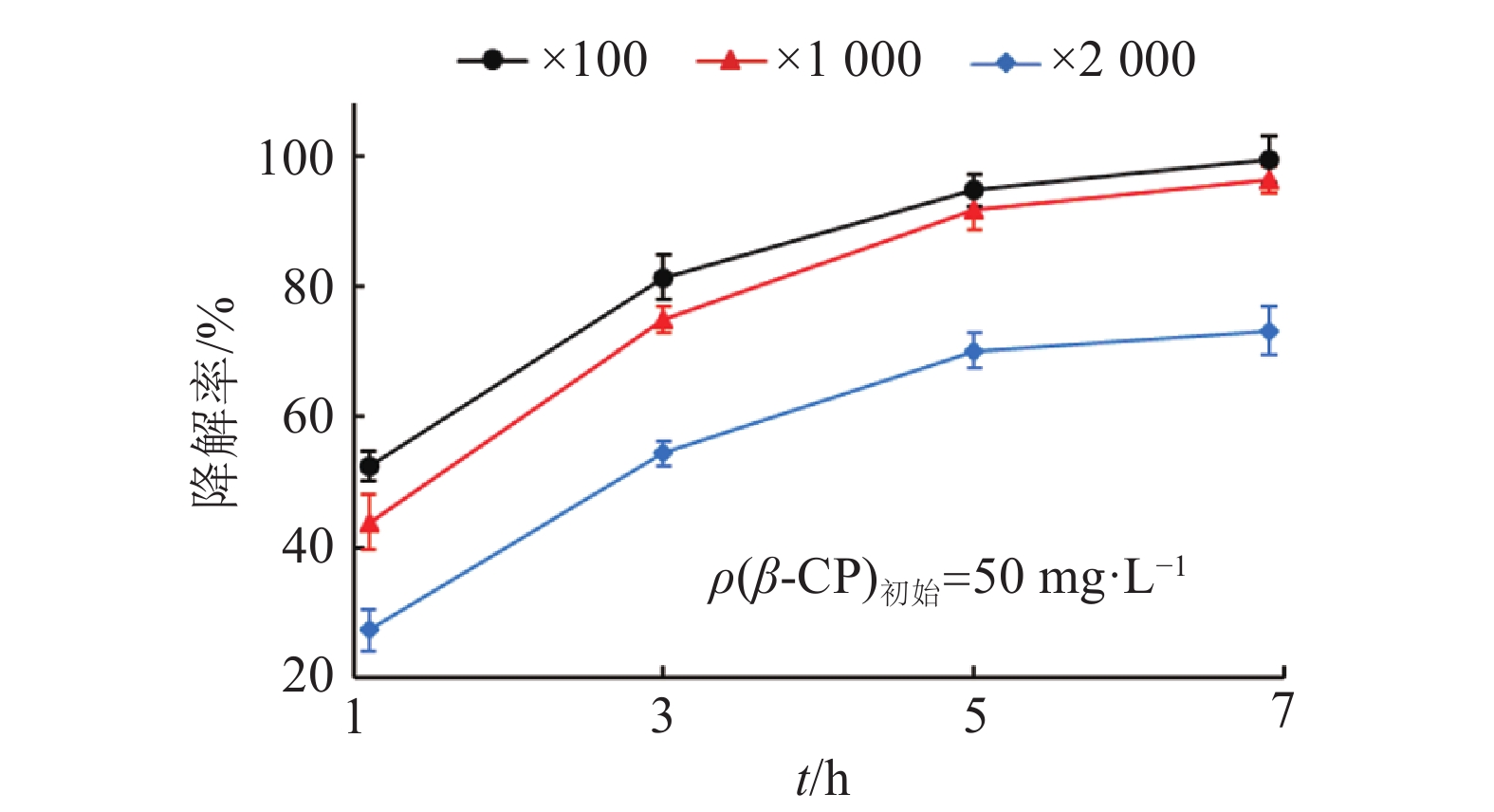
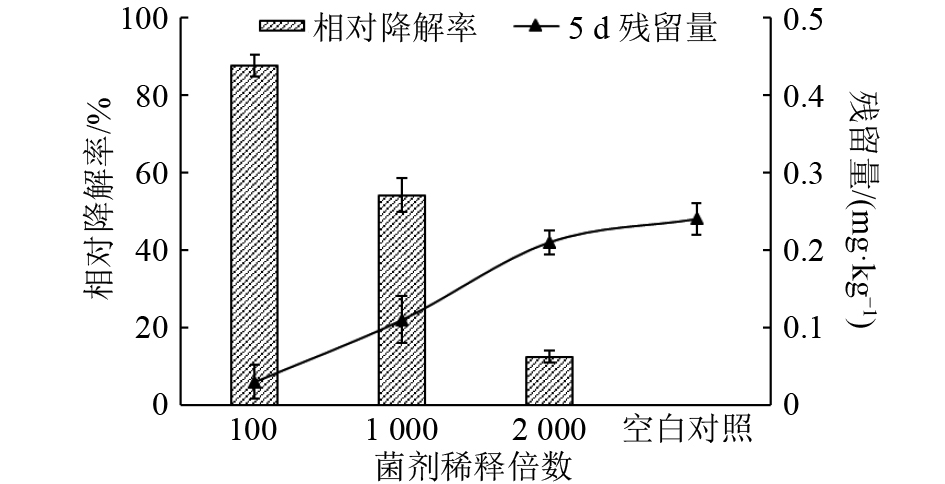
结果试验明确了BSF01菌剂的最佳配方为:以w为30%的BSF01菌粉为主体,添加w为5%的十二烷基苯磺酸钠作为润湿剂、w为7 %的阿拉伯树胶为分散剂、w为4%的磷酸钾为稳定剂和w为1%的糊精为保护剂,并补足载体高岭土至w为100%。该菌剂主要质量指标的检测结果表明,BSF01菌剂芽孢含量为6.50×1011 cfu·g–1,含水量(w)≤0.6%,细度≥99%,润湿时间为32.0 s,悬浮率为78.0%,符合国家标准。将BSF01菌剂稀释100、1 000及2 000倍后,分别投入受β-CP污染的田间土壤,5 d后,以100倍菌剂稀释液处理的土壤中β-CP降解率达到87.50%,有效降低了土壤中β-CP的残留水平。
结论枯草芽孢杆菌BSF01菌剂可成为消除农田拟除虫菊酯类农药残留污染的高效安全生物制品。
Abstract:ObjectiveTo prepare a bacterial agent that is able to degrade beta-cypermethrin (β-CP).
MethodBased on previously isolated and cultured Bacillus subtilis BSF01 which had excellent potential in rapidly degrading β-CP, the bacterial formulation was determined by optimizing additives and dosage. The degrading ability of prepared bacterial agent was evaluated in β-CP-contaminated soil under laboratory conditions.
ResultThe optimal formulation was determined to blend 30% bacterial powder with 5% sodium dodecyl benzene sulfonate as wetting agent, 7% acacia gum as dispersant and 4% potassium phosphate as stabilizer, appending kaolin as the carrier to 100%. The quality assessment verified that the spore intensity of prepared bacterial agent reached 6.50×1011 cfu·g–1 with low water content (≤0.6%), high fineness (≥99%), short wetting time (32 s) and 78% suspensibility. The prepared agent was sprayed on β-CP-contaminated soil by diluting to 100, 1 000 and 2 000 times, respectively. After five days, about 87.50% of residual β-CP in soil was degraded by bacterial agent at 100-fold dilution, which rapidly decreased the residual level of β-CP in soil.
ConclusionThe prepared β-CP bacterial agent exhibits outstanding potential in realistic application with further optimization, which may provide an effective, safe and promising bacterial product for eliminating pyrethroid contamination in agricultural environment.
-
Keywords:
- beta-cypermethrin /
- Bacillus subtilis /
- biodegradation /
- bacterial agent /
- pestiside
-
华南地区属亚热带季风气候,高温多雨,山地丘陵比例高,赤红壤分布广泛。新开垦的果园普遍存在土壤肥力低下、水土流失严重和偏酸等问题[1]。传统果园清耕模式地表裸露较多,水土流失严重,果园地力退化,病虫、杂草危害多,农药使用量大[2],这不仅对生态环境造成危害,也严重制约了果园的可持续发展。果园间作是针对传统果园土壤潜在负面危害采取的重要管理措施,20世纪70年代已成为生态果园建设的主流模式[3]。间作能有效改善果园生态环境[4],提高土壤有机质、氮、磷、钾含量和阳离子交换量[5-6],显著降低土壤容重,增加土壤孔隙度[7],增强土壤微生物及酶活性[8-9]。氮素作为果树生长发育必须的大量元素之一[10],在果树的生长及果实产量和品质提高等方面起着重要作用[11]。施用氮肥可以获得明显的增产效果,但氮肥在土壤中被植物吸收利用率低于50%[12]。研究表明,间作模式可以增加土壤氮素水平,提高氮素的有效利用率[13],从而减轻氮素流失对环境污染的负荷。本研究选取华南地区典型的具有固氮能力的经济作物花生Arachis hypogaea、非固氮能力的禾本科牧草黑麦草Lolium perenne和优良牧草柱花草Stylosanthes guianensis为研究对象,将这3种作物间作在华南幼龄龙眼 Dimocarpus longan 园中,探索幼龄果园间作豆科作物(花生、柱花草)和非豆科作物(黑麦草)对土壤氮素不同组分的影响,为果园土壤氮的有效管理及果园土壤质量的提高提供理论依据。
1. 材料与方法
1.1 试验地概况
试验于2015年8月—2016年7月在华南农业大学增城教学科研基地的幼龄龙眼园(龙眼树于2013年种植)进行,E113°38′,N23°14′,海拔30 m,属亚热带季风气候,年平均气温21.7 ℃,高温月为7—8月,低温月为1—2月(11月下旬至翌年2月中旬出现霜冻)。全年10 ℃以上的积温7 000.0~7 910.9 ℃,年平均降水量为1 967.8 mm,集中在5—7月,11月到翌年3月为旱季,年平均太阳辐射值为4 482.3 MJ·m–2,年平均日照时数为1 707.2 h。
试验地土壤类型为花岗岩风化物发育而成的赤红壤,耕层土壤0~10 cm,pH 5.51,有机质和全氮分别为18.21和1.29 g·kg–1,碱解氮、有效磷和速效钾分别为75.57、18.32 和 25.22 mg·kg–1。
1.2 试验设计
试验采用完全随机区组设计,共设4个处理:龙眼园清耕(CK)、龙眼园间作花生(Dl/Ah)、龙眼园间作柱花草(Dl/Sg)和龙眼园间作黑麦草(Dl/Lp),每个处理重复3次,对照区定期将地上杂草清除并返还到土壤中。各小区面积均为9 m×16 m,每小区6棵龙眼树,龙眼树株行距5 m×6 m。花生株(穴)行距20 cm×25 cm,每穴2粒。柱花草和黑麦草均采用拌土条播,其中柱花草播种行距50 cm,黑麦草播种行距25 cm。播种前全园施用挪威复合肥[m(N)∶m(P2O5)∶m(K2O)=15∶15∶15] 600 kg·hm–2 (基肥一次性施入),整个生育期间不再追肥。花生收获后,将花生、柱花草和黑麦草秸秆全部切断归还于原来的小区。
1.3 采样方法
在花生苗期、花针期、成熟期采用S型五点混合取样法,分别取各小区0~10 cm土层的土壤,带回实验室4 ℃保存。样品处理时,剔除活体根系、石块等杂物,将土壤样品分成2等份:一份过2 mm筛后置于4 ℃冰箱恒温保存,进行土壤微生物生物量氮、铵态氮、硝态氮、溶解性有机氮等含量的测定;一份自然风干,通过1 mm筛后在常温下保存,供土壤有机质、碱解氮、全氮含量的测定。花生成熟期分别在各间作小区内随机取3个1 m×1 m样方的间作作物地上部分茎和叶,带回室内放入鼓风干燥箱,105 ℃杀青30 min后,85 ℃烘干至恒质量,称其质量,粉碎后用于测定间作作物植株的碳、氮含量(注:2016年黑麦草是在5月底取样,因为花生成熟期时,黑麦草已枯死)。
1.4 测定方法
土壤容重采用环刀法测定;土壤有机质和植株碳含量均采用重铬酸钾容量法测定;土壤全氮和植株氮含量均采用凯氏定氮法测定;土壤碱解氮采用碱解扩散法测定;土壤NO3––N采用还原蒸馏法测定[14]。土壤微生物生物量氮(MBN)采用氯仿熏蒸–提取法测定[15];土壤溶解性有机氮(DON)用0.5 mol·L–1K2SO4溶液浸提新鲜土壤[m(土)∶m(液)= 1∶5],然后用SKALAR流动分析仪(SAN++,荷兰)进行测定[16]。
1.5 统计方法
所有数据经Excel 软件处理后,用 SPSS 21.0 软件进行统计分析,采用 Origin 8.1 作图。处理间差异采用单因素方差分析(One-way ANOVA)和Duncan’s法检验。用Pearson法(若数据符合正态分布)或Spearman法(若数据不符合正态分布)分析植株碳、氮含量、碳氮比、生物量与土壤N组分含量的相关关系,显著性水平均设为P<0.05。
2. 结果与分析
2.1 幼龄果园间作对土壤容重和有机质含量的影响
2015年秋季,在花生3个生长时期,4个处理土壤容重表现为:CK>Dl/Lp>Dl/Sg>Dl/Ah,其中Dl/Sg和Dl/Ah土壤容重均显著低于对应时期的CK(P<0.05)(表1)。2016年春季花生苗期和花针期,与CK相比,Dl/Sg和Dl/Ah处理均显著降低了土壤容重;成熟期,仅Dl/Ah土壤容重显著低于CK(P<0.05)。说明果园间作花生和柱花草降低了土壤容重,提高了土壤的通气性。
表 1 幼龄果园间作不同作物处理下土壤容重和有机质含量1)Table 1. The soil bulk density and organic matter contents in different intercropping systems in young orchard年份 花生生长期 容重/(g·cm–3) w(有机质)/(g·kg–1) CK Dl/Ah Dl/Sg Dl/Lp CK Dl/Ah Dl/Sg Dl/Lp 2015 苗期 1.53±0.09a 1.25±0.06b 1.26±0.05b 1.41±0.05ab 19.80±1.05a 21.04±1.79a 21.85±1.74a 20.52±0.01a 花针期 1.61±0.09a 1.35±0.03b 1.43±0.01ab 1.56±0.06a 18.21±0.11c 23.58±0.78a 21.26±1.47ab 20.54±0.41bc 成熟期 1.45±0.07a 1.23±0.06b 1.26±0.01b 1.36±0.02ab 17.98±0.18b 20.89±1.57ab 21.27±0.81a 18.88±0.51ab 2016 苗期 1.54±0.01a 1.30±0.04b 1.31±0.09b 1.51±0.08ab 19.96±0.42a 21.66±1.38a 22.69±0.93a 20.31±0.70a 花针期 1.78±0.05a 1.50±0.10b 1.56±0.03b 1.63±0.05ab 20.27±0.63b 22.70±0.29a 22.87±0.35a 20.19±0.26b 成熟期 1.63±0.06ab 1.45±0.04c 1.49±0.02bc 1.66±0.07a 18.21±0.11b 24.08±1.50a 24.82±0.93a 19.04±0.34b 1)相同指标同行数据后凡是有一个相同小写字母者,表示不同处理间差异不显著(P>0.05,Duncan’s 法)。 2季花生花针期和2016年春季花生成熟期,Dl/Ah和Dl/Sg处理土壤有机质含量均显著高于对应时期的CK(P<0.05)(表1)。2015年秋季花生成熟期,Dl/Sg处理土壤有机质含量比CK显著提高18.3%(P<0.05)。说明果园间作花生和柱花草能明显提高土壤有机质含量。
2.2 幼龄果园间作对土壤全氮及氮组分含量的影响
2.2.1 全氮(TN) 由图1可以看出,2015年秋季花生成熟期,Dl/Ah和Dl/Sg处理土壤TN含量分别比CK显著提高25.5%和19.4%(P<0.05)。2016年春季在花生3个生长时期,4个处理土壤TN含量均表现为:Dl/Ah>Dl/Sg>Dl/Lp>CK,且在花生花针期和成熟期,Dl/Ah和Dl/Sg土壤TN含量均显著高于对应时期的CK和Dl/Lp(P<0.05);花针期,Dl/Ah和Dl/Sg土壤TN含量分别比CK显著提高90.1%和75.8%(P<0.05);成熟期,Dl/Ah和Dl/Sg土壤TN含量分别比CK显著提高72.6%和61.8%(P<0.05)。说明幼龄果园间作花生和柱花草有助于提高土壤全氮含量,间作花生对土壤全氮含量的提升幅度较大,但间作黑麦草对土壤全氮含量提高效果不明显。
2.2.2 碱解氮(AN) 由图2可以看出,2015年秋季和2016年春季,除花生苗期外,4个处理土壤AN含量均表现为:Dl/Ah>Dl/Sg>Dl/Lp>CK。两季花生花针期,Dl/Ah处理土壤AN含量分别比对应时期的CK显著提高27.5%和18.4%(P<0.05)。
2.2.3 硝态氮(NO3––N) 由图3可知,在2015 年秋季花生花针期,Dl/Ah 处理土壤NO3––N 含量显著高于其他3个处理(P<0.05),Dl/Ah比CK显著提高31.2%,但Dl/Sg和Dl/Lp处理土壤NO3––N含量与CK差异不明显(P>0.05);2015年秋季成熟期,Dl/Sg处理土壤NO3––N含量比CK显著提高了17.4% (P<0.05)。2016年春季花针期,Dl/Ah和Dl/Sg处理土壤NO3––N含量分别比CK显著提高64.4%和34.2%(P<0.05),但Dl/Lp与CK差异不显著(P>0.05)。说明果园间作花生和柱花草可显著提高土壤硝态氮含量,且间作花生对土壤硝态氮的改善效果较好。
2.2.4 溶解性有机氮(DON) 由图4可以看出,2015年秋季花生花针期,Dl/Ah和Dl/Sg土壤DON含量分别比CK显著提高69.9%和64.5%(P<0.05),但Dl/Ah与Dl/Sg处理无显著性差异(P>0.05)。2016年春季花生苗期和成熟期,与CK相比,Dl/Ah和Dl/Sg均显著提高了土壤DON含量,且Dl/Ah土壤DON含量(47.28、19.39 mg·kg–1)高于Dl/Sg(36.03、19.04 mg·kg–1);而Dl/Lp土壤DON含量与CK差异不显著(P>0.05)。说明果园间作花生和柱花草均能显著提高土壤溶解性有机氮含量,且间作花生对土壤DON提高幅度较大。
2.2.5 微生物生物量氮(MBN) 由图5可以看出,2015年秋季花生成熟期,Dl/Sg、Dl/Ah和Dl/Lp土壤MBN含量均显著高于CK(P<0.05),分别比CK高21.5%、36.6%和36.1%。花针期,Dl/Ah土壤MBN含量显著低于其他3个处理(P<0.05),这可能是由于花生在此时期由营养生长向生殖生长转化,需要吸收大量的养分。2016年春季花生成熟期,各间作处理土壤MBN含量均显著高于CK(P<0.05),依次为:Dl/Sg>Dl/Ah>Dl/Lp>CK,且Dl/Sg、Dl/Ah土壤MBN含量显著高于Dl/Lp处理(P<0.05)。可见,果园间作花生、柱花草和黑麦草均能在不同程度上增加土壤MBN含量,间作柱花草对土壤MBN含量提升效果最好,其次是花生。
2.3 幼龄果园间作作物生物量和植株碳、氮含量的变化
2季花生成熟期,柱花草的生物量均显著高于对应时期的黑麦草和花生(P<0.05)(表2);2016年春季,黑麦草的生物量显著高于花生(P<0.05),但2015年秋季二者差异不显著(P>0.05)。花生和柱花草植株N含量均显著高于对应时期的黑麦草(P<0.05),3种作物植株C含量差异不显著(P>0.05)。3种作物的植株C/N差异显著(P<0.05),2季均依次黑麦草>柱花草>花生。
表 2 幼龄果园不同间作作物的植株生物量以及碳、氮含量1)Table 2. The above ground biomass, carbon and nitrogen contents of different intercropping plants in young orchard年份 间作作物 生物量/(t·hm–2) w(C)/% w(N)/% C/N 2015 花生 5.26±0.68b 42.48±0.31a 4.42±0.03a 9.61±0.18c 柱花草 14.45±1.66a 42.80±0.09a 3.39±0.12b 12.67±0.85b 黑麦草 3.31±0.53b 42.99±0.89a 2.28±0.14c 18.99±1.63a 2016 花生 4.03±0.41c 41.50±0.84a 4.11±0.22a 10.13±0.71c 柱花草 24.35±3.42a 41.23±0.49a 3.25±0.07b 12.71±0.38b 黑麦草 11.44±0.21b 42.65±0.82a 2.22±0.07c 19.27±0.63a 1)取样时间为花生成熟期;相同年份、同列数据后具有一个相同小写字母者,表示处理间差异不显著(P>0.05,Duncan’s 法)。 2.4 间作作物植株碳、氮含量以及生物量与土壤N组分含量的相关关系
土壤全氮(TN)、溶解性有机氮(DON)和NO3––N含量均与植株C含量和植株C/N呈显著(P<0.05)或极显著负相关(P<0.01),与植株N含量呈显著(P<0.05)或极显著正相关(P<0.01)(表3)。说明间作作物的植株C、N含量以及C/N对土壤的TN、DON、NO3––N含量有显著影响。
表 3 不同间作作物植株C、N含量、生物量与土壤N组分含量的相关系数1)Table 3. Correlation coefficients between the contents of nitrogen component in soil and the biomass, carbon and nitrogen contents of different intercropping plants指标 土壤 N 组分1) TN AN MBN DON NO3––N 植株 C 含量 –0.867** –0.533 –0.133 –0.700* –0.750* 植株 N 含量 0.892** 0.296 0.312 0.839** 0.716* 植株 C/N –0.853** –0.317 0.154 –0.746* –0.691* 植株生物量 –0.333 –0.300 0.383 –0.117 0.100 1) TN:全氮,AN: 碱解氮,MBN:微生物生物量氮,DON:溶解性有机氮;*和**分别表示 0.05 和 0.01 水平显著相关。 3. 讨论和结论
3.1 幼龄果园间作对土壤全氮和氮组分含量的影响
氮是植物生长发育所需的大量营养元素之一,对作物生长和高产起着重要的作用[17]。本研究结果表明,幼龄果园间作花生和柱花草能明显提高土壤全氮和碱解氮含量,且间作花生对土壤全氮和碱解氮的提升效果最明显。这与章家恩等[1]研究结果一致,幼龄果园间作豆科牧草能更好地促进土壤氮的固定,而间作非豆科作物(黑麦草)对土壤全氮和碱解氮没有显著影响。
土壤硝态氮是土壤中一个重要的有效氮组分,其含量占无机态氮总量的91%,可被植物直接吸收利用,对作物生长起着重要作用[18]。土壤中硝态氮极易溶于水,可以随水流失,也可以在反硝化细菌的作用下形成N2或N2O释放到大气中[19],导致土壤中的硝态氮含量下降。邹亚丽等[20]的研究表明,幼龄樱桃园间作三叶草土壤硝态氮含量比对照显著提高127.5%。本研究结果表明果园间作花生和柱花草明显提高了土壤硝态氮含量,但间作黑麦草并没有明显改变硝态氮含量,导致这一结果的可能原因:1)花生和柱花草通过固氮作用增加了土壤中的硝态氮含量[21];2)黑麦草氮素吸收量与土壤硝态氮含量呈显著正相关关系[22],说明黑麦草生长过程中以硝态氮为主要氮源,从而导致间作黑麦草处理土壤中的硝态氮含量较低。间作花生对土壤硝态氮的改善效果较好是因为花生的生物量低于柱花草,使其从土壤中吸收的硝态氮量也相对较少。
土壤中溶解性有机氮(DON)主要来源于新近凋落物和土壤腐殖质,其中新鲜凋落物对DON有显著影响[23]。Casals等[24]观察到松林土壤沥出液中绝大部分DON都来自于新近的凋落物层。本研究发现,幼龄龙眼园间作豆科作物明显提高了土壤DON含量,而间作禾本科作物黑麦草的效果不显著。这是因为:1)花生和柱花草都属豆科植物,具有固氮作用,同时花生的分泌物能增加土壤微生物群落物种的丰富度和均匀度[25],促进微生物活动与生长,为土壤DON的生成提供更多的物质基础;2)柱花草的生物量大于黑麦草的生物量,生物量及凋落物的增加,促进了土壤DON含量的提高。
土壤微生物生物量氮(MBN)作为土壤有机质中最活跃的一部分,是土壤养分转化过程中一个重要的源和库,在调节土壤养分保持与供应方面具有不可忽视的作用[26]。有研究表明,在贫瘠土壤种植植物后,土壤MBN含量显著提高[27]。Peacock等[28]认为有机质输入量越大,土壤MBN含量越高。本研究中幼龄果园间作 3 种作物后显著提高了土壤 MBN 含量。 3 个间作处理中间作柱花草的土壤 MBN 含量最高,这是由于柱花草生物量大,凋落物和残茬数量大,为土壤微生物提供更多的有机质。
3.2 间作作物植株养分含量、生物量与土壤N组分含量的相关关系
本研究结果表明,土壤全氮(TN)、溶解性有机氮(DON)、硝态氮(NO3––N)含量均与间作作物植株C含量、植株C/N呈显著或极显著负相关关系,而与植株N含量呈显著或极显著正相关关系。说明在幼龄果园间作植株N含量高而C/N小的作物(花生、柱花草)有利于土壤TN、DON和NO3––N含量的提高。这是因为植物残体的分解过程受到植物本身总氮量、木质素含量以及C/N大小的控制[29-30],总氮量越高、C/N比越低的植物其分解速率越快[31]。
3.3 结论
幼龄龙眼园间作花生和柱花草对提高土壤全氮(TN)、碱解氮(AN)、硝态氮(NO3––N)、溶解性有机氮(DON)和微生物生物量氮(MBN)的效果优于间作禾本科作物黑麦草,其中间作花生对提高土壤 TN、DON和NO3––N 含量的效果最好,间作柱花草后土MBN含量增加幅度最大。土壤 TN、DON和NO3––N 含量与间作作物植株 C 含量、C/N 呈显著负相关关系,与植株 N 含量呈显著正相关关系。表明幼龄果园间作花生和柱花草可明显提高土壤全氮和氮组分含量,这 2 种间作模式是幼龄果园增加土壤氮素水平、增加果园地表覆盖面积和减少水土流失的重要生态农业种植模式,其中幼龄果园间作花生模式的效果更佳。
-
表 1 添加不同种类及质量分数润湿剂后BSF01菌剂的润湿时间和芽孢含量1)
Table 1 The wetting time and spore intensity of strain BSF01 agent with different types and contents of wetting agents
润湿剂 t润湿/s 芽孢含量/(×1013 cfu·g–1) 3% 5% 7% 3% 5% 7% SDBS 32.0±1.2a 31.2±1.1a 30.4±0.6a 3.3±0.3a 4.8±0.4a 4.4±0.8a 洗衣粉 16.8±1.6b 10.4±0.9b 10.6±1.1b 2.8±0.1a 2.3±0.5b 1.9±0.2b SDS 11.2±0.5c 9.6±1.2b 9.0±0.8b 1.6±0.1b 1.3±0.2c 1.2±0.1c 对照 32.6±0.2a 32.6±0.2a 32.6±0.2a 1.3±0.2b 1.3±0.2c 1.3±0.2c 1)表中数据为3次重复的平均值±标准误,同列数据后凡是有一个相同小写字母者,表示差异不显著(P>0.05,Duncan’s 法) 表 2 添加不同种类及质量分数分散剂后BSF01菌剂的悬浮率和芽孢含量1)
Table 2 The suspending rate and spore intensity of strain BSF01 agent with different types and contents of dispersants
分散剂 悬浮率/% 芽孢含量/(×1012 cfu·g–1) 3% 5% 7% 3% 5% 7% PEG-8000 49.0±3.6b 58.0±4.0b 59.0±3.3b 8.3±0.7a 8.0±0.6a 7.7±0.4a 阿拉伯树胶 65.0±5.2a 67.0±2.6a 77.0±4.1a 9.7±0.5a 10.0±0.6a 8.0±0.9a PVA 46.0±4.1b 52.0±2.2b 56.0±3.5b 0.4±0.1b 0.5±0.1b 0.6±0.2b 1)表中数据为3次重复的平均值±标准误,同列数据后凡是有一个相同小写字母者,表示差异不显著(P>0.05,Duncan’s 法) -
[1] KOLACZINSKI J H, CURTIS C F. Chronic illness as a result of low-level exposure to synthetic pyrethroid insecticides: A review of the debate[J]. Food Chem Toxicol, 2004, 42(5): 697-706.
[2] CASIDA J E. Pyrethrum flowers and pyrethroid insecticides[J]. Environ Health Persp, 1980, 34: 189-202.
[3] XIAO Y, CHEN S, GAO Y, et al. Isolation of a novel beta-cypermethrin degrading strain Bacillus subtilis BSF01 and its biodegradation pathway[J]. Appl Microbiol Biot, 2015, 99(6): 2849-2859.
[4] FIELD L M, EMYR DAVIES T G, O’REILLY A O, et al. Voltage-gated sodium channels as targets for pyrethroid insecticides[J]. Eur Biophys J, 2017, 46(7): 675-679.
[5] HANSEN M R H, J RS E, LANDER F, et al. Neurological deficits after long-term pyrethroid exposure[J]. Environ Health Insights, 2017. doi: 10.1177/1178630217700628
[6] JOHNSTONE A F M, STRICKLAND J D, CROFTON K M, et al. Effects of an environmentally relevant mixture of pyrethroid insecticides on spontaneous activity in primary cortical networks on microelectrode arrays[J]. Neurotoxicology, 2017, 60: 234-239.
[7] CORCELLAS C, ELJARRAT E, BARCEL D. First report of pyrethroid bioaccumulation in wild river fish: A case study in Iberian river basins (Spain)[J]. Environ Int, 2015, 75: 110-116.
[8] MUGGELBERG L L, HUFF HARTZ K E, NUTILE S A, et al. Do pyrethroid-resistant Hyalella azteca have greater bioaccumulation potential compared to non-resistant populations? Implications for bioaccumulation in fish[J]. Environ Pollut, 2017, 220(Pt A): 375-382.
[9] HUGHES M F, ROSS D G, STARR J M, et al. Environmentally relevant pyrethroid mixtures: A study on the correlation of blood and brain concentrations of a mixture of pyrethroid insecticides to motor activity in the rat[J]. Toxicology, 2016, 359/360: 19-28.
[10] AZNAR-ALEMANY Ò, ELJARRAT E, BARCEL D. Effect of pyrethroid treatment against sea lice in salmon farming regarding consumers’ health[J]. Food Chem Toxicol, 2017, 105: 347-354.
[11] CYCOŃ M, PIOTROWSKA-SEGET Z. Pyrethroid-degrading microorganisms and their potential for the bioremediation of contaminated soils: A review[J]. Front Microbiol, 2016. doi: 10.3389/fmicb.2016.01463
[12] TRAN N H, URASE T, NGO H H, et al. Insight into metabolic and cometabolic activities of autotrophic and heterotrophic microorganisms in the biodegradation of emerging trace organic contaminants[J]. Bioresource Technol, 2013, 146(10): 721-731.
[13] CYCOŃ M, MROZIK A, PIOTROWSKA-SEGET Z. Bioaugmentation as a strategy for the remediation of pesticide-polluted soil: A review[J]. Chemosphere, 2017, 172: 52-71.
[14] XIAO Z J, LIU P H, QIN J Y, et al. Statistical optimization of medium components for enhanced acetoin production from molasses and soybean meal hydrolysate[J]. Appl Microbiol Biot, 2007, 74(1): 61-68.
[15] 中华人民共和国国家质量监督检验检疫总局. 农药可湿性粉剂润湿性测定方法: GB/T 5451—2001[S]. 北京: 中国标准出版社, 2001. [16] 中华人民共和国国家质量监督检验检疫总局. 农用微生物菌剂: GB 20287—2006[S]. 北京: 中国标准出版社, 2006. [17] LIU J, HUANG W, HAN H, et al. Characterization of cell-free extracts from fenpropathrin-degrading strain Bacillus cereus ZH-3 and its potential for bioremediation of pyrethroid-contaminated soils[J]. Sci Total Environ, 2015, 523: 50-58.
[18] CHEN S, CHANG C, DENG Y, et al. Fenpropathrin biodegradation pathway in Bacillus sp. DG-02 and its potential for bioremediation of pyrethroid-contaminated soils[J]. J Agr Food Chem, 2014, 62(10): 2147-2157.
[19] FERNANDEZ-FONTAINA E, PINHO I, CARBALLA M, et al. Biodegradation kinetic constants and sorption coefficients of micropollutants in membrane bioreactors[J]. Biodegradation, 2013, 24(2): 165-177.
[20] DUAN H, KOE L C C, YAN R, et al. Biological treatment of H2S using pellet activated carbon as a carrier of microorganisms in a biofilter[J]. Water Res, 2006, 40(14): 2629-2636.
[21] ZHU S M, DENG Y L, RUAN Y J, et al. Biological denitrification using poly(butylene succinate) as carbon source and biofilm carrier for recirculating aquaculture system effluent treatment[J]. Bioresource Technol, 2015, 192: 603-610.
[22] WEN D, ZHANG J, XIONG R, et al. Bioaugmentation with a pyridine-degrading bacterium in a membrane bioreactor treating pharmaceutical wastewater[J]. J Environ Sci, 2013, 25(11): 2265-2271.



 下载:
下载: