Preparation of bacterial agent based on Bacillus subtilis BSF01 and its biodegradation effect on beta-cypermethrin
-
摘要:目的
制备高效氯氰菊酯(β-CP)的降解菌菌剂。
方法将前期分离驯化的β-CP高效降解菌株枯草芽孢杆菌Bacillus subtilis BSF01,通过各助剂成分及含量优化,获得菌剂最佳配方。采用室内模拟试验,检验该菌剂对土壤中β-CP的降解效果。
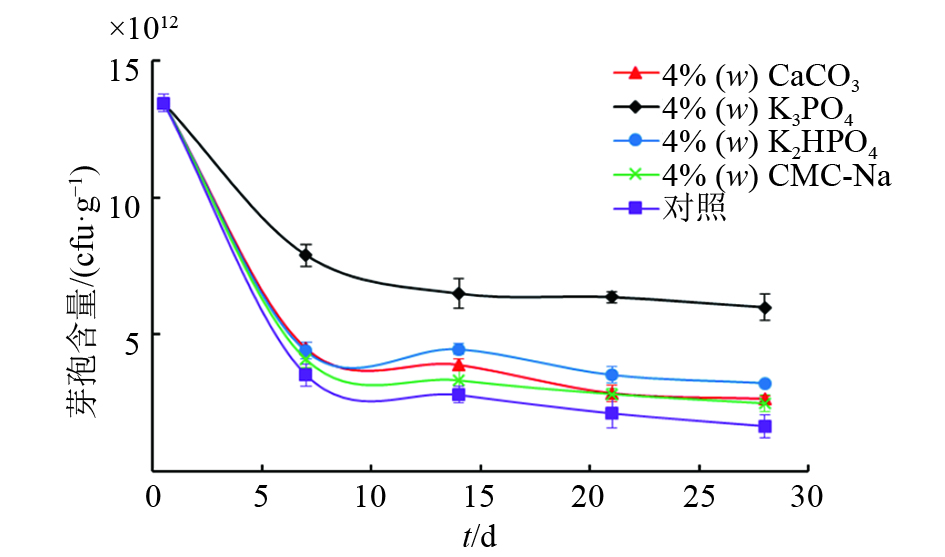
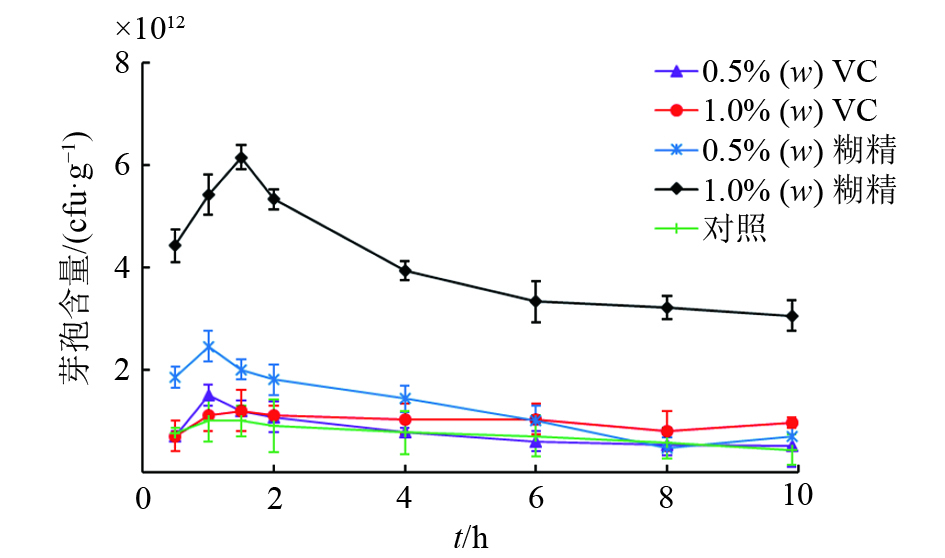
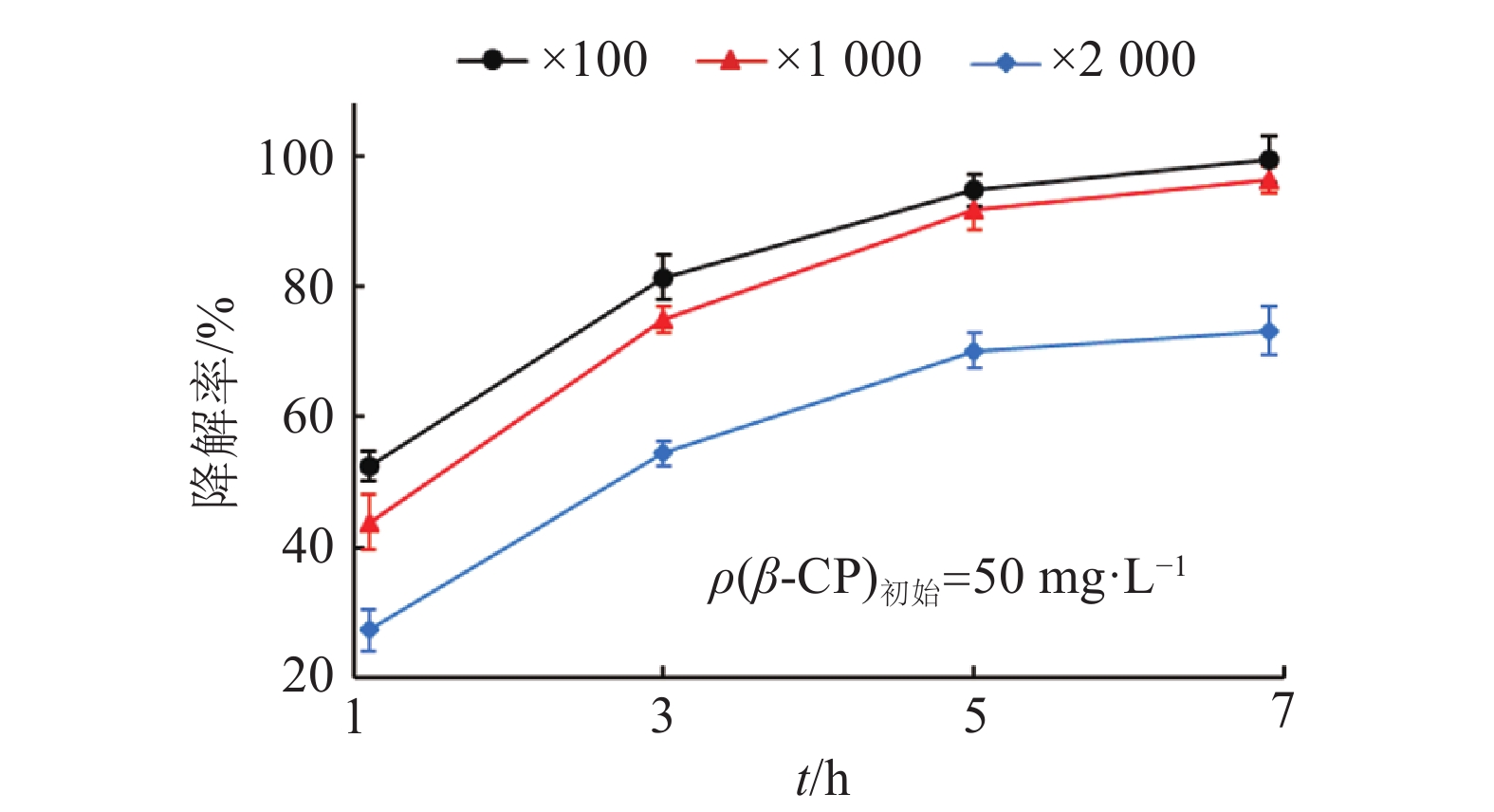
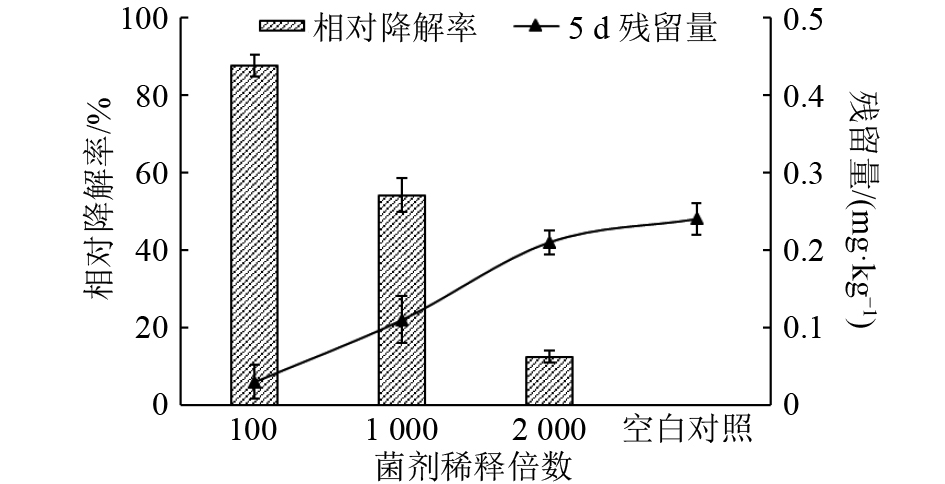
结果试验明确了BSF01菌剂的最佳配方为:以w为30%的BSF01菌粉为主体,添加w为5%的十二烷基苯磺酸钠作为润湿剂、w为7 %的阿拉伯树胶为分散剂、w为4%的磷酸钾为稳定剂和w为1%的糊精为保护剂,并补足载体高岭土至w为100%。该菌剂主要质量指标的检测结果表明,BSF01菌剂芽孢含量为6.50×1011 cfu·g–1,含水量(w)≤0.6%,细度≥99%,润湿时间为32.0 s,悬浮率为78.0%,符合国家标准。将BSF01菌剂稀释100、1 000及2 000倍后,分别投入受β-CP污染的田间土壤,5 d后,以100倍菌剂稀释液处理的土壤中β-CP降解率达到87.50%,有效降低了土壤中β-CP的残留水平。
结论枯草芽孢杆菌BSF01菌剂可成为消除农田拟除虫菊酯类农药残留污染的高效安全生物制品。
Abstract:ObjectiveTo prepare a bacterial agent that is able to degrade beta-cypermethrin (β-CP).
MethodBased on previously isolated and cultured Bacillus subtilis BSF01 which had excellent potential in rapidly degrading β-CP, the bacterial formulation was determined by optimizing additives and dosage. The degrading ability of prepared bacterial agent was evaluated in β-CP-contaminated soil under laboratory conditions.
ResultThe optimal formulation was determined to blend 30% bacterial powder with 5% sodium dodecyl benzene sulfonate as wetting agent, 7% acacia gum as dispersant and 4% potassium phosphate as stabilizer, appending kaolin as the carrier to 100%. The quality assessment verified that the spore intensity of prepared bacterial agent reached 6.50×1011 cfu·g–1 with low water content (≤0.6%), high fineness (≥99%), short wetting time (32 s) and 78% suspensibility. The prepared agent was sprayed on β-CP-contaminated soil by diluting to 100, 1 000 and 2 000 times, respectively. After five days, about 87.50% of residual β-CP in soil was degraded by bacterial agent at 100-fold dilution, which rapidly decreased the residual level of β-CP in soil.
ConclusionThe prepared β-CP bacterial agent exhibits outstanding potential in realistic application with further optimization, which may provide an effective, safe and promising bacterial product for eliminating pyrethroid contamination in agricultural environment.
-
Keywords:
- beta-cypermethrin /
- Bacillus subtilis /
- biodegradation /
- bacterial agent /
- pestiside
-
甘蔗Saccharum hybrids spp. 是世界上最重要的糖料作物及较有发展前景的可再生绿色能源作物。在我国,蔗糖产量占国民食糖需求总量的90%以上[1]。但随着经济的发展,甘蔗与果蔬争地矛盾日趋突出,甘蔗生产逐渐向干旱缺水的坡地和偏远山区转移,而甘蔗的种植对自然资源有一定的要求,特别是对水分和温度的要求较严格[2]。干旱己成为制约我国蔗糖产量及品质的关键因素之一,选育和推广抗旱性强的高产、高糖品种对提高甘蔗产量、降低生产成本具有重要意义。
在干旱胁迫条件下,作物能通过产生保护性物质降低对干旱的敏感性,或产生一系列生理生化变化,减轻干旱的伤害,表现出抗逆性[3]。研究表明甘蔗根系活力,叶片可溶性蛋白含量、可溶性糖含量、脯氨酸含量变化可作为甘蔗抗旱性鉴定和评价的重要指标[4-6]。在干旱胁迫条件下,植物叶片中的超氧化物歧化酶(Superoxide dismutase,SOD)、过氧化物酶(Peroxidase,POD)和过氧化氢酶(Catalase,CAT)这3种酶活性快速降低,使植物的膜系统受外界不良因素的影响而损坏,这种反应与生物氧自由基有一定关联性[7-8]。边芯等[3]通过研究干旱胁迫对持绿性甘蔗细茎野生种叶片生理及甘蔗生物量的影响,表明在干旱胁迫条件下持绿性甘蔗细茎野生种能通过产生保护性物质降低对干旱的敏感性,通过SOD、CAT、POD活性变化,减轻干旱对植株的伤害,从而表现出更好的抗旱性,SOD、CAT、POD活性可作为衡量甘蔗抗旱能力的指标。
甘蔗受到干旱胁迫后,产生的各种生理变化错综复杂,受多种因素影响,仅根据某单一指标评定甘蔗品种的抗旱性会造成评定结果的片面性。综合运用主成分分析法和模糊隶属函数法评价作物的抗旱性可综合评定作物主要抗旱性生理生化指标,对参试作物品种的抗旱性强弱进行排序及聚类,得到较单一指标更为客观可靠的抗旱性评定结果[9-10]。这种方法在大豆[9]、玉米[10]等主要农作物的抗旱性评价中已得到较好应用,在甘蔗品种抗旱性评价中尚未广泛应用,甘蔗品种抗旱性评价以单一指标或少数指标为主。本研究以华南农业大学和湛江市农业科学研究院联合培育的甘蔗10个优良新品系和甘蔗主栽品种ROC22为材料,测定甘蔗伸长初期人工干旱胁迫和正常供水2种处理甘蔗叶片及根系的8项生理参数,运用主成分分析结合聚类分析综合评价参试甘蔗材料的抗旱性,为甘蔗优良抗旱新品种选育提供科学依据。
1. 材料与方法
1.1 试验材料
参试材料为华南农业大学甘蔗研究室和湛江市农业科学研究院联合培育的10个甘蔗优良新品系:A6−13115、A3−1320、A6−13111、A13−1396、A1−1305、A11−1390、A7−13120、A6−13122、A7−13104、A4−1316,以及目前我国甘蔗主栽耐旱品种ROC22(对照)。
1.2 材料种植与处理
试验于2017年2—5月在华南农业大学甘蔗育种基地温室进行。采用盆栽种植的方法,用高、上径、下径分别为32.0、33.5、28.0 cm的塑料桶,每个桶的桶底钻3~5个直径为0.4 cm的圆孔,排去土壤中多余水分。所用栽培土壤为大田土,每桶装2/3高的土壤。蔗种砍成单芽段,每桶种4~5个单芽,每份材料种6桶,下种后覆土3~5 cm,待甘蔗成苗后每桶保留3株长势相近的蔗苗。
待甘蔗生长到伸长初期时,每个材料分成2组(每组3桶),充分淋水至桶里土壤水分饱和。一组正常供水(对照组),另一组不供水进行干旱胁迫处理(处理组)。干旱胁迫开始后,每天定时观察2组蔗株的生长情况,当处理组大多数蔗株正3叶以下全部枯黄,且正3叶全部萎蔫时(约干旱胁迫15 d),甘蔗达到干旱胁迫处理要求,此时分别取对照组和处理组心叶下面第1片叶片和根系进行超低温保存,次日进行生理指标测定。
1.3 测定项目及方法
甘蔗根系活力测定采用TTC法[11],叶片可溶性蛋白含量测定采用考马斯亮蓝G−250比色法[12],叶片可溶性糖含量测定采用蒽酮比色法[13],叶片SOD活性测定采用氮蓝四唑光化还原法[14],叶片CAT活性测定采用过氧化氢还原法[14],叶片POD活性测定用愈创木酚法[15],叶片脯氨酸含量测定采用酸性茚三酮显色法[16],叶片丙二醛(Malondialdehyde,MDA)含量测定采用硫代巴比妥酸法[17]。除根系活力外,其余指标的试验结果都用叶片的鲜质量表示。
1.4 数据处理
抗旱系数(DC)[18]:
$$ {\rm{DC}} = {\text{干旱胁迫处理测定值}}/{\text{对照测定值}} \times 100 \;{\text{%}}{\text{ ,}} $$ (1) 综合指标的隶属函数值(UXj)[19]:
$$ {U_{{X_j}}} = \left( {{X_j} - {X_{\min }}} \right)/\left( {{X_{\max }} - {X_{\min }}} \right)\;\;\;\;\;\;j = 1,2, \ldots ,{{n}}, $$ (2) 式中,Xj表示第j个综合指标的值,Xmin表示第j个综合指标的最小值,Xmax表示第j个综合指标的最大值。
综合指标的权重(Wj)[20]:
$$ {W_j} = {P_j}/\sum\limits_{j = 1}^{{n}} {{P_{{j}}}} \;\;\;\;\;j = 1,2, \ldots ,{{n}}, $$ (3) 式中,Wj表示第j个综合指标在所在综合指标中的重要程度,即权重;Pj为各品系第j个综合指标的贡献率。
甘蔗品种在干旱胁迫条件下抗旱性的综合评价值用D表示[21]:
$$ D = \sum\limits_{j = 1}^{{n}} {\left( {{U_{{X_j}}} \times {{{\rm{W}}_{{j}}}} } \right)} \;\;\;\;\;j = 1,2, \ldots ,{{n}}, $$ (4) 采用Microsoft Excel 2013进行数据处理和作图,使用IBM SPSS 22.0软件进行方差分析和聚类分析,聚类用欧式距离作为相似性尺度。
2. 结果与分析
2.1 干旱胁迫对甘蔗根系活力的影响
由图1可知,与正常供水相比,伸长初期受到干旱胁迫后,甘蔗新品系及对照种ROC22的根系活力都呈现不同程度的降低,且降幅均达显著差异水平。降幅最小的品系是A6−13122,为34.13%;降幅最大的是A4−1316,为51.47%;对照种ROC22的降幅为35.47%。
2.2 干旱胁迫对甘蔗叶片渗透调节物质含量的影响
与正常供水相比,伸长初期受到干旱胁迫后,甘蔗新品系及对照种ROC22叶片脯氨酸含量、可溶性蛋白含量和可溶性糖含量都呈现不同程度的增加趋势,且增幅均达差异显著水平(图2)。脯氨酸含量增幅最小的品系是A7−13104,为52.50%;增幅最大的品系是A6−13111,为69.48%;对照种ROC22增幅为57.34%(图2A)。可溶性蛋白含量增幅最小的品系是A4−1316,为22.83%;增幅最大的是对照种ROC22,为36.12%(图2B)。可溶性糖含量增幅最小的品系是A4−1316,为51.13%;增幅最大的品系是A3−13104,为77.93%;对照种ROC22的增幅为75.67%(图2C)。
![]() 图 2 干旱胁迫对甘蔗叶片渗透调节物质含量和抗氧化酶活性的影响各图中相同性状相同品系(品种)柱形图上的不同小写字母,表示差异显著(P<0.05,Duncan’ s法)Figure 2. Effects of drought stress on osmotic regulating substance content and antioxidant enzyme activity in sugarcane leavesDifferent lowercase letters on bars of the same trait and line (cultivar) in each figure indicate significant differences (P<0.05, Duncan’ s method)
图 2 干旱胁迫对甘蔗叶片渗透调节物质含量和抗氧化酶活性的影响各图中相同性状相同品系(品种)柱形图上的不同小写字母,表示差异显著(P<0.05,Duncan’ s法)Figure 2. Effects of drought stress on osmotic regulating substance content and antioxidant enzyme activity in sugarcane leavesDifferent lowercase letters on bars of the same trait and line (cultivar) in each figure indicate significant differences (P<0.05, Duncan’ s method)2.3 干旱胁迫对甘蔗叶片抗氧化酶活性的影响
与正常供水相比,伸长初期受到干旱胁迫后,甘蔗新品系及对照种ROC22叶片SOD、POD和CAT活性都呈现不同程度的增加趋势,且增幅均达差异显著水平。SOD活性增幅最小的品系是A1−1305,为34.17%;增幅最大的品系是A7−13120,为59.55%;对照种ROC22增幅为49.67%(图2D)。POD活性增幅最小的品系是A7−13120,为36.36%;增幅最大的是对照种ROC22,为64.75%(图2E)。CAT活性增幅最小的品系是A7−13120,增幅为41.82%;增幅最大的品系是A6−13115,为84.21%;对照种ROC22的增幅为71.59%(图2F)。
2.4 干旱胁迫对甘蔗叶片丙二醛含量的影响
与正常供水相比,伸长初期受到干旱胁迫后,甘蔗新品系及对照种ROC22叶片MDA含量都呈现不同程度的增加趋势,且增幅均达显著差异水平。增幅最小的品系是A7−13120,为29.46%;增幅最大的品系是A6−13115,为86.53%;对照种ROC22的增幅为70.87%(图3)。
2.5 干旱胁迫下甘蔗主要生理指标的主成分分析
对根系活力、脯氨酸含量、可溶性蛋白含量、可溶性糖含量、MDA含量、SOD活性、POD活性、CAT活性8个生理指标的抗旱系数(表1)进行主成分分析后,将8个指标转化成为相互独立的综合新指标CI1~CI8,前2个综合指标的贡献率分别为68.62%、12.64%,累积贡献率达到81.26%(表2),因此忽略CI3~CI8这6个综合指标。由表2可以看出,在第一主成分CI1中,根系活力、脯氨酸含量、可溶性蛋白含量、可溶性糖含量、SOD活性、POD活性、CAT活性的系数较大,占了全部信息的68.62%,因此该成分代表了根系活力、脯氨酸含量、可溶性蛋白含量、可溶性糖含量、SOD活性、POD活性、CAT活性;在第二主成分CI2中,MDA含量的系数较大,反映了全部信息的12.64%,因此该成分代表了MDA含量。
表 1 甘蔗品系各单项指标的抗旱系数Table 1. Drought resistance coefficient for each individual indicator of sugarcane lines% 品系
Line根系活力
Root activityw(可溶性蛋白)
Soluble protein contentw(可溶性糖)
Soluble sugar contentw(脯氨酸)
Proline contentSOD活性
SOD activityPOD活性
POD activityCAT活性
CAT activityb(MDA)
MDA contentA6−13115 54.28 148.88 168.17 160.87 195.48 174.42 118.83 186.03 A3−1320 64.79 163.23 185.45 176.92 181.38 159.45 120.10 168.60 A6−13111 56.81 134.78 140.18 153.14 166.04 135.24 113.82 117.97 A13−1396 53.33 130.56 157.28 163.88 179.55 152.22 117.89 184.74 A1−1305 47.64 132.09 158.66 128.31 132.78 125.59 111.03 119.73 A11−1390 57.84 131.50 161.01 142.47 154.76 144.48 114.01 111.45 A7−13120 48.30 128.24 122.47 134.36 141.13 124.09 109.70 146.73 A6−13122 67.15 130.01 151.96 165.32 170.19 158.70 128.36 159.61 A7−13104 52.69 125.66 136.60 146.59 132.39 127.89 112.05 133.73 A4−1316 46.63 124.63 133.94 122.63 148.11 133.02 112.46 120.99 ROC22 65.35 153.54 161.69 157.26 163.16 165.51 123.90 121.85 表 2 各综合指标的系数及贡献率Table 2. Coefficient and contribution rate of each comprehensive indicator生理指标
Physiological index主成分 Principal component CI1 CI2 根系活力 Root activity 0.34 −0.50 可溶性蛋白含量 Soluble protein content 0.34 −0.19 可溶性糖含量 Soluble sugar content 0.34 −0.13 脯氨酸含量 Proline content 0.39 0.06 SOD活性 SOD activity 0.37 0.33 POD活性 POD activity 0.40 0.04 CAT活性 CAT activity 0.36 −0.22 MDA含量 MDA content 0.27 0.73 特征值 Characteristic value 5.49 1.01 贡献率/% Contribution rate 68.62 12.64 累积贡献率/% Cumulative contribution rate 68.62 81.26 通过公式(2)可得出2个主成分综合指标相应的隶属函数值(UXj),根据2个指标的贡献率通过公式(3)求出权重(Wj),最后通过公式(4)得到不同品系抗旱性的综合评价值(D),并对D值进行排序(表3)。D值越大,说明甘蔗的综合抗旱能力越强。A3−1320的D值最大,为0.886,评价为最抗旱;A4−1316的D值最小,为0.115,评价为最不抗旱;其他品系介于二者之间;对照种ROC22的D值为0.603,综合抗旱能力排在第5位。
表 3 甘蔗品系的综合指标值、Wj值、UXj值、D值及排序Table 3. The comprehensive index values, Wj values, UXj values, D values and ranking of tested sugarcane lines品系 Line CI1 CI2 UX1 UX2 D 排序 Rank A6−13115 2.64 1.45 0.86 0.96 0.879 2 A3−1320 3.53 −0.23 1.00 0.43 0.886 1 A6−13111 −0.72 −0.40 0.32 0.38 0.333 6 A13−1396 1.11 1.57 0.61 1.00 0.691 3 A1−1305 −2.41 −0.37 0.05 0.39 0.118 10 A11−1390 −0.65 −0.93 0.33 0.21 0.308 7 A7−13120 −2.73 0.78 0.00 0.75 0.150 9 A6−13122 2.05 −0.40 0.76 0.38 0.687 4 A7−13104 −2.10 −0.06 0.10 0.49 0.178 8 A4−1316 −2.71 0.19 0.00 0.56 0.115 11 ROC22 1.99 −1.60 0.75 0.00 0.603 5 Wj 0.84 0.16 2.6 甘蔗抗旱性综合评价值的聚类分析
通过对参试甘蔗材料抗旱性综合评价值(D)进行聚类分析,将10个甘蔗新品系及对照种ROC22分成抗旱性强、中度抗旱和抗旱性弱3个类型(图4)。抗旱性强的品系有2个:A6−13115、A3−1320,所占比例为18.18%;中度抗旱的品系(品种)有3个:ROC22、A13−1396、A6−13122,所占比例为27.27%;抗旱性弱的品系有6个:A6−13111、A1−1305、A11−1390、A7−13120、A7−13104、A4−1316,所占比例为54.55%。
3. 讨论与结论
抗旱性是作物在干旱胁迫下正常生长、繁殖或生存,胁迫解除后能够迅速恢复生长的能力[22]。抗旱性鉴定是通过筛选、评价和归类,提供优异抗旱种质资源的过程[23]。植物遭受干旱胁迫时会造成细胞膜系统的破坏和代谢紊乱,从而导致大量活性氧积累,SOD、POD、CAT是植物活性氧的清除剂,这3种酶的活性与植物抗旱性密切相关[24-25]。本研究中,甘蔗受干旱胁迫后,与对照组(正常供水)相比,甘蔗叶片SOD、POD和CAT活性均显著增加,上述3种酶的活性增幅最小的品系依次为A1−1305、A7−13120和A7−13120,抗旱性聚类均为抗旱性弱类型,CAT活性增幅最大的品系为A6−13115,抗旱性聚类属于抗旱性强类型,验证了Devi等[24]和Huseynova等[25]的研究结果。作物根系生理活性与根系主动吸水有关,根系越发达,作物吸水效率越高,可缓解干旱对植株的影响[26-27]。本研究中,甘蔗受干旱胁迫后,与正常供水相比,甘蔗根系活力均显著降低。根系活力降幅最小的品系为A6−13122,降幅最大的品系为A4−1316,抗旱性聚类表明前者属于中度抗旱类型,后者为抗旱性弱类型,这也验证了上述观点[26-27]。王川等[28]研究发现小麦植株受干旱胁迫后,抗旱性强的小麦品种总能保持较高的可溶性糖含量,因此认为可溶性糖含量可以作为小麦抗旱性评价的指标,本研究也得到类似结论。张明生等[29]发现甘薯处于逆境时,与抗逆性相关的基因被激活,诱导合成新的蛋白,导致植株可溶性蛋白含量增加,增强细胞的吸水能力从而提高植株抗旱性,因此认为可溶性蛋白含量可作为甘薯抗旱性评价指标。本研究中,甘蔗受干旱胁迫后,叶片可溶性蛋白质含量均显著增加,增幅最小的品系为A4−1316,最大的为对照种ROC22,抗旱性评价聚类表明前者为抗旱性弱类型,后者为中度抗旱类型,这也表明可溶性蛋白含量与甘蔗的抗旱性相关。
参试甘蔗品系抗旱性综合评价结果表明,A6−13115抗旱性强,A7−13104、A4−1316、A1−1305和A7−13120抗旱性弱。作物抗旱性是各生理生化代谢途径对干旱胁迫响应综合作用的结果,对不同指标作物的抗旱反应不一定相同,单一指标评价作物抗旱性往往具有片面性,评价结果可靠性差,采用多个指标综合分析能使评价结果更加可靠和科学。本研究采用抗旱系数对各指标进行数据处理,使其具有可比性,结合主成分分析法可以在不损失或很少损失原有信息的前提下,将原来个数较多而且彼此相关的指标转换成少数几个新的彼此独立的综合指标,并结合其隶属函数值及权重,得到甘蔗抗旱性综合评价值D值。D值是一个无量纲的数,且位于[0, 1],从而使得甘蔗品种的抗旱性差异具有可比性[30]。主成分分析法在大豆、水稻、小麦的抗旱性鉴定中已得到较好的应用[9, 21, 23],因此采用主成分分析结合聚类分析的综合评价方法可提高甘蔗抗旱性鉴定结果的可靠性。本研究中,A3−1320鉴定为抗旱性强品系,A13−1396鉴定为中度抗旱品系,与田间抗旱表现一致。对照品种ROC22鉴定为中度抗旱的甘蔗品种,这与ROC22多年田间种植表现一致,但与檀小辉等[31]对54个广西区试甘蔗品种进行抗旱性评价的结果不一致,可能是抗旱评价标准不同导致。
采用主成分和聚类方法对多个指标综合评价,能提高甘蔗抗旱评价的可靠性和准确性。本研究对参试的甘蔗新品系和对照品种ROC22作抗旱性评价,将其分为抗旱性强、中度抗旱和抗旱性弱3个类型。抗旱性强的品系有A6−13115、A3−1320;中度抗旱的品系有A13−1396、A6−13122及ROC22;抗旱性弱的品系有A6−13111、A1−1305、A11−1390、A7−13120、A7−13104、A4−1316。
-
表 1 添加不同种类及质量分数润湿剂后BSF01菌剂的润湿时间和芽孢含量1)
Table 1 The wetting time and spore intensity of strain BSF01 agent with different types and contents of wetting agents
润湿剂 t润湿/s 芽孢含量/(×1013 cfu·g–1) 3% 5% 7% 3% 5% 7% SDBS 32.0±1.2a 31.2±1.1a 30.4±0.6a 3.3±0.3a 4.8±0.4a 4.4±0.8a 洗衣粉 16.8±1.6b 10.4±0.9b 10.6±1.1b 2.8±0.1a 2.3±0.5b 1.9±0.2b SDS 11.2±0.5c 9.6±1.2b 9.0±0.8b 1.6±0.1b 1.3±0.2c 1.2±0.1c 对照 32.6±0.2a 32.6±0.2a 32.6±0.2a 1.3±0.2b 1.3±0.2c 1.3±0.2c 1)表中数据为3次重复的平均值±标准误,同列数据后凡是有一个相同小写字母者,表示差异不显著(P>0.05,Duncan’s 法) 表 2 添加不同种类及质量分数分散剂后BSF01菌剂的悬浮率和芽孢含量1)
Table 2 The suspending rate and spore intensity of strain BSF01 agent with different types and contents of dispersants
分散剂 悬浮率/% 芽孢含量/(×1012 cfu·g–1) 3% 5% 7% 3% 5% 7% PEG-8000 49.0±3.6b 58.0±4.0b 59.0±3.3b 8.3±0.7a 8.0±0.6a 7.7±0.4a 阿拉伯树胶 65.0±5.2a 67.0±2.6a 77.0±4.1a 9.7±0.5a 10.0±0.6a 8.0±0.9a PVA 46.0±4.1b 52.0±2.2b 56.0±3.5b 0.4±0.1b 0.5±0.1b 0.6±0.2b 1)表中数据为3次重复的平均值±标准误,同列数据后凡是有一个相同小写字母者,表示差异不显著(P>0.05,Duncan’s 法) -
[1] KOLACZINSKI J H, CURTIS C F. Chronic illness as a result of low-level exposure to synthetic pyrethroid insecticides: A review of the debate[J]. Food Chem Toxicol, 2004, 42(5): 697-706.
[2] CASIDA J E. Pyrethrum flowers and pyrethroid insecticides[J]. Environ Health Persp, 1980, 34: 189-202.
[3] XIAO Y, CHEN S, GAO Y, et al. Isolation of a novel beta-cypermethrin degrading strain Bacillus subtilis BSF01 and its biodegradation pathway[J]. Appl Microbiol Biot, 2015, 99(6): 2849-2859.
[4] FIELD L M, EMYR DAVIES T G, O’REILLY A O, et al. Voltage-gated sodium channels as targets for pyrethroid insecticides[J]. Eur Biophys J, 2017, 46(7): 675-679.
[5] HANSEN M R H, J RS E, LANDER F, et al. Neurological deficits after long-term pyrethroid exposure[J]. Environ Health Insights, 2017. doi: 10.1177/1178630217700628
[6] JOHNSTONE A F M, STRICKLAND J D, CROFTON K M, et al. Effects of an environmentally relevant mixture of pyrethroid insecticides on spontaneous activity in primary cortical networks on microelectrode arrays[J]. Neurotoxicology, 2017, 60: 234-239.
[7] CORCELLAS C, ELJARRAT E, BARCEL D. First report of pyrethroid bioaccumulation in wild river fish: A case study in Iberian river basins (Spain)[J]. Environ Int, 2015, 75: 110-116.
[8] MUGGELBERG L L, HUFF HARTZ K E, NUTILE S A, et al. Do pyrethroid-resistant Hyalella azteca have greater bioaccumulation potential compared to non-resistant populations? Implications for bioaccumulation in fish[J]. Environ Pollut, 2017, 220(Pt A): 375-382.
[9] HUGHES M F, ROSS D G, STARR J M, et al. Environmentally relevant pyrethroid mixtures: A study on the correlation of blood and brain concentrations of a mixture of pyrethroid insecticides to motor activity in the rat[J]. Toxicology, 2016, 359/360: 19-28.
[10] AZNAR-ALEMANY Ò, ELJARRAT E, BARCEL D. Effect of pyrethroid treatment against sea lice in salmon farming regarding consumers’ health[J]. Food Chem Toxicol, 2017, 105: 347-354.
[11] CYCOŃ M, PIOTROWSKA-SEGET Z. Pyrethroid-degrading microorganisms and their potential for the bioremediation of contaminated soils: A review[J]. Front Microbiol, 2016. doi: 10.3389/fmicb.2016.01463
[12] TRAN N H, URASE T, NGO H H, et al. Insight into metabolic and cometabolic activities of autotrophic and heterotrophic microorganisms in the biodegradation of emerging trace organic contaminants[J]. Bioresource Technol, 2013, 146(10): 721-731.
[13] CYCOŃ M, MROZIK A, PIOTROWSKA-SEGET Z. Bioaugmentation as a strategy for the remediation of pesticide-polluted soil: A review[J]. Chemosphere, 2017, 172: 52-71.
[14] XIAO Z J, LIU P H, QIN J Y, et al. Statistical optimization of medium components for enhanced acetoin production from molasses and soybean meal hydrolysate[J]. Appl Microbiol Biot, 2007, 74(1): 61-68.
[15] 中华人民共和国国家质量监督检验检疫总局. 农药可湿性粉剂润湿性测定方法: GB/T 5451—2001[S]. 北京: 中国标准出版社, 2001. [16] 中华人民共和国国家质量监督检验检疫总局. 农用微生物菌剂: GB 20287—2006[S]. 北京: 中国标准出版社, 2006. [17] LIU J, HUANG W, HAN H, et al. Characterization of cell-free extracts from fenpropathrin-degrading strain Bacillus cereus ZH-3 and its potential for bioremediation of pyrethroid-contaminated soils[J]. Sci Total Environ, 2015, 523: 50-58.
[18] CHEN S, CHANG C, DENG Y, et al. Fenpropathrin biodegradation pathway in Bacillus sp. DG-02 and its potential for bioremediation of pyrethroid-contaminated soils[J]. J Agr Food Chem, 2014, 62(10): 2147-2157.
[19] FERNANDEZ-FONTAINA E, PINHO I, CARBALLA M, et al. Biodegradation kinetic constants and sorption coefficients of micropollutants in membrane bioreactors[J]. Biodegradation, 2013, 24(2): 165-177.
[20] DUAN H, KOE L C C, YAN R, et al. Biological treatment of H2S using pellet activated carbon as a carrier of microorganisms in a biofilter[J]. Water Res, 2006, 40(14): 2629-2636.
[21] ZHU S M, DENG Y L, RUAN Y J, et al. Biological denitrification using poly(butylene succinate) as carbon source and biofilm carrier for recirculating aquaculture system effluent treatment[J]. Bioresource Technol, 2015, 192: 603-610.
[22] WEN D, ZHANG J, XIONG R, et al. Bioaugmentation with a pyridine-degrading bacterium in a membrane bioreactor treating pharmaceutical wastewater[J]. J Environ Sci, 2013, 25(11): 2265-2271.








 下载:
下载: