Expression patterns of PI3K signaling pathway key genes in porcine follicular development
-
摘要:目的
研究不同时期猪卵巢卵泡发生的形态特征及磷脂酰肌醇3–激酶(Phosphoinositide 3-kinase, PI3K)信号通路关键基因在卵泡发生发育中的作用。
方法通过HE染色观察12日龄、30日龄、70日龄、20月龄卵泡期及黄体期、48月龄的长大二元母猪卵巢卵泡发育的形态变化,应用实时荧光定量PCR检测PI3K通路关键基因在这些时期的表达规律,并通过Western blot法检测PI3K通路重要的下游效应因子p-rpS6在不同时期猪卵巢的表达情况。
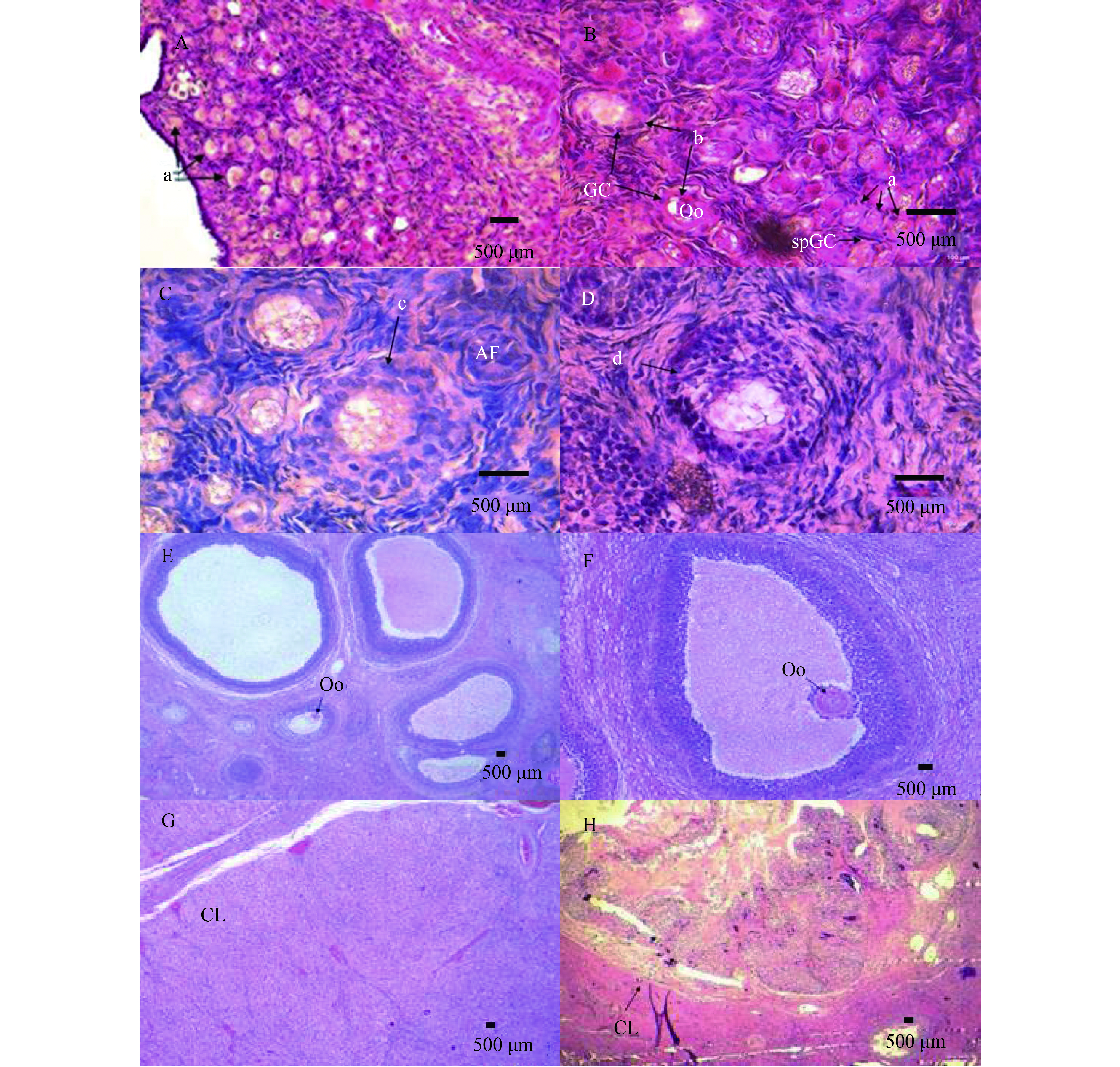
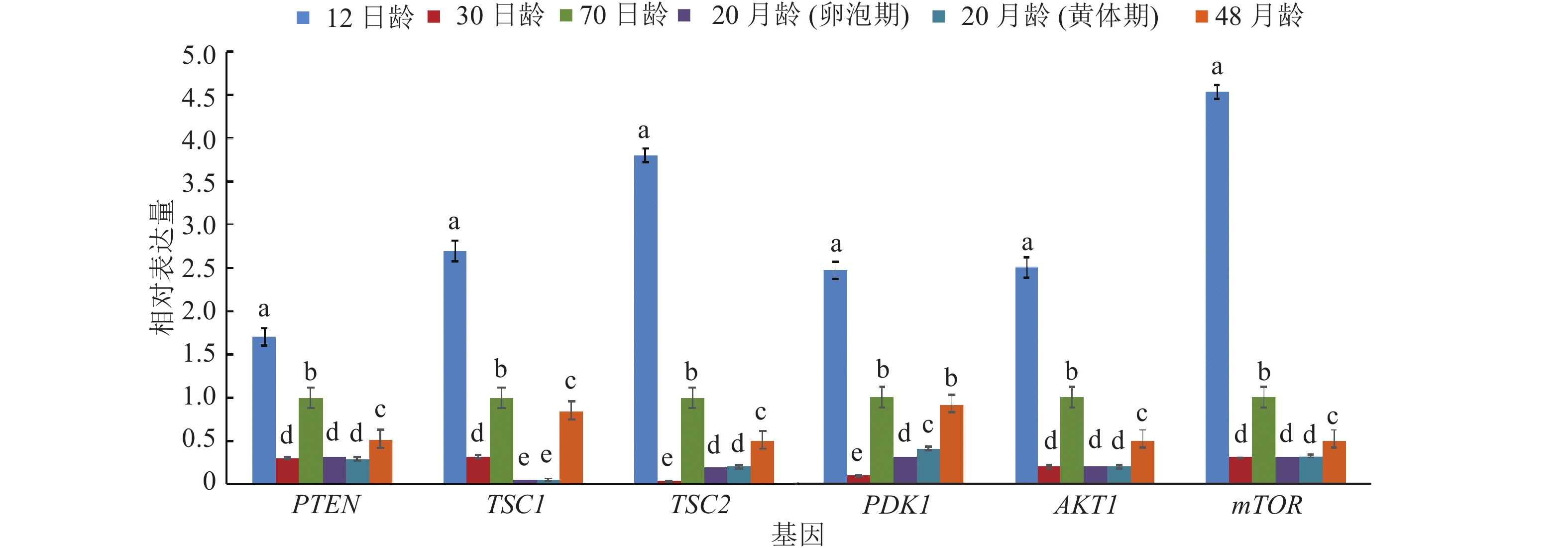
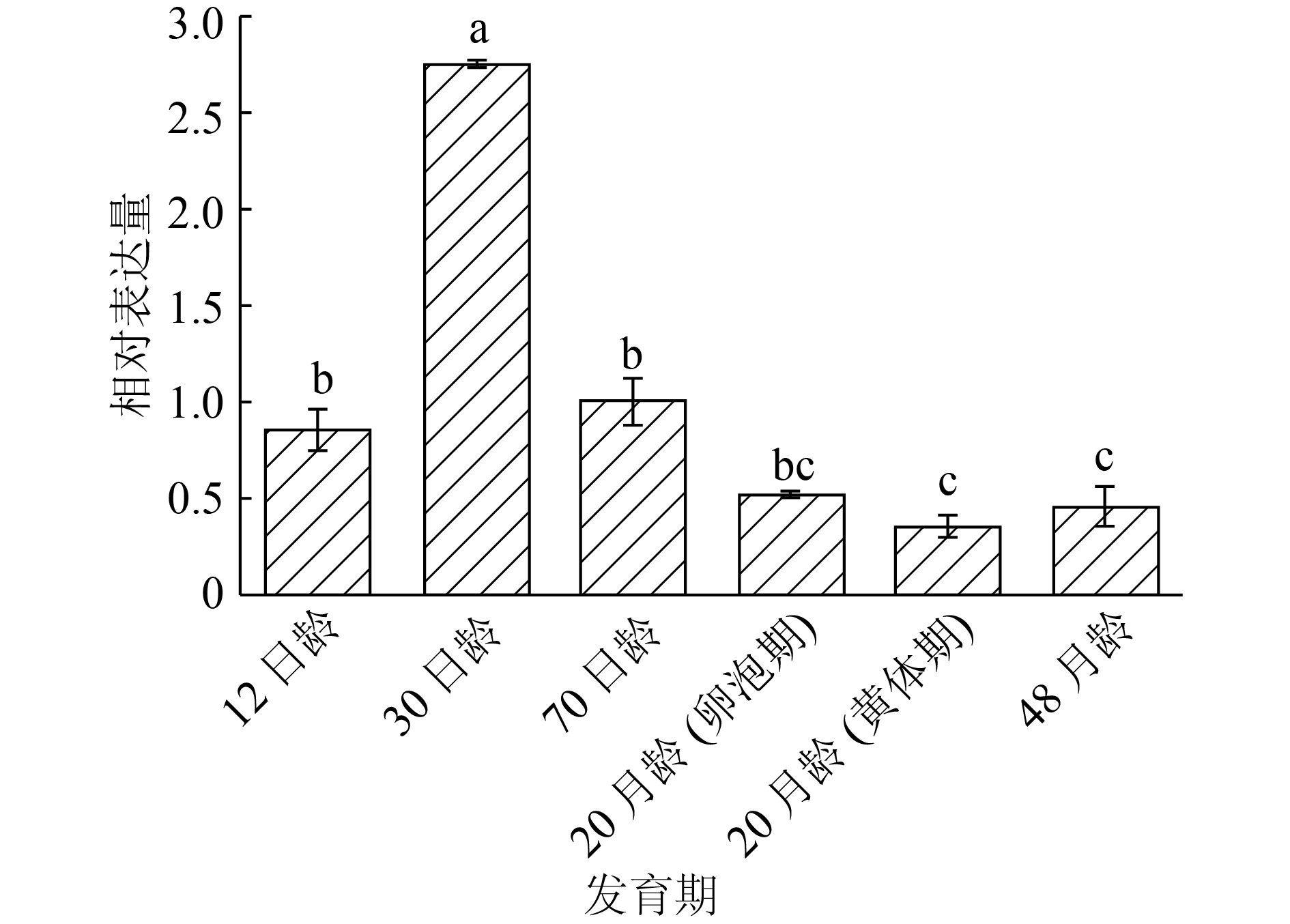
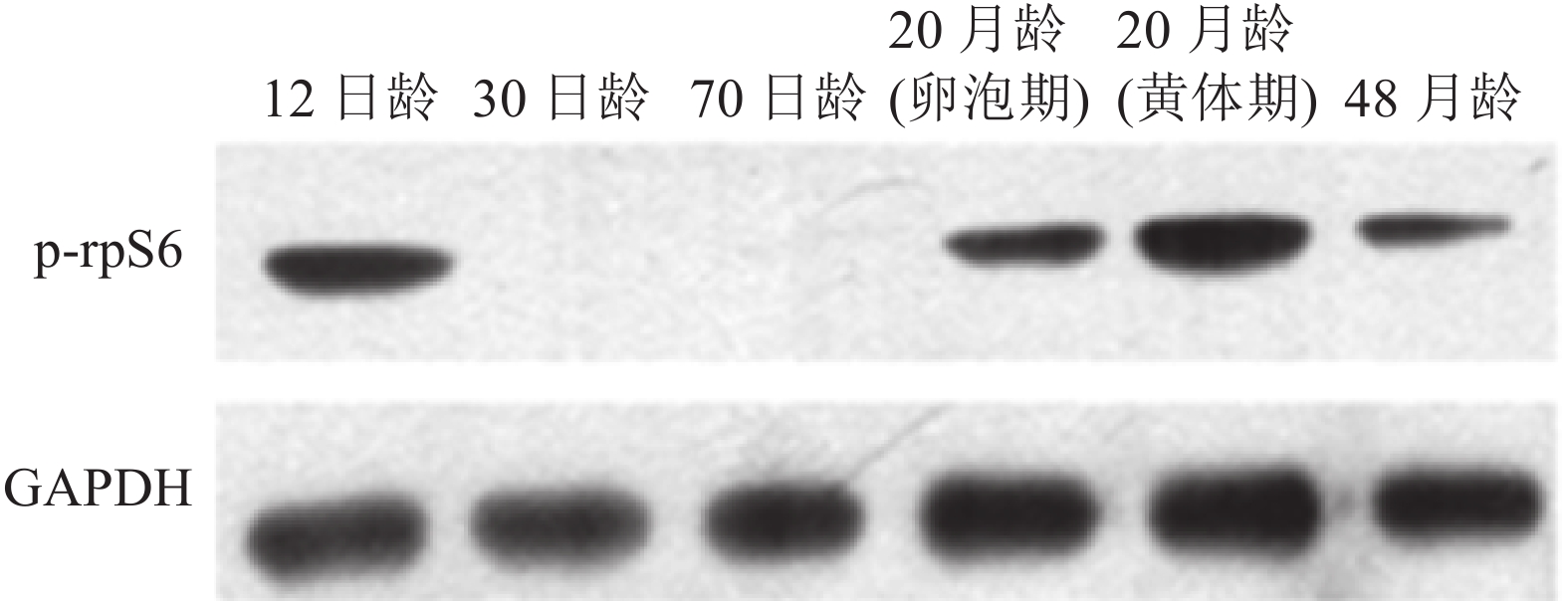
结果12日龄母猪卵巢皮质边缘有大量的原始卵泡,皮质与髓质交界处可见少量初级卵泡及个别的次级卵泡;30日龄母猪卵巢次级卵泡数量增加;70日龄出现3级卵泡;20月龄卵泡期、黄体期分别有大量成熟卵泡、大体积的黄体;48月龄较难观察到原始卵泡。PI3K通路抑制因子PTEN、TSC1、TSC2与激活因子PDK1、AKT1、mTOR的mRNA均在12日龄表达量最高, 70日龄、48月龄表达量次之, 30日龄和20月龄表达量最低;下游效应基因rpS6的mRNA 30日龄表达量最高,20和48月龄表达量最低, p-rpS6蛋白在12日龄、20月龄、48月龄母猪卵巢高表达,在30日龄、70日龄中几乎不表达。
结论PI3K通路关键基因在不同时期母猪卵巢中的表达水平不同,说明该通路参与了猪卵泡的早期发生及卵泡成熟的调控过程。
Abstract:ObjectiveTo study the morphological characteristics of pig ovarian follicles at different developmental stages and possible roles of key genes of phosphoinositide 3-kinase (PI3K) signaling pathway in follicular development.
MethodThe morphological changes in follicles of 12-, 30-, 70-day postpartum, 20-month follicular phase, 20-month luteal phase and 48-month luteal phase of landrace×large white sows were observed using HE staining. The expressions of key genes of PI3K pathway in these periods were detected by qRT-PCR. The expression of p-rpS6, a downstream effector, was detected by Western blot assay in porcine ovaries at different stages.
ResultA large number of primordial follicles were observed at the cortical edges of ovaries for 12-day-old pigs, and a small amount of primary follicles and a few secondary follicles were found at the junction of cortex and medulla. The number of secondary follicles increased in 30-day-old pigs. Tertiary follicles appeared in ovaries of 70-day-old pigs. At 20 months of age, a large number of mature follicles and bulked corpus luteum were found at follicular and luteal phases, respectively. It was difficult to observe primary follicles at 48 months of age. For PI3K pathway, the ovarian mRNA expression of inhibitors PTEN, TSC1, TSC2 and activators PDK1, AKT1, mTOR showed the highest levels at 12 days of age, followed by 70 days and 48 months of ages, and the lowest levels at 30 days and 20 months of ages. The downstream effector gene rpS6 of PI3K pathway exhibited the highest level of ovarian mRNA expression at 30 days of age, and the lowest level at 20 and 48 months of ages, while p-rpS6 protein had higher ovarian expression level at 12 days, 20 and 48 months of ages, and no expression at 30 and 70 days of ages.
ConclusionThe key genes of PI3K pathway have different expression levels at different developmental stages of porcine ovary, which indicates that the pathway is involved in the processes of porcine follicular generation and maturation.
-
Keywords:
- pig /
- PI3K pathway /
- follicular development /
- inhibitor /
- activator /
- p-rpS6
-
桑树Morus alba Linn.属桑科Moraceae桑属Morus,原产我国中部,是一种具有重要经济价值的落叶乔木。种桑养蚕是我国的传统产业,我国已有约4 000的桑树栽培历史[1]。随着“东桑西移”发展战略的实施,广西逐步成为我国蚕茧生产第一大省区和世界重要原料蚕茧生产基地,2012年,广西桑树种植面积达1.69×105 hm2,家蚕饲养量为655万张,蚕茧产量达2.56×105 t[2]。由可可毛色二孢Lasiodiplodia theobromae Pat.Griffon & Maubl桑树的新病害,2014年,Xie等[3]曾报道该病害在我国广西横县发生,发病面积达2 400 hm2,其后在广西其他蚕桑种植区均发现该病害的存在。
桑根腐病是一种根部新病害,目前生产上鲜见有防治效果好的化学药剂,且化学防治易对桑树和家蚕产生药害,因此,针对该病害开展生物防治的研究具有重要意义,而获得有显著拮抗效果的菌株是病害生物防治的基础。本研究采集健康桑树根际土壤,筛选能显著抑制L. theobromae的拮抗细菌,以期为桑根腐病的生物防治奠定基础。
1. 材料与方法
1.1 材料
Ezup柱式细菌基因组DNA抽提试剂盒、DNA Ladder Min Marker(SM0337)、Dream Taq Green PCR MasterMix(2×)、PCR引物等均购自上海生物工程技术服务有限公司;PDA粉(广东环凯微生物科技有限公司);快速革兰氏染色试剂盒(济南百博生物科技有限责任公司);孔雀石绿(天津市大茂化学试剂厂)。
NA培养基:牛肉浸膏3.0 g、蛋白胨5 g、葡萄糖2.5 g,琼脂粉15 g,用少量蒸馏水加热溶解后,补充蒸馏水至1 L。
可可毛色二孢Lasiodiplodia theobromae菌株由广西大学农学院植保系实验室分离保存。
1.2 方法
从广西自治区南宁市、河池市和来宾市的桑园中,采集健康桑树根际土壤用于分离拮抗细菌。参考孙正祥等[4]的方法分离和纯化细菌菌株。
1.2.1 拮抗细菌对L. theobromae菌丝生长的影响
采用平板对峙法[5]测定拮抗细菌对菌丝生长的影响。将保存的病原菌菌株和细菌菌株分别在PDA培养基和NA培养基上活化。用灭菌打孔器(直径6 mm)取L. theobromae菌饼接种至PDA培养基平板中央,其两侧2 cm处对称放置细菌菌落块,放置于28 ℃培养箱中培养。待对照处理的菌落长满平板后,测量各处理菌落的直径,参照谢晨昭等[6]的方法计算生长抑制率,并在显微镜下观察抑菌带菌丝的形态特征。各处理重复3次。从参试的细菌菌株中筛选出拮抗效果最好的菌株进行后续试验。
1.2.2 细菌培养液对L. theobromae菌丝生长的影响
将筛选出的细菌菌落块接种到150 mL液体NA培养基中,于振荡培养箱中(28 ℃,150 r·min-1)培养3 d。培养液经0.22 μm的微孔滤膜过滤后,备用。取活化好的L. theobromae菌饼接种到PDA培养基中央,在其周围对称放置3片灭菌滤纸片(直径5 mm),再用移液枪吸取10 μL细菌上清液滴在滤纸片上。重复3次,计算生长抑制率。
1.2.3 细菌培养液对L. theobromae孢子萌发的影响
采用载玻片孢子萌发法[5]:利用过滤的细菌培养液配制孢子悬浮液(约1×106个·mL-1),以清水为对照, 将500 μL孢子悬浮液滴在干净的载玻片上,再将载玻片放入垫有湿润滤纸的培养皿中,然后放置于28 ℃培养箱中培养20 h后观察孢子萌发情况,计算孢子萌发率。以芽管长度超过孢子长度的一半作为萌发标准。
1.2.4 拮抗菌株的鉴定
将活化好的拮抗菌株菌落划线接种在NA培养基平板上,放入28 ℃培养箱中培养2 d后,观察菌落特征,并进行革兰氏染色和芽孢染色观察形态特征[7]。参照《常见细菌系统鉴定手册》[7]的方法测定拮抗细菌的生理生化特征。试剂盒提取菌株总DNA,保存于-20 ℃备用。参考并利用Chun等[8]的引物扩增gyrA基因。PCR反应体系:Dream Taq Green PCR MasterMix(2×)25 μL,引物各2 μL,DNA模板2 μL,加ddH2O至50 μL。反应条件:95 ℃预变性3 min;95 ℃ 35 s,62 ℃ 1 min,72 ℃ 2 min,重复30次;72 ℃ 10 min。gyrB基因引物为UP1和UP2r[9]。除引物不同外,PCR反应体系中各成分的量和反应条件与gyrA基因序列扩增试验相同。
PCR扩增完成后,取PCR产物在10 g·L-1琼脂糖凝胶中电泳(150 V、100 mA、20 min)检测产物的特异性并委托上海生工测序。将测得的菌株序列在NCBI上进行BLAST比对,确定菌株的分类地位,同时下载NCBI中与参试菌株序列相似性高的序列用Mega 5软件进行同源性分析,构建系统发育树。
1.2.5 YZ14-3大田防治桑根腐病效果
在广西自治区横县石塘镇选择树龄为4~6年的桑园作为试验田,试验田随机设置3个小区,每小区65~70棵桑树。施用生防菌剂前,先调查记录好各小区的病死桑树。将YZ14-3培养液9 L(4.8×108 CFU·mL-1)兑水18 L后均匀浇灌于各小区桑树根部土壤。试验期限为2014年4月至2015年5月,前5个月,每月施用培养液2次,其后每月施用1次。对照用等量的清水代替YZ14-3培养液。最后1次施药1个月后,调查各处理小区及对照的病死株数,参照赖传雅的方法[10]并稍作改进计算防治效果:
防治效果=[(对照区校正病死率-处理区校正病死率)/对照区校正病死率]×100%,
校正病死率=用药后病死率-用药前病死率。
2. 结果与分析
2.1 拮抗菌株分离及拮抗效果测定
从采集的45份土样中分离到菌落形态有明显差异的菌株22个,经筛选得到对L. theobromae有显著抑制效果的8个菌株,其中菌株YZ14-3的抑菌效果最好(图 1)。YZ14-3菌落与L. theobromae对峙培养时,抑菌圈半径为12 mm,对L. theobromae的生长抑制率为73.3%。因此,选定菌株YZ14-3进行后续试验。研究发现,菌株YZ14-3的培养液能显著抑制L. theobromae的生长,抑菌圈半径为8 mm,抑制率为55.6%。观察发现抑菌圈外缘的L. theobromae菌丝变黑(图 1),挑取变黑的菌丝在显微镜下观察,发现菌丝膨大、畸形、易断裂(图 2)。
2.2 菌株YZ14-3培养液对L. theobromae孢子萌发的影响
采用载玻片孢子萌发法测定了YZ14-3培养液对L. theobromae分生孢子萌发的影响,培养20 h后,在显微镜下观察孢子的萌发情况。每个视野随机观测500个孢子,观察3个视野,共1 500个孢子。观察发现,L. theobromae分生孢子在YZ14-3的培养液中不能萌发且YZ14-3的培养液能降解L. theobromae分生孢子的细胞壁,使分生孢子解体。
2.3 菌株YZ14-3的鉴定
2.3.1 形态特征
菌株YZ14-3在NA培养基的主要培养特征(图 3A)如下:菌落乳白色,边缘不整齐,表面有皱褶,隆起不透明,菌落干爽无光泽;液体静止培养时形成乳白色菌膜。显微镜下观察发现,YZ14-3革兰氏染色阳性,呈紫色(图 3B),菌体短杆状,直或略弯,菌体单个或呈短链状排列,芽孢顶生或生于菌体中部(图 3C)。根据形态特征,初步鉴定YZ14-3为芽孢杆菌Bacillus sp.。
2.3.2 生理生化特性
本研究测定了YZ14-3的部分生理生化特征(表 1)。将本文测定结果与已发表的B. amyloliquefaciens相关菌株生理生化特征测定结果[11-12]相比较,并参考《常见细菌系统鉴定手册》[7],YZ14-3被初步鉴定为解淀粉芽孢杆菌Bacillus amyloliquefaciens。
表 1 菌株YZ14-3的生理生化特性1)Table 1. Physiological and biochemical characteristics of YZ14-3
2.3.3 gyrA和gyrB序列分析鉴定
菌株YZ14-3的gyrA基因扩增后,获得1个长度为1 013 bp的片段。PCR产物纯化、测序后,将该基因序列在NCBI上进行BLAST相似性分析,比对结果表明,YZ14-3的gyrA序列与GenBank中的B. amyloliquefaciens的gyrA序列相似性均高于98%。从GenBank中下载与YZ14-3的gyrA序列相似性较高的B. amyloliquefaciens gyrA序列11个、B. subtilis序列8个、B. licheniformis序列6个,以大肠埃希菌Escherichia coli菌株的gyrA序列(登录号:DQ447131)为外群构建系统发育树(图 4A)。由系统发育树可知,YZ14-3与11株B. amyloliquefaciens聚在一群,并与其他菌株分离,表明YZ14-3与B. amyloliquefaciens具有很高的遗传相似性。
菌株YZ14-3的gyrB基因扩增后,获得1个长度为1 243 bp的片段。PCR产物纯化、测序后,将该基因序列在NCBI上进行BLAST相似性分析,结果发现,YZ14-3的gyrB序列与GenBank中的B. amyloliquefaciens的gyrB序列相似性均高于99%。下载GenBank中与YZ14-3的gyrB序列相似性较高的7个B. amyloliquefaciens菌株序列、7个B. subtilis序列、3个B. licheniformis序列、3个B. thuringiensis序列,以E.coli菌株的gyrB序列(登录号:AB083949)为外群构建系统发育树(图 4B)。由系统发育树可知,YZ14-3与7株B. amyloliquefaciens聚在一群,并与7株B. subtilis分离,表明YZ14-3与B. amyloliquefaciens的遗传相似性很高。
由gyrA和gyrB序列构建的系统发育树可鉴定菌株YZ14-3为B. amyloliquefaciens。
2.3.4 菌株YZ14-3的田间防治效果
施用YZ14-3培养液前后各调查1次桑树病死情况,施用YZ14-3培养液用药前和用药后桑树病死率分别为14.44%和18.89%,用药后的桑树病死率显著地低于对照的(29.44%)。生防菌剂处理的校正病死率约为4.45%,显著高于对照的校正病死率13.88%。由生防菌剂处理和对照的校正病死率得YZ14-3的田间防治效果为67.94%。
3. 讨论与结论
B. amyloliquefaciens与B. subtilis亲缘性很高,能分泌一系列抑制真菌、细菌、病毒和支原体生长发育的抗菌脂肽[13]。王奕文等[14]从甜瓜果实表面分离到1株B. amyloliquefaciens,该菌株对灰葡萄孢Botrytis cinerea、链格孢Alternaria sp.、尖孢镰刀菌Fusarium. oxysporum等病原真菌的拮抗作用显著。陈妍等[15]从土壤中分离出1株对棉花黄萎病菌Verticillium dahliae有良好拮抗作用的B. amyloliquefaciens菌株。陈成等[16]从土壤中分离到1株B. amyloliquefaciens,其对黑曲霉Aspergillus niger、稻瘟病菌Magnaporthe oryzae和水稻纹枯病菌Rhizoctonia solani等植物病原真菌有很强的抑制作用。B. amyloliquefaciens菌株DFE16及其发酵液不仅能抑制病菌生长,而且能诱导油菜对黑胫病产生抗性[17]。B. amyloliquefaciens的发酵液对油茶炭疽病具有很强的抑制作用,进一步研究发现发酵液中的抑菌物质为脂肽,该物质能使病菌菌丝畸形[18]。B. amyloliquefaciens分泌的胞外非蛋白类物质能有效抑制鱼腥藻的生长[19]。枯草芽孢杆菌不同种群在植物病害的生物防治中有广泛的应用,其作用机制主要有竞争、抗生、溶菌等[20]。本研究从健康桑树的根际土壤中分离出1株B. amyloliquefaciens YZ14-3,其对桑根腐病菌L. theobromae的抑制效果显著,YZ14-3的无菌培养液能完全抑制病菌分生孢子的萌发,降解分生孢子的细胞壁,从而使孢子解体,说明YZ14-3的培养液中含有溶菌物质。溶菌作用是B. amyloliquefaciens菌株YZ14-3抑制病原菌生长的一种机制。田间防治试验结果表明,YZ14-3的生防效果较显著达67.94%,具有一定的应用前景。本研究结果为菌株YZ14-3在桑根腐病生物防治中的应用奠定了基础。
16S rDNA/RNA基因序列被广泛应用于细菌鉴定或研究细菌的系统进化关系,但由于16S rDNA/RNA基因序列过于保守,在亲缘关系很近的分类类群间,由于序列间的相似度太高而无法区分近缘种[21]。Wang等[22]研究认为16S rDNA/RNA基因序列不能有效区分枯草芽孢杆菌的菌株,而gyrA和gyrB基因序列可以用于枯草芽孢杆菌的鉴定。gyrA和gyrB基因的分子进化速率比16S rDNA/RNA基因大,可以弥补16S rDNA/RNA基因的不足[22-23]。菌株SWB16的16S rRNA序列与B. subtilis、B. amyloliquefaciens、B. licheniformis和贝莱斯芽孢杆菌B. velezensis有99%的相似性,但利用gyrA序列构建的系统发育树显示SWB16与B. amyloliquefaciens聚为一群[24]。本文利用gyrA和gyrB基因序列构建了系统发育树,2株系统发育树均能将B. amyloliquefaciens与B. subtilis及其他芽孢杆菌近缘种区分开。目前,gyrA和gyrB基因已经应用到许多细菌近缘种的鉴别中,如枯草芽孢杆菌组(B. subtilis group)[21, 25-26]、假单孢菌属Pseudomonas[27]、气单孢菌属Aeromonas[28]、分枝杆菌属Mycobacterium[29]等。
-
表 1 RT-qPCR引物序列
Table 1 Sequences of primers for RT-qPCR
基因 登录号 转录本 引物序列(5′→3′) 长度/bp PTEN 43991 NM_001143696.1 F: AAGCAGTTATTTTTCTTTTCCC
R: CTGGTTTCAAGACAGGAGTTC230 TSC1 10015472 XM_021070814.1 F: GACCCATATCTATGCGGACCC
R: TGCTGGTACTGAAGCG GTTG101 TSC2 100505408 XM_021086774.1 F: GCTGGGCACCATCAAAG
R: ACCTGCGAGGCCATGTT201 PDK1 100286871 NM_001159608.1 F: TTTGGATGCCGGAACAC
R: TAGTAAAGCAGTGGGGAATG189 AKT1 100126861 NM_001159776.1 F: AGGTACCTGTGGATCCTGTC
R: TTCTGCCATTATCCTATGTCTAC192 mTOR 100127359 XM_003127584.6 F: CGATGGCCAGGGATCTCTTC
R: TCGGCCAAGTTTAAGAGCGT151 rpS6 100038023 XM_021063193.1 F: CTGAGGTCTGCCAGAAGC
R: AACAGAAGAAGGAAGGGAGT150 GAPDH 396823 XM_021091114.1 F: TCCCGCCAACATCAAAT
R: CACGCCCATCACAAACAT163 -
[1] 王笑, 王甄真, 陈雁. PI3K/AKT信号通路在维持血糖平衡中的作用[J]. 生命科学, 2013(2): 133-139. [2] MABUCHI S, KURODA H, TAKAHASHI R, et al. The PI3K/AKT/mTOR pathway as a therapeutic target in ovarian cancer[J]. Gynecol Oncol, 2015, 137(1): 173-179.
[3] CANTLEYL C. The phosphoinositide 3-kinase pathway[J]. Science, 2002, 296(5573): 1655-1657.
[4] ENGELMANJ A, LUO J, CANTLEY L C. The evolution of phosphatidylinositol 3-kinases as regulators of growth and metabolism[J]. Nat Rev Genet, 2006, 7(8): 606-619.
[5] REDDY P, ZHENG W, LIU K. Mechanisms maintaining the dormancy and survival of mammalian primordial follicles[J]. Trends Endocrin Met, 2010, 21(2): 96-103.
[6] ZELEZNIK A J, SAXENA D, LITTLE-IHRIG L. Protein kinase B is obligatory for follicle-stimulating hormone-induced granulosa cell differentiation[J]. Endocrinology, 2003, 144(9): 3985-3994.
[7] FAN H Y, RICHARDS J S. Minireview: Physiological and pathological actions of RAS in the ovary[J]. Mol Endocrinol, 2010, 24(2): 286-298.
[8] GONZALEZ-ROBAYNA I J, FALENDERA E, OCHSNER S, et al. Follicle-stimulating hormone (FSH) stimulates phosphorylation and activation of protein kinase B (PKB/Akt) and serum and glucocorticoid-lnduced kinase (Sgk): Evidence for a kinase-independent signaling by FSH in granulosa cells[J]. Mol Endocrinol, 2000, 14(8): 1283-1300.
[9] ZHENG W, NAGARAJU G, LIU Z, et al. Functional roles of the phosphatidylinositol 3-kinases (PI3Ks) signaling in the mammalian ovary[J]. Mol Cell Endocrinol, 2012, 356(1/2): 24-30.
[10] RUVINSKY I, SHARON N, LERER T, et al. Ribosomal protein S6 phosphorylation is a determinant of cell size and glucose homeostasis[J]. Gene Dev, 2005, 19(18): 2199-2211.
[11] BLACK J L, ERICKSON B H. Oogenesis and ovarian development in the prenatal pig[J]. Anat Rec, 1968, 161(1): 45-55.
[12] GOSDEN R G, TELFER E. Numbers of follicles and oocytes in mammalian ovaries and their allometric relationships[J]. Proceedings of the Zoological Society of London, 1987, 211(1): 169-175.
[13] BLAKE J A, EPPIG J T, RICHARDSON J E, et al. The mouse genome database (MGD): Integration nexus for the laboratory mouse[J]. Nucleic Acids Res, 2001, 29(1): 91-94.
[14] RINGWALD M, DAVIS G L, SMITH A G, et al. The mouse gene expression database GXD[J]. Nucleic Acids Res, 1997, 32(1): 489-497.
[15] EPPIG J J. Oocyte control of ovarian follicular development and function in mammals[J]. Reproduction, 2001, 122(6): 829-838.
[16] 徐春琳, 路晓琳, 闫晓楠, 等. PI3K/Akt/NF-κB信号通路在FSH促进卵巢癌细胞增殖与侵袭中的作用[J]. 中华妇产科杂志, 2012, 47(2): 134-138. [17] JOHN G B, SHIDLER M J, BESMER P, et al. Kit signaling via PI3K promotes ovarian follicle maturation but is dispensable for primordial follicle activation[J]. Dev Biol, 2009, 331(2): 292-299.
[18] BROWN C, LAROCCA J, PIETRUSKA J, et al. Subfertility caused by altered follicular development and oocyte growth in female mice lacking PKB alpha/Akt1[J]. Biol Reprod, 2010, 82(2): 246-256.
[19] REDDY P, ADHIKARI D, ZHENG W, et al. PDK1 signaling in oocytes controls reproductive aging and lifespan by manipulating the survival of primordial follicles[J]. Mol Genet, 2009, 18(15): 2813-2824.
[20] FAN H Y, LIU Z, CAHILL N, et al. Targeted disruption of Pten in ovarian granulosa cells enhances ovulation and extends the life span of luteal cells[J]. Mol Endocrinol, 2008, 22(9): 2128-2140.
[21] FINGAR D C, BLENIS J. Target of rapamycin (TOR): An integrator of nutrient and growth factor signals and coordinator of cell growth and cell cycle progression[J]. Oncogene, 2004, 23(18): 3151-3171.
[22] NYGARD O, NILSSON L. Translational dynamics. Interactions between the translational factors, tRNA and ribosomes during eukaryotic protein synthesis[J]. Eur J Biochem, 1990, 191(1): 1-17.
[23] 朱士恩. 动物生殖生理学[M]. 北京: 中国农业出版社, 2006: 359. [24] FOURNIER M J, MAXWELL E S. The nucleolar snRNAs: Catching up with the spliceosomal snRNAs[J]. Trends Biochem Sci, 1993, 18(4): 131-135.
[25] 张春林, 李科瑛, 刘明兰, 等. 卵母细胞生发泡破裂(GVBD)发生前后脱卵丘细胞对猪卵母细胞体外成熟的影响[J]. 农业生物技术学报, 2014, 22(9): 1090-1096.




 下载:
下载: