Effects of N and P additions on leaf litter decomposition in Michelia macclurei woodland
-
摘要:目的
研究外源性氮和磷对火力楠Michelia macclurei凋落叶分解速率以及分解过程中N、P、K含量变化的影响,为科学合理经营火力楠人工林提供科学依据。
方法在广东云勇林场的火力楠林地上建立4块5 m×5 m的小样地,将凋落叶放入尼龙网袋,并分别喷施N、P或N+P,每隔3个月取样测定凋落叶分解速率和N、P、K含量的变化。
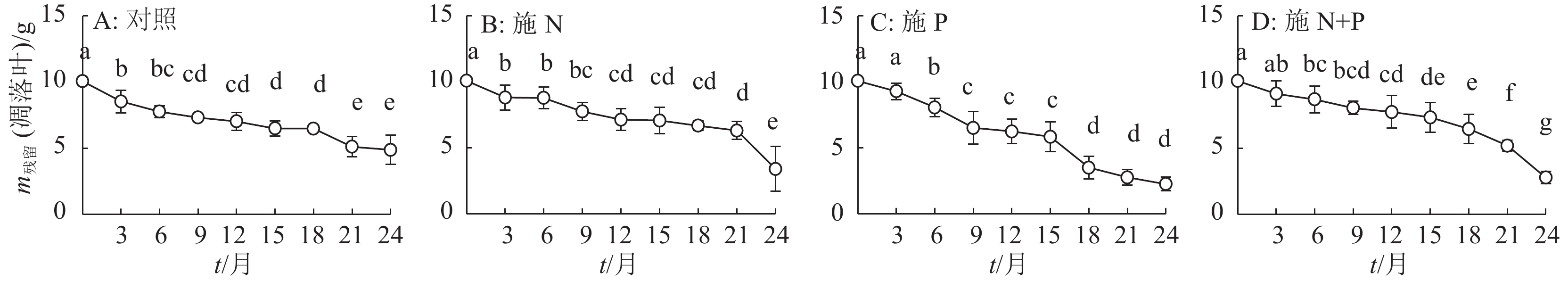
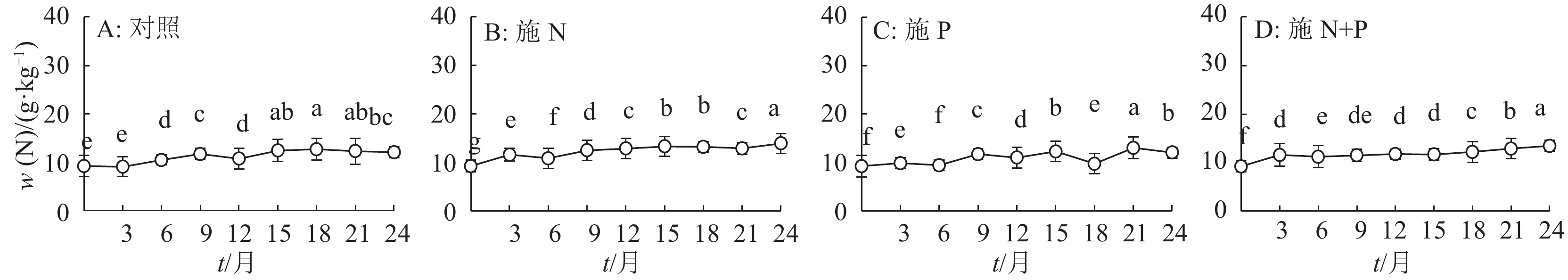
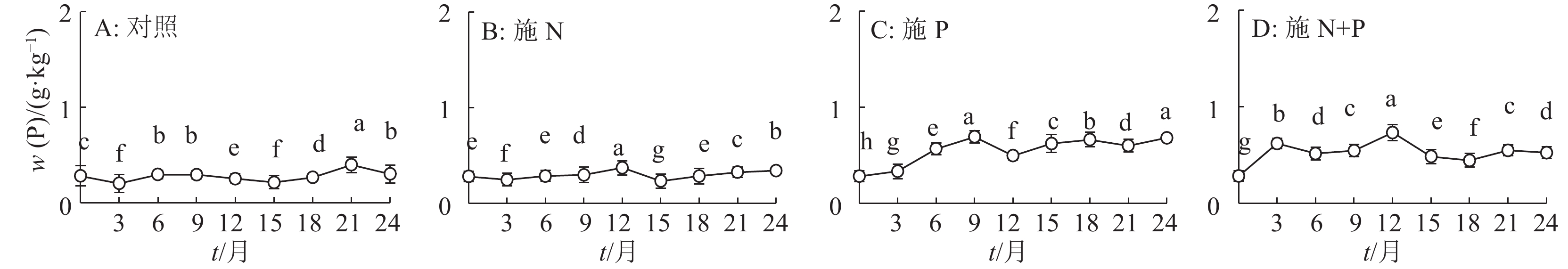
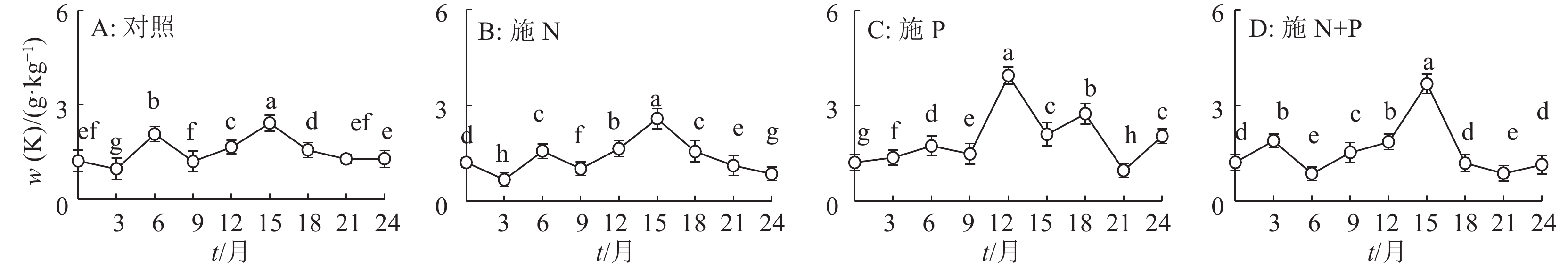
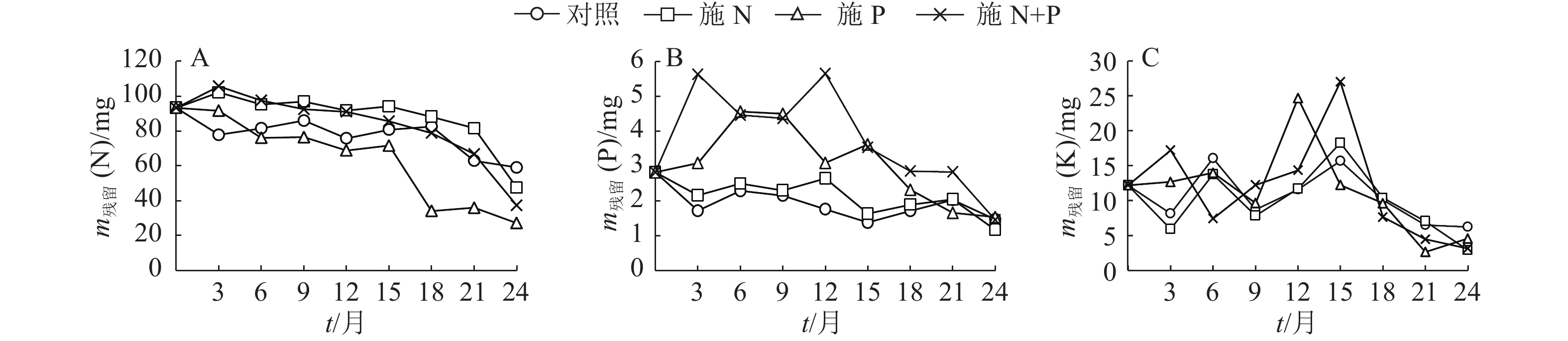
结果施N、P及N+P后凋落叶的分解速率有不同程度的加快,分解24个月后,对照及施N、P和N+P的凋落叶分别分解了52%、66%、78%和73%;对照及施N、P和N+P的凋落叶N含量分别增加了23%、33%、23%和31%,火力楠林地各处理的凋落叶N含量显著大于凋落叶的初始N含量,其中施N和N+P的凋落叶N含量显著大于对照;对照及施N、P和N+P的凋落叶P含量分别增加了7%、18%、59%和46%,且显著大于初始P含量,其中施P和N+P的凋落叶P含量显著大于对照。各处理的凋落叶K含量变化无规律,施 N和N+P的凋落叶K含量显著小于对照,而施P的显著大于对照。对照的凋落叶N和K残留量显著大于其他处理,而施N处理的凋落叶P残留量显著小于对照。
结论施N、P及N+P均可促进火力楠凋落叶的分解,其中施用P肥效果最佳,建议在火力楠林地可适当施用P肥,促进火力楠林的养分循环。
Abstract:ObjectiveThe effects of external nitrogen and phosphorus on leaf litter decomposition rate and changes in N, P, K contents during the decomposition process were studied in a Michelia macclurei woodland to provide a basis for scientific and rational management of M. macclurei plantations.
MethodFour 5 m×5 m sample plots were set in a M. macclurei woodland of Yunyong forest farm, Guangdong Province. Leaf litters were placed in nylon bags and were sprayed with N, P or N+P respectively. The leaf litter decomposition rate and N, P and K contents were determined every three months.
ResultThe decomposition rate of leaf litter was significantly accelerated by N, P and N+P additions. After 24 months of deconposition, the leaf litter decomposition rates of the control, N, P and N+P additions reached 52%, 66%, 78% and 73% respectively. N content of leaf litters of the control, N, P and N+P additions increased by 23%, 33%, 23% and 31% respectively, and was significantly higher than their initial N content, among which N contents of leaf litters treated with N and N+P additions were significantly greater than the control. P content of leaf litters of the control, N, P and N+P additions increased by 7%, 18%, 59% and 46% respectively, and was significantly higher than their initial P content, among which P content of leaf litters treated with P or N+P additions was significantly greater than the control. K content of leaf litters changed irregularly, and that treated with N or N+P additions was significantly smaller than the control, while that treated with P addition was significantly greater than the control. Remaining amounts of N and K of leaf litter in the control were significantly greater than the other treatments, and remaining amount of P treated with N addition was significantly less than the control.
ConclusionN, P and N+P additions can accelerate leaf litter decomposition in M. macclurei woodland, P addition had the best effect. It is suggested that P fertilizer might be added appropriately in M. macclurei woodlands to promote nutrient cycling.
-
Keywords:
- Michelia macclurei /
- leaf litter /
- decomposition rate /
- external N and P
-
大环内酯类抗生素是临床常用的治疗动物呼吸道疾病的药物,如泰乐菌素、替米考星、泰万菌素和加米霉素等,该类药物的作用机制均是通过与敏感菌的核糖体50S亚基结合,抑制肽链的合成和延长,从而影响细菌蛋白质的合成[1]。泰地罗新是新型的动物专用16环内酯类抗生素,属于半合成的泰乐菌素衍生物,结构式见图1。泰地罗新一般用于预防和治疗猪和牛呼吸道系统疾病,具有给药后生物利用度高,残留量低,用量少,消除半衰期长和一次给药等特点[2-4]。2011年欧盟兽用药品委员会批准了Intervet公司以泰地罗新为主要成分的无菌注射液(商品名为Zuprevo)的市场许可申请,随后美国也相继批准上市。
大环内酯类抗生素常见的检测方法有微生物法、二极管阵列检测(Diode array detector,DAD)法[5-7]、紫外检测法[5]、荧光检测(Fluorescence detector,FLD)法[8]、电化学检测(Electron capture detector,ECD)法[9]、分子印迹法[10-11]、免疫金色谱法[12]、气相质谱联用(Gas chromatography-mass spectrometry,GC-MS)法[13]以及液相质谱联用(Liquid chromatography-tandem mass spectrometry,LC-MS/MS)法[14-16]。目前国内外最常用的是LC-MS/MS法,该法选择性强,灵敏度高。针对泰地罗新检测方法的研究还相对较少,欧洲药品管理局规定泰地罗新在猪组织中的最高残留限量(Maximum residue limit,MRL)分别为:肌肉1 200 ng·g–1,肝脏5 000 ng·g–1,肾脏10 000 ng·g–1,皮脂800 ng·g–1,注射部位7 500 ng·g–1。本研究采用高效液相色谱−串联质谱(HPLC-MS/MS)法分析猪组织(肌肉、肝脏、肾脏和皮脂)中泰地罗新残留,并进行了方法学评价。
1. 材料与方法
1.1 仪器与试剂
LC-20A型高效液相色谱仪(岛津,日本);API4000 MS/MS电喷雾−串联四级杆质谱仪(AB SCIEX,美国),配Analyst 4.1.5软件;AUX 120型电子分析天平(岛津,日本);Mach 1.6R冷冻型离心机(Thermo,美国);Milli-Q纯水机(Millipore,美国)。
泰地罗新对照品纯度(w)为99.1%,购自上海同仁药业股份有限公司;超纯水由Milli-Q超纯水仪制取;HLB固相萃取柱:500 mg,6 mL(CNW公司);乙腈、甲醇和甲酸均为色谱纯;磷酸二氢钾和正己烷均为国产分析纯;0.1 mol·L–1 磷酸二氢钾溶液配制方法:准确称取13.61 g磷酸二氢钾,加水溶解,定容至1 000 mL,用磷酸调pH至2.5。
1.2 标准工作液的配制
泰地罗新标准储备液(1 g·L–1)的配制:准确称取10 mg泰地罗新标准品于10 mL容量瓶中,用甲醇溶解并定容至10 mL,配成1 g·L–1的标准储备液,–20 ℃冰箱贮存备用,有效期6个月。
泰地罗新标准工作液的配制:准确吸取泰地罗新储备液1 mL于10 mL容量瓶中,用甲醇溶解并定容至10 mL,稀释成0.1 g·L–1的工作液,再依次稀释至500、200、100、50、20、10、5、2 μg·L–1的标准工作液,–20 ℃冰箱贮存备用,有效期6个月。
1.3 HPLC-MS/MS条件
1.3.1 HPLC条件
色谱柱:Phenomenex Luna Omega C18,2.1 mm×50 mm×1.6 μm。流动相:A相为乙腈,B相为φ为0.1%的甲酸水溶液。梯度洗脱程序:0~0.7 min,100% B;0.8~3.5 min,90% A,10% B;3.6~5.0 min,100% B。流速:0.25 mL·min–1,柱温:35 ℃,进样量:5 μL。
1.3.2 MS/MS条件
质谱扫描模式:多反应检测(Multiple reaction monitoring,MRM),电喷雾离子源正离子扫描,电喷雾电压:5.5 kV,雾化气压:60 psi,辅助气压:50 psi,气帘气压:25 psi,离子源温度:650 ℃。泰地罗新MRM参数:母离子m/z为734.6,子离子m/z为98.1、174.4,其中m/z 734.6/98.1是定量离子对;去簇电压:144 V;射入电压:10 V;碰撞室电压:12 V;碰撞能量:75 V/53 V。
1.4 样品前处理
称取待检测组织 (2.00±0.02) g 于50 mL离心管中,加适量泰地罗新标准工作液,涡旋30 s,静置20 min,加入15 mL 0.1 mol·L–1 的磷酸二氢钾提取液,涡旋30 s,振摇10 min,40 kHz超声10 min,离心10 min (10 000 r·min–1,4 ℃),收集上清液。残渣用15 mL 0.1 mol·L–1 的磷酸二氢钾提取液重复提取1次,合并上清液,加入5 mL正己烷,涡旋1 min,离心10 min (6 000 r·min–1,4 ℃),弃上层正己烷层,备用。
采用HLB固相萃取柱对上述提取液进行净化,萃取柱预先依次用6 mL甲醇和6 mL纯水活化,取15 mL提取液上柱,确保溶液缓慢流过HLB柱(必要时可采用真空泵),然后用5 mL纯水洗涤,8 mL甲醇洗脱。净化后的提取液于室温下用氮气吹至2 mL,加入3 mL纯水定容至5 mL,涡旋1 min,过0.22 μm滤膜,供HPLC-MS/MS测定。
空白肝脏、肾脏组织按上述方法前处理后得到空白基质,分别用空白基质对肝脏2 500、5 000、10 000 ng·g-1添加剂量样品进行4倍稀释,对肾脏5 000、10 000、20 000添加剂量样品进行10倍稀释,过0.22 µm滤膜,供HPLC-MS/MS测定。
1.5 标准曲线的制备
取7份空白肌肉、肝脏、肾脏和皮脂样品,按照“1.4”样品前处理方法处理,分别用所得空白猪组织样品溶液将泰地罗新工作液稀释,具体为肌肉480、240、120、48、24、12、5 μg·L–1,肝脏500、200、100、50、20、10、5 μg·L–1,肾脏400、200、100、40、20、10、5 μg·L–1,皮脂320、160、80、32、16、8、5 μg·L–1。按照“1.3”确定的HPLC-MS/MS条件进行分析,以测得的泰地罗新特征离子峰面积为纵坐标,对应的剂量为横坐标,绘制标准曲线,求得线性回归方程和相关系数 (r2)。
1.6 回收率与精密度
肌肉、肝脏、肾脏和皮脂样品分别在定量限、1/2MRL、MRL和2MRL 4个剂量进行添加回收试验。欧洲药品管理局规定猪肌肉、肝脏、肾脏和皮脂的MRL分别为1 200、5 000、10 000和800 ng·g–1。在 (2.00±0.02) g空白猪组织中加入适量对应质量分数的泰地罗新标准工作液,制备空白加标样品。按“1.4”样品前处理方法处理,按“1.3”HPLC-MS/MS条件检测。以外标法定量,计算求得4个剂量的回收率。每个处理设3批样品,每批样品做6次重复。
2. 结果与分析
2.1 质谱参数确定
分别采用电喷雾离子源正离子与负离子扫描,用蠕动泵将泰地罗新标准工作液以10 μL·min–1的速度注入离子源中,结果显示正离子模式下泰地罗新响应值更高,并得到[M+H]+(m/z734.6)和[M+2H]2+(m/z 368.2)准分子离子峰,对比发现[M+H]+(m/z 734.6)具有更高的响应值。进行二级质谱扫描,对去簇电压、碰撞能量等参数进行调整优化,选择响应值高,峰形无干扰的特征子离子,最终以m/z 98.1作为泰地罗新定量离子,以m/z 174.4作为定性离子。泰地罗新的二级质谱图见图2。
2.2 方法的特异性
分析猪肌肉、肝脏、肾脏和皮脂样品时,特征离子质量色谱图中目标化合物的保留时间处没有杂质干扰,表明该方法有较好的特异性。空白肌肉样品及添加25 ng·g–1泰地罗新的肌肉样品特征离子质量色谱图见图3。
2.3 检测限与定量限
以3倍信噪比为方法的检测限,测得肌肉、肝脏、肾脏和皮脂中泰地罗新的检测限均为10 ng·g–1,以10倍信噪比为方法的定量限,测得4种组织中泰地罗新的定量限均为25 ng·g–1。
2.4 标准曲线与线性范围
肌肉、肝脏、肾脏和皮脂中泰地罗新添加剂量分别在25~2 400、25~2 500、25~2 000和25~1 600 ng·g–1范围内,特征离子峰面积与对应添加剂量的线性关系良好,r2≥0.99。肌肉、肝脏、肾脏和皮脂中泰地罗新残留检测的基质匹配标准曲线见表1。
表 1 猪组织中泰地罗新检测的基质匹配标准曲线Table 1. The martrix-matched standard curves of tildipirosin detected in swine tissues组织样品 w (泰地罗新)1)/
(ng·g–1)标准曲线方程 2) r2 肌肉 25~2 400 y=109x+120 0.995 5 肝脏 25~2 500 y=124x−201 0.998 7 肾脏 25~2 000 y=55.1x+133 0.997 3 皮脂 25~1 600 y=50.8x+214 0.997 5 1)猪组织中泰地罗新的添加剂量范围;2)x:猪组织中泰地罗新的添加剂量,y:泰地罗新特征离子峰面积 2.5 回收率与精密度
肌肉中泰地罗新添加剂量在25~2 400 ng·g–1范围内,批内平均回收率93.3%~101.0%,批内回收率相对标准偏差4.3%~9.5%,批间回收率相对标准偏差6.1%~7.4%。肝脏中泰地罗新添加剂量在25~10 000 ng·g–1范围内,批内平均回收率93.3%~101.0%,批内回收率相对标准偏差2.3%~8.0%,批间回收率相对标准偏差5.3%~7.1%。肾脏中泰地罗新添加剂量在25~20 000 ng·g–1范围内,批内平均回收率85.6%~101.0%,批内回收率相对标准偏差2.5%~8.9%,批间回收率相对标准偏差4.7%~6.4%。皮脂中泰地罗新添加剂量在25~1 600 ng·g–1范围内,批内平均回收率90.7%~105.0%,批内回收率相对标准偏差3.2%~9.0%,批间相对标准偏差5.2%~7.6%。具体回收率结果见表2。
表 2 猪组织中添加泰地罗新样品回收率及相对标准偏差Table 2. Recoveries and relative standard deviations of swine tissue samples added tildipirosin组织
样品w (泰地罗新)添加/
(ng·g–1)批内平均回收率/% 批内回收率相对标准偏差/% 批间平均
回收率/%批间回收率相对
标准偏差/%批次1 批次2 批次3 批次1 批次2 批次3 肌肉 25 101.0 96.6 96.3 6.6 7.3 5.3 97.8 6.4 600 93.3 100.0 97.6 8.5 4.3 8.1 97.1 7.4 1 200 97.5 95.5 97.9 9.5 5.6 6.6 97.0 7.1 2 400 99.0 98.5 99.6 4.7 7.9 6.3 99.1 6.1 肝脏 25 99.1 96.8 101.0 6.7 8.0 7.1 99.1 7.1 2 500 99.9 99.1 101.0 6.4 6.8 3.1 100.0 5.4 5 000 96.0 101.0 93.3 5.8 2.3 4.6 96.7 5.3 10 000 96.7 100.0 93.9 5.4 2.6 6.2 96.9 5.3 肾脏 25 101.0 98.4 101.0 4.3 8.9 6.1 100.0 6.4 5 000 92.3 96.1 97.2 6.0 4.9 2.9 95.2 5.0 10 000 85.6 91.5 93.8 2.5 4.5 4.5 90.3 5.5 20 000 93.3 90.0 96.1 4.9 3.3 3.7 93.1 4.7 皮脂 25 100.0 105.0 102.0 6.3 4.2 4.8 102.0 5.2 400 94.6 102.0 90.7 3.2 4.1 4.6 95.8 6.3 800 92.3 94.4 91.1 8.2 5.9 6.5 92.6 6.7 1 600 92.4 94.7 91.5 9.0 5.6 8.8 92.9 7.6 3. 讨论与结论
3.1 色谱条件优化
为考察不同流动相配比与洗脱条件对泰地罗新出峰的影响,分别采取了0.1% (φ)甲酸水溶液−乙腈和0.1% (φ)甲酸水溶液−甲醇的流动相配比,考察基质匹配同等剂量下泰地罗新的峰型、峰面积与响应值。对比发现0.1% (φ)甲酸水溶液−乙腈条件下泰地罗新响应值更高,且峰型良好无拖尾。相比甲醇作为流动相,乙腈洗脱能力更强,峰型更好。在色谱柱的选择上,在对大环内酯类药物的研究中多采用C8与C18类反相色谱柱[11, 17]。大环内酯类药物多含有碱性叔胺结构,在硅胶基固定相中易出现拖尾[18],因此本研究选用了非极性端基封尾的Phenomenex Luna Omega C18(2.1 mm×50 mm×1.6 μm)色谱柱,并与Phenomenex Kinetex F5(2.1 mm×50 mm×1.6 μm)进行了柱效对比,发现Phenomenex Luna Omega C18和kinetex F5对目标物质均有较好的分离效果,保留时间稳定。考虑到成本差异,最终选用Phenomenex Luna Omega C18色谱柱。
3.2 前处理方法优化
3.2.1 提取剂选择
大环内酯类生物样品的提取剂常有乙腈[14, 19]、磷酸二氢钾溶液[5, 20]、偏磷酸−甲醇(体积比7∶3)[7, 21]、磷酸二氢钾−乙腈(体积比3∶1)[6]、φ为70%的甲醇水溶液[22-23]、甲醇−乙腈(体积比1∶1)[24]和二氯甲烷[25]等,也有研究者使用pH 10的硼酸钠缓冲液−乙酸乙酯(体积比1∶1)进行泰拉霉素和替米考星等药物的提取[11]。国内针对泰地罗新的特异性提取方法研究较少,结合泰地罗新的理化性质,本研究考察了乙腈与0.1 mol·L–1磷酸二氢钾溶液为提取剂对泰地罗新进行提取的回收率比较试验。采用“1.4”的提取和净化程序,在其他试验条件一致的情况下,肌肉、肝脏和肾脏中2种提取液的回收率结果并无显著差异,且均在80%以上,但皮脂中2种提取液的回收率均不高且表现不稳定,低剂量下部分样品回收率低于50%。可能是动物脂肪组织中复杂的内源性物质对目标物提取造成了干扰。通过调节磷酸二氢钾溶液pH值进行提取效果优化,发现0.1 mol·L–1 pH 2.5的磷酸二氢钾溶液的回收率更高且平行性较好,结果稳定可取,因此最终选用为本研究的提取液。在提取液使用量的选择上,0.1 mol·L–1的磷酸二氢钾溶液在同种方法下相较于单次提取,2次提取的回收率可普遍提高约11%~16%,能达到更好的提取效果。
3.2.2 净化条件的选择
对于大环内酯类生物样品的提取和净化,主要使用SPE固相萃取柱,如C18[26]、SCX[7, 20]、HLB[27-29]和silica SPE小柱[14]等,本文结合文献报道,选用了HLB和C18这2种填料的固相萃取柱进行泰地罗新的回收率比对试验。采用“1.4”的提取方法对猪空白组织进行提取,上清液中添加相同体积与质量浓度的泰地罗新标准工作液,以排除前期提取过程可能造成的误差与干扰,分别进行2种不同固相萃取柱净化与回收效果的对比。结果显示HLB柱萃取净化的样品回收率要高于C18约11%~19%,另外,C18柱在操作时对流速要求较高,柱床一旦干涸,会发生相塌陷使样品无法正常保留,降低回收率,综合考虑最终选用HLB固相萃取柱作为猪组织中泰地罗新提取液的净化方法。在3 mL 200 mg、3 mL 500 mg、6 mL 200 mg以及6 mL 500 mg 4种规格的选择上,3 mL 200 mg的HLB固相萃取柱即可满足残留分析,但在皮脂组织提取中,存在回收率过低及过柱期间堵塞的情况,因此最终选择6 mL 500 mg的规格,完全能够满足泰地罗新残留分析的要求。
3.3 结论
本文建立了一种可靠、灵敏的适用于猪肌肉、肝脏、肾脏和皮脂组织中泰地罗新残留量检测的高效液相色谱−串联质谱(HPLC-MS/MS)法。样品采用磷酸二氢钾缓冲溶液提取,HLB固相萃取柱净化,并利用HPLC-MS/MS测定分析。方法简单易行,所需材料廉价易得,特异性好,仪器方法检测限远低于欧盟规定的泰地罗新在猪体内的MRL值,灵敏度高,易于重复,可作为猪组织中泰地罗新残留量检测方法的参考。
-
表 1 火力楠凋落叶分解24个月时的凋落叶养分含量和残留量1)
Table 1 Remaining mass of leaf litter and nutrient in the Michelia macclurei woodland after 24 months of decomposition
处理 m残留(凋落叶)/g w/(g·kg-1) m残留/mg N P K N P K 对照 4.89±1.10a 12.10±0.11c 0.30±0.00c 1.28±0.07b 59.12±0.13a 1.47±0.00a 6.24±0.07a 施 N 3.40±1.69b 13.93±0.06a 0.34±0.00c 0.85±0.01c 47.52±0.09b 1.16±0.00b 2.90±0.02c 施 P 2.25±0.50d 12.07±0.12c 0.68±0.01a 2.04±0.03a 27.15±0.06d 1.53±0.00a 4.59±0.01b 施 N+P 2.77±0.47c 13.46±0.12b 0.52±0.00b 1.14±0.00c 37.29±0.05c 1.45±0.00a 3.15±0.00c 1)表中数据为平均值±标准差;同列数据后凡是具有一个相同字母者表示处理间差异不显著(P>0.05,Duncan’s 法) -
[1] 卢广超, 邵怡若, 薛立. 氮沉降对凋落物分解的影响研究进展[J]. 世界林业研究, 2014, 27(1): 35-42. [2] 王相娥, 薛立, 谢腾芳. 凋落物分解研究综述[J]. 土壤通报, 2009, 40(6): 1473-1478. [3] 仲米财, 王清奎, 高洪, 等. 中亚热带主要树种凋落叶在杉木人工林中分解及氮磷释放过程[J]. 生态学杂志, 2013, 32(7): 1653-1659. [4] 赵喆, 刘延文, 纪福利, 等. 华北落叶松–白桦凋落物混合分解研究[J]. 中南林业科技大学学报, 2016, 36(12): 74-78. [5] WANG G G, KLINKA K. White spruce foliar nutrient concentrations in relation to tree growth and soil nutrient amounts[J]. Forest Ecol Manag, 1997, 98(1): 89-99.
[6] 遆超普, 颜晓元. 基于氮排放数据的中国大陆大气氮素湿沉降量估算[J]. 农业环境科学学报, 2010, 29(8): 1606-1611. [7] MATSON P, LOHSE K A, HALL S J. The globalization of nitrogen deposition: Consequences for terrestrial ecosystems[J]. AMBIO: A: J Human Environ, 2002, 31(2): 113-119.
[8] 樊后保, 刘文飞, 徐雷, 等. 氮沉降下杉木(Cunninghamia lanceolata)人工林凋落叶分解过程中C、N元素动态变化[J]. 生态学报, 2008, 28(6): 2546-2553. [9] WISSUWA M. How do plants achieve tolerance to phosphorus deficiency? Small causes with big effects[J]. Plant Physiol, 2003, 133(4): 1947-1958.
[10] 李银, 曾曙才, 黄文娟. 模拟氮沉降对鼎湖山森林土壤酸性磷酸单酯酶活性和有效磷含量的影响[J]. 应用生态学报, 2011, 22(3): 631-636. [11] 涂利华, 胡红玲, 胡庭兴, 等. 华西雨屏区亮叶桦凋落叶分解对模拟氮沉降的响应[J]. 植物生态学报, 2012, 36(2): 99-108. [12] 张毓涛, 李吉玫, 李翔, 等. 模拟氮沉降对天山云杉凋落叶分解及其养分释放的影响[J]. 干旱区研究, 2016, 33(5): 966-973. [13] 毛宏蕊, 陈金玲, 金光泽. 氮添加对典型阔叶红松林凋落叶分解及养分释放的影响[J]. 北京林业大学学报, 2016, 38(3): 21-31. [14] 肖银龙, 涂利华, 胡庭兴, 等. 模拟氮沉降对华西雨屏区苦竹林凋落物基质质量的影响[J]. 生态学报, 2013, 33(20): 6587-6594. [15] 周世兴, 肖永翔, 向元彬, 等. 模拟氮沉降对华西雨屏区天然常绿阔叶林凋落叶分解过程中基质质量的影响[J]. 生态学报, 2016, 36(22): 7428-7435. [16] 葛晓改, 曾立雄, 肖文发, 等. 三峡库区森林凋落叶化学计量学性状变化及与分解速率的关系[J]. 生态学报, 2015, 35(3): 779-787. [17] 陈法霖, 郑华, 欧阳志云, 等. 土壤微生物群落结构对凋落物组成变化的响应[J]. 土壤学报, 2011, 48(3): 603-611. [18] 李艳红, 杨万勤, 罗承德, 等. 桉–桤不同混合比例凋落物分解过程中土壤动物群落动态[J]. 生态学报, 2013, 33(1): 159-167. [19] 廖姝, 杨万勤, 彭艳, 等. 土壤动物对四川盆地四种树种凋落叶在不同物候时期可溶性碳和氮动态的影响[J]. 生态学杂志, 2016, 35(12): 3172-3182. [20] 郝建, 莫慧华, 黄弼昌, 等. 西南桦和尾巨桉凋落叶分解及其与土壤性质的相关性[J]. 林业科学研究, 2016, 29(2): 202-208. [21] 金龙, 吴志祥, 杨川, 等. 不同环境下橡胶凋落叶分解的微生物研究[J]. 森林与环境学报, 2016, 36(1): 73-79. [22] 黄宇, 冯宗炜, 汪思龙, 等. 杉木、火力楠纯林及其混交林生态系统C、N 贮量[J]. 生态学报, 2005, 25(12): 3146-3154. [23] 鲁如坤. 土壤农业化学分析方法[M]. 北京: 中国农业科技出版社, 2000. [24] BERG B, WESSÉN B, EKBOHM G. Nitrogen level and decomposition in Scots pine needle litter[J]. Oikos, 1982, 38(3): 291-296.
[25] BOXMAN A W, BLANCK K, BRANDRUD T et al. Vegetation and soil biota response to experimentally-changed nitrogen inputs in coniferous forest ecosystems of the NITREX project[J]. Forest Ecol Manag, 1998, 101(1/2/3): 65-79.
[26] 徐演鹏. 外源碳、氮对土壤节肢动物群落的影响[D]. 哈尔滨: 东北林业大学, 2014. [27] VOŘÍŠKOVÁ J, DOBIÁŠOVÁ P, ŠNAJDR J, et al. Chemical composition of litter affects the growth and enzyme production by the saprotrophic basidiomycete Hypholoma fasciculare[J]. Fungal Ecol, 2011, 4(6): 417-426.
[28] AMEND A S, MATULICH K L, MARTNYJ B H. Nitrogen addition, not initial phylogenetic diversity, increases litter decomposition by fungal communities[J]. Front Microbiol, 2015, 6: 109.
[29] ÅGREN G I, BOSATTA E, MAGILL A H. Combining theory and experiment to understand effects of inorganic nitrogen on litter decomposition[J]. Oecologia, 2001, 128(1): 94-98. ÅGREN G I, BOSATTA E, MAGILL A H. Combining theory and experiment to understand effects of inorganic nitrogen on litter decomposition[J]. Oecologia, 2001, 128(1): 94-98.
[30] 彭少麟, 刘强. 森林凋落物动态及其对全球变暖的响应[J]. 生态学报, 2002, 22(9): 1534-1544. [31] 陆晓辉, 丁贵杰, 陆德辉. 人工调控措施下马尾松凋落叶化学质量变化及与分解速率的关系[J]. 生态学报, 2017, 37(7): 2325-2333. [32] 李雪峰, 韩士杰, 胡艳玲, 等. 长白山次生针阔混交林叶凋落物中有机物分解与碳、氮和磷释放的关系[J]. 应用生态学报, 2008, 19(2): 245-251. [33] LI L J, ZENG D H, YU Z Y, et al. Impact of litter quality and soil nutrient availability on leaf decomposition rate in a semi-arid grassland of Northeast China[J]. J Arid Environ, 2011, 75(9): 787-792.
[34] 董喜光, 张越, 薛立, 等. 火力楠林的土壤特性对外源性N 和P 的响应[J]. 中南林业科技大学学报, 2016, 36(9): 104-108. [35] QUALLS R G, RICHARDSON C J. Phosphorus enrichment affects litter decomposition, immobilization, and soil microbial phosphorus in wetland mesocosms[J]. Soil Sci Soc Am J, 2000, 64(2): 799-808.
[36] XU X N, HIRATA E. Decomposition patterns of leaf litter of seven common canopy species in a subtropical forest: N and P dynamics[J]. Plant Soil, 2005, 273(1/2): 279-289.
[37] 朱仕明, 董喜光, 薛立, 等. 外源性氮和磷添加对藜蒴林土壤养分及生化特性的影响[J]. 安徽农业大学学报, 2015, 42(3): 347-352. [38] 陈金林, 吴春林, 黄全能. 杉林红壤的供P缓冲性与P肥需要量研究[J]. 林业科学研究, 2002, 15(5): 588-592. [39] 庞丽, 张一, 周志春, 等. 模拟氮沉降对低磷胁迫下马尾松生长和磷效率的影响[J]. 应用生态学报, 2014, 25(5): 1275-1282. [40] WIEDER W R, CLEVELAND C C, TOWNSEND A R. Controls over leaf litter decomposition in wet tropical forests[J]. Ecology, 2009, 90(12): 3333-3341.
[41] TU L H, HU H L, HU T X, et al. Decomposition of different litter fractions in a subtropical bamboo ecosystem as affected by experimental nitrogen deposition[J]. Pedosphere, 2011, 21(6): 685-695.
[42] 弓晓静, 余明泉, 胡小飞, 等. 氮磷添加对红壤区城郊湿地松林凋落叶分解的影响[J]. 生态学杂志, 2010, 29(12): 2327-2333. [43] PRESCOTT C E. Does nitrogen availability control rates of litter decomposition in forests?[J]. Plant Soil, 1995, 168(1): 83-88.
[44] 李仁洪, 胡庭兴, 涂利华, 等. 华西雨屏区慈竹林凋落叶分解过程养分释放对模拟氮沉降的响应[J]. 林业科学, 2010, 46(8): 8-14.




 下载:
下载: