Phenotypic identification and genetic analysis of two rice (Oryza sativa L.) mutants induced by heavy ion
-
摘要:目的
明确2个水稻突变体的表型特征与遗传方式。
方法通过重离子诱变野生型籼稻种质BBS,从其M2代中筛选出2个突变体,分别命名为m2和m3。通过表型观察和性状比较,对突变体材料进行鉴定;构建了粳稻种质02428(父本)与m2、m3的F2群体,并进行遗传分析。
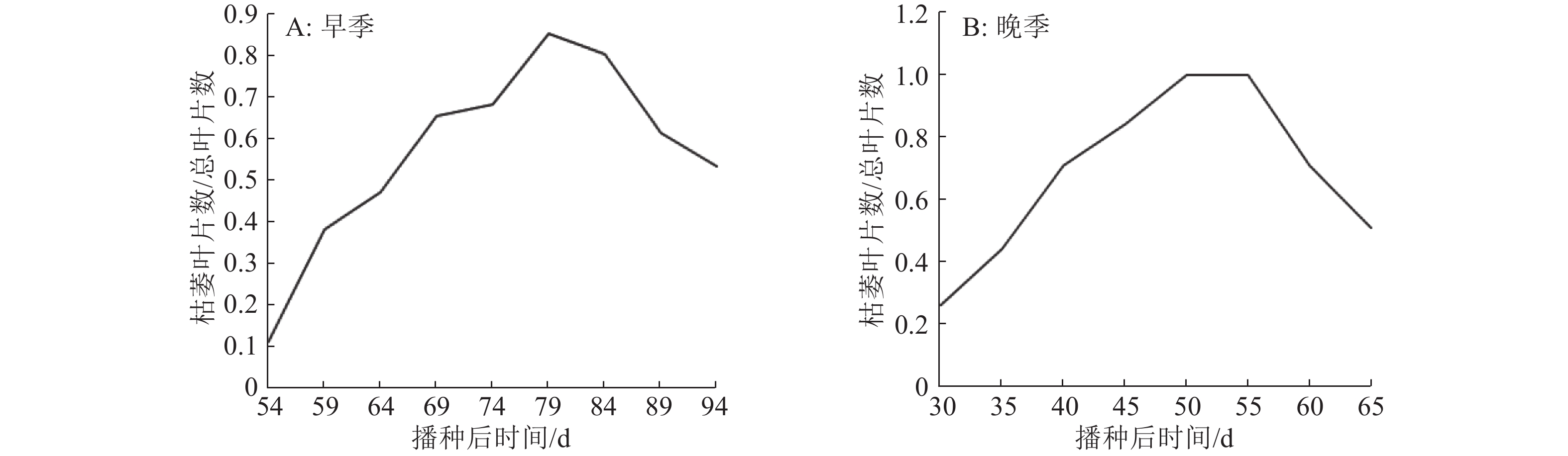
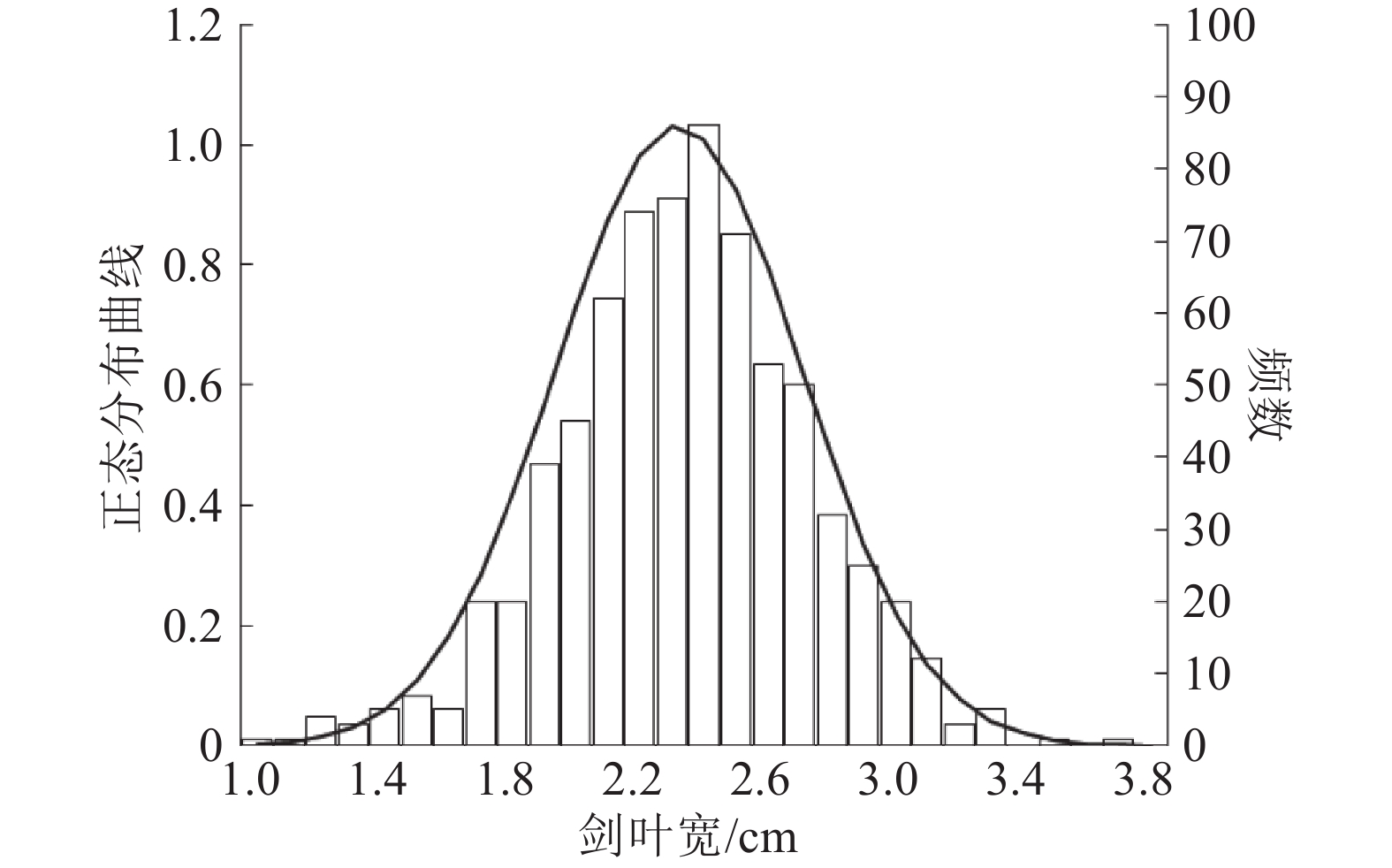
结果与野生型BBS相比,m2全生育期叶宽极显著变窄且内卷;m2剑叶、倒2叶和倒3叶的卷曲度分别为22.30%、38.15%和28.84%,与野生型BBS差异达到极显著水平;m2表现出高度不育。早季播种后第54天、晚季播种后第30天,m3从主茎新叶叶梢开始枯萎,整个叶枯表型持续25 d左右,之后新长出的叶片恢复正常;m3主穗质量和主穗粒数极显著下降,其他农艺性状与野生型BBS无显著差异。遗传分析结果表明,m2/02428的F2群体剑叶宽的频率分布符合正态分布,m3/02428的F2群体中正常个体与叶片枯萎个体的分离比符合3∶1的理论比值。
结论m2为窄叶突变体,其窄叶性状受多个基因控制;m3为叶片枯萎突变体,其突变性状受1对隐性核基因控制。
Abstract:ObjectiveTo clarify the phenotypic characteristics and genetic patterns of two rice (Oryza sativa L.) mutants.
MethodTwo mutants were screened from the M2 generation of the indica rice germplasm BBS (wild type) induced by heavy ion, named m2 and m3 respectively. Firstly, the mutant materials were identified by means of phenotypic observation and agronomic trait comparison. Secondly, the F2 populations of 02428 (male parent)/m2 and 02428/m3 were constructed for genetic analysis.
ResultCompared with BBS, the leaves of m2 were inner-rolled and the leaf width was significantly reduced during the whole growth period. The rolling index of flag leaf, the 2nd and 3rd leaf from the top were 22.30%, 38.15% and 28.84% respectively, which were significantly different from BBS. The mutant m2 showed a high level of sterility. The new leaf tip of m3 main stem started necrosis on the 54th day after sowing in early season or 30th day after sowing in late season. The leaf necrosis phenotype sustained about 25 days and then new leaves recovered to normal phenotype. Compared with BBS, the main panicle weight and grain number of m3 dropped highly significantly, but other agronomic traits had no significant difference. Genetic analysis indicated that the frequency distribution of flag leaf width of the F2 population of m2/02428 was in accordance with normal distribution. The segregation ratio of normal individuals and leaf necrotic individuals fitted 3∶1 in the F2 generation of m3/02428.
ConclusionThe mutant m2 is a narrow leaf mutant and the narrow leaf trait is controlled by multiple genes, whereas m3 is a leaf necrosis mutant and the mutant phenotype is controlled by a pair of recessive nuclear genes.
-
Keywords:
- rice (Oryza sativa L.) /
- heavy ion irradiation /
- mutant /
- narrow leaf /
- leaf necrosis
-
-
表 1 野生型BBS以及突变体m2和m3 的农艺性状1)
Table 1 Agronomic traits of wild type BBS, m2 and m3
材料 株高/cm 主穗总粒数 主穗质量/g 主穗结实率/% 千粒质量/g 粒长宽比 m2 96.34±4.40** — — — — — m3 109.92±1.57 189.71±15.70** 3.64±0.29** 87.42±3.49 19.83±0.88 3.12±0.02 BBS 114.46±1.23 347.40±8.96 6.96±0.48 87.34±3.50 20.09±0.19 3.09±0.03 材料 剑叶 倒 2 叶 倒 3 叶 长/cm 宽/cm 长/cm 宽/cm 长/cm 宽/cm m2 35.66±1.39* 1.28±0.04** 53.23±1.25 0.96±0.02** 51.50±0.44 0.67±0.01** m3 37.16±1.55 2.09±0.05 — — — — BBS 42.70±3.30 2.13±0.06 48.75±1.25 1.65±0.06 54.00±4.00 1.64±0.01 1)“*”、“**”分别表示与野生型(BBS)比较,差异达 0.05、0.01 的显著水平(t 检验)。“—”表示数据缺失,其中 m2 高度不育,故主穗总粒数、主穗重、主穗结实率、千粒质量、长宽比无法测量;m3 部分叶片枯死,无法准确测量倒 2 叶和倒 3 叶的叶长和叶宽 表 2 野生型BBS和突变体m2叶片的卷曲度及叶夹角1)
Table 2 Leaf rolling indexes and leaf angles of m2 and wild type BBS
材料 卷曲度/% 叶夹角/(°) 剑叶 倒 2 叶 倒 3 叶 剑叶 倒 2 叶 倒 3 叶 m2 22.37±3.56** 38.15±4.27** 28.84±3.09** 19.69±2.61 13.65±0.53** 22.13±0.79* BBS 10.28±1.69 7.35±1.19 4.22±0.93 17.39±0.35 7.90±1.20 18.60±0.46 1) “*”、“**”分别表示与野生型(BBS)比较,差异达 0.05、0.01 的显著水平(t 检验) -
[1] 余增亮, 何建军, 邓建国, 等. 离子注入水稻诱变育种机理初探[J]. 安徽农业科学, 1989(1): 12-16. [2] HIRANO T, KAZAMA Y, ISHII K, et al. Comprehensive identification of mutations induced by heavy-ion beam irradiation in Arabidopsis thaliana[J]. Plant J, 2015, 82(1): 93-104.
[3] 韦祖生, 李开绵. 作物诱变育种及突变体鉴定与筛选研究进展[J]. 江西农业学报, 2007, 19(10): 38-41. [4] LING A P K, UNG Y C, HUSSEIN S, et al. Morphological and biochemical responses of Oryza sativa L. (cultivar MR219) to ion beam irradiation[J]. JZUSB, 2013, 14(12): 1132-1143.
[5] RAKWAL R, KIMURA S, SHIBATO J, et al. Growth retardation and death of rice plants irradiated with carbon ion beams is preceded by very early dose- and time-dependent gene expression changes[J]. Mol Cells, 2008, 25(2): 272-278.
[6] HWANG J E, HWANG S, KIM S, et al. Transcriptome profiling in response to different types of ionizing radiation and identification of multiple radio marker genes in rice[J]. Physiol Plant, 2014, 150(4): 604-619.
[7] WANG W, GU D P, ZHENG Q, et al. Leaf proteomic analysis of three rice heritable mutants after seed space flight[J]. Adv Space Res, 2008, 42(6): 1066-1071.
[8] KIM S, SONG M, LEE K J, et al. Genome-wide transcriptome profiling of ROS scavenging and signal transduction pathways in rice (Oryza sativa L.) in response to different types of ionizing radiation[J]. Mol Biol Rep, 2012, 39(12): 11231-11248.
[9] 冯章丽. 水稻叶色突变体基因定位研究进展[J]. 黑龙江农业科学, 2014(9): 135-139. [10] 张克勤, 戴伟民, 樊叶杨, 等. 水稻剑叶角度与主穗产量的遗传剖析[J]. 中国农学通报, 2008, 24(9): 186-192. [11] 颉红梅, 卫增泉, 郝冀方, 等. 重离子束辐照育种概述[C]//西部地区第二届植物科学与开发学术讨论会论文摘要集, 乌鲁木齐: 中国植物学会, 2001: 119. [12] ISHII K, KAZAMA Y, MORITA R, et al. Linear energy transfer-dependent change in rice gene expression profile after heavy-ion beam irradiation[J]. PLoS One, 2016, 11(7): 1-11.
[13] XU X, LIU B M, ZHANG L L, et al. Mutagenic effects of heavy ion irradiation on rice seeds[J]. Nucl Instrum Methods Phys Res B, 2012, 290(1): 19-25.
[14] 李文建, 周利斌, 陈积红, 等. 重离子诱变育种及其应用[C]//第三届全国微生物资源学术暨国家微生物资源平台运行服务研讨会会议论文摘要集, 兰州: 中国微生物学会, 2011. [15] SHI J, LU W, SUN Y. Comparison of space flight and heavy ion radiation induced genomic/epigenomic mutations in rice (Oryza sativa)[J]. Life Sci Space Res, 2014, 1(1): 74-79.
[16] 王昆, 罗琼, 蔡庆红, 等. 水稻株型的研究进展[J]. 湖南农业科学, 2013(17): 1-4. [17] 袁隆平. 杂交水稻超高产育种[J]. 杂交水稻, 1997, 12(6): 1-6. [18] XIANG J J, ZHANG G H, QIAN Q, et al. SEMI-ROLLED LEAF1 encodes a putative glycosylphosphatidylinositol: Anchored protein and modulates rice leaf rolling by regulating the formation of bulliform cells[J]. Plant Physiol, 2012, 159(4): 1488-1500.
[19] 张宝来. 水稻叶片衰老的研究进展[J]. 天津农业科学, 2013, 19(4): 19-24. [20] 郑庆伟. 中国农科院等提出高产优质超级杂交水稻设计育种新模型[J]. 农药市场信息, 2016(7): 48. [21] UBAIDILLAH M, KIM K, KIM Y H, et al. Identification of a drought-induced rice gene, OsSAP, that suppresses bax-induced cell death in yeast[J]. Mol Biol Rep, 2013, 40(11): 6113-6121.




 下载:
下载: