Nutrient element contents of root bleeding sap of soybeans at late growth stages
-
摘要:目的
研究不同产量水平的大豆Glycine max (L.) Merr.品种生育后期根系伤流液中氮素等养分元素含量的变化规律,以期为大豆育种和高产栽培提供生理依据。
方法以3种不同产量水平(低、中、高产)的大豆品种为试验材料,栽培管理条件相同,测定开花期(R2期)、结荚期(R4期)和鼓粒期(R6期)大豆根系伤流强度及伤流液中氮素(总氮、硝态氮、铵态氮和氨基酸)以及磷、钾、钙和钠等养分含量。
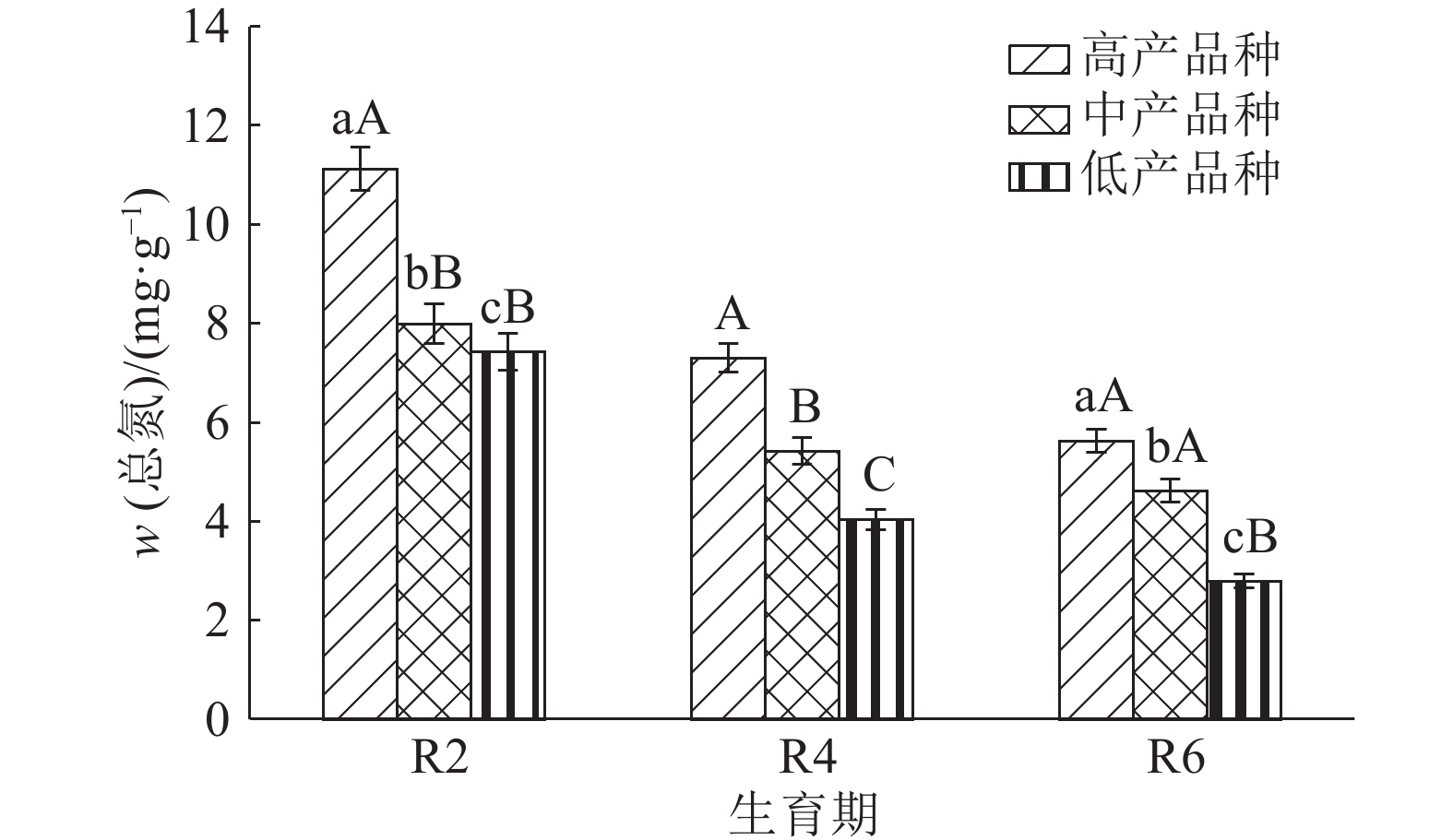
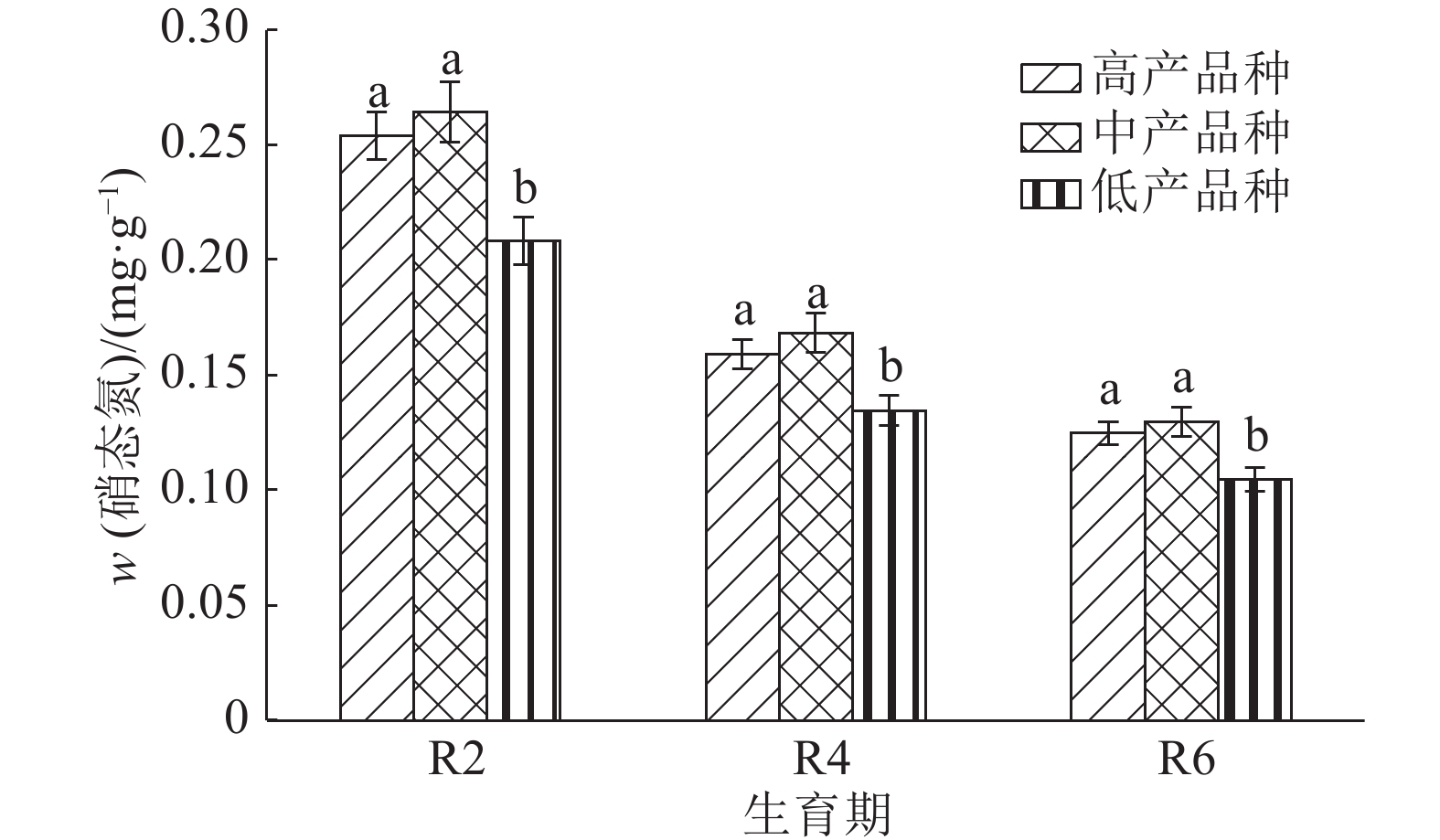
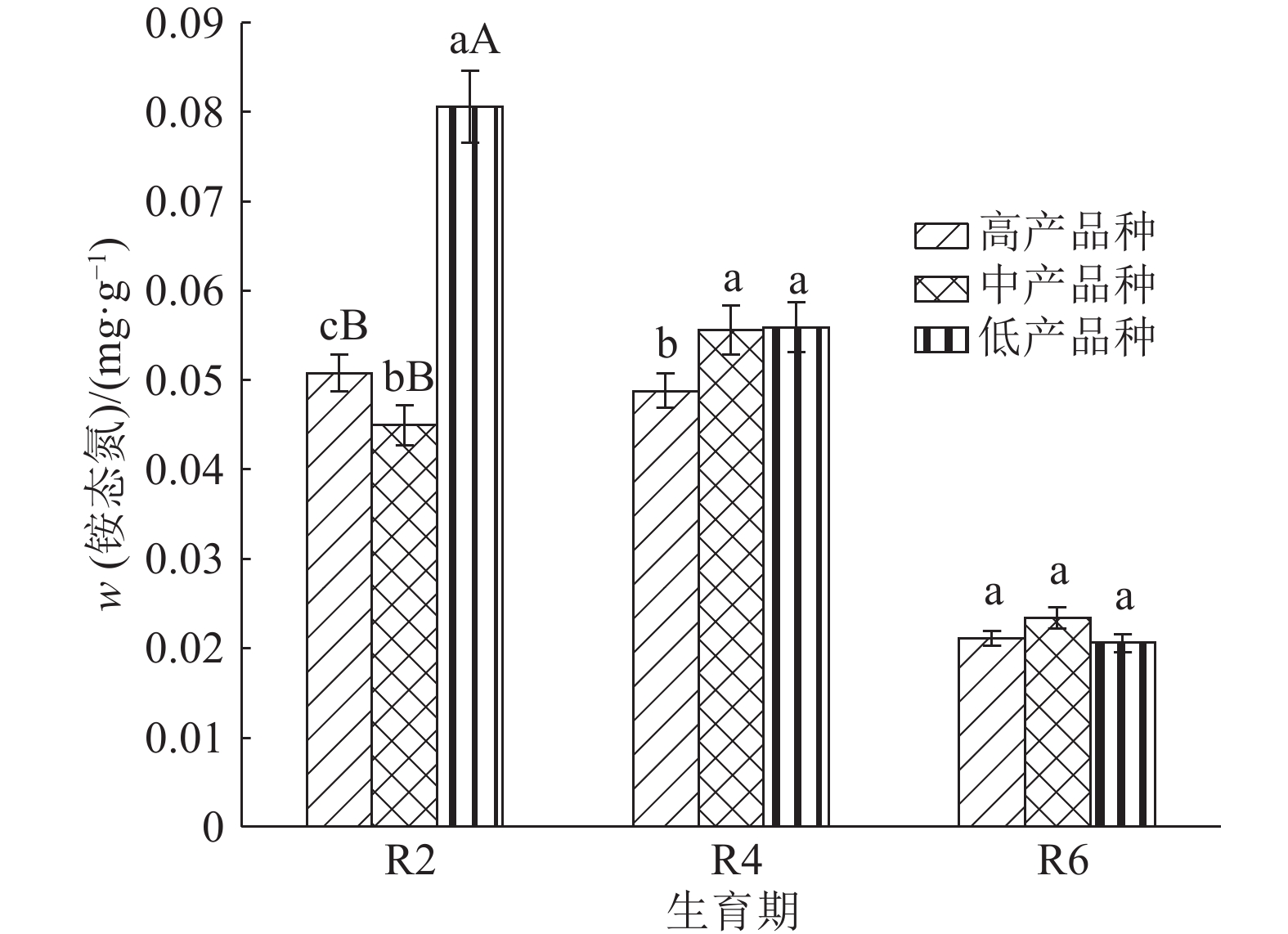
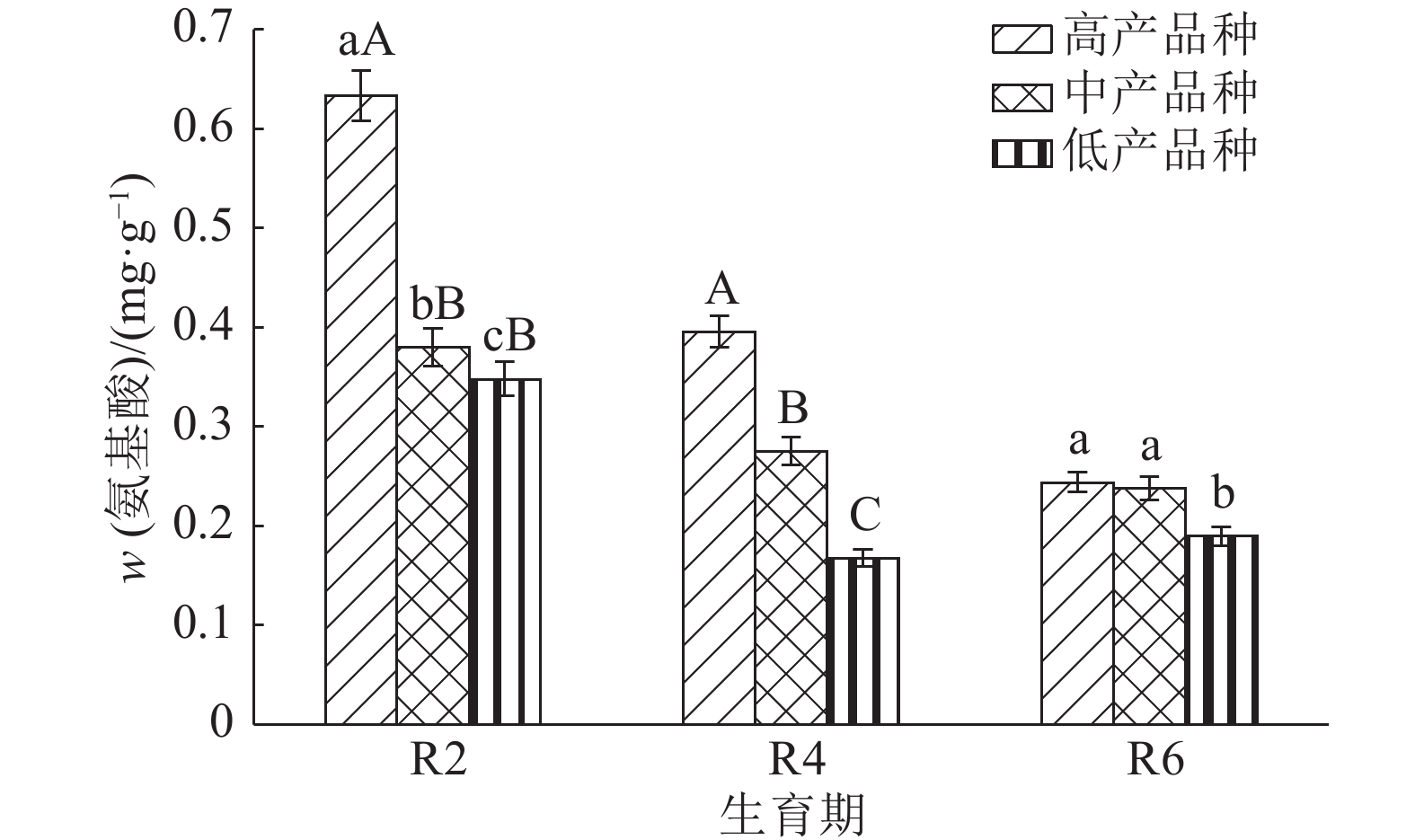
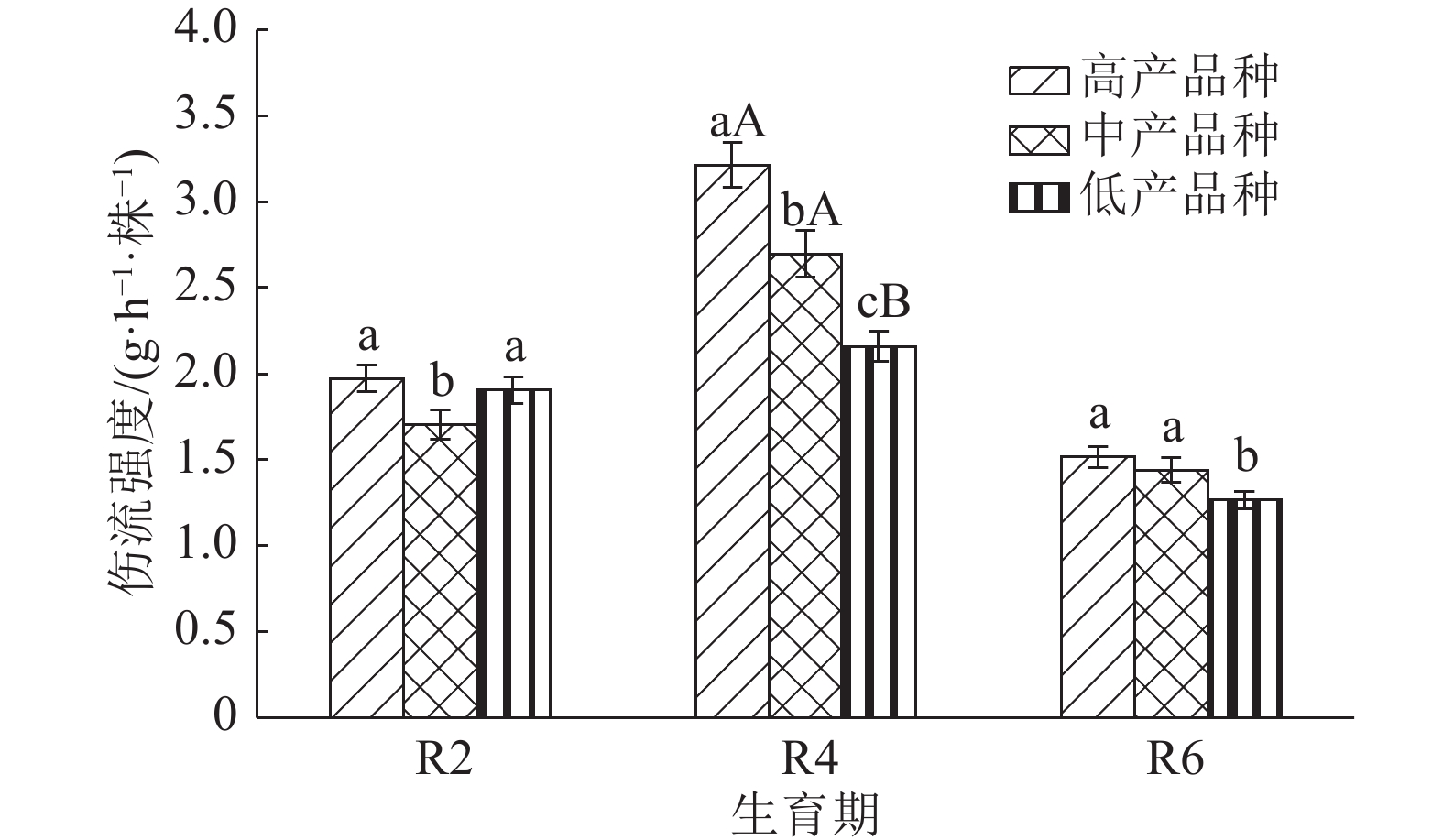
结果整个生育后期高产大豆品种根系伤流强度、总氮、氨基酸含量明显高于中、低产品种,平均值分别高13.4%和24.0%、31.9%和74.2%、46.3%和81.0%。根系伤流液中硝态氮含量高于低产品种,平均值高19.9%;铵态氮含量低于低产品种,平均值低16.5%;根系养分元素磷、钾、钙含量均高于中、低产品种。不同产量水平的大豆品种伤流强度的最高值均出现在R4期,R4期籽粒产量与伤流强度呈极显著正相关(r=0.765**);根系伤流液中总氮和氨基酸含量在R2期达最高值,磷、钾在R4期含量最高。
结论在开花期以后,高产大豆品种根系代谢旺盛,具有较强的吸收能力和活力,这可能是大豆高产的关键因素。
Abstract:ObjectiveTo explore changes of nitrogen and nutrient element contents of root bleeding saps of soybeans [Glycine max (L.) Merr.] with different yield levels at late growth stages, and provide a physiological basis for soybean breeding and high-yielding cultivation.
MethodSoybean cultivars with three different yield levels (low-, middle- and high-yielding) were planted under the same cultivation condition. Root bleeding intensity, the contents of nitrogen compounds (total nitrogen, nitrate nitrogen, ammonium nitrogen and amino acids) and other nutrient elements (P, K, Ca and Na) in root bleeding saps of soybeans were measured at flowering (R2), podding (R4) and seed-filling (R6) stages respectively.
ResultRoot bleeding intensities, total nitrogen and amino acid contents of high-yielding cultivars were 13.4% and 24.0%, 31.9% and 74.2%, 46.3% and 81.0% higher than those of middle- and low-yielding cultivars at late growth stages. Nitrate nitrogen content of high-yielding cultivar was 19.9% higher than that of low-yielding cultivar, while ammonium nitrogen content of high-yielding cultivar was 16.5% lower than that of low-yielding cultivar. The P, K and Ca contents of high-yielding cultivar were higher than those of low- and middle-yielding cultivars. The bleeding intensities of soybeans with different yield levels reached the maxinum values at R4 stage, and the grain yield was significantly positively correlated with bleeding intensity at R4 stage (r = 0.765**). The contents of total nitrogen and amino acid in root bleeding saps reached the maximum values at R2 stage while the contents of P and K were the highest at R4 stage.
ConclusionRoot metabolism of high-yielding cultivar was vigorous and had stronger absorption capacity and vitality, which might be the key factors to increase soybean yield.
-
Keywords:
- soybean /
- late growth stage /
- bleeding sap /
- nitrogen /
- nutrient element
-
表 1 不同产量水平的大豆品种
Table 1 The soybean cultivars with different yield levels
产量水平 品种 产量/(kg·hm–2) 高产 长农16号 3 370 吉农19号 3 251 吉育95号 3 013 中产 吉林35号 2 445 吉林36号 2 409 吉林38号 2 535 低产 吉林5号 1 714 吉林8号 1 840 吉林16号 2 008 表 2 不同产量水平大豆品种根系伤流液中养分元素含量的比较1)
Table 2 Comparison of nutrient element contents in root bleeding sap of soybeans with different yield levels
养分元素 生育期 w/ (mg·g–1) 高产品种 中产品种 低产品种 P R2 66.7±3.98a 54.5±2.46a 49.5±4.73a R4 121.1±10.90a 108.6±7.61b 101.5±8.61b R6 94.7±6.84a 83.6±7.97b 79.3±4.12c K R2 170.1±11.91a 163.2±5.19a 157.8±11.16a R4 363.1±19.98a 325.8±16.29b 322.4±22.6b R6 292.9±11.72a 265.8±21.3b 247.2±17.5c Ca R2 59.1±6.51a 58.5±5.27a 54.6±4.94b R4 72.3±7.95a 70.5±5.53b 63.3±5.26c R6 56.3±3.38a 49.5±3.96b 52.6±5.13c Na R2 15.4±1.39a 17.1±0.65b 19.9±8.45c R4 29.1±1.74a 38.4±4.11b 31.7±1.15c R6 66.7±3.98a 33.1±1.51b 32.2±2.42b 1) 同行数据后凡是有一个相同小写字母者,表示差异不显著 (P>0.05,Duncan’s 法)。 -
[1] LIEDGENS M, SOLDATI M, STAMP P, et al. Root development of maize (Zea mays L.) as observed with minirhizotrons in lysimeters[J]. Crop Sci, 2000, 40(6): 1665-1672.
[2] 马兆慧, 车仁君, 王海英, 等. 种植密度和种植方式对超高产大豆根系形态和活力的影响[J]. 中国农业科学, 2015, 48(6): 1084-1094. [3] 刘胜群, 张天柱, 宋凤斌, 等. 不同耐旱基因型玉米伤流液中元素含量研究[J]. 土壤与作物, 2012, 1(3): 175-180. [4] MORITA S, OKAMOTO M, ABE J, et al. Bleeding rate of field-grown maize with reference to root system development[J]. Jpn J Crop Sci, 2000, 69(1): 80-85.
[5] 赵全志, 吕德彬, 程西永, 等. 杂种小麦群体光合速率及伤流强度优势研究[J]. 中国农业科学, 2002, 35(8): 925-928. [6] 肖金川, 武志海, 徐克章, 等. 吉林省47年育成的水稻品种根系伤流液重量变化及其与剑叶光合速率的关系[J]. 植物生理学报, 2012, 48(5): 499-504. [7] 田丰, 张永成. 马铃薯根系吸收活力与产量相关性研究[J]. 干旱地区农业研究, 2004, 22(2): 105-107. [8] 李国强, 周吉, 曹治彦, 等. 玉米根系伤流量与产量关系研究[J]. 华北农学报, 2011, 26(6): 114-117. [9] CUI X Y, DONG Y Z, GI P, et al. Relationship between root vigour, photosynthesis and biomass in soybean cultivars during 87 years of genetic improvement in the northern China[J]. Photosynthetica, 2016, 54(1): 81-86.
[10] OHWAKI Y, SUGAHAR A K. Active extrusion of protons and exudation of carboxylic acids in response to iron deficiency by roots of chickpea (Cicer arietinum L.)[J]. Plant Soil, 1997, 189(1): 49-55.
[11] OSAKI M, SHINANO T, MATSUMOTO M, et al. A root-shoot interaction hypothesis for high productivity of field crops[J]. Soil Sci Plant Nutr, 1997, 43(S1): 1079-1084.
[12] 孙庆泉, 胡昌浩, 董树亭, 等. 我国不同年代玉米品种生育全程根系特性演化的研究[J]. 作物学报, 2003, 29(5): 641-645. [13] 杨峰, 娄莹, 刘沁林, 等. 玉米行距配置对套作大豆生物量、根系伤流及养分的影响[J]. 中国农业科学, 2016, 49(20): 4056-4064. [14] LORENZ H. Nitrate, ammonium and amino acids in the bleeding sap of tomato plants in relation to form and concentration of nitrogen in the medium[J]. Plant Soil, 1976, 45(1): 169-175.
[15] FEHR W R, CAVINESS C E, BURMOOD D T, et al. Stage of development descriptions for soybean, Glycine max (L.) Merrill[J]. Crop Sci, 1971, 34: 1143-1151.
[16] 李合生. 植物生理生化实验原理和技术[M]. 北京: 高等教育出版社, 2000: 121-195. [17] 梁剑光, 朱玲, 徐正军. 靛酚蓝–分光光度法测定发酵液中铵态氮含量研究[J]. 食品与发酵工业, 2006, 32(9): 134-137. [18] 张志良, 瞿伟菁. 植物生理学实验指导[M]. 北京: 高等教育出版社, 2003: 50-52. [19] 周蓉, 陈海峰, 王贤智, 等. 大豆幼苗根系性状的QTL分析[J]. 作物学报, 2011, 37(7): 1151-1158. [20] 孙彪, 孙苗苗, 徐克章, 等. 不同年代大豆品种根系伤流液重量变化及其与地上生物量的关系[J]. 大豆科学, 2012, 31(4): 579-583. [21] GUAN D, Al-KAISI M M, ZHANG Y, et al. Tillage practices affect biomass and grain yield through regulating root growth, root-bleeding sap and nutrients uptake in summer maize[J]. Field Crops Res, 2014, 157(2): 89-97.
[22] ZHANG H, XUE Y, WANG Z, et al. Morphological and physiological traits of roots and their relationships with shoot growth in “super” rice[J]. Field Crops Res, 2009, 113(1): 31-40.
[23] BARTHES L, DELEENS E, BOUSSER A J, et al. Nitrate use and xylem exudation in detopped wheat seedlings: An early diagnosis for predicting varietal differences in nitrogen utilization?[J]. Aust J Plant Physiol, 1996, 23(1): 33-44.
[24] SCHJØRRING J K. Nitrate and ammonium absorption by plants growing at a sufficient or insufficient level of phosphorus in nutrient solutions[J]. Plant Soil, 1986, 91(3): 313-318.
[25] 杨光, 张惠君, 宋书宏, 等. 超高产大豆根系相关性状的比较研究[J]. 大豆科学, 2013, 32(2): 176-181. [26] COSTA C, DWYER L M, HAMILTON R I, et al. A sampling method for measurement of large rootsystems with scanner-based image analysis[J]. Agron J, 2000, 92(4): 621-627.
[27] 郭小红, 王兴才, 孟田, 等. 中美大豆Ⅲ熟期组代表品种根系形态和活力的比较研究[J]. 中国农业科学, 2015, 48(19): 3821-3833. [28] 王威, 张联合, 李华, 等. 水稻营养吸收和转运的分子机制研究进展[J]. 中国科学: 生命科学, 2015, 45(6): 569-590. [29] 刘莹, 肖付明, 张孟臣. 冀南地区不同产量类型夏大豆根系性状的研究[J]. 大豆科学, 2009, 28(4): 665-669.



 下载:
下载: