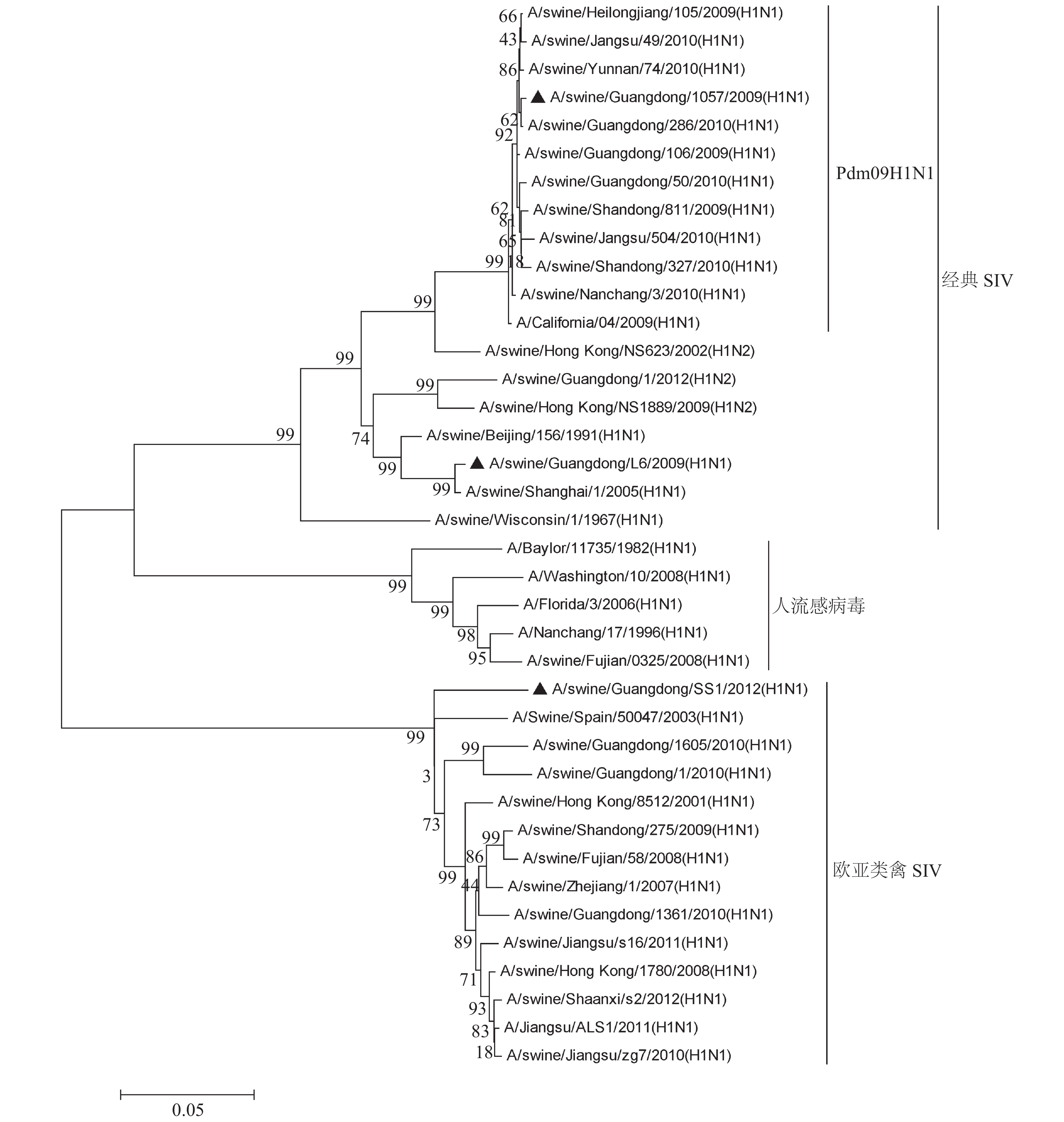
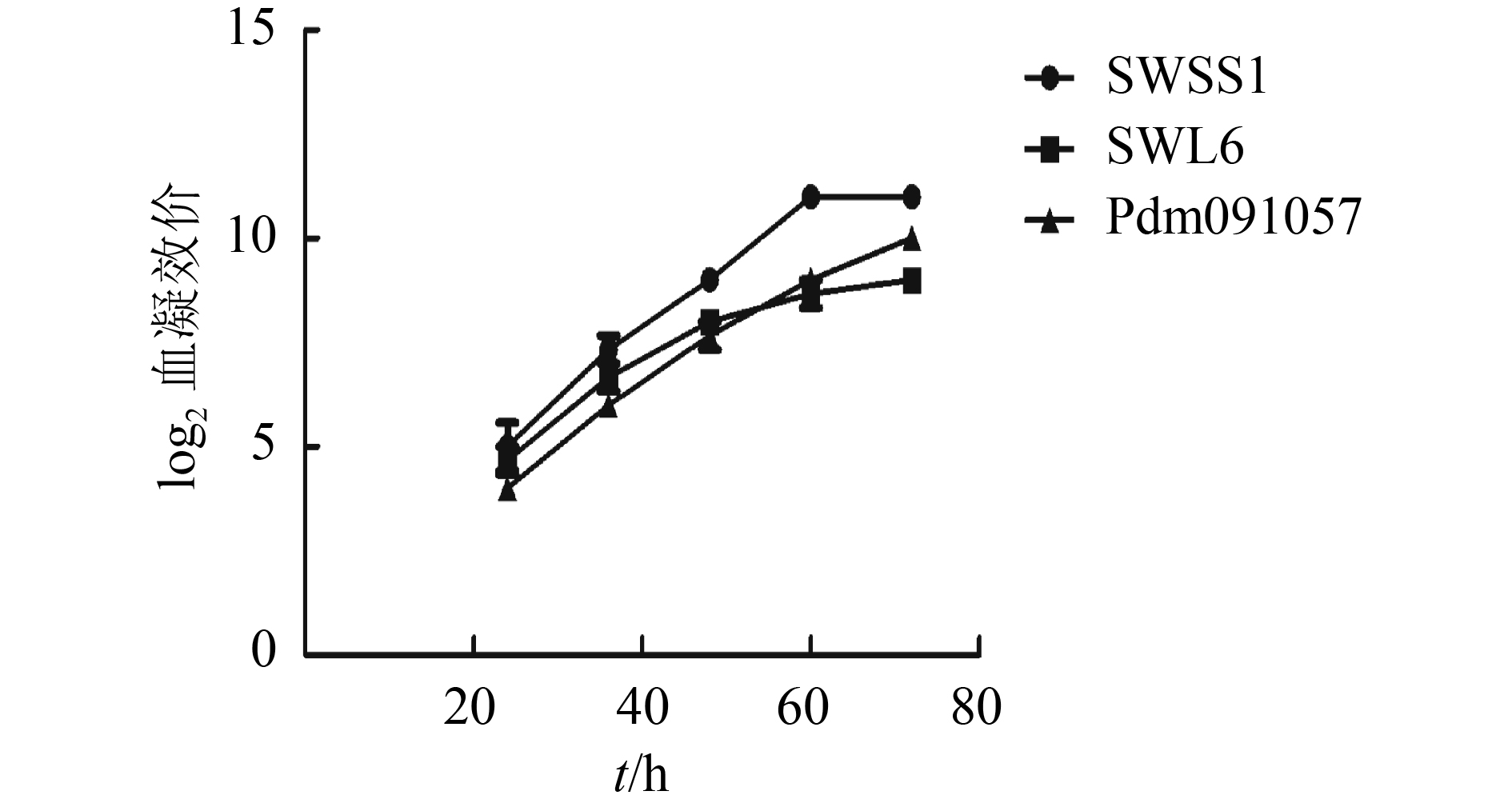
Analysis of genetic information in HA genes and antigen specificities of three strains of H1N1 swine influenza virus
-
摘要:目的
分析3株属于欧亚类禽(SWSS1)、经典(SWL6)与Pdm09H1N1(Pdm091057)分支的猪流感病毒的HA基因遗传信息及抗原的特异性,为HA基因抗原表位的功能研究及流感防控奠定基础。
方法以SWSS1株、SWL6株和Pdm091057株流感病毒为材料,比较分析3株H1N1亚型HA基因片段的遗传信息,制备全病毒灭活疫苗,各免疫3只雌性新西兰大白兔,采用血凝抑制(Hemagglutination inhibition, HI)反应试验检测抗体滴度。
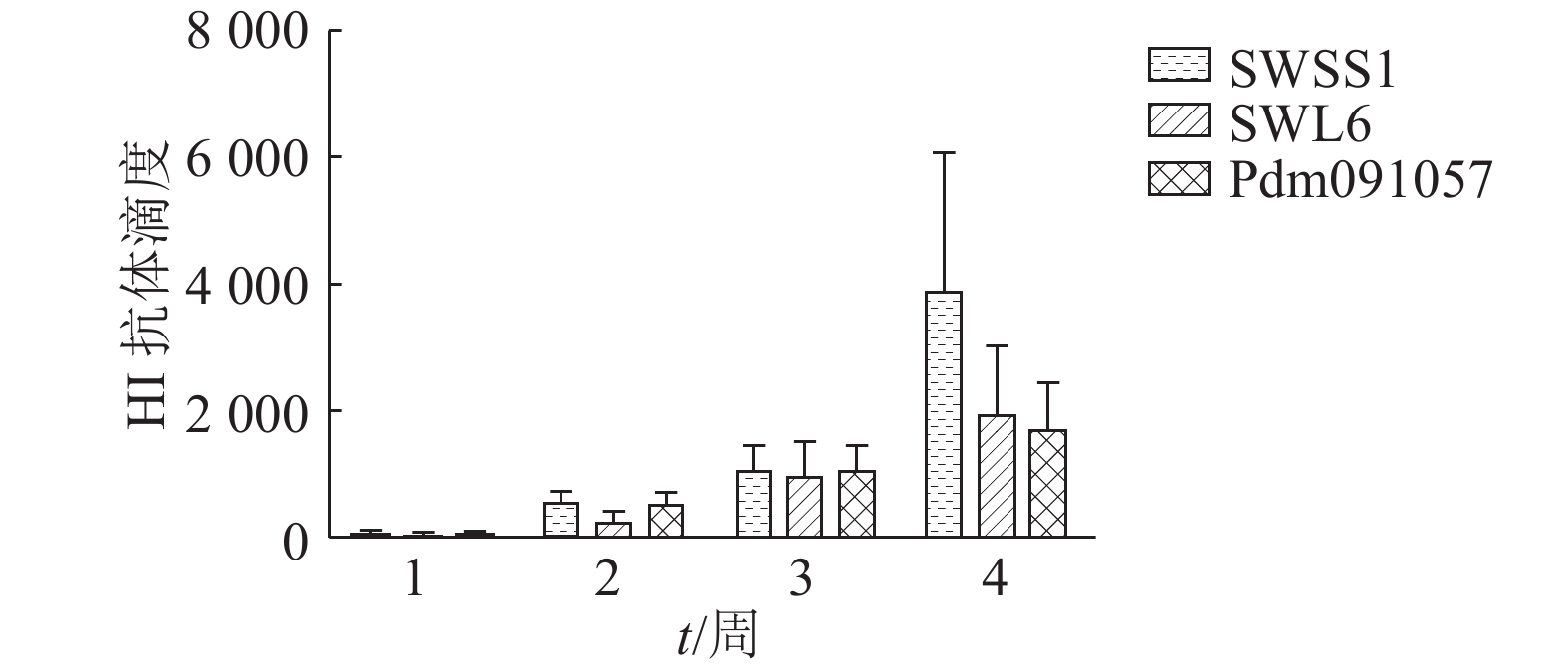
结果3株病毒的HA基因片段的氨基酸序列相似性为69.4%~89.1%,各分支的HA基因的抗原表位存在差异;3株病毒经过2次免疫后平均HI抗体滴度均能达1 280以上,且SWSS1的平均HI抗体滴度高达2 560。同时SWSS1与SWL6、Pdm091057这2株病毒均无血清学交叉反应,而SWL6与Pdm091057有较低的血清学交叉反应。
结论3株猪流感病毒的HA基因片段抗原表位存在着差异,可能是3毒株之间血清学交叉反应较低的原因。3株病毒免疫原性均较好,可作为候选疫苗株。
Abstract:ObjectiveTo study the genetic information in HA genes and antigen specificities of SWSS1, SWL6 and Pdm091057 strains which respectively belongs to Eurasian avaian-like, classical and Pdm09H1N1 branches of H1N1 swine influenza viruses (SIV), and provide a basis for functional study on antigenic epitopes of HA gene as well as prevention and control of influenza virus.
MethodWe compared the genetic information in HA gene fragments of three H1N1 subtypes, SWSS1, SWL6 and Pdm091057. Inactivated SIV vaccines were prepared and each type of vaccine was used to immune three New Zealand white rabbit. The hemagglutination inhibition (HI) reaction was used to detect antibody titers.
ResultThe amino acid sequences of HA gene fragments had 69.4%–89.1% similarities among three SIV strains. There were variations in antigenic epitopes ofHA genes of the three strains. The average HI antibody titers were all above 1 280 for three strains after the second immunization, and the average HI antibody titer for SWSS1 reached 2 560. SWSS1 had no serological cross reaction with SWL6 or Pdm091057 strain, while SWL6 and Pdm091057 strains had low degree of serological cross reaction.
ConclusionThree SIV strains have differences in antigenic epitopes of HA gene, which may be the reason for the low degree of serological cross reaction among strains. All three strains have good immunogenicity, and can be used as candidate vaccine strains.
-
Keywords:
- swine influence virus /
- H1N1 /
- genetic information /
- antigenic epitope /
- hemagglutination inhibition /
- antibody titer /
- HA gene
-
杜仲Eucommia ulmoides又名思仙、思仲、扯丝皮、丝绵树等,是我国特有的经济树种和珍稀二级保护植物。杜仲雌雄异株,雄花簇生于当年生枝条基部,花量大,易于采集[1-2]。杜仲雄花富含多种氨基酸、维生素、多糖、微量元素等营养物质,同时具有很高的药用价值[3-4],目前,杜仲雄花被批准为新食品原料,以杜仲雄花为原料开发出的茶制品、保健酒、功能饮料等产品在市场上倍受青睐[5-6]。
氨基酸是重要的生物活性物质,参与人体内正常的代谢和生理活动,具有营养、生理、生化等多种重要功能[7-8]。植物中氨基酸的含量、种类是评价其营养和药用价值优劣的主要指标之一[9]。因此,杜仲雄花中氨基酸的种类和含量对杜仲雄花产品品质有显著影响,分析其种类和含量则显得尤为重要,然而,氨基酸种类较多,分析困难,科学的选择统计分析方法也至关重要。主成分分析(Principal component analysis, PCA)是采用降维的方法,从多个存在一定相关关系的变量中选出几个新的综合变量,而新的综合变量又能反映原来多个变量所提供的主要信息,从而简化数据结构,寻找变量间的线性关系[10-11]。利用主成分分析产品品质的方法已经展开研究,马云明等[12]通过对云南烤烟主要化学成分的主成分分析得到3个主成分。王沛等[13]通过主成分分析对中早熟苹果脆片进行品质评价。薛敏等[14]对不同品种猕猴桃果实游离氨基酸进行主成分分析与综合评价。目前对杜仲雄花中氨基酸主成分分析的研究鲜见报道。本文以193份雄花用杜仲为材料,利用氨基酸自动分析仪对雄花中氨基酸含量进行测定,并以氨基酸作为分析变量,对不同种质杜仲雄花氨基酸品质进行主成分分析与综合评价,为评价杜仲雄花品质及选择优良育种材料提供依据。
1. 材料与方法
1.1 材料、试剂与仪器
供试材料共193份,均采自中国林业科学研究院经济林研究开发中心原阳试验基地(113°36′E,34°55′N)杜仲基因库,基因库采用6株小区,定植行间距为3 m×3 m。每份试验材料选取6株树,每株树均于盛花期分别在树冠中部的东、西、南、北4个方向采摘雄花各约10簇,低温冷藏带回实验室,保存备用。
17种氨基酸标准品购自于美国Sigma公司,高纯氮气购自于河南源正科技发展有限公司,茚三酮、抗坏血酸、盐酸等均为分析纯。
A300型自动氨基酸分析仪(德国曼默博尔公司产品);FA1204B型万分之一电子分析天平(上海精密仪器仪表有限公司产品);ND200-1氮吹仪(杭州瑞诚仪器有限公司产品);DHG-91013SA型电热恒温鼓风干燥箱(上海三发科学仪器有限公司产品)。
1.2 色谱条件
阳离子交换树脂分析柱,检测波长570和440 nm,缓冲液流速0.4 mL·min-1,改变5次,柱压9.8~ 10.2 kPa,柱温57 ℃;茚三酮溶液流速0.4 mL·min-1,泵压2.8~3.0 kPa,柱压9.6~9.8 kPa,分析时间40 min,进样量20 μL,标准品浓度100 nmol·mL-1,氮气压0.4 kPa。
1.3 样品测定及含量计算
氨基酸含量测定参照GB/T5009.124-2003《食品中氨基酸的测定》[15]方法,并略有改动。将采集的杜仲雄花样品于105 ℃杀青3 min,然后60 ℃烘干,粉碎过60目筛。称取0.100 g杜仲雄花样品,置于10 mL安瓿瓶中,精密加入6 mol·L-1盐酸溶液10 mL,抽真空后封口,于110 ℃烘箱内水解24 h,取出冷却后过滤,定容至50 mL,从中取0.5 mL滤液脱酸,加入2 mL样品稀释液,过0.45 μm微孔滤膜,用A300型氨基酸自动分析仪分析,进样量为20 uL。
1.4 分析方法
1.4.1 适用性检验
适用性检验采用相关系数矩阵检验,计算氨基酸之间的Pearson相关系数,根据相关系数的大小确定氨基酸含量之间的线性关系来进行适用性检验。
1.4.2 主成分分析
特征值和贡献率是选择主成分的依据。首先对原始数据进行标准化处理,然后计算性状相关矩阵的特征值和特征向量,以及各个主成分的方差贡献率和累积方差贡献率,以累积贡献率大于85%且特征值大于1为提取主成分的标准[16-17]。
1.4.3 杜仲雄花氨基酸品质综合评价
杜仲雄花氨基酸的综合评价得分(Z)按照下式进行计算:
$$ Z = \sum {{Z_i}} \times {y_i}, $$ (1) $$ {Z_i} = \sum {{A_i}} \times {X_j}, $$ (2) 式中,Zi为各主成分得分值,i =1~6,yi为各主成分对应的方差贡献率, A为主成分向量值,j =1~17,Xj为各主成分对应的性状。
2. 结果与分析
2.1 杜仲雄花17种氨基酸测定结果
氨基酸混合标准品色谱图见图 1,17种氨基酸在80 min内得到很好的分离;杜仲雄花水解氨基酸色谱图见图 2,17种氨基酸在80 min内依次出峰,基线平稳,峰间距较为合理。杜仲雄花17种氨基酸及总氨基酸含量见表 1。杜仲雄花氨基酸含量高,种类丰富。总氨基酸质量分数平均为206.23 mg·g-1,17种氨基酸中,谷氨酸质量分数最高(42.91 mg·g-1),占总氨基酸含量的20.81%;其次为天冬氨酸(29.84 mg·g-1),占总氨基酸质量分数的14.47%,表明谷氨酸和天冬氨酸是杜仲雄花中的主要氨基酸;胱氨酸和蛋氨酸占总氨基酸含量的比例最低,分别为1.40%和0.75%。杜仲雄花中必需氨基酸质量分数(68.37 mg·g-1),占总氨基酸含量的33.15%,7种必需氨基酸中,亮氨酸质量分数最高(16.11 mg·g-1),其次是赖氨酸(11.36 mg·g-1)和缬氨酸(11.29 mg·g-1),必需氨基酸含量由高到低排序依次为:亮氨酸、赖氨酸、缬氨酸、异亮氨酸、苯丙氨酸、苏氨酸和蛋氨酸。
表 1 杜仲雄花氨基酸含量基本统计1)Table 1. Basic statistic parameters of amino acid contents in Eucommia ulmoides male flowersw/(mg·g-1) 氨基酸种类 平均值±标准差 变异幅度 极差 Asp 29.84±5.85 14.37~41.76 27.39 Thr* 8.85±1.64 5.15~13.03 7.88 Ser 10.23±1.64 6.67~17.66 10.99 Glu 42.91±11.09 21.83~75.59 53.76 Gly 8.79±1.36 5.40~11.73 6.33 Ala 10.48±1.89 6.40~15.26 8.86 Cys 2.89±1.19 1.37~8.48 7.11 Val* 11.29±1.88 7.23~16.06 8.83 Met* 1.54±0.53 0.68~3.59 2.91 Ile* 9.62±1.60 6.64~14.63 7.99 Leu* 16.11±2.95 11.32~24.28 12.96 Tyr 4.64±1.04 2.40~8.37 5.97 Phe* 9.59±2.07 5.62~18.73 13.11 His 6.28±1.12 3.62~10.85 7.23 Lys* 11.36±4.42 3.61~20.70 17.09 Arg 13.84±4.65 6.30~31.37 25.07 Pro 7.96±3.45 2.01~21.47 19.46 EAA2) 68.37±11.07 50.61~94.32 43.71 TAA3) 206.23±25.90 154.26~254.66 100.40 1)*代表必需氨基酸; 2) EAA为总的必需氨基酸;3) TAA为总氨基酸。 2.2 适用性检验
依据相关系数矩阵的直观检验原则,计算杜仲雄花氨基酸含量之间的相关系数,结果见表 2。杜仲雄花氨基酸含量之间有正相关,也有负相关。除脯氨酸与其他氨基酸之间相关性不显著外,其他氨基酸之间大都存在显著或极显著相关性。氨基酸含量间较强的相关性说明,可以通过主成分分析杜仲雄花氨基酸间的复杂关系。
表 2 杜仲雄花氨基酸含量相关性1)Table 2. Correlation between amino acid contents in Eucommia ulmoides male flowers氨基酸 Asp Thr Ser Glu Gly Ala Cys Val Met Ile Leu Tyr Phe His Lys Arg Pro Asp 1.000 Thr 0.252** 1.000 Ser 0.345** 0.739** 1.000 Glu 0.167* -0.175* -0.033 1.000 Gly 0.297** 0.427** 0.552** 0.196** 1.000 Ala 0.087 0.454** 0.468** 0.076 0.759** 1.000 Cys 0.235** -0.073 0.137 0.179* 0.184** 0.072 1.000 Val 0.291** 0.262** 0.380** 0.281** 0.661** 0.464** 0.013 1.000 Met 0.110 0.184** 0.194** -0.013 0.277** 0.325** 0.081 0.093 1.000 Ile 0.334** 0.244** 0.446** 0.149* 0.661** 0.512** 0.376** 0.606** 0.197** 1.000 Leu 0.212** 0.286** 0.453** 0.201** 0.653** 0.585** 0.246** 0.611** 0.158* 0.836** 1.000 Tyr 0.252** 0.100 0.382** 0.108 0.584** 0.380** 0.274** 0.444** 0.256** 0.670** 0.489** 1.000 Phe 0.458** 0.113 0.315** 0.173* 0.555** 0.330** 0.387** 0.647** 0.132 0.640** 0.570** 0.535** 1.000 His 0.640** 0.086 0.333** 0.300** 0.465** 0.183* 0.338** 0.402** 0.258** 0.452** 0.304** 0.471** 0.583** 1.000 Lys 0.214** -0.102 0.157* 0.300** 0.325** 0.148* 0.339** 0.604** -0.080 0.581** 0.522** 0.501** 0.747** 0.345** 1.000 Arg 0.107 -0.137 -0.018 0.464** 0.254** 0.164* 0.286** 0.504** 0.015 0.404** 0.259** 0.331** 0.582** 0.266** 0.663** 1.000 Pro -0.001 0.116 0.035 -0.128 0.074 0.069 -0.119 0.100 -0.060 -0.001 -0.118 0.007 0.111 0.045 -0.029 0.135 1.000 1)* *和*分别表示在0.01和0.05水平上显著相关(Pearson法)。 2.3 主成分分析
对杜仲雄花17种氨基酸含量进行主成分分析,结果见表 3、表 4。由表 3可知,前6个主成分的累积方差贡献率达到了88.592%,基本包括了全部氨基酸具有的信息,因此可以将原来的17种氨基酸转化为6个主成分。第1主成分的特征值为5.835,方差贡献率为39.326%,代表了17种氨基酸全部性状39.326%的信息;第2主成分的特征值为2.478,方差贡献率为16.701%,代表了17种氨基酸全部性状16.701%的信息;第3主成分的特征值为1.513,方差贡献率为10.197%;第4主成分的特征值为1.261,方差贡献率为8.498%;第5主成分的特征值为1.048,方差贡献率为7.063%;第6主成分的特征值为1.010,方差贡献率为6.807%。
表 3 杜仲雄花氨基酸的主成分分析Table 3. Principal component analysis of amino acids in Eucommia ulmoides male flowers主成分 特征值 贡献率/% 累积贡献率/% PC-1 5.835 39.326 39.326 PC-2 2.478 16.701 56.027 PC-3 1.513 10.197 66.224 PC-4 1.261 8.498 74.722 PC-5 1.048 7.063 81.785 PC-6 1.010 6.807 88.592 表 4 杜仲雄花氨基酸的主成分特征向量Table 4. Feature vector of principal component of amino acids in Eucommia ulmoides male flowers氨基酸 PC-1 PC-2 PC-3 PC-4 PC-5 PC-6 Asp 0.089 0.214 0.861 0.070 -0.056 -0.025 Thr -0.082 0.867 0.082 -0.150 0.014 0.079 Ser 0.197 0.788 0.254 -0.155 0.038 -0.065 Glu 0.110 -0.195 0.169 0.823 0.017 -0.224 Gly 0.529 0.552 0.074 0.215 0.390 0.046 Ala 0.359 0.570 -0.234 0.153 0.475 0.028 Cys 0.579 -0.254 0.359 -0.261 0.083 -0.344 Val 0.611 0.369 0.056 0.471 -0.026 0.212 Met -0.006 0.059 0.122 -0.031 0.878 -0.028 Ile 0.829 0.275 0.100 -0.027 0.157 -0.127 Leu 0.720 0.422 -0.085 0.111 0.095 -0.269 Tyr 0.679 0.092 0.173 -0.094 0.339 -0.005 Phe 0.783 0.075 0.387 0.108 0.007 0.167 His 0.308 0.029 0.787 0.161 0.255 0.036 Lys 0.839 -0.094 0.142 0.223 -0.225 0.011 Arg 0.621 -0.268 0.068 0.461 -0.038 0.233 Pro 0.027 0.008 0.011 -0.121 -0.005 0.905 由表 4可知,第1主成分包括了Gly、Cys、Val、Ile、Leu、Tyr、Phe、Lys和Arg 9个氨基酸指标变量;第2主成分包括了Thr、Ser、Gly和Ala 4个氨基酸指标变量;第3主成分包括了Asp和His 2个氨基酸指标变量;第4主成分只包括了Glu 1个氨基酸指标变量;第5主成分只包括了Met 1个氨基酸指标变量;第6主成分只包括了Pro 1个氨基酸指标变量。
2.4 综合评价
经过主成分分析提取6个主成分,计算193份种质杜仲雄花在各个主成分中的得分,并按照5%入选率确定6种类型氨基酸性状优良的雄花资源,即得分前9位的为优良资源,结果见表 5。综合得分前9位的种质有10419x、10519x、10345x、10444x、10370x、10552x、10589x、10339x和10515x。
表 5 杜仲种质的主成分得分和综合得分Table 5. Principal component scores and overall scores of Eucommia ulmoides germplasms排名 PC-1 PC-2 PC-3 PC-4 PC-5 PC-6 综合型 编号 得分 编号 得分 编号 得分 编号 得分 编号 得分 编号 得分 编号 得分 1 10419x 14.07 10419x 8.14 11041x 7.42 10079x 5.88 11041x 9.96 11041x 4.15 10419x 8.53 2 10345x 11.26 10333x 7.35 10419x 6.36 10295x 4.97 10419x 6.71 10446x 3.06 10519x 6.30 3 10519x 10.79 10552x 6.95 10519x 6.30 10330x 4.95 10370x 6.54 10419x 2.77 10345x 6.12 4 10552x 10.14 10515x 6.66 10303x 5.93 10022x 4.52 10339x 6.36 10418x 2.75 10444x 5.90 5 10371x 10.03 10417x 6.56 10589x 5.72 10288x 4.36 10022x 5.66 10080x 2.68 10370x 5.84 6 10444x 10.02 11041x 6.30 10546x 5.25 10423x 4.12 10359x 4.95 10330x 2.67 10552x 5.72 7 10456x 9.83 10370x 6.27 10330x 5.12 10453x 3.91 10079x 4.25 10444x 2.53 10589x 5.70 8 10333x 9.69 10519x 5.80 10485x 5.12 10419x 3.89 10344x 4.15 10319x 2.53 10339x 5.29 9 10589x 9.50 10456x 5.44 10079x 5.03 10389x 3.70 10589x 4.13 10329x 2.45 10515x 5.26 3. 讨论与结论
主成分分析中各主成分是一个相对独立的指标体系,彼此各不相关,同时研究对象在各主成分上存在明显差异,便于对研究对象做出较直观的分析判断与评价[17]。本文通过对193份杜仲种质雄花氨基酸进行主成分分析,从检测出的17种氨基酸中提取了6个主成分,将多维指标降维,简化选择程序,其累积方差贡献率达到了88.592%,包含了所有氨基酸绝大部分信息。研究还发现必需氨基酸因子对杜仲雄花氨基酸含量影响较大,且主要集中在第1和第2主成分,这与李晓杰[18]对陕西银杏栽培品种氨基酸评价标准相类似。
以方差贡献率为权重,根据各主成分得分值和对应的方差贡献率构建综合评价模型,得到不同种质杜仲雄花氨基酸含量的综合得分,为衡量杜仲雄花氨基酸性状指标提供理论依据。综合得分的高低表明了杜仲雄花氨基酸综合质量的高低。本文按照5%的入选率筛选出得分前9位的氨基酸性状优良的雄花资源。以10419x杜仲为例,第1、第2主成分得分和综合得分均最高,且较大程度地超出其他种质的得分,其总氨基酸和必需氨基酸质量分数分别为224.86和90.74 mg·g-1,明显高于193份杜仲种质雄花总氨基酸质量分数(206.23 mg·g-1)和必需氨基酸质量分数均值(68.37 mg·g-1),说明10419x杜仲雄花氨基酸综合质量较高。
主成分分析法可以有效地比较不同种质间杜仲雄花氨基酸综合质量,对优良育种材料的选择及开发利用有较大的应用价值。通过主成分分析,发现不同杜仲种质间雄花氨基酸综合质量存在差异,这也将导致杜仲雄花茶、杜仲雄花酒、杜仲雄花功能饮料风味和营养价值不同,经比较可以筛选出氨基酸品质较优的雄花资源。
本文仅研究了杜仲雄花氨基酸综合质量,如需筛选出综合品质较优的杜仲雄花资源,还需对其他性状,如树体生长因子、雄花形态性状及雄花活性成分含量进行综合分析,这也将是今后研究的重点,以便从中选出各性状指标均优良的种质,为杜仲育种及开发利用奠定基础。
-
表 1 不同亚型抗原对标准血清抗体滴度检测结果
Table 1 The titers of different subtypes of the influenza virus against the standard serums
毒株(四单位抗原) HI抗体滴度 抗SWSS1血清 抗SWL6血清 抗Pdm091057血清 A/swine/Guangdong/SS1/2012(H1N1)1) 2 560 <20 <20 A/swine/Guangdong/L6/2012(H1N1)2) <20 1 280 40 A/Guangdong/1057/2010(H1N1)3) <20 40 1 280 A/swine/Guangdong/l22/2010(H3N2) 40 <20 <20 A/Duck/Anhui/1/2006/(H5N1) <20 <20 <20 A/Chicken/Shanghai/10/2001(H9N2) <20 <20 <20 A/Pigeon/Shanghai/S1421/2013(H7N9) <20 <20 <20 1) 为SWSS1; 2) 为SWL6;3) 为Pdm091057。 -
[1] QIAO C, LIU L, YANG H, et al. Novel triple reassortant H1N2 influenza viruses bearing six internal genes of the pandemic 2009/H1N1 influenza virus were detected in pigs in China[J]. J Clin Virol, 2014, 61(4): 529-534.
[2] FAN X, ZHU H, ZHOU B, et al. Emergence and dissemination of a swine H3N2 reassortant influenza virus with 2009 pandemic H1N1 genes in pigs in China[J]. J Virol, 2012, 86(4): 2375-2378.
[3] ZHU H, ZHOU B, FAN X, et al. Novel reassortment of Eurasian avian-like and pandemic/2009 influenza viruses in swine: Infectious potential for humans[J]. J Virol, 2011, 85(20): 10432-10439.
[4] CHEN J, MA J, WHITE S K, et al. Live poultry market workers are susceptible to both avian and swine influenza viruses, Guangdong Province, China[J]. Vet Microbiol, 2015, 181(3/4): 230-235.
[5] DUCATEZ M F, HAUSE B, STIGGER-ROSSER E, et al. Multiple reassortment between pandemic (H1N1) 2009 and endemic influenza viruses in pigs, United States[J]. Emerg Infect Dis, 2011, 17(9): 1624-1629.
[6] MORENO A, DI TRANI L, FACCINI S, et al. Novel H1N2 swine influenza reassortant strain in pigs derived from the pandemic H1N1/2009 virus[J]. Vet Microbiol, 2011, 149(3/4): 472-477.
[7] ANDERSON T K, CAMPBELL B A, NELSON M I, et al. Characterization of co-circulating swine influenza A viruses in North America and the identification of a novel H1 genetic clade with antigenic significance[J]. Virus Res, 2015, 201: 24-31.
[8] YANG H, CHEN Y, QIAO C, et al. Prevalence, genetics, and transmissibility in ferrets of Eurasian avian-like H1N1 swine influenza viruses[J]. Proc Natl Acad Sci USA, 2016, 113(2): 392-397.
[9] LIU W, WEI M T, TONG Y, et al. Seroprevalence and genetic characteristics of five subtypes of influenza A viruses in the Chinese pig population: A pooled data analysis[J]. Vet J, 2011, 187(2): 200-206.
[10] QIU Y, DE HERT K, VAN REETH K. Cross-protection against European swine influenza viruses in the context of infection immunity against the 2009 pandemic H1N1 virus: Studies in the pig model of influenza[J]. Virus Res, 2015, 46: 105.
[11] VIJAYKRISHNA D, POON L L, ZHU H C, et al. Reassortment of pandemic H1N1/2009 influenza A virus in swine[J]. Science, 2010, 328(5985): 1529.
[12] CHEN Y, ZHANG J, QIAO C, et al. Co-circulation of pandemic 2009 H1N1, classical swine H1N1 and avian-like swine H1N1 influenza viruses in pigs in China[J]. Infect Genet Evol, 2013, 13: 331-338.
[13] GARTEN R J, DAVIS C T, RUSSELL C A, et al. Antigenic and genetic characteristics of swine-origin 2009 A(H1N1) influenza viruses circulating in humans[J]. Science, 2009, 325(5937): 197-201.
[14] 王舒宁, 李国庆, 吴迪, 等. 甲型H1N1流感病毒HA蛋白抗原表位及受体结合位点突变特性的对比研究[J]. 生物物理学报, 2012(6): 486-498. [15] SUI J, YANG D, QIAO C, et al. Protective efficacy of an inactivated Eurasian avian-like H1N1 swine influenza vaccine against homologous H1N1 and heterologous H1N1 and H1N2 viruses in mice[J]. Vaccine, 2016, 34(33): 3757-3763.




 下载:
下载: