Prokaryotic expression of S5-2 gene and cloning of S5 segment from Anhui isolate of Southern rice black-streaked dwarf virus
-
摘要:目的
探讨南方水稻黑条矮缩病毒(Southern rice black-streaked dwarf virus,SRBSDV)安徽分离物(SRBSDV-AnHui-HN2)的遗传特性,并获得原核表达的P5-2蛋白。
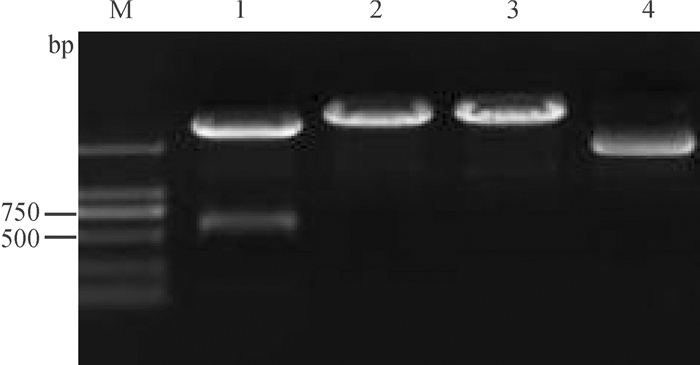
方法RT-PCR扩增SRBSDV S5片段,克隆、测序并进行序列分析。将S5-2基因插入原核表达载体,重组载体转化大肠埃希菌并用IPTG诱导,Ni2+-NTA亲和柱纯化融合蛋白,SDS-PAGE分析P5-2蛋白的表达情况。
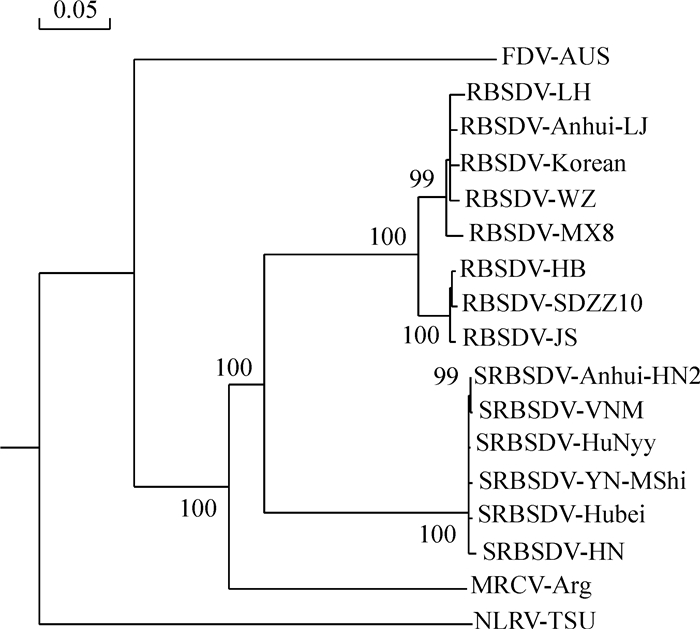
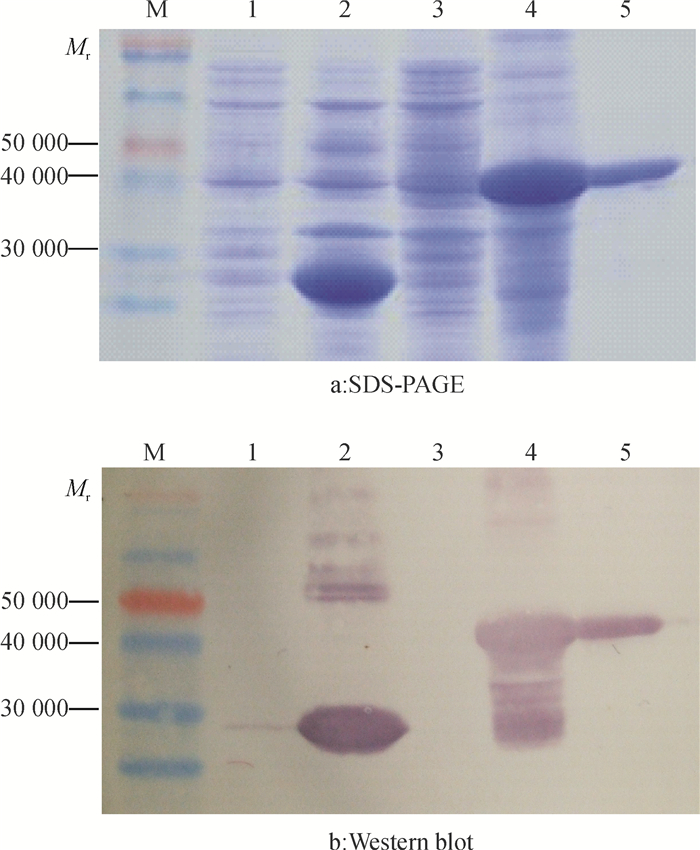
结果SRBSDV-AnHui-HN2 S5片段全长3 167 bp,包含S5-2基因全长612 bp,编码204个氨基酸。序列比对结果显示,SRBSDV-AnHui-HN2 S5片段与其他SRBSDV分离物S5片段的序列相似性极高,达99.0%~99.7%,而与斐济病毒属(Fijivirus)其他成员S5片段的序列相似性较低,仅为38.0%~71.3%;构建的S5片段系统发育树表明SRBSDV和RBSDV聚成1个分支,其中6个SRBSDV分离物聚成1个亚分支。原核表达获得相对分子质量约为47 000的重组蛋白,Western blot分析显示,GST单抗能够与重组融合蛋白发生特异性反应。
结论SRBSDV各分离物之间亲缘关系非常近,而与Fijivirus其他成员亲缘关系较远,原核表达获得的融合蛋白为靶标蛋白。
-
关键词:
- 南方水稻黑条矮缩病毒 /
- S5片段 /
- S5-2基因 /
- 原核表达
Abstract:ObjectiveTo study genetic characteristics of the isolates of Southern rice black-streaked dwarf virus(SRBSDV) from Anhui province, and to obtain P5-2 protein by prokaryotic expression.
MethodThe S5 segment of SRBSDV was amplified by RT-PCR, and it was cloned, sequenced and analyzed. Gene S5-2 was inserted into prokaryotic expression vector. The recombinant vector was transformed into Escherichia coli and was induced by IPTG. The fusion protein was purified by Ni2+-NTA affinity column. The expression of P5-2 protein was analyzed by SDS-PAGE.
ResultThe S5 segment from Anhui isolate of SRBSDV(SRBSDV-AnHui-HN2) was 3 167 bp in full length and contained a 612 bp S5-2 gene encoding 204 amino acids. Sequence comparison showed that the S5 segment of SRBSDV-AnHui-HN2 shared high sequence similarity(99.0%-99.7%) with other SRBSDV isolates, while had relatively low sequence similarity(38.0%-71.3%) to other Fijivirus members. The phylogenetic tree based on S5 segment sequences showed that SRBSDV and RBSDV clustered into a branch, and six isolates of SRBSDV clustered into a sub-branch. The recombinant protein with approximately 47 000 relative molecular mass was obtained by prokaryotic expression. Western blot analysis revealed that GST monoclonal antibody could specifically bind to the fusion protein.
ConclusionAll isolates of SRBSDV are closely related, and they have relatively far relationship to other Fijivirus members. The fusion protein obtained by prokaryotic expression is the target protein.
-
农业生产中水资源需求巨大,尤其是农田灌溉用水[1-2]。目前,我国已在高标准农田建设和节水灌溉技术等方面取得突破性进展,并将农业节水灌溉技术普及应用于农业生产活动中,取得良好的效果[3]。但事实上,节水技术可能无法真正实现节约用水,因为累积增加的回水流量大于累积减少的无益用水量[4]。与微灌、喷灌、管灌等节水灌溉模式相比,保水剂具有保水效果良好、施用简单、不需要投入过多成本等优点,而且保水剂不仅能够增强土壤的保水性能,还能改善其理化性质,增强土壤微生物活性和酶活性[5-6]。此外,保水剂施用到土壤后,能够重复吸水、释水,在土壤环境中形成一个“微型水库”,明显提高土壤水分利用系数、降低灌溉频率。保水剂已广泛应用于农业、园艺绿化和沙漠土地保护等农林领域[7]。此外,保水剂还能控制肥料的释放,提高肥料利用率;Tubert等[8]合成了1种掺杂肥料的交联型丙烯酸−纤维素保水剂,并研究了其对桉树根部养分运输的影响,结果表明施用保水剂后气孔导度提高350%,根系和地上部分分泌物增加1倍,肥料利用效率明显提升,成功减少了化肥使用量。此外,Hou等[9]研究不同保水剂施用量对旱作区土壤容重、水分状况、马铃薯生长及产量的影响,结果表明施用保水剂后,土壤容重降低6.4%,马铃薯株高和茎秆直径均高于对照的,平均产量和结果率分别提高38.2%和50.5%,同时显著提高作物水分利用效率。因此,作为化学控制节水剂、肥料缓释剂,保水剂在农业领域具有广阔的应用前景。
作为一种具有三维空间网状结构的功能性高分子材料,保水剂含有大量的羟基(—OH)、羧基(—COOH)、氨基(—NH2)等亲水官能团[10],它们可与水分子形成氢键,增加保水剂内部渗透压,使水进入保水剂内部。保水剂吸水后发生剧烈膨胀,体积增加到原来的几百倍甚至上千倍[11-12]。保水剂种类繁多,按原材料可分为天然高吸水性聚合物、合成高吸水性聚合物和有机−无机复合保水剂[13]。合成高吸水性聚合物主要由聚乙烯醇、聚丙烯酸盐等物质合成,由于难以生物降解而产生大量废弃物,对环境产生不利影响。研究者在合成聚合物中加入无机添加剂制备有机−无机复合保水剂,以增加其溶解度并改善降解性能。但在使用矿石或工业废料作为无机添加剂时,可能会引入重金属并释放到土壤中,对土壤造成不利影响[13]。天然和可生物降解的聚合物可作为替代品,但天然聚合物如海藻酸、淀粉、海藻多糖等的吸水性低于合成聚合物的[14],因此,越来越多的研究者通过改性处理,让天然聚合物与聚丙烯酸盐、丙烯酸进行交联反应,使其具有更好的生物相容性,改性后的保水剂具有强吸水性、强耐盐性和可生物降解性[15-16]。此外,天然多糖具有环保、可降解、可再生的特点,可极大地降低合成保水剂的成本及环境风险,增强保水剂的应用潜力[17-18]。
我国海洋资源丰富,是世界上重要的海藻生产国。欧盟 REACH已将海藻酸盐、岩藻多糖、层糖苷、甘露醇和多酚等确定为海藻提取物中的主要成分[18]。大多数研究者通常使用海藻提取物中的海藻酸盐合成保水剂[19-20]。牛红艳等[21]通过添加海藻酸裂解酶和岩藻多糖裂解酶活化海藻并提取海藻多糖进而制备海藻生物保水剂。研究更多关注于海藻酸盐保水剂的合成及性能研究,忽视了岩藻多糖在保水剂合成方面的潜在应用价值。作为海藻提取物,岩藻多糖是一种化学组成和结构十分复杂的天然水溶性大分子多糖化合物,富含L−岩藻糖和硫酸基结构,其中,L−岩藻糖是一种单糖,分子结构中含有多个亲水性官能团羟基;硫酸基是一种带有负电荷的强亲水性基团,在水溶液中发生电离产生硫酸根离子和氢离子,硫酸根离子的负电荷会吸引水分子中带正电荷的氢原子,从而使硫酸基周围聚集大量水分子,表现出良好的亲水性[22]。因此,富含L−岩藻糖和硫酸基等亲水结构的岩藻多糖可能是合成聚合物的理想替代品,然而,目前关于岩藻多糖作为原料制备生物保水剂的研究鲜见报道。
本研究以岩藻多糖为材料,以过硫酸铵(Ammonium persulfate, APS)为引发剂,N,N′−亚甲基双丙烯酰胺(N,N'-Methylenebis acrylamide, MBA)为交联剂,采用水溶液聚合技术制备岩藻多糖生物保水剂,探讨不同反应变量对保水剂吸水倍率的影响,并研究其吸淡水、吸NaCl溶液、重复吸水等性能;同时通过盆栽试验检测岩藻多糖生物保水剂对白菜生长的影响。以期为岩藻多糖类生物保水剂在农业节水、土壤保水、土壤性质改善等方面的开发应用提供基础数据。
1. 材料与方法
1.1 试验试剂与仪器
岩藻多糖(试剂纯,上海麦克林生化科技有限公司),丙烯酸(Acrylic acid, AA) (化学纯,上海麦克林生化科技有限公司),NaOH(分析纯,天津市致远化学试剂有限公司), APS (分析纯,天津市风船化学试剂科技有限公司),MBA (分析纯,上海阿拉丁生化科技股份有限公司),NaCl(上海阿拉丁生化科技股份有限公司)。
傅里叶变换红外光谱仪(Fourier-transform infrared spectroscopy, FT-IR) (Thermo Scientific Nicolet iS10),OSB-2200恒温水浴锅(EYELA),扫描电子显微镜(Scanning electron microscope, SEM) (Tescan MIRA LMS),DHG-9240A电热鼓风干燥箱(上海精密实验设备有限公司),QUINTIX125D-1SAR电子天平[赛多利斯科学仪器(北京)有限公司],LGJ-12真空冷冻干燥机(河南兄弟仪器设备有限公司),Eco-151UV超纯水机(上海和泰仪器有限公司),移液枪(Eppendorf Research plus),SK8200B超声波清洗机(上海科导超声仪器有限公司),三颈烧瓶,烧杯,玻璃棒等。
1.2 岩藻多糖生物保水剂的合成
1.2.1 保水剂的形成原理
交联剂(MBA)和引发剂(APS)存在的条件下,通过水溶液聚合技术进行AA单体接枝共聚,该过程主要涉及在加热条件下过硫酸盐分解,释放出硫酸盐阴离子自由基[23-24],随后由自由基引发AA接枝在天然高分子岩藻多糖主链上进行共聚反应,合成岩藻多糖生物保水剂。根据该反应,引发剂产生的自由基攻击AA以增加聚合链,随后成为相邻分子的自由基供体以扩展接枝链,接枝的聚合物链与交联剂反应,成功制备岩藻多糖生物保水剂。
1.2.2 保水剂的合成
采用水溶液聚合技术合成岩藻生物保水剂。具体步骤如下:首先,称取适量的岩藻多糖加入三颈烧瓶中,加入固定比例的水使其溶解,使岩藻多糖终质量浓度为100 g/L;称取一定量的AA及NaOH固体在水浴条件下中和;将中和后的溶液加入三颈烧瓶中,同时称取适量的引发剂溶于去离子水 (ddH2O),并加入三颈烧瓶中,70 ℃水浴搅拌产生自由基;反应1 h后,加入交联剂,在70 ℃水浴条件充分反应2 h,直至生成黏弹性胶状物,将所得产物用无水乙醇进行充分洗涤,取出后将样品置于65 ℃烘箱中,直到其质量保持恒定,然后破碎至粒径为10~20目,即岩藻多糖生物保水剂。
通过文献阅读及预试验确定岩藻多糖生物保水剂初始制备条件为:m(岩藻多糖)∶m(AA) = 1.0∶7.0,中和度为 75%,m(APS)∶m(AA)= 3.0%,m(MBA)∶m(AA) = 0.2%。除4个需要优化的变量外,其他所有合成条件(温度、反应时间)均相同。采用单因素试验逐步优化产物的制备工艺,根据已知条件,将各参数按初始或已优化的条件设定为固定值,并按照表1中设定的梯度,对各项参数进行调整。选取吸水倍率最大的梯度参数作为最佳用量,将此项比例固定,随后进行下一阶段的合成,合成试验共需进行25轮,每轮试验均重复3次。优化调整后,成功制备出具有良好吸水性能的保水剂。
表 1 单因素逐步优化合成梯度表1)Table 1. Single-factor stepwise optimization for synthesizing gradient梯度序号
Gradient No.S1 中和度 (S2)
Neutralization引发剂(S3)
Initiator交联剂(S4)
Crosslinker1 1.0∶6.0 60 0.020 0.05×10−2 2 1.0∶6.5 65 0.025 0.10×10−2 3 1.0∶7.0 70 0.030 0.15×10−2 4 1.0∶7.5 75 0.035 0.20×10−2 5 1.0∶8.0 80 0.040 0.25×10−2 1) S1、S3和S4分别表示m(岩藻多糖)∶m (AA)、m (APS)∶m (AA)和m (MBA)∶m (AA)。
1) S1, S3 and S4 represent m (fucoidan) ∶ m (AA), m (APS) ∶ m (AA) and m (MBA) ∶ m (AA), respectively.1.3 保水吸水性能测试与表征
1.3.1 保水剂吸水能力测试
保水剂的吸水能力通常用吸水倍率[20]表示。本研究采用茶袋法测定吸水倍率,首先将茶袋浸泡在ddH2O中24 h后取出,无水滴滴下后再称质量,取1.0 g (精确到0.1 g)岩藻多糖生物保水剂样品,加入充分浸泡的茶袋中,将封装好的茶袋分别全部浸泡在1 L ddH2O和9 g∙L−1的 NaCl 溶液中。每天更换同等量的水和NaCl溶液,试验进行7 d,以确保最大程度的溶胀,同时定期记录溶胀样品的质量。吸液饱和后取出茶袋,无水滴滴下后再称质量,吸水倍率(Q)按照公式(1)计算:
$$ Q=\frac{{m}_{3}-{m}_{2}-{m}_{1}}{{m}_{2}} \text{,} $$ (1) 式中,m1为完全浸水的茶袋的质量,g;m2为吸水前保水剂的质量,g;m3为吸水饱和后保水剂和茶袋的质量,g。
1.3.2 重复吸水能力测试
称取1.0 g样品,采用茶袋法进行吸水倍率测试,待吸水饱和后称质量;将吸水后的样品置于65 ℃烘箱中,直到其质量保持恒定,再次取出按照“1.3.1”操作测试吸水倍率,多次重复操作,观察吸水倍率的变化趋势,方法参考文献[20]。
1.3.3 FT-IR分析
采用FT-IR对进行KBr颗粒压片法的岩藻多糖和岩藻多糖生物保水剂样品进行红外光谱分析,在500~
4000 cm−1波长范围内以4 cm−1的分辨率收集光谱,对所有样品进行共32次扫描。在进一步分析之前,使用OMNIC软件对所有光谱进行基线校正和归一化处理,方法参考文献[25]。1.3.4 SEM 观察
将干燥后的保水剂样品充分研磨后,固定在样品座上,在25 mm厚度和10 kV电压下喷金,利用SEM观察样品的表面形貌变化。
1.4 岩藻多糖生物保水剂对植物生长的影响
盆栽试验在云南省昆明理工大学现代农业工程学院塑料大棚(102° 86′ E,24° 84′ N,海拔
1978.9 m)内进行。供试土壤为老冲积层发育形成的红褐土, pH 为 6.5~7.5,有机质质量分数为 15.05 g∙kg−1,硝态氮、速效磷和速效钾初始质量分数分别为 47.98、13.71 和92.16 mg∙kg−1。通过盆栽试验初步研究岩藻多糖保水剂对白菜生长的影响,为避免其他因素的影响,供试土壤自然风干后过 2 mm 筛,每个盆栽均按相同土壤质量填装。供试白菜苗购买自云南省昆明市蔬菜育苗基地。将岩藻多糖生物保水剂与土壤按照不同质量比均匀混合后装在花盆中进行试验,试验设置3个处理,保水剂与土壤质量比分别为2 (T1)、4 (T2)和6 g∙kg−1 (T3),以空白土壤为对照(CK),每个处理及对照设3次重复。每隔7 d给花盆浇水500 mL。按照当地种植管理措施,整个生长周期施肥2次,第1次施肥于白菜定植前,第2次施肥于处理10 d后,每次施用剂量为尿素 (N)1.26 g、硫酸钾(K)0.97 g、酶活性磷肥(P)2.78 g。其他管理措施均相同,处理35 d后收获植株并测量相关指标。
1.5 数据处理
试验数据采用 Microsoft Excel 2019 进行归纳整理,所有数据均以带标准差的平均值表示。使用SPSS 27.0软件进行统计学分析,Origin 2021b(Origin Lab,USA)进行绘图,采用单因素方差分析评估不同处理对参数的影响,采用 Duncan’s 法确定处理间的差异显著性。
2. 结果与分析
2.1 单因素逐步优化试验
作为一种极易发生聚合反应的亲水性单体,AA的用量直接影响产物的吸水性能。保持其他试剂用量不变,调整岩藻多糖与AA的比例。随着m (岩藻多糖) : m (AA)比例增加,保水剂的吸水倍率呈现先上升后下降的趋势,当岩藻多糖与丙烯酸质量比为1.0∶7.5时,吸水倍率最高可达409.0 g∙g−1,在 9 g∙L−1NaCl 溶液中吸水倍率为 60.5 g∙g−1(图1A)。可能原因是当AA含量较低时,—COOH含量较少,体系呈弱酸性,不利于引发剂的正常分解,从而导致交联度和吸水倍率变低。在保水剂合成过程中,AA含量增加使保水剂的交联程度增强,此时形成的网络结构较为稳定。而当单体比例进一步增加时,一方面聚合物网络结构中—COOH的数量较多,自由基和单体的运动受阻;另一方面,AA聚合物的相对分子质量过大时,其交联度可能会因聚合物链之间的缠结而增加,而交联程度过高引起聚合物网络结构过于紧密,限制保水剂的高分子链和空间网络结构扩展,引起空间网络壁厚度增加,孔隙结构变小,从而导致保水剂吸水能力下降。Zhao等[26]以氨基磺酸改性淀粉为原料制备保水剂,保水剂的溶胀率先随m (改性淀粉):m (AA)的增加而升高,质量比增加到1.0∶7.5以上后,溶胀率会降低。本研究结果与之类似,AA增加到一定量时,自由基和单体运动受阻;同时保水剂交联度过高限制空间网络结构的拓展。
从丙烯酸中和度对保水剂吸水性能的影响(图1B)可以看出,AA中和度的增加会导致岩藻多糖生物保水剂的吸水倍率先增加然后逐渐减小。在AA中和度达到70%前,—SO3— 和聚合物中的羧酸基团 (—COO—)相互作用导致相邻磺酸盐基团之间的静电排斥增加,扩大了保水剂三维网络空间结构。中和过程中的NaOH单体释放出Na+,使得聚合物内部Na+的浓度增加,从而加大聚合物内外的渗透压差,因此,保水剂吸水能力增强。AA中和度为70%时,吸水倍率达到最大限度,在ddH2O中为368.9 g∙g−1,在 9 g∙L−1 NaCl 溶液中吸水倍率为56.5 g∙g−1。当AA中和度超过70%时,吸水倍率降低;这是由于中和度较高时,保水剂网络空间结构中 —COONa含量过高,导致分子链无法完全伸展,同时过量Na+的存在会引发电荷屏蔽现象,导致相邻硫酸基团和羧酸盐基团之间的排斥作用被屏蔽,因此在ddH2O和NaCl溶液中的吸水能力降低。Zhang等[27]利用2−丙烯酰胺−2−甲基−1−丙烷磺酸(AMPS)和AA合成了1种基于废弃白菜的新型保水剂,中和度为70%时,吸水倍率达到最大;因此认为由于磺酸基团和羧酸基团之间存在排斥力,保水剂的吸水效果会因中和度过高或过低而受到影响。
引发剂是自由基聚合过程中的重要元素,通常用于调节聚合过程中单体转化为聚合物的速度,因为引发剂(如过硫酸铵)的分解速率决定着保水剂的聚合速率。引发剂的主要作用机制是在加热条件下,过硫酸盐分解释放硫酸盐阴离子自由基,在溶液中形成自由基活性中心,同时附近的单体成为自由基活性中心的受体,进而形成保水剂。如图1C所示,当引发剂的质量为AA质量的3.0%时,保水剂吸水倍率最高,为377.1 g∙g−1,在 9 g∙L−1 NaCl 溶液中吸水倍率为60.1 g∙g−1。当引发剂质量低于AA的3.0%时,增加引发剂用量,自由基也随之增加,同时自由基能够增加单体与接枝主链的反应位点,从而发生更多的接枝聚合反应,形成更稳定的网络结构,使得聚合物骨架上吸水性基团的数量增多,增强了吸水性能。当引发剂质量高于AA的3.0%时,增加引发剂的用量,保水剂的吸水倍率下降。这可能是由于产生的过量自由基通过双分子碰撞抑制下一步反应的发生[27],进而使得聚合物网络结构的密度增加,支链的相对分子质量降低,从而缩短了聚合物链的平均长度,导致吸水能力下降。Chen等[28]合成了一种基于羧甲基壳聚糖的聚酰胺保水剂,发现在一定范围内随着引发剂用量的增加,保水剂的吸水倍率升高,而后引发剂用量增加吸水能力反而下降。因此在自由基聚合过程中,当其他条件保持不变时,引发剂用量的多少与平均动力学链长呈负相关,同样,支链的相对分子质量较小,导致形成的网络不够完整,因此,保水剂的吸水能力降低。
交联剂(MBA)用量对保水剂的吸水能力有显著影响,交联剂用量增加可以提高交联密度,减小共聚物链间的距离。由图1D可知,交联剂投加量为AA质量的0.2%时,在ddH2O中吸水倍率最高为401.7 g∙g−1,在 9 g∙L−1 NaCl 溶液中为57.2 g∙g−1。随着交联剂含量的增加,保水剂的吸水能力呈现下降趋势。当交联剂投加量较少时,形成的保水剂吸水能力弱,因为低交联密度在茶袋法测量吸水倍率时无法保持吸收的水分;适量的MBA能够保持较高的吸水倍率,因为适量交联剂含量可以增加聚合物的交联密度、减少共聚物链间的间隙,但保水剂的高度交联结构会阻碍保水剂网络聚合物在溶胀过程中的体积膨胀,从而显著降低其吸水倍率。Zhang等[27]用AMPS(2−丙烯酰胺−2−甲基−1−丙烷磺酸)和 AA合成一种基于废弃卷心菜的新型保水剂,当MBA与单体(AMPS和AA)的质量比为0.10%时,达到最大的吸水倍率。因此,在不同类型保水剂合成过程中,过多的交联剂会阻碍聚合物在溶胀过程中的体积膨胀,从而显著降低其吸水倍率。
2.2 岩藻多糖生物保水剂的性质表征
岩藻多糖生物保水剂和岩藻多糖分别在
3410 、3470 cm−1[25]处存在明显的宽吸收峰(图2),对应于—OH的伸缩振动。1067 cm−1[20]处是C—O—C的非对称拉伸振动的吸收峰,2947 cm−1[7, 25]处是饱和C—H的拉伸振动峰,在1259 cm−1[29]的吸收峰是由岩藻多糖硫酸基中的S=O伸缩振动引起的,它是岩藻多糖的特征吸收峰,说明制备的保水剂中有硫酸基团存在,岩藻多糖与AA发生了接枝共聚反应。岩藻多糖生物保水剂在1721 cm−1[30]处为C=O拉伸振动的吸收峰,1571 cm−1[31]处为 —COO— 的伸缩振动峰,而在岩藻多糖的红外光谱图中没有发现相关峰,可能是AA和交联剂中产生的羧酸官能团。岩藻多糖在898、791 cm−1[32]的吸收峰分别对应 N—H 的面外弯曲振动吸收峰和环状 —CH 的弯曲振动,在岩藻多糖保水剂中没有发现相关峰,1067 cm−1处的吸收峰明显减弱,原因可能是岩藻多糖中的环状结构断裂,说明岩藻多糖与AA发生了接枝共聚反应,成功合成了岩藻多糖保水剂。保水剂的表面微观结构和吸水性能密切相关,从岩藻多糖生物保水剂表面颗粒SEM结果(图3)可以看出岩藻多糖生物保水剂表面结构紧凑,存在的褶皱可以增加保水剂的比表面积,有利于提高吸水能力;岩藻多糖生物保水剂内部存在大量相互连通的孔洞,形成了紧密交织的立体状多孔网络结构,且表面交联形态不均匀;保水剂孔隙率高、比表面积大,使得更多的水分子和阳离子进入内部并与亲水基团结合,同时部分大孔径结构增加了内部网络结构的弹性结合力,使得水分子结合更加紧密而不易蒸发,可以提高保水剂的吸水能力。
2.3 岩藻多糖生物保水剂的吸水性能
岩藻多糖生物保水剂在吸水过程中随时间变化的溶胀形态见图4。岩藻多糖生物保水剂在 0~168 h 形态变化十分明显,且96 h后保水剂自身的颜色变浅,但并不影响其吸水性能,168 h 后形态变化较小,同时保水剂的边缘出现轻微脱落现象,说明此时已达到吸水平衡,但检测发现保水剂依旧在持续吸水。结果表明岩藻多糖生物保水剂表现出良好的吸水性能,根据保水剂吸水性能测试试验可知,平衡时(168 h)吸水倍率可达到 420.9 g∙g−1。从图4也可以看出保水剂能够有效吸收并长时间保持大量水分,同时能较好地维持其形态完整性。
为研究保水剂在ddH2O、9 g∙L−1NaCl溶液中的吸水速率,参考其他研究[30, 33],采用拟一级吸水动力学模型评估其吸水行为,表达式为:
$$ \mathit{Q} _{ \mathit{t} } \mathrm= \mathit{Q} _{ \text{e} } -{{\mathrm{e}}^{{({\mathrm{ln}}}Q_{\mathrm{e}}- {k}_{1} {t)}}}{\text{,}} $$ (2) 式中,Qt、Qe分别为 t和平衡时刻的吸水倍数,g∙g−1;k1 为 拟一级模型速率常数,min−1。
保水剂在ddH2O (图5A) 、9 g∙L−1NaCl溶液 (图5B) 的拟一级动力学模型拟合程度较好,决定系数(Coefficient of determination, R2)分别为
0.9610 和0.9813 。保水剂在2种溶液中均在168 h达到吸水平衡,在ddH2O中吸水倍率较高,为420.9 g∙g−1,在9 g∙L−1 的NaCl 溶液中的吸水倍率较低,为63.8 g∙g−1,原因是NaCl溶液中的Na+、Cl−等离子强度大,减小了保水剂内外的渗透压差,导致吸水能力减弱。经过连续吸水−解吸循环测定岩藻多糖生物保水剂在ddH2O中的再吸水能力 (图6)。岩藻多糖生物保水剂在ddH2O中的吸水能力随着吸水次数的增加呈现先增强后减弱的趋势,但变化速率相对较慢,原因可能是经过多次吸水干燥后保水剂网络结构发生改变,交联度变小,同时在多次吸水后,存在部分凝胶被溶解,导致吸水能力下降。在重复吸水6次后,岩藻多糖生物保水剂的吸水倍率为297.7 g∙g−1,为第1次吸水倍率的70.8%,表明岩藻多糖生物保水剂具有优异的重复吸水性能,可以增加保水剂的使用次数,降低成本,为保水剂在后续农业种植中的应用提供良好前景。
2.4 岩藻多糖生物保水剂对植物生长的影响
为进一步证实岩藻多糖生物保水剂对植物生长的促进作用,本研究选取生长状况一致的白菜幼苗栽种在含有保水剂与土壤质量比为2 (T1)、4 (T2)和6 (T3) g∙kg−1的盆栽中。结果(图7)表明,在施用岩藻多糖生物保水剂盆栽中,白菜受旱 35 d的影响较小。在CK(仅土壤)中种植的白菜生长迟缓,而在添加不同用量保水剂的盆栽中,白菜生长茂盛、叶片增大 (图7A) ,图7B 显示不同添加量的保水剂作用下白菜根部的代表性照片,随着保水剂施用量的增加,白菜根长显著增长。随着干旱胁迫的持续,土壤含水量随着保水剂添加量的增加而明显上升 (图8A)。经保水剂处理的土壤含水量高于CK的,在 35 d 后含水量仅为 28.6%,与此同时,T3处理的土壤含水量较CK显著提升 8.98%。此外,植株高度和根长 (图8B)也随着保水剂含量的增加而增加,尤其是T3处理更为明显,植株高度和根长分别较CK增加了71.6%和48.1%。在相同条件下,每千克土壤中添加 6 g 保水剂的白菜枝叶更茂密。一方面,保水剂可抑制土壤中水分的蒸发,为缺水条件下的植物提供水分。另一方面, 保水剂还能增加土壤孔隙度、改变土壤颗粒结构,使植物生长得更好。
![图 8 保水剂对白菜生长的影响]() 图 8 保水剂对白菜生长的影响CK为土壤对照,T1、T2、T3处理的保水剂与土壤质量比分别为2、4和6 g·kg−1;各小图中,同一指标图柱上的不同小写字母表示差异显著(P < 0.05,Duncan’s 法)。Figure 8. Effect of superabsorbent polymer on the growth of Chinese cabbageCK is the soil control, the mass ratios of superabsorbent polymer to soil in T1, T2 and T3 are 2, 4 and 6 g·kg−1 respectively. In each figure,different lowercase letters on the columns of the same indicator indicate significant differences (P < 0.05, Duncan’s method ).
图 8 保水剂对白菜生长的影响CK为土壤对照,T1、T2、T3处理的保水剂与土壤质量比分别为2、4和6 g·kg−1;各小图中,同一指标图柱上的不同小写字母表示差异显著(P < 0.05,Duncan’s 法)。Figure 8. Effect of superabsorbent polymer on the growth of Chinese cabbageCK is the soil control, the mass ratios of superabsorbent polymer to soil in T1, T2 and T3 are 2, 4 and 6 g·kg−1 respectively. In each figure,different lowercase letters on the columns of the same indicator indicate significant differences (P < 0.05, Duncan’s method ).研究不同添加量的岩藻多糖生物保水剂对白菜的生长条件和功效的影响,对相同生长周期内白菜地上和地下部分的生物量、叶片长度、宽度、叶片数量进行测量。结果(图8)表明,不同保水剂施用量与白菜叶片数之间差异不显著,然而保水剂施用量为每千克土壤2、4和6 g时,较CK地上部分鲜质量分别提高46.0%、67.6%和130.0%,较CK地下部分鲜质量分别提高23.5%、43.2%和81.1%。T3处理较CK叶片宽度和长度分别提高140.0%和57.8%,保水剂能有效提高白菜根茎和叶片的平均生物量,其顺序为T3 > T2 > T1 >CK。这充分证明了每千克土壤中添加6 g保水剂更能显著促进植物的生长。
3. 结论
1) 本研究创新性地以岩藻多糖为原料制备岩藻多糖生物保水剂。将天然高分子岩藻多糖接枝在AA上进行共聚反应,FT-IR和SEM分析表明产物在
1259 、1571 cm−1出现新的吸收峰,可能是岩藻多糖的特征吸收峰S=O以及AA和交联剂反应中产生的羧酸官能团 (—COO—),说明成功合成了岩藻多糖生物保水剂,同时其内部形成紧密交织的立体状多孔网络结构,表面褶皱形态增加了保水剂的比表面积,有利于提高吸水能力。2) 通过单因素优化试验确定了最佳的合成工艺并探究其吸水性能。在最佳合成条件下,保水剂在168 h达到吸水平衡,此时在去ddH2O中的吸水倍率为420.9 g∙g−1,在 9 g∙L−1的NaCl 溶液中的吸水倍率,为63.8 g∙g−1;在重复吸水6次后,岩藻多糖生物保水剂的吸水倍率为297.7 g∙g−1,为第1次吸水倍率的70.8%;同时保水剂在ddH2O和9 g∙L−1 NaCl溶液的拟一级动力学模型拟合程度较好,R2分别为
0.9610 和0.9813 。3) 系统地评估了岩藻多糖生物保水剂对白菜生长的影响。即使每千克土壤添加2~6 g岩藻多糖保水剂也能有效提高土壤的持水能力和保水率。与CK相比,当保水剂含量为每千克土壤6 g时,土壤含水量提高8.98%。同时,随着在盆栽混合物中每千克土壤加入6 g的保水剂,植株总生物量增加了105.5%。研究表明,本研究所制备的岩藻多糖保水剂能使白菜在极度缺水的情况下更好地生存,在相同条件下,每千克土壤中添加 6 g保水剂时植物生长最好。
鉴于上述特性,岩藻多糖生物保水剂可作为土壤改良剂和保水剂应用于农业领域,研究为农业节水保水应用提供了重要依据。
致谢:感谢昆明理工大学环境科学与工程学院潘波老师和分析测试中心老师给予的支持和帮助!
-
表 1 SRBSDV-Anhui-HN2 S5片段与16个斐济病毒属其他分离物S5片段核苷酸序列的相似性
Table 1 Nucleotide sequence similarity between S5 segment of SRBSDV-Anhui-HN2 and S5 segments of 16 other isolates of Fijivirus
分离物 GenBank登录号 来源地 相似性/% SRBSDV-Anhui-HN2 HF954999 中国安徽 100.0 SRBSDV-VNM JQ692576 越南 99.7 SRBSDV-HuNyy JQ034352 中国湖南 99.5 SRBSDV-Hubei HM585275 中国湖北 99.4 SRBSDV-YN-MShi JQ773424 中国云南 99.2 SRBSDV-HN FN563993 中国海南 99.0 RBSDV-HB KC134293 中国河北 71.3 RBSDV-JS KM921677 中国江苏 71.1 RBSDV-SDZZ10 JX421768 中国山东 70.2 RBSDV-MX8 HF954989 中国安徽 70.2 RBSDV-Anhui-LJ HF955009 中国安徽 70.2 RBSDV-WZ KC801047 中国浙江 70.1 RBSDV-LH KC801046 中国浙江 70.0 RBSDV-Korean HQ670667 韩国 69.9 FDV-AUS NC_007160 澳大利亚 49.9 MRCV-Arg AY607587 阿根廷 64.1 NLRV-TSU D49697 古巴 38.0 -
[1] ZHOU G H, WEN J J, CAI D J, et al. Southem rice black-streaked dwarf virus: A new proposed Fijivirus species in the family Reoviridae[J]. Chinese Sci Bull, 2008, 53(23): 3677-3685. doi: 10.1007/s11434-008-0467-2
[2] 季英华, 高瑞珍, 张野, 等.一种快速同步检测水稻黑条矮缩病毒和南方水稻黑条矮缩病毒的方法[J].中国水稻科学, 2011, 25(1): 91-94. http://www.cnki.com.cn/Article/CJFDTOTAL-ZGSK201101015.htm [3] 王强, 周国辉, 张曙光.南方水稻黑条矮缩病毒一步双重RT-PCR检测技术及其应用[J].植物病理学报, 2012, 42(1): 84-87. http://www.cnki.com.cn/Article/CJFDTOTAL-ZWBL201201013.htm [4] 周国辉, 张曙光, 邹寿发, 等.水稻新病害南方水稻黑条矮缩病发生特点及危害趋势分析[J].植物保护, 2010, 36(2): 144-146. http://www.cnki.com.cn/Article/CJFDTOTAL-ZWBH201002039.htm [5] ZHOU G H, XU D L, XU D G, et al. Southern rice black-streaked dwarf virus: A white-backed planthopper-transmitted fijivirus threatening rice production in Asia[J]. Front Microbiol, 2013, 4: 270.
[6] 刘欢, 倪跃群, 饶黎霞, 等.南方水稻黑条矮缩病毒和水稻条矮缩病毒的单抗制备及其检测应用[J].植物病理学报, 2013, 43(1): 27-34. http://www.cnki.com.cn/Article/CJFDTOTAL-ZWBL201301004.htm [7] 杨迎青, 兰波, 孟凡, 等.江西省白背飞虱消长动态及南方水稻黑条矮缩病带毒率的测定[J].华中农业大学学报, 2013, 32(6): 60-64. http://www.cnki.com.cn/Article/CJFDTOTAL-HZNY201306012.htm [8] 郑兆阳, 张启勇, 沈光斌.安徽省南方水稻黑条矮缩病发生现状和综防对策[J].安徽农学通报, 2011, 17(7): 132-188. http://www.cnki.com.cn/Article/CJFDTOTAL-AHNB201107066.htm [9] 丁铭, 尹跃艳, 方琦, 等.云南水稻上检测到南方水稻黑条矮缩病毒[J].植物病理学报, 2011, 41(6): 640-644. http://youxian.cnki.com.cn/yxdetail.aspx?filename=ZWBH20170118002&dbname=CAPJ2015 [10] LIU Y, JIA D S, CHEN H Y, et al. The P7-1 protein of Southern rice black-streaked dwarf virus, a fijivirus, induces the formation of tubular structures in insect cells[J]. Arch Virol, 2011, 156(10): 1729-1736. doi: 10.1007/s00705-011-1041-9
[11] 羊健. 水稻黑条矮缩病毒S5基因组功能的研究[D]. 长沙: 湖南农业大学, 2007: 1-57. [12] ZHANG P, MAR T T, LIU W W, et al. Simultaneous detection and differentiation of Rice black streaked dwarf virus (RBSDV) and Southern rice black streaked dwarf virus (SRBSDV) by duplex real time RT-PCR[J]. Virol J, 2013(10): 24-35.
[13] 张恒木, 雷娟利, 陈剑平, 等.浙江和河北发生的一种水稻, 小麦, 玉米矮缩病是水稻黑条矮缩病毒引起的[J].中国病毒学, 2001, 16(3): 246-251. http://www.cnki.com.cn/Article/CJFDTOTAL-ZBDX200103010.htm [14] 章松柏, 王开放, 刘小娟, 等.南方水稻黑条矮缩病毒非结构蛋白的亚细胞定位研究[J].热带作物学报, 2013, 34(11): 2102-2107. doi: 10.3969/j.issn.1000-2561.2013.11.005 [15] 卢嫣红, 张金凤, 熊如意, 等.南方水稻黑条矮缩病毒S6编码一个沉默抑制子[J].中国农业科学, 2011, 44(14): 2909-2917. doi: 10.3864/j.issn.0578-1752.2011.14.007 [16] 羊健, 张恒木, 陈剑平, 等.水稻黑条矮缩病毒p8蛋白的原核表达、抗血清制备及其特性[J].植物保护学报, 2007, 34(3): 252-258. http://www.cnki.com.cn/Article/CJFDTOTAL-ZWBF200703007.htm [17] 张蔚明, 刘燕娟, 周倩, 等.南方水稻黑条矮缩病毒外壳蛋白P10的原核表达和抗血清制备及应用[J].湖南农业大学学报(自然科学版), 2011, 37(4): 400-402. http://www.cnki.com.cn/Article/CJFDTOTAL-HNND201104010.htm [18] LIU X Y, YANG J, XIE L, et al. P5-2 of Rice black-streaked dwarf virus is a non-structural protein targeted to chloroplasts[J]. Arch Virol, 2015, 160(5): 1211-1217. doi: 10.1007/s00705-015-2382-6
[19] 洪健, 李德葆, 周雪平, 等.植物病毒分类图谱[M].北京:科学出版社, 2001: 64-67. [20] NAKASHIMA N, KOIZUMI M, WATANABE H, et al. Complete nucleotide sequence of the Nilaparvata lugens reovirus: A putative member of the genus Fijivirus[J]. J Gen Virol, 1996, 77(1): 139-146. doi: 10.1099/0022-1317-77-1-139
[21] HARDING R M, BURNS P, GEIJSKES R J, et al. Molecular analysis of Fiji disease virus segments 2, 4 and 7 completes the genome sequence[J]. Virus Genes, 2006, 32(1): 43-47. doi: 10.1007/s11262-006-5844-x
[22] DISTEFANO A J, CONCI L R, HIDALGO M M, et al. Sequence analysis of genome segments S4 and S8 of Mal de Rio Cuarto virus(MRCV): Evidence that the virus should be a separate Fijivirus species[J]. Arch Virol, 2002, 147(9): 1699-1709. doi: 10.1007/s00705-002-0840-4
[23] 张上林, 孙丽英, 陈剑平.四种水稻蛋白与水稻黑条矮缩病毒编码非结构蛋白P7-2的互作分析[J].浙江农业学报, 2013, 25(6): 1298-1303. http://www.cnki.com.cn/Article/CJFDTOTAL-ZJNB201306026.htm [24] 陈秀, 饶雪琴, 阮小蕾, 等.香蕉线条病毒MP功能域基因的克隆、原核表达及抗血清制备[J].华南农业大学学报, 2014, 35(2): 47-52. doi: 10.7671/j.issn.1001-411X.2014.02.009



 下载:
下载: