Effects of G418 treatment of donor cells on the in vitro developmental efficiency of cloned porcine embryos
-
摘要:目的
探索G418处理供体细胞对其核移植胚胎发育效率的影响。
方法利用G418单独处理猪成体成纤维细胞6 d后,收集细胞,利用荧光定量PCR的方法检测处理前后细胞中抗氧化应激、细胞凋亡相关基因的表达水平,运用亚硫酸盐结合测序法分别检测基因组重复序列LINE-1、微卫星的DNA甲基化状态,以及其核移植胚胎体外发育的能力。
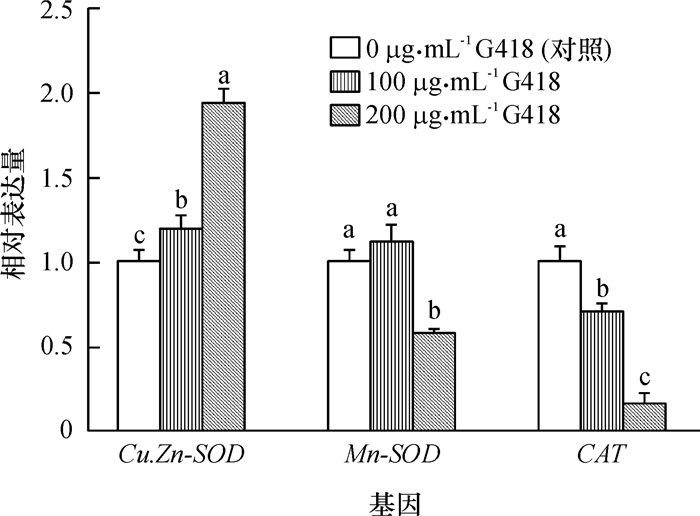
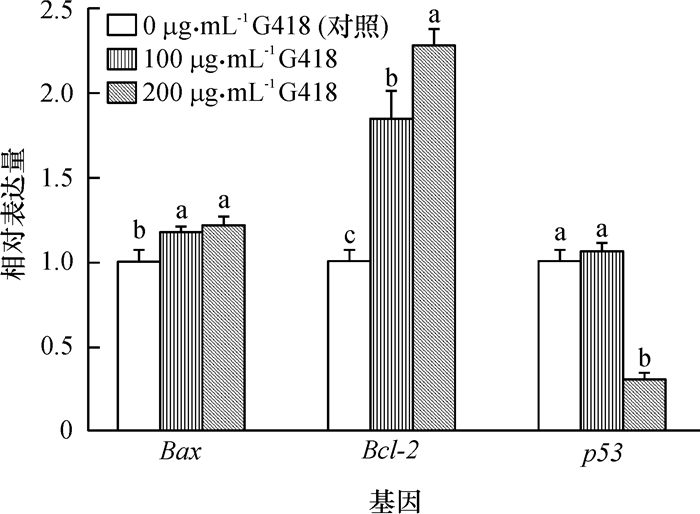
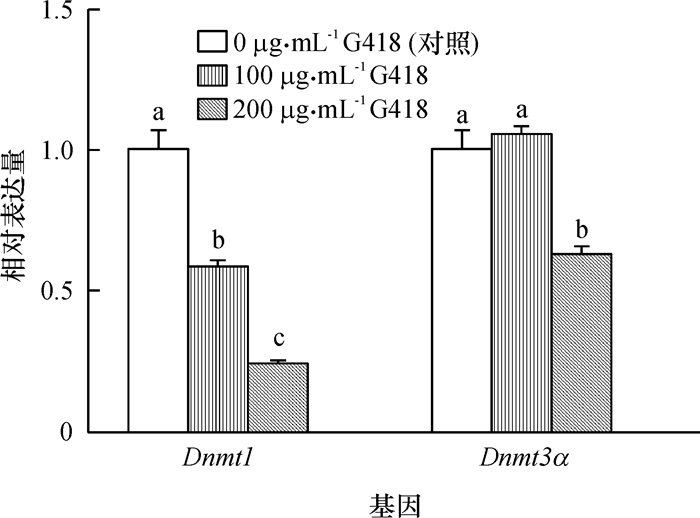
结果经不同质量浓度G418处理的供体细胞的抗氧化应激酶相关基因及细胞凋亡基因表达发生显著变化(P<0.05),但其DNA甲基化水平没有发生改变(P>0.05);经G418处理的供体细胞的核移植胚胎的体外发育效率显著低于对照组(P<0.05)。
结论G418处理供体细胞可能对其克隆胚胎体外发育效率有抑制作用。
Abstract:ObjectiveTo explore the influence of G418 treatment of donor cells on the developmental efficiency of somatic cell nuclear transfer (SCNT) embryos.
MethodPorcine adult fibroblasts were collected after six days of G418 treatment. Expression levels of antioxidation and apoptosis-related genes were detected by quantitative RT-PCR before and after G418 treatment. The DNA methylation levels of LINE-1 repetitive sequences and microsatellites were analyzed using bisulfites sequencing analysis, and the in vitro developmental rates of SCNT embryos were investigated.
ResultG418 treatment of donor cells caused significant (P < 0.05) changes in expression levels of genes related to antioxidation and apoptosis, but did not significantly(P > 0.05) change DNA methylation levels. SCNT embryos cloned from G418-treated donor cells exhibited a significantly (P < 0.05) lower in vitro developmental rates compared with the control group.
ConclusionG418 treatment of donor cell may inhibit the development of SCNT embryo.
-
Keywords:
- G418 /
- porcine /
- cloning /
- nuclear transfer /
- transgene /
- embryonic development
-
动物肠道存在数量众多和种类各异的微生物,既包括乳酸杆菌和双歧杆菌等有益菌,也存在沙门菌和大肠埃希菌等致病菌或条件致病菌[1].肠道内正常微生物菌群不仅是肠道内抵抗外来病原菌以及内源条件致病菌的第一道防线,而且也是影响动物肠道发育和消化吸收功能的重要因素[2-3].仔猪,尤其是从出生到断奶前后的仔猪,由于肠道发育尚不成熟,其肠道微生态的平衡容易受到气候、断奶应激和饲料等因素的影响,从而造成微生物菌群失调,病原微生物感染,进而出现腹泻甚至导致仔猪死亡[4].因此,如何调节仔猪肠道微生物区系,改变有益菌和病原菌的比例,对养猪生产具有重要意义.
长期以来,抗生素一直被认为是抑制猪肠道病原微生物的首选添加剂.但抗生素滥用所造成的药物残留和细菌耐药性等问题也日益凸显.近年来的大量动物试验研究表明,酸制剂在降低肠道pH、提高饲料蛋白消化率和抑制有害微生物生长等方面均发挥着重要的作用[5],因而被认为是能有效替代抗生素的饲料添加剂之一[6].目前养殖生产中常用的酸制剂的种类和组合多样,既包括各种单一有机酸及其盐和无机酸,又包括各种复合酸[7].由于动物活体试验存在干扰因素多,动物个体差异大和试验重复性差等限制,导致不同酸制剂以及不同酸制剂组合之间的效果往往难以进行客观的评价和系统性地比较.
为快速便捷地测定有机酸对有害微生物的抑菌效应,研究人员多选择标准菌株进行药敏试验[8-9].但标准菌株既不能完全代表肠道野生菌株,同时又忽略了肠道内多种微生物之间的互作效应,其研究结果往往也很难在活体动物试验中得到重复验证.因此,本试验利用体外厌氧共培养技术,分离培养仔猪小肠内微生物,并利用16S rRNA定量分析食糜内微生物菌群的数量.研究结果不仅可以为有机酸的效价分析提供有效的体外模型,而且对于养猪生产中有机酸种类和剂量的选择同样具有指导意义.
1. 材料与方法
1.1 试验材料
有机酸:甲酸、乙酸、丙酸、丁酸、乳酸、富马酸、柠檬酸、苯甲酸、苹果酸和山梨酸,均为广州吉祥生物科技有限公司产品,为分析纯.
1.2 试验动物和厌氧培养
每次选择2头35日龄健康断奶仔猪(华南农业大学原种猪场),于代谢笼中饲养(饲粮配方见表 1)5 d后,屠宰取其空肠和回肠内食糜,放入冰浴的烧杯中,用保鲜膜封口后置于厌氧工作站(试验开始前用氮气和二氧化碳混合气体将厌氧工作站内氧气排尽,温度调节至39 ℃)中,并搅拌混匀,按照每管300 μL食糜分装于40个2 mL离心管中.40个离心管随机分成4组,即未培养组、空白培养组、5 mg·mL-1氨苄青霉素组(5 mg·mL-1 AMP)和10 mg·mL-1氨苄青霉素组(10 mg·mL-1 AMP).其中,未培养组和空白培养组添加100 μL无菌生理盐水,抗生素组添加不同剂量氨苄青霉素.除未培养组外,其余3组均厌氧培养4 h后立即置于-20 ℃保存备用.采用定量PCR检测微生物菌群,每个处理设10个重复.
表 1 饲粮配方表(风干基础)Table 1. Diet formulations (air dry basis)
1.3 有机酸对全食糜厌氧培养体系微生物菌群的影响
按照“1.2”方法制备仔猪肠道食糜,分别采用30 mmol·L-1的甲酸、乙酸、丙酸、丁酸、乳酸、富马酸、柠檬酸、苯甲酸、苹果酸和山梨酸培养食糜4 h.采用定量PCR检测有机酸对食糜内微生物菌群的影响.随后选择抑菌活性较强的甲酸、乙酸、丁酸、乳酸、柠檬酸,每种有机酸分别设置5、10、15、20、25和30 mmol·L-1浓度梯度,研究这些有机酸抑菌活性的浓度梯度效应.有机酸与食糜厌氧条件下共培养4 h后立即置于-20 ℃保存备用.每个处理设10个重复.
1.4 引物设计
根据NCBI中GenBank发表的基因序列,用Primer Premier 5.0软件设计不同菌属16S rRNA的上、下游引物(表 2),引物由北京奥科鼎盛生物科技有限公司合成.
表 2 荧光定量PCR引物一览表Table 2. Primer sequences used in real-time PCR analyses
1.5 细菌DNA的提取
食糜解冻后,定量称取300 mg于离心管中,加入50 μL溶菌酶,轻轻振荡混匀,于37 ℃水浴放置30 min,随后加入40 μL的0.1 g·mL-1 SDS和10 μL蛋白酶K,65 ℃水浴20 min后加入5 mol·L-1 NaCl 100 μL于65 ℃水浴10 min.采用酚/三氯甲烷/异戊醇法提取DNA.所得DNA用体积分数为75%的预冷乙醇洗涤沉淀并干燥,最后用含有终质量浓度为20 μg·μL-1 RNAase的灭菌TE Buffer溶解沉淀,于37 ℃水浴中孵育30 min.所得DNA样品置于-20 ℃保存备用.
1.6 16S rRNA定量分析
采用Mx3005P型实时荧光定量PCR仪进行扩增与分析,20 μL反应体系包括基因组DNA 1 μL,上、下游引物(10 μmol · L-1)1 μL,RealtimePCR Master Mix(含荧光染料SYBR green)10 μL,ddH2O 8 μL.反应程序为:95 ℃预变性1 min;95 ℃变性15 s,58 ~ 61 ℃退火15 s,72 ℃延伸30 s,共40个循环后结束.PCR产物胶回收后制作标准曲线.扩增结果用Mx3005P型实时荧光定量PCR仪进行分析并制作标准曲线.细菌数量(以拷贝数计)采用下列公式计算:

式中,C表示各样品根据标准曲线计算得到的DNA浓度,单位μg·μL-1;S表示待测细菌基因组DNA的定量PCR产物的碱基数;V表示从单位质量食糜中获取的DNA溶液体积,单位μL.
1.7 数据统计
数据采用SPSS19.0软件进行统计分析,检验试验数据的正态分布性,对不同处理组间的数值进行单因素方差分析(Analysis of variance,ANOVA)和独立t检验(Independent samples t test).数值用平均值±标准误表示.
2. 结果与分析
2.1 断奶仔猪肠道食糜厌氧培养效果鉴定
经过4 h厌氧培养后,食糜中总菌和各菌属的数量均急剧增加,添加5和10 mg·mL-1氨苄青霉素可极显著抑制总菌、沙门菌属和大肠埃希菌的数量(表 3).氨苄青霉素对乳杆菌属和双歧杆菌属也有显著抑制作用,但抑菌活性相对较弱.上述结果表明该体外培养模型可用于后续试验.
表 3 断奶仔猪肠道食糜体外厌氧培养效果1)Table 3. The construction of in vitro anaerobic culture system for total chyme from the small intestine of weaned piglets
2.2 不同种类有机酸对仔猪全食糜培养体系微生物菌群的影响
试验选取的10种有机酸对微生物菌群的影响如表 4所示.结果发现:与对照组相比,30 mmol·L-1甲酸、乙酸、丙酸、丁酸、乳酸和山梨酸能提高乳杆菌属数量2倍以上,而丁酸、乳酸和山梨酸能显著提高双歧杆菌属数量1.4 ~ 2.0倍.对于病原菌,柠檬酸、甲酸、乙酸和苹果酸表现出对大肠埃希菌和沙门菌属较强的抑菌效应.与对照组相比,柠檬酸、甲酸、乙酸、苹果酸、丁酸和乳酸处理组沙门菌数仅分别为对照组的5.2%、7.8%、10.0%、10.1%、12.6%和17.4%,大肠埃希菌数仅分别为对照组的5.5%、11.2%、12.7%、16.1%、20.2%和40.0%.因此,30 mmol·L-1情况下综合各种有机酸对有益菌和有害菌的效应,甲酸和乙酸可以有效提高乳杆菌的数量,抑制有害菌的繁殖,但对双歧杆菌没有显著的促进作用;柠檬酸对有害菌具有最强的抑制作用,但是对有益菌也表现出抑制作用;只有丁酸和乳酸既能够有效促进有益菌的繁殖,又能较有效地抑制有害菌.
表 4 不同种类有机酸对仔猪空肠和回肠中厌氧培养微生物菌群的影响1)Table 4. The effects of organic acids on intestinal bacteria profiles in vitro anaerobic culture system
2.3 有机酸调控仔猪全食糜培养体系微生物菌群的剂量效应
为进一步研究有机酸调控猪肠道微生物菌群的剂量效应,试验选择甲酸、乙酸、丁酸、乳酸和柠檬酸,分别设置6个浓度梯度进行试验.试验结果如图 1所示,甲酸、丁酸和柠檬酸能呈现剂量依赖性地抑制细菌增殖,而乙酸对总菌数量影响不大(图 1A).对益生菌而言,柠檬酸能显著抑制乳杆菌属和双歧杆菌属的增殖,但低剂量的乳酸(10 mmol·L-1)能显著促进乳杆菌属和双歧杆菌属的增殖(图 1B、1C),且低剂量的乙酸(15 ~ 20 mmol·L-1)也能促进双歧杆菌属的增殖(图 1C).所选择的5种有机酸在浓度达到10 ~ 15 mmol·L-1时,均能有效抑制病原菌(沙门菌和大肠埃希菌)的增殖(图 1D、1E).因此,体外厌氧培养条件下使用单一有机酸时:乙酸应使用约15 mmol·L-1,丁酸约15 mmol · L-1,乳酸约10 ~ 15 mmol·L-1,柠檬酸只能使用约5 mmol·L-1.
综上所述,体外厌氧培养条件下使用单一有机酸调节微生物菌群,15 mmol · L-1乙酸和10 ~ 15 mmol·L-1乳酸是较好的选择.
3. 讨论与结论
3.1 不同有机酸对肠道有害菌的影响
多数研究显示,有机酸在抑制肠道病原菌(大肠埃希菌、沙门菌)方面作用显著[10-12],本研究待筛选的10种酸所用浓度为30 mmol·L-1,换算成质量分数后结果与部分文献的结果也基本一致[6, 13],但关于有机酸作用效果的报道仍存在差异,主要原因包括有机酸种类的不同、添加剂量存在差异.有学者认为有机酸抑制病原菌的机制主要有2个方面,首先是有机酸电离产生的氢离子,可以通过降低消化道pH间接减少细菌数量;其次,有机酸在某些复杂的酶作用下直接进入细菌的细胞从而抑制革兰阴性菌[14-15].现有的有机酸中,已有研究表明富马酸、柠檬酸、苹果酸和乳酸主要通过改变pH来抑菌,而甲酸、乙酸、丙酸和山梨酸等则可以进入细菌内,从而杀灭或抑制细菌[16].本文中的甲酸和乙酸等对大肠埃希菌和沙门菌的抑菌活性明显高于乳酸和富马酸等,说明甲酸和乙酸等直接添加在体外培养食糜中,可能同时通过两方面不同的机制发挥抑菌作用,因而表现出更强的抑菌活性.此外,有机酸电离氢离子的部位对其抑菌活性也有不同的影响.Gauthier等[17]则将肠道细菌分为pH敏感型(大肠埃希菌等)和pH不敏感型(乳酸杆菌和双歧杆菌).研究表明,未解离状态的有机酸能够穿透某些细菌的细胞膜,在细菌体内发生解离,释放出氢离子和阴离子.细胞内pH降低,无法耐受细胞内外pH变化的pH敏感型细菌则会由于消耗大量能量用来维持正常pH而被杀灭[18].由此可以推测,由于柠檬酸的pKa值较低,将保留更多的未解离状态,从而可能产生更强的抑菌活性.
3.2 不同有机酸对仔猪肠道有益菌的影响
本文研究结果发现,短链脂肪酸和乳酸能显著提高乳杆菌属数量,而丁酸、乳酸和山梨酸则对双歧杆菌属增殖有明显的促进效应.陈宝江等[19]通过试验也发现,添加酸化剂后,回肠中乳酸杆菌、厌氧菌数量呈上升趋势,且随着添加剂量增加,乳酸杆菌随之上升.而且多数报道也指出,添加单一有机酸或者复合酸化剂后,肠道内乳酸杆菌数量呈上升趋势[20-21],这主要是由于肠道pH降低,抑制有害微生物的活动和繁殖,从而促使有益菌繁殖[22],由此可见,不同种类和配比的酸化剂对仔猪肠道微生物区系的影响也不尽相同.
目前对有机酸的研究大多是通过动物试验的方式来进行,添加的有机酸也都通过不同的工艺方式进行加工处理,常用的酸化剂的加工工艺有吸附混合、流化床包衣和脂埋等技术,而随着工艺的改进,酸化剂的使用效果将不受饲料因素影响,且缓释性能得到极大的提高,从而导致不同研究中的添加剂量差异很大[23].本文通过体外研究模型,筛选出每种酸的最佳处理浓度,以期为生产实践中添加剂量的选择提供参考.而生产实践中,通过合理设置酸化剂的组合是增加肠道有益菌,降低病原菌,改善肠道健康的有效途径.
3.3 结论
综上所述,本试验采用仔猪食糜离体厌氧培养体系,研究各种有机酸对肠道微生物菌群的影响,并初步筛选确定了体外厌氧培养条件下使用单一有机酸调节微生物菌群,15 mmol · L-1乙酸和10 ~ 15 mmol·L-1乳酸是较好的选择.研究结果为进一步优化仔猪用有机酸制剂的配比提供了直接的试验依据.
-
图 4 不同质量浓度G418处理猪成体成纤维细胞基因组重复序列甲基化水平的影响
图中1~3为3个处理组个体重复;1条链表示1个克隆测序结果,1个圈表示1个CpG,其中,黑色实心圆圈表示甲基化的CpG,白色空心圆圈表示未甲基化的CpG,串珠图中“ǀ ”表示该位点发生非CG或TG突变。A、B、C分别为LINE-1对照组0 μg·mL-1G418、100 μg·mL-1 G418处理组、200 μg·mL-1 G418处理组; D、E、F分别为微卫星对照组0 μg·mL-1G418、100 μg·mL-1 G418处理组、200 μg·mL-1 G418处理组。
Figure 4. DNA methylation levels of genomic repeat sequences in porcine adult fibroblasts treated with different concentrations of G418
表 1 不同质量浓度G418致死所有细胞所需时间
Table 1 Cell death time under different concentrations of G418

表 2 G418处理猪成体成纤维细胞对猪体细胞克隆胚胎体外发育性能的影响1)
Table 2 The effects of G418 on the in vitro development of porcine somatic cell nuclear transfer embryos

-
[1] 金其煌. 乙酰胆碱酯酶在细胞凋亡中的作用及G418诱导细胞凋亡的分子机制[D]. 上海: 中国科学院研究生院(上海生命科学研究院), 2004. http://cdmd.cnki.com.cn/Article/CDMD-80100-2004138063.htm [2] JIN Q H, ZHAO B, ZHANG X J. Cytochrome c release and endoplasmic reticulum stress are involved in caspase-dependent apoptosis induced by G418[J]. Cell Mol Life Sci, 2004, 61(14): 1816-1825. http://www.wanfangdata.com.cn/details/detail.do?_type=perio&id=QK200502979316
[3] 李文哲. 体细胞核移植技术生产转人β-防御素3基因牛的研究[D]. 杨凌: 西北农林科技大学, 2010. http://cdmd.cnki.com.cn/article/cdmd-10712-2010149414.htm [4] LIU Y, LI J, LOVENDAHL P, et al. In vitro manipulation techniques of porcine embryos: A meta-analysis related to transfers, pregnancies and piglets[J]. Reprod Fertil Dev, 2015, 27(3): 429-439. doi: 10.1071/RD13329
[5] 许卫华, 吴珍芳, 余波, 等.供体细胞系基因座位特异DNA甲基化多态性及其与猪克隆效率的关联分析[J].广东农业科学, 2014, 41(12): 165-170. doi: 10.3969/j.issn.1004-874X.2014.12.036 [6] KUMAR B M, JIN H, KIM J, et al. Differential gene expression patterns in porcine nuclear transfer embryos reconstructed with fetal fibroblasts and mesenchymal stem cells[J]. Dev Dynam, 2007, 236(2): 435-446. doi: 10.1002/(ISSN)1097-0177
[7] 周荣, 罗绿花, 石俊松, 等.胚胎培养液中能量底物对猪体细胞克隆胚胎体外培养的影响[J].广东畜牧兽医科技, 2015, 40(5): 28-31. doi: 10.3969/j.issn.1005-8567.2015.05.009 [8] 潘登科. 影响猪体细胞克隆胚胎发育能力的因素研究[D]. 北京: 中国农业大学, 2005. http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=Y773675 [9] 张小建, 李键, 王蕊, 等.供体细胞对哺乳动物体细胞核移植的影响[J].动物医学进展, 2007, 28(3): 82-85. doi: 10.3969/j.issn.1007-5038.2007.03.023 [10] 李武. 活性氧对生长抑素的调节与代谢综合征的关系研究[D]. 南京: 江南大学, 2010. http://cdmd.cnki.com.cn/Article/CDMD-10295-2010075452.htm [11] AITKEN R J, CLARKSON J S, FISHEL S. Generation of reactive oxygen species, lipid peroxidation, and human sperm function[J]. Biol Reprod, 1989, 41(1): 183-197. doi: 10.1095/biolreprod41.1.183
[12] HALLIWELL B, ARUOMA O I. DNA damage by oxygen-derived species: Its mechanism and measurement in mammalian systems[J]. FEBS Lett, 1991, 281(1/2): 9-19. doi: 10.1016-0014-5793(91)80347-6/
[13] 王晓静.氧化应激相关的细胞凋亡过程中基因表达改变[J].国外医学(肿瘤学分册), 2004, 31(1): 10-14. doi: 10.3760/cma.j.issn.1673-422X.2004.01.003 [14] 周桔, 罗荣保, 汤长发, 等. Bcl-2蛋白家族和p53基因在细胞凋亡中的调控效应[J].中国组织工程研究与临床康复, 2007, 11(10): 1950-1952. doi: 10.3321/j.issn:1673-8225.2007.10.048 [15] 颜昊. DNA甲基化修饰与体细胞核移植的关系[J].生命科学, 2009, 21(4): 542-548. http://cdmd.cnki.com.cn/Article/CDMD-10126-1013293408.htm [16] ZAMUDIO S, TORRICOS T, FIK E, et al. Hypoglycemia and the origin of hypoxia-induced reduction in human fetal growth[J]. PLoS One, 2010, 5(1): e8551. doi: 10.1371/journal.pone.0008551
[17] 戚文华, 蒋雪梅, 肖国生, 等.猪全基因组中微卫星分布规律[J].畜牧与兽医, 2014, 46(8): 9-13. http://d.old.wanfangdata.com.cn/Periodical/xmysy201408003 [18] OKANO M, BELL D W, HABER D A, et al. DNA methyltransferases Dnmt3a and Dnmt3b are essential for de novo methylation and mammalian development[J]. Cell, 1999, 99(3): 247-257. doi: 10.1016/S0092-8674(00)81656-6
[19] 顾晓龙, 张廷宇, 戴建军, 等. RG108对猪胎儿成纤维细胞甲基化水平及克隆胚胎发育的影响[J].核农学报, 2014, 28(1): 14-21. http://d.old.wanfangdata.com.cn/Periodical/hnxb201401003 [20] BONK A J, LI R, LAI L, et al. Aberrant DNA methylation in porcine in vitro, parthenogenetic, and somatic cell nuclear transfer-produced blastocysts[J]. Mol Reprod Dev, 2008, 75(2): 250-264. doi: 10.1002/(ISSN)1098-2795



 下载:
下载: