Dynamic changes of cadmium and non-protein thiol in different organs of different soybean genotypes under cadmium stress
-
摘要:目的
探讨不同大豆品种各器官镉和非蛋白巯基物质的动态变化,揭示巯基物质在大豆镉抗性和积累中的作用。
方法在镉(Cd)污染的土壤中种植镉抗性和籽粒积累不同的大豆品种中黄24和华夏3号,采集不同生育时期的根、茎和叶,分析各品种的Cd抗性指标(根系和地上部鲜质量)、Cd积累指标(各器官Cd浓度)和非蛋白巯基物质[总非蛋白巯基肽(NPT)、谷胱甘肽(GSH)和植物螯合肽(PC)]的浓度变化。
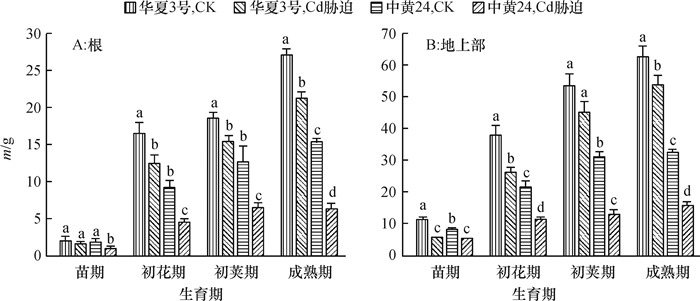
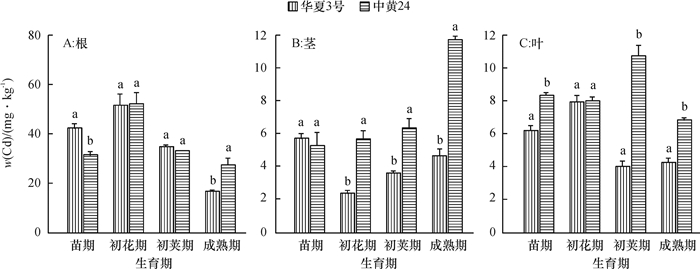
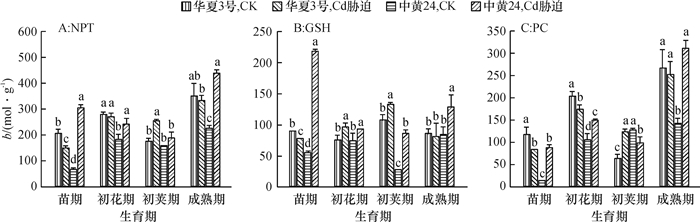
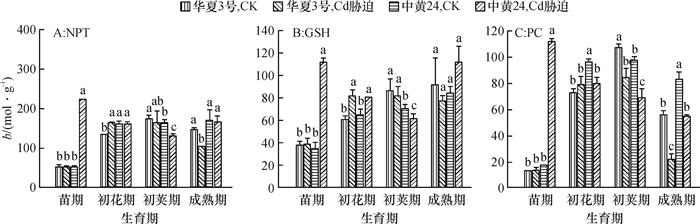
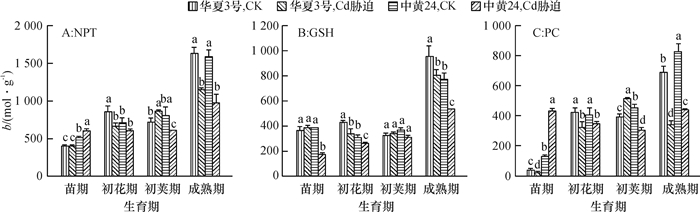
结果在10 mg·kg-1的Cd胁迫下,中黄24不同时期Cd抗性指标明显低于华夏3号,而中黄24初花期后各器官Cd浓度均显著地高于华夏3号。Cd胁迫下2个品种随发育进程根系中NPT、GSH和PC浓度上升,而叶片中则下降;敏感品种中黄24各器官中巯基物质对Cd胁迫响应比抗性品种华夏3号更显著。关联分析发现,大豆根部巯基物质浓度与各器官Cd浓度呈正相关,且以成熟期最为显著,而初花期后地上部的PC与各器官Cd浓度呈负相关。
结论在大豆不同生育期不同器官中Cd和非蛋白巯基物质浓度变化复杂,非蛋白巯基物质在大豆抵抗Cd胁迫中扮演多种角色。
Abstract:ObjectiveDynamic changes of cadmium and non-protein thiols in different soybean genotypes were researched to investigate effects of non-protein thiols on Cd tolerance and accumulation of soybean.
MethodThe soybean varieties of Zhonghuang24 and Huaxia3 were planted in the pots with contaminated soil. Roots, shoots and leaves were collected in different periods. Cd tolerance indexes (including root and shoot fresh mass), Cd accumulation and the concentrations of non-protein thiols [including the total of non-protein thiol peptides (NPT), glutathione (GSH) and phytochelatins(PC)] of soybeans in different periods were determined.
ResultThe resistance indexes of Zhonghuang24 were significantly lower than those of Huaxia3 in different periods at the Cd concentration of 10 mg·kg-1, and Cd accumulations in all organs were higher than those of Huaxia3 after flowering stage (especially at pod and mature stages). The NPT, GSH and PC concentrations increased in root and reduced in leaf along with the development progress, and the effects of non-protein thiols in Zhonghuang24 under Cd stress were stronger those of Huaxia3. The correlation analysis indicated that there was a positive correlation between thiol concentration in root and the Cd concentration in all organs, especially at mature stage. There was a negative correlation between PC concentrations in stem and leaf after flowering stage, especially more significant at pod and mature stages.
ConclusionThe concentrations of thiols and Cd in soybean organs show complex changes at different growth stages under Cd stress. Non-protein thiols play multiple roles in Cd detoxification and transportation at different growth stages.
-
Keywords:
- Cd stress /
- soybean /
- non-protein thiol /
- glutathione /
- phytochelatin
-
光是植物进行光合作用的主要驱动因子,是决定植物生长发育及生理功能的重要环境因素[1]。由于植物自身生长习性的差异,其对光环境的适应性不尽相同[2]。即使对于同一种植物,其对光的需求以及对光环境的适应性亦因生长发育阶段而异,这种差异亦是林分更新和群落演替的重要驱动机制[3]。通常情况下,光照不足会造成植物光合受阻和碳供应障碍,进而引发植物叶片黄化和死亡[4];而光照过强则易引发光抑制,导致光合作用减弱,植物光化学效率降低[5]。对光环境进行适度调控更有利于植物的生长发育,对红锥 Castanopsis hystrix[6]、夏腊梅Sinocalycanthus chinensis[7]、香樟Cinnamomum camphora[8]、桢楠Phoebe zhennan[8]、花榈木Ormosia henryi[9]等植物的幼苗研究发现,适度遮阴较全光照对其生长发育更为有利,且可提高苗木生长量及质量[10-11]。
造林密度是人工林营建的基础,其决定着林分内的竞争状态及光环境,进而影响到树冠及枝条发育。Mäkinen[12]通过不同密度欧洲白桦Betula pendula 人工林分枝解析发现,随着密度增加分枝增量减少,分枝寿命增加,枯死枝条掉落率降低;Ulvcrona等[13]分析樟子松Pinus sylvestris 人工林分枝特性与林分密度的关系,发现分枝直径随林分密度增加而减小,但林分密度对每轮分枝数和分枝角度无显著影响;王志海等[14]的研究表明,米老排Mytilaria laosensis 林分死枝下高随造林密度增大而增加,枯枝率升高,枝条直径和分枝角度减小。然而,有关树冠及枝条发育与光环境间关系的实证研究尚少,Dong等[15]对杉木Cunninghamia lanceolata 幼树的遮阴试验表明,枝条生长不仅受林分整体光环境影响,亦与树冠内光环境异质性相关。开展此类实证研究,有助于增进理解树冠和枝条发育对造林密度的响应机制。
西南桦Betula alnoides是我国热带、亚热带地区乡土珍贵用材树种,树干通直,材质优良,生长较快,对环境适应性强,适宜培育大径材[16]。随着国家退耕还林等政策的实施,我国西南桦人工林发展迅速,至2015年底,其种植面积已超过15万hm2[17]。近年来,随着市场对于西南桦优质大径级无节材需求的增加,其价格逐年攀升。如何进行大径材高效培育已成为西南桦人工林培育的重点。基于此,我们前期研究了西南桦生长及枝条发育与造林密度[18-19]的关系,探明了造林密度对枝条发育调控的有效性。为深入解析林分密度对枝条发育的调控机制,本研究以5年生西南桦幼林为对象,设置系列遮阴处理,研究林木生长及枝条发育动态,揭示林木生长和枝条发育对光环境的响应规律,以期为西南桦林分密度合理配置提供理论依据。
1. 研究地概况
西南桦密度试验林位于广东省郁南林场镇龙庙工区 (111°53′E,23°05′N),海拔440 m。该地属于南亚热带季风气候,年均气温21.6 ℃,年降水量1 400~1 700 mm,降雨主要集中在4—9月份,年平均湿度80%。土壤为赤红壤。试验林营建于2012年5月,造林苗木为中国林业科学研究院热带林业实验中心生产的FB4无性系组培苗,基于前期对造林密度与冠层的光合特征研究,为尽可能消除造林密度及林地小环境的影响,取造林密度为625 株·hm−2 (4 m×4 m) 的林地为试验地,造林面积约0.333 hm2。造林当年于雨季末抚育1次,并松土追肥;随后2年内,每年雨季初和雨季末各抚育1次,并结合第1次抚育进行施肥;施肥采用穴施方式,肥料为复合肥,m(N)︰m(P2O5)︰m(K2O) = 15︰15︰15,施肥量逐年递增,3次的每穴施肥量分别为100、250和300 g。
2. 研究方法
2.1 试验设计
考虑到当地西南桦的物候特殊性,即西南桦在9月上旬至中旬落叶,9月底—10月初萌发新叶,因此,于2017年10月初铺设试验。于试验林内选取西南桦优势木和亚优势木12株,调查其树高、胸径和枝下高,并计算其冠长(表1)。基于前期对不同冠层光合能力的测定,上部冠层(约1/3)光合能力基本不受造林密度影响,因此,模拟不同造林密度林分的光环境,设置不遮阴(对照,CK)、低遮阴率(40%~45%)、中遮阴率(55%~60%) 和高遮阴率(80%~90%) 4个处理,在自顶梢开始向下1/3冠长处用不同透光率的遮阴网搭建遮阴棚,遮阴棚长、宽均为6 m。试验采用随机区组设计,单株小区,每个处理3次重复。对于该位置以下所有枝条,依次挂牌、编号,测定其高度位置、基径、长度等指标。枝条基径采用电子游标卡尺测定(精度0.01 mm),枝条长度采用伸缩尺测定(精度0.01 m)。
2.2 林木生长与枝条发育调查
自2018年1月开始至2019年1月,每隔3~4个月调查试验单株及标记枝条的生长情况。测定胸径、树高、枝下高以及枝条基径和长度,并记录枝条存活情况。
表 1 不同遮阴率处理下参试植株的生长状况1)Table 1. Growth performance of test individuals in different shading treatments遮阴率/%
Shade rate树高/m
Tree height胸径/cm
DBH枝下高/m
Height below branch冠长/m
Crown length0(CK) 6.77±0.484 7.83±0.133 1.73±0.338 5.03±0.393 40~45 6.87±0.067 7.43±0.176 1.30±0.058 5.57±0.882 55~60 6.37±0.584 6.63±0.869 1.67±0.633 4.70±0.750 80~90 6.87±0.636 7.17±0.120 1.58±0.434 5.28±0.812 1) 表中数据为平均值±标准误(n=3)
1) The data in the table are means ± standard errors (n=3)2.3 数据分析
利用SPSS21.0 (IBM-SPSS Inc., Chicago, USA) 对每个调查时间段及整个试验期内西南桦单株及枝条各生长指标的增量进行单变量协方差分析。对于每个时间段,协变量为上次的测量值;对于整个试验期,协变量为第1次的测量值。自然整枝率为每次测量时单株枝条死亡数量与第1次调查时枝条总数的比值,方差分析之前先进行arcsin转换,不同处理间多重比较采用Duncan’s方法。
3. 结果与分析
3.1 林木生长对遮阴的响应
遮阴处理1年后,西南桦幼林树高增量随着遮阴度的增加基本呈现先增加后降低趋势,而胸径增量的变化趋势不明显;各处理间树高、胸径增量差异均未达到显著水平(P≥0.05)。每个调查时间段内,各处理间树高和胸径增量亦无显著差异。胸径在1至4月份生长最快,2018−01—04期间各处理的增量均超过0.73 cm (表2)。
表 2 不同遮阴率处理下西南桦幼林树高、胸径生长动态1)Table 2. Growth dynamics of tree height and diameter at breast height for young Betula alnoides in different shading treatments指标
Index遮阴率/%
Shade rate2017–10—2018–01 2018–01—04 2018–04—07 2018–07—2019–01 合计
Totalh/m 0(CK) 0.283±0.044a 0.417±0.060a 0.333±0.088a 0.400±0.115a 1.433±0.120a 40~45 0.167±0.089a 0.367±0.167a 0.900±0.100a 0.600±0.057a 2.033±0.145a 55~60 0.167±0.033a 0.567±0.203a 0.567±0.285a 0.533±0.089a 1.833±0.088a 80~90 0.400±0.039a 0.367±0.145a 0.300±0.115a 0.467±0.076a 1.533±0.145a DBH/cm 0(CK) 0.433±0.120a 0.733±0.133a 0.400±0.057a 0.967±0.120a 2.533±0.384a 40~45 0.367±0.145a 1.000±0.153a 0.100±0.033a 0.833±0.088a 2.300±0.252a 55~60 0.267±0.088a 0.833±0.120a 0.300±0.057a 0.800±0.115a 2.200±0.208a 80~90 0.133±0.067a 0.967±0.145a 0.400±0.020a 0.833±0.376a 2.333±0.561a 1) h:树高增量;DBH:胸径增量;表中数据为平均值±标准误(n=3);相同指标同列数据后的相同小写字母表示处理间差异不显著(P≥0.05,Duncan’s法)
1) h: Tree height increment; DBH: DBH increment; The data in the table are means ± standard errors (n=3); The same lowercase letters in the same column of the same index indicate no significant difference among treatments (P≥0.05,Duncan’s method)3.2 枝条发育对遮阴的响应
3.2.1 枝条直径对遮阴的响应
由表3可知,在每个调查时间段内及整个试验期间,西南桦幼林枝条直径增量随着遮阴率的增加而呈现降低趋势,各遮阴处理间大多差异显著 (P<0.05)。整个试验期间,CK的枝条直径增量是遮阴率80%~90%处理的1.73倍,达4.680 mm。每个时间段内,CK的枝条直径增量显著高于遮阴率55%~60% (仅2018−04—07期间例外)和80%~90%处理;CK和遮阴率40%~45%处理间,仅2018−01—04期间的枝条直径增量差异显著;遮阴率40%~45%和55%~60%处理间在2017−10—2018−04期间差异显著,此后时间段内差异不显著;遮阴率55%~60%和80%~90%处理间仅在2018−07—2019−01期间差异显著。
表 3 不同遮阴率处理下西南桦幼林枝条生长动态1)Table 3. Branch growth dynamics of young Betula alnoides in different shading treatments指标
Index遮阴率/%
Shade rate2017–10—2018–01 2018–01—04 2018–04—07 2018–07—2019–01 合计
Totald/mm 0(CK) 1.213±0.059a 1.197±0.056a 0.841±0.074a 1.429±0.072a 4.680±0.261a 40~45 1.123±0.062a 1.021±0.058b 0.846±0.094a 1.288±0.100ab 4.278±0.314b 55~60 0.805±0.061b 0.776±0.057c 0.661±0.120ab 1.109±0.127b 3.351±0.365c 80~90 0.753±0.061b 0.687±0.057c 0.552±0.111b 0.708±0.116c 2.700±0.345d l/m 0(CK) 0.118±0.008a 0.135±0.009a 0.086±0.008a 0.135±0.009a 0.474±0.034a 40~45 0.081±0.008b 0.136±0.009a 0.081±0.010a 0.132±0.013a 0.430±0.040a 55~60 0.072±0.008b 0.090±0.009b 0.067±0.012a 0.107±0.016ab 0.336±0.045b 80~90 0.070±0.008b 0.076±0.009b 0.065±0.012a 0.075±0.015b 0.286±0.044b 1) d:枝条直径增量;l:枝条长度增量;表中数据为平均值±标准误(n=3);相同指标同列数据后的不同小写字母表示处理间差异显著(P<0.05,Duncan’s法)
1) d: Branch diameter increment; l: Branch length increment; The data in the table are means ± standard errors (n=3); Different lowercase letters in the same column of the same index indicate significant differences among treatments (P<0.05, Duncan’s method)3.2.2 枝条长度对遮阴的响应
由表3可知,相对于枝条直径生长,西南桦幼林枝条长度增量对遮阴处理的敏感性稍弱,亦随着遮阴率的增加呈现降低趋势。其中,2017−10—2018−01期间,CK的枝条长度增量显著高于其他3个遮阴处理 (P<0.05),达到0.118 m;然而随着时间的推移,2018−01—04期间遮阴率40%~45%处理与CK间的枝条长度增量差异不显著 (P≥0.05),两者均显著高于遮阴率55%~60%和80%~90%处理;2018−04—07期间各遮阴处理间枝条长度增量均无显著差异;2018−07—2019−01期间,仅遮阴率80%~90%处理的枝条长度增量显著低于CK和遮阴率40%~45%处理。整个试验期内,遮阴率40%~45%处理与CK的枝条长度增量无显著差异,两者均显著高于遮阴率55%~60%和80%~90%处理。
3.2.3 自然整枝对遮阴的响应
由表4可知,遮阴试验开始后的6个月 (2017−10—2018−04) 内,各处理间西南桦幼林自然整枝率虽无显著差异(P≥0.05),但各遮阴处理西南桦幼林自然整枝率均明显高于CK;第6个月以后,西南桦自然整枝率随遮阴率的增加呈升高趋势,其中CK的自然整枝率均显著低于各遮阴处理(P<0.05),但3个遮阴处理间差异不显著,至试验期末(2019−01),各遮阴处理西南桦幼林自然整枝率均超过74%,遮阴率55%~60%和80%~90%处理的自然整枝率超过81%。自然整枝过程主要发生在4—7月份,期间各遮阴处理的自然整枝率增量均超过47%,其中遮阴率55%~60%处理的自然整枝率超过66%。
表 4 不同遮阴处理下西南桦幼林自然整枝率1)Table 4. Natural pruning rate of young Betula alnoides in different shading treatment% 遮阴率/% Shade rate 2018–01 2018–04 2018–07 2019–01 0(CK) 2.020±2.020a 5.374±3.566a 37.778±2.222b 38.788±1.212b 40~45 19.341±4.847a 21.397±5.517a 68.661±5.144a 74.359±4.933a 55~60 8.530±5.279a 11.235±5.852a 77.982±10.029a 81.598±7.967a 80~90 18.046±9.194a 21.233±8.926a 77.674±7.792a 81.297±8.033a 1) 表中数据为平均值±标准误(n=3);同列数据后的不同小写字母表示处理间差异显著(P<0.05,Duncan’s法)
1) The data in the table are means ± standard errors (n=3); different lowercase letters in the same column indicate significant differences among treatments (P<0.05, Duncan’s method)4. 讨论与结论
光对植物的生长发育和形态构建有十分重要的作用,过强或过弱的光照均有可能对林木生长产生不利影响。本研究发现,不同遮阴处理间西南桦幼林在每个调查时间段和整个试验期内树高、胸径增量均未呈现出显著差异。究其原因,林木可能通过改善自身对弱光的利用能力,部分弥补因遮阴造成的光合损失,此可从遮阴后各调查时间段胸径增量差异的变化趋势得到验证,遮阴处理初期 (2017−10—2018−01) 胸径增量差异最大,此后差异变小。我们前期通过不同造林密度西南桦幼林各冠层光合能力测定发现,随造林密度增加西南桦幼林对弱光利用能力增强[20]。尽管如此,各遮阴处理胸径增量均明显低于CK组,表明遮阴对西南桦的胸径生长具有负面影响,这与王振兴等[21]对闽楠Phoebe bournei和郑坚等[22]对降香黄檀Dalbergia odorifera等的研究结果一致。
枝条发育主要表现为枝条基径和长度的生长。本研究中,各调查时间段及整个试验期内西南桦枝条基径和长度增量均随遮阴率增加呈降低趋势,其主要原因是,遮阴条件下光照不足,下部枝条上叶片亦较少[23],且不能合成更多的光合产物同时满足树干和枝条的生长,此亦可从本研究中西南桦单株生长尚未受到显著影响得到验证。Mori等[24]比较分析了2个演替后期冷杉Abies fabri林下5株受强遮阴以及5株开阔地带生长旺盛的冷杉幼树,亦发现遮阴条件下幼树会增加对树干的能量分配,从而造成枝条生长受到抑制。
本研究还发现,2018–01—04时间段西南桦幼林枝条长度增量明显高于其他3个时间段,这一方面是与当地西南桦的物候特征有关,其夏季叶片开始衰老,9月份落叶,落叶后约2周即萌发新叶,春季是其快速生长期;另一方面可能与植物自身对环境改变的适应性有关,遮阴后植株可通过增加叶面积以增加光截获能力[25],作为支撑叶片的枝条也将通过伸长生长增加生长空间获得更多的光以满足生长需求。尽管如此,从长期来看,短时间内林木自身的适应还不足以抵消遮阴造成的负面影响,致使遮阴下枝条生长显著低于全光环境。
自然整枝是林分达到郁闭后,下层枝条由于上层树冠的遮挡长期光照不足发生一系列生理变化而出现枝条枯萎并相继脱落的现象[26],枝条脱落后形成节子,会降低木材质量[27]。本研究发现,西南桦幼树自然整枝率随遮阴强度增加而增大,即枝条寿命在遮阴环境中明显低于全光照,这与占峰等[28]对桂花Osmanthus fragrans和水杉Metasequoia glyptostroboides以及Mori等[24]对冷杉的研究结果相反,造成这一差异的原因可能与西南桦是强阳性树种有关,这也说明不同树种对光环境的响应亦不同。本研究还发现,自然整枝主要发生在4—7月份,这一时期各遮阴处理的整枝率增量均超过47%,而CK组的自然整枝率也超过32%。究其原因,其一、遮阴处理一段时间后叶片光合产能不足以满足枝条正常需求,致使枝条提前衰老;其二、此时期西南桦叶片处于衰老期,叶片光合能力进一步降低,进而加速枝条死亡;其三、陶玉华等[29]对造林密度为2 m×4 m的西南桦造林后连续15年观测发现,西南桦自然整枝高峰期在造林后6~7年,本研究中林分在2018年4月时亦满6年,可能开始处于自然整枝高峰期,这也是潜在的原因之一;其四、4—7月份试验地进入雨季,多暴风雨,亦可能促进自然整枝。
综上所述,本研究基于系列密度西南桦林分的树冠光环境模拟试验,发现各调查时间段及整个试验期间,遮阴处理的树高、胸径增量与CK(全光照)差异不显著,而枝条基径、长度增量则显著低于CK,且自然整枝率随遮阴率增加呈上升趋势,这验证了我们前期研究的论断,即通过造林密度调控枝条发育的关键在于林内光环境差异[20]。通过适度提高西南桦造林密度,促进林分提前郁闭,营造林分内弱光环境,有助于降低西南桦主要用材区段枝条大小,加快自然整枝,提升木材质量,结合合理施肥、间伐等技术措施,实现其大径级无节材的高效培育。
-
表 1 大豆各器官中巯基物质与镉浓度和抗性指数的相关分析1)
Table 1 Correlation analysis of non-protein thiol and Cd contents in organs, and tolerance indexes of two soybean genotypes

-
[1] 曾希柏, 徐建明, 黄巧云, 等.中国农田重金属问题的若干思考[J].土壤学报, 2013, 50(1): 186-193. http://d.old.wanfangdata.com.cn/Periodical/trxb201301023 [2] SANITA D, TOPPI L, GABBRIELLI R. Response to cadmium in higher plants [J]. Environ Exp Bot, 1999, 41(2): 105-130. doi: 10.1016/S0098-8472(98)00058-6
[3] BENAVIDES M P, GALLEGO S M, TOMARO M L. Cadmium toxicity in plants [J]. Brazil J Plant Physiol, 2005, 17(1): 21-34. doi: 10.1590/S1677-04202005000100003
[4] LUX A, MARTHINK M, VACULIK M, et al. Root responses to cadmium in the rhizosphere: A review [J]. J Exp Bot, 2011, 62(1): 21-37. doi: 10.1093/jxb/erq281
[5] ZHAO Y, FANG X, MU Y, et al. Metal pollution (Cd, Pb, Zn, and As) in agricultural soils and soybean, Glycine max, in southern China [J]. B Environ Contam Tox, 2014, 92(4): 427-432. doi: 10.1007/s00128-014-1218-5
[6] ZHUANG P, LI Z A, ZOU B, et al. Heavy metal contamination in soil and soybean near the Dabaoshan Mine, South China [J]. Pedosphere, 2013, 23(3): 298-304. doi: 10.1016/S1002-0160(13)60019-3
[7] 赵云云, 钟彩霞, 方小龙, 等.华南地区夏播大豆品种镉耐性及籽粒镉积累的差异[J].大豆科学, 2013, 32(3): 336-340. http://d.old.wanfangdata.com.cn/Periodical/ddkx201303012 [8] 赵云云, 钟彩霞, 方小龙, 等.华南地区11个春播大豆品种抗镉性的差异[J].华南农业大学学报, 2014, 35(3): 111-113. http://xuebao.scau.edu.cn/zr/hnny_zr/ch/reader/view_abstract.aspx?flag=1&file_no=201403020&journal_id=hnny_zr [9] GRANT C A, CLARKE J M, DUGUID S, et al. Selection and breeding of plant cultivars to minimize cadmium accumulation[J]. Sci Total Environ, 2008, 390(2/3): 301-310. http://d.old.wanfangdata.com.cn/NSTLQK/NSTL_QKJJ026480049/
[10] 赵云云, 郭秀兰, 钟彩霞, 等. 大豆抗镉污染低积累育种的研究进展[J/OL]. 分子植物育种(网络版), 2011, 9: 1692-1699(2011-08-12)[2015-03-08]. http://www.biopublisher.cn/index.php/mpb/article/html/576/.DOI:10.5376/mpb.cn.2011.09.0096. [11] SHARMA S S, DIETZ K. The relationship between metal toxicity and cellular redox imbalance [J]. Trends Plant Sci, 2009, 14(1): 43-50. doi: 10.1016/j.tplants.2008.10.007
[12] CUYPERS A, KAREN S, JOS R, et al. The cellular redox state as a modulator in cadmium and copper responses in Arabidopsis thaliana seedlings [J]. J Plant Physiol, 2011, 168(4): 309-316. doi: 10.1016/j.jplph.2010.07.010
[13] LIN Y F, AARTS M G. The molecular mechanism of zinc and cadmium stress response in plants [J]. Cell Mol Life Sci, 2012, 69(19): 3187-3206. doi: 10.1007/s00018-012-1089-z
[14] SETH C S, REMANS T, KEUNEN E, et al. Phytoextraction of toxic metals: A central role for glutathione [J]. Plant Cell Environ, 2012, 35(2): 334-346. doi: 10.1111/j.1365-3040.2011.02338.x
[15] HARTLEY-WHITAKER J, AINSWORTH G, VOOIJS R, et al. Phytochelatins are involved in differential arsenate tolerance in Holcus lanatus [J]. Plant Physiol, 2001, 126(1): 299-306. doi: 10.1104/pp.126.1.299
[16] GALLEGO S M, PENA L B, BARCIA R A, et al. Unravelling cadmium toxicity and tolerance in plants: Insight into regulatory mechanisms [J]. Environ Exp Bot, 2012, 83: 33-46. doi: 10.1016/j.envexpbot.2012.04.006
[17] GUO J, DAI X, XU W, et al. Overexpressing GSH1 and AsPCS1 simultaneously increases the tolerance and accumulation of cadmium and arsenic in Arabidopsis thaliana[J]. Chemosphere, 2008, 72(7): 1020-1026. doi: 10.1016/j.chemosphere.2008.04.018
[18] SARWAR N, ISHAQ W, FARID G, et al. Zinc-cadmium interactions: Impact on wheat physiology and mineral acquisition[J]. Ecotox Environ Safe, 2015, 122: 528-536. doi: 10.1016/j.ecoenv.2015.09.011
[19] 高可辉. 镉胁迫及缺硫对水稻非蛋白巯基物质含量和谷胱甘肽硫转移酶活性的影响[D]. 南京: 南京农业大学, 2011. [20] EBBS S, LAU I, AHNER B, et al. Phytochelatin synthesis is not responsible for Cd tolerance in the Zn/Cd hyperaccumulator Thlaspi caerulescens (J. & C. Presl) [J]. Planta, 2002, 214(4): 635-640. doi: 10.1007/s004250100650
[21] LI Y, DHANKHER O P, CARREIR L, et al. Overexpression of phytochelatin synthase in Arabidopsis leads to enhanced arsenic tolerance and cadmium hypersensitivity[J]. Plant Cell Physiol, 2004, 45(12): 1787-1797. doi: 10.1093/pcp/pch202
[22] WOJAS S, CLEMENS S, HENNIG J, et al. Over expression of phytochelatin synthase in tobacco: Distinctive effects of AtPCS1 and CePCS genes on plant response to cadmium[J]. J Exp Bot, 2008, 59(8): 2205-2219. doi: 10.1093/jxb/ern092
[23] ANETOLI M, VOOIJS R, TEN BOOKUM W, et al. Arsenate tolerance in Silene paradoxa does not rely on phytochelatin-dependent sequestration[J]. Environ Pollut, 2008, 152(3): 585-591. doi: 10.1016/j.envpol.2007.07.002
[24] MAIER E A, MATTHEWS R D, MCDOWELL J A, et al. Environmental cadmium levels increase phytochelatin and glutathione in lettuce grown in a chelator-buffered nutrient solution[J]. J Environ Qual, 2003, 32(4): 1356-1364. doi: 10.2134/jeq2003.1356
[25] JOZEFCZAK M, REMANS T, VANGRONSVELD J, et al. Glutathione is a key player in metal-induced oxidative stress defenses[J]. Int J Mol Sci, 2012, 13(3): 3145-3175. doi: 10.3390/ijms13033145
[26] JOZEFCZAK M, KEUNEN E, SCHAT H, et al. Differential response of Arabidopsis leaves and roots to cadmium: Glutathione-related chelating capacity vs antioxidant capacity[J]. Plant Physiol Bioch, 2014, 83: 1-9. doi: 10.1016/j.plaphy.2014.07.001
[27] ZAGORCHEV L, SEAL C E, KRANNER I, et al. A central role for thiols in plant tolerance to abiotic stress [J]. Int J Mol Sci, 2013, 14(4): 7405-7432. doi: 10.3390/ijms14047405
[28] VAZQUEZ S, GOLDSBROUGH P, CARPENA R O. Comparative analysis of the contribution of phytochelatins to cadmium and arsenic tolerance in soybean and white lupin[J]. Plant Physiol Bioch, 2009, 47(1): 63-67. doi: 10.1016/j.plaphy.2008.09.010
[29] WEI S, LI Y, ZHAN J, et al. Tolerant mechanisms of Rorippa globosa (Turcz.) Thell. hyper accumulating Cd explored from root morphology[J]. Bioresource Technol, 2012, 118: 455-459. doi: 10.1016/j.biortech.2012.05.049
[30] RAMA DEVI S, PRASAD M. Copper toxicity in Ceratophyllum demersum L. (Coontail), a free floating macrophyte: Response of antioxidant enzymes and antioxidants[J]. Plant Sci, 1998, 138(2): 157-165. doi: 10.1016/S0168-9452(98)00161-7
[31] GUPTA M, RAI U N, TRIPATHI R D, et al. Lead induced changes in glutathione and phytochelatin in Hydrilla verticillata (lf) Royle[J]. Chemosphere, 1995, 30(10): 2011-2020. doi: 10.1016/0045-6535(95)00075-J
[32] BHARGAVA P, KUMAR SRIVASTAVA A, URMI S, et al. Phytochelatin plays a role in UV-B tolerance in N2-fixing cyanobacterium Anabaena doliolum[J]. J Plant Physiol, 2005, 162(11): 1220-1225. doi: 10.1016/j.jplph.2004.12.006
[33] GILL S S, TUTEJA N. Cadmium stress tolerance in crop plants[J]. Plant Signal Behav, 2011, 6(2): 215-222. doi: 10.4161/psb.6.2.14880
[34] LI H, DONG Y, YIN H, et al. Characterization of the stress associated micro RNAs in Glycine max by deep sequencing[J]. BMC Plant Biol, 2011, 11: 170. doi: 10.1186/1471-2229-11-170
[35] VERBRUGGEN N, HERMANS C, SCHAT H. Molecular mechanisms of metal hyper accumulation in plants[J]. New Phytol, 2009, 181(4): 759-776. doi: 10.1111/j.1469-8137.2008.02748.x
[36] LI T, DI Z, ISLAM E, et al. Rhizosphere characteristics of zinc hyperaccumulator Sedum alfredii involved in zinc accumulation[J]. J Hazard Mater, 2011, 185(2/3): 818-823. http://www.wanfangdata.com.cn/details/detail.do?_type=perio&id=JJ0223879793
[37] AHSAN N, NAKAMURA T, KOMATSU S. Differential responses of microsomal proteins and metabolites in two contrasting cadmium (Cd)-accumulating soybean cultivars under Cd stress[J]. Amino Acids, 2012, 42(1): 317-327. doi: 10.1007/s00726-010-0809-7
-
期刊类型引用(5)
1. 许文英. 西南桦的生长特征及栽培技术探讨. 农村科学实验. 2024(07): 82-84 .  百度学术
百度学术
2. 连晓倩,田云龙,黄健,钟兆全,周垂帆,黄伟,吴鹏飞. 杉木林分密度对套种闽楠树型、光合能力及生物量分配的影响. 林业科学研究. 2024(05): 13-22 .  百度学术
百度学术
3. 余清海. 不同基质·遮阴强度对盐肤木种子萌发的影响. 安徽农业科学. 2023(23): 90-92+103 .  百度学术
百度学术
4. 代嵩华,黄印冉,冯树香,闫淑芳,刘易超,陈丽英,樊彦聪. 不同遮阴强度对白桦幼苗生长情况的影响. 河北林业科技. 2022(02): 25-27+36 .  百度学术
百度学术
5. 朱秀征,靳超,房丽莎,刘震,王艳梅,蔡齐飞,李志,耿晓东. 不同密度下山桐子自然整枝差异性分析. 河南科学. 2022(08): 1257-1263 .  百度学术
百度学术
其他类型引用(3)



 下载:
下载: